一种靶向β淀粉样蛋白的荧光探针及制备以及其在阿尔兹海默症中的应用
一种靶向
β
淀粉样蛋白的荧光探针及制备以及其在阿尔兹海默症中的应用
技术领域
1.本发明属于生物医药领域,特别涉及一种靶向β淀粉样蛋白的荧光探针及制备以及其在阿尔兹海默症中的应用。
背景技术:
2.阿尔兹海默症(alzheimer’s disease,ad)是一种由多种致病原因导致的不可逆的神经退行性疾病。临床病症主要为记忆退行性丧失,认知和学习能力减弱等。针对阿尔兹海默症患者的致病原因目前还没有完全研究清楚。通过大量病理学研究,对于阿尔兹海默症的致病机制主要有3大经典假说:aβ蛋白沉积假说、tau蛋白过度磷酸化假说和胆碱能神经元退行性病变假说。其中aβ蛋白沉积假说可行度极高。在病理学特征中主要表现为β淀粉样蛋白在大脑皮层和海马区沉积形成老年斑。正常情况下,aβ蛋白是由前体app水解并通过血脑屏障输送出大脑,或者受体介导的细胞的吞噬将其清除。但在病理状态下,aβ的产生与清除失衡,导致大量的aβ蛋白过度聚集从而形成斑块沉积在大脑内,诱发神经性毒性。
3.目前,阿尔兹海默症的临床诊断主要依据精神和认知能力的测试,病理确证通过尸体大脑组织的病理学特征观察aβ斑点和tau的纤维化。近些年,成像技术被广泛的运用于监控和诊断aβ斑点和tau纤维化。正电子发射断层成像(pet)、磁共振成像(mri)和单光子发射计算机断层成像(spect)用于体内和体外评估阿尔兹海默症,大大提高了阿尔兹海默症患者的确证手段。但是,pet在成像aβ蛋白时灵敏度较低,mri只能检测到尺寸大于50μm的aβ斑点,而spect技术中的碘化探针难以透过血脑屏障,并且具有放射性的辐射。所以需求花费低,选择性和灵敏性高,分辨率高,使用安全便捷的阿尔兹海默症检测方法是亟待解决的。
4.荧光探针成像技术因为其优良的选择性,灵敏性,生物相容性以及分辨率等被用于早期阿尔兹海默症的诊断,其中近红外荧光(nirf)探针成像技术由于它的组织穿透力强,背景干扰小和分辨率高等优点被许多科学研究者开发研究。近年来,aβ蛋白的荧光探针发展迅速,已经有很多荧光探针用于阿尔兹海默症的早期诊断。概括来说,这些aβ蛋白荧光探针的结构主要是供体、连接桥和受体三部分组成。比如噻吩类衍生物(niad
‑
4、niad
‑
11、niad
‑
16)、噁嗪类衍生物(aoi
‑
987)、姜黄素类衍生物(cranad
‑
2、cranad
‑
3、cranad
‑
58)和喹啉
‑
丙二腈类衍生物(dcm
‑
n)等。自从20世纪30年代以来,喹啉类化合物(qm
‑
fn
‑
so3)主要作为抗疟疾的药物。除了抗疟疾的作用之外,含有喹啉环的很多药物还具有抗肿瘤、抗菌、消炎、增强记忆、抗抑郁和抗高血压等生物活性。随着荧光探针成像技术的发展,喹啉类化合物因为具有很好的成药性,并且喹啉类探针具有发射波长在近红外,stock’s位移大,信噪比高等特点,在荧光探针成像领域具有很大的潜在价值。
[0005][0006]
技术实现要素:
[0007]
本发明的首要目的在于克服现有技术的缺点与不足,提供一种荧光探针化合物在制备诊断阿尔兹海默症的产品中的应用。
[0008]
本发明的另一目的在于提供上述荧光探针化合物在制备检测β淀粉样蛋白的产品中的应用。
[0009]
本发明的又一目的在于提供上述的荧光探针化合物,其能够靶向β淀粉样蛋白。
[0010]
本发明的再一目的在于提供上述荧光探针化合物的制备方法。
[0011]
本发明的目的通过下述技术方案实现:
[0012]
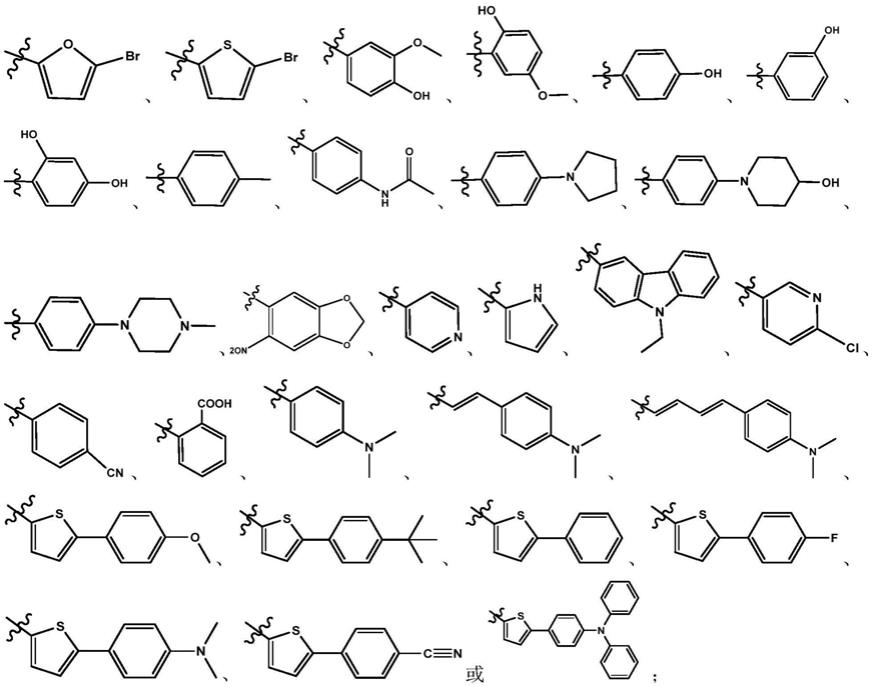
一种荧光探针化合物在制备诊断阿尔兹海默症的产品中的应用,所述的荧光探针化合物的结构式如式ⅰ所示:
[0013][0014]
式中:r1和r2为甲基;r3为甲基或1
‑
磺酸丁烷基;
[0015]
r4选自如下任一基团:
[0016][0017][0018]
x为卤素元素;优选为卤素元素cl、br或i;更优选为卤素元素i。
[0019]
所述的荧光探针化合物具体为:
[0020][0021]
所述的产品包括荧光探针、试剂或试剂盒等。
[0022]
上述荧光探针化合物在制备检测β淀粉样蛋白的产品中的应用。
[0023]
所述的产品包括荧光探针、试剂或试剂盒等。
[0024]
所述的β淀粉样蛋白为aβ聚集体;优选为aβ1
‑
42聚集体。
[0025]
上述荧光探针化合物,具有特异性靶向β淀粉样蛋白的特点;其结构式具体如下:
[0026][0027]
制备上述荧光探针化合物的方法,包括如下步骤:
[0028]
(1)中间体i制备
[0029]
①
中间体1的制备
[0030]
将n,n
‑
二甲基
‑
1,4
‑
对苯二胺、巴豆醛和甲苯加入到盐酸溶液中,在保护性气体氛围、115
±
5℃条件下进行回流反应,待反应结束后冷却至室温,去除上层甲苯溶液,并在冰水浴条件下调节ph值至中性,萃取、分离纯化,得到中间体1;
[0031]
②
中间体dapdea的制备
[0032]
将4
‑
二甲氨基肉桂醛、18
‑
冠
‑6‑
醚和(1,3
‑
二氧戊环
‑2‑
基)甲基三苯基溴化膦加入到四氢呋喃中,在保护性气体氛围下进行反应,然后加入氰化钠在室温条件下搅拌反应,再加水淬灭反应物,萃取、减压旋蒸浓缩至残渣,并将其溶于含有草酸的四氢呋喃溶液中,继续搅拌反应,待反应结束后调节ph至碱性使固体析出,抽滤、滤液用乙酸乙酯萃取、干燥、接着减压旋蒸、分离纯化,得到中间体dapdea;
[0033]
③
中间体sf
‑
1~4、sf
‑
6和sf
‑
nph3的制备
[0034]
将苯硼酸化合物和四(三苯基膦)钯溶于甲苯中,得到混合液a;将5
‑
溴
‑2‑
甲醛噻吩和k2co3加入到乙醇中,得到混合液b;然后将混合液a和b混合均匀后,在保护性气体氛围、80~100℃条件下进行反应,待反应结束后,减压旋干至滤渣,分离纯化,得到中间体sf
‑
1、sf
‑
2、sf
‑
3、sf
‑
4、sf
‑
6或sf
‑
nph3;其中,所述的苯硼酸化合物为对甲氧基苯硼酸、对叔丁基苯硼酸、苯硼酸、对氟苯硼酸、对氰基苯硼酸和4
‑
硼酸三苯胺中的一种;
[0035]
④
中间体sf
‑
5的制备
[0036]
将对二甲胺基溴苯和四(三苯基膦)钯(pd(pph3)4)溶于甲苯中,得到混合液c;将5
‑
硼酸
‑2‑
甲醛噻吩和k2co3加入到乙醇中,得到混合液d;然后将混合液c和d混合均匀后,在保护性气体氛围、100
±
5℃条件下进行反应,待反应结束后,减压旋干至滤渣,分离纯化,得到中间体sf
‑
5;
[0037]
(2)中间体ii的制备
[0038]
⑤
中间体2的制备
[0039]
将中间体1溶于有机溶剂中,滴加碘甲烷(ch3i),然后在密封、79℃
±
5℃条件下进行反应,待反应结束后抽滤、分离纯化,得到中间体2;
[0040]
⑥
中间体qs的制备
[0041]
将步骤(1)
①
中得到的中间体1和1,4
‑
丁磺酸内酯加入到邻二氯苯中,然后在密封、120℃
±
5℃条件下进行反应,待反应结束后分离纯化,得到中间体qs;
[0042]
(3)荧光探针化合物的制备
[0043]
将中间体ii、醛类配体化合物和醋酸钾加入到有机溶剂中,然后滴加哌啶,在密封、80℃
±
5℃条件下进行缩合反应,待反应结束后析出固体、抽滤,洗涤,干燥,得到所述的荧光探针化合物;其中,
[0044]
所述的中间体ii为中间体2和中间体qs中的一种;
[0045]
所述的醛类配体化合物为5
‑
溴
‑
2甲醛呋喃、5
‑
溴
‑2‑
醛基噻吩、3
‑
甲氧基
‑4‑
羟基苯甲醛、3
‑
甲氧基
‑6‑
羟基苯甲醛、4
‑
羟基苯甲醛、3
‑
羟基苯甲醛、2,4
‑
二羟基苯甲醛、对甲基苯甲醛、4
‑
乙酰氨基苯甲醛、4
‑
(1
‑
四氢吡咯)苯甲醛、4
‑
(4
‑
羟基哌啶
‑1‑
基)苯甲醛、4
‑
(4
‑
甲基哌嗪)苯甲醛、6
‑
硝基胡椒醛、4
‑
醛基吡啶、2
‑
醛基吡咯、n
‑
乙基咔唑
‑3‑
甲醛、2
‑
氯
‑5‑
醛基吡啶、4
‑
氰基苯甲醛、2
‑
羧基苯甲醛、对二甲氨基苯甲醛、对二甲氨基肉桂醛、4
‑
吡咯苯甲醛、中间体dapdea、中间体sf
‑
1、中间体sf
‑
2、中间体sf
‑
3、中间体sf
‑
4、中间体sf
‑
5、中间体sf
‑
6和中间体sf
‑
nph3中的一种。
[0046]
步骤(1)
①
中所述的n,n
‑
二甲基
‑
1,4
‑
对苯二胺与巴豆醛的摩尔比为1:1~2;优选为1:2。
[0047]
步骤(1)
①
中所述的盐酸溶液为hcl与水按体积比为1:1混合得到的盐酸溶液。
[0048]
步骤(1)
①
中所述的盐酸溶液、巴豆醛和甲苯的体积比为250:7:30。
[0049]
步骤(1)中所述的保护性气体均为氮气或氩气。
[0050]
步骤(1)
①
中所述的回流反应的时间为6~8h;优选为7h。
[0051]
步骤(1)
①
中所述的调节ph值为采用饱和naoh溶液进行调节。
[0052]
步骤(1)
①
中所述的萃取为采用二氯甲烷(dcm)进行萃取;优选为采用二氯甲烷(dcm)萃取三次以上。
[0053]
步骤(1)
①
中所述的分离纯化为采用硅胶柱层析进行分离纯化。
[0054]
所述的硅胶柱层析为在100~200目硅胶柱中进行色谱分离。
[0055]
所述的硅胶柱层析采用石油醚和乙酸乙酯的混合溶剂为洗脱剂进行梯度洗脱;其中,石油醚与乙酸乙酯的体积比为20:1。
[0056]
步骤(1)
①
中所述的中间体1的结构式如式所示:
[0057][0058]
式ⅱ中,r1,r2位甲基。
[0059]
步骤(1)
②
中所述的4
‑
二甲氨基肉桂醛、18
‑
冠
‑6‑
醚和(1,3
‑
二氧戊环
‑2‑
基)甲基三苯基溴化膦的摩尔比为配比是5:1:6。
[0060]
步骤(1)
②
中所述的含有草酸的四氢呋喃的用量为按每毫摩尔4
‑
二甲氨基肉桂醛配比5~10ml含有草酸的四氢呋喃计算;优选为按每毫摩尔4
‑
二甲氨基肉桂醛配比7ml含有草酸的四氢呋喃计算。
[0061]
步骤(1)
②
中所述的搅拌反应的时间为1~2h;优选为1h。
[0062]
步骤(1)
②
中所述的含有草酸的四氢呋喃溶液中草酸的浓度为体积百分比10%。
[0063]
步骤(1)
②
中所述的继续搅拌反应的时间为10~15h;优选为1 2h。
[0064]
步骤(1)
②
中所述的调节ph至碱性为采用饱和碳酸氢钠溶液进行调节。
[0065]
步骤(1)
②
中所述的萃取为采用乙酸乙酯进行萃取。
[0066]
步骤(1)
②
中所述的干燥为采用无水硫酸镁进行干燥。
[0067]
步骤(1)
②
中所述的分离纯化为采用硅胶柱层析进行分离纯化。
[0068]
所述的硅胶柱层析为在100~200目硅胶柱中进行色谱分离。
[0069]
所述的硅胶柱层析采用石油醚和乙酸乙酯的混合溶剂为洗脱剂进行梯度洗脱;其中,石油醚与乙酸乙酯的体积比为30:1。
[0070]
步骤(1)
③
中所述的苯硼酸化合物、四(三苯基膦)钯(pd(pph3)4)、5
‑
溴
‑2‑
甲醛噻吩和k2co3的摩尔比为1~1.3:0.1:0.9~1.1:1~1.3。
[0071]
步骤(1)
③
中所述的甲苯的用量为按每毫摩尔苯硼酸化合物配比4~10ml甲苯计算;优选为按每毫摩尔苯硼酸化合物配比4~6ml甲苯计算。
[0072]
步骤(1)
③
和
④
中所述的乙醇的用量为按每毫摩尔5
‑
溴
‑2‑
甲醛噻吩配比4~6ml 5
‑
溴
‑2‑
甲醛噻吩计算。
[0073]
步骤(1)
③
和
④
中所述的反应的时间为2~6h;优选为2.5~5h。
[0074]
步骤(1)
③
和
④
中所述的分离纯化为采用硅胶柱层析进行分离纯化。
[0075]
所述的硅胶柱层析为在100~200目硅胶柱中进行色谱分离。
[0076]
所述的硅胶柱层析采用石油醚和乙酸乙酯的混合溶剂为洗脱剂进行梯度洗脱;其中,石油醚与乙酸乙酯的体积比为10:1。
[0077]
步骤(1)
④
中所述的甲苯的用量为按每毫摩尔二甲胺基溴苯配比4~10ml甲苯计算;优选为按每毫摩尔二甲胺基溴苯配比4~6.5ml甲苯计算。
[0078]
步骤(1)
④
中所述的对二甲胺基溴苯、四(三苯基膦)钯(pd(pph3)4)、5
‑
硼酸
‑2‑
甲醛噻吩和k2co3的摩尔比为1~1.3:0.1:0.9~1.1:1~1.3。
[0079]
步骤(2)
⑤
中所述的中间体1和碘甲烷(ch3i)的摩尔比为1:2~5;优选为1:2.5。
[0080]
步骤(2)
⑤
和(3)中所述的有机溶剂为乙醇。
[0081]
步骤(2)
⑤
中所述的有机溶剂的用量为按每毫摩尔中间体1配比4.5~5ml有机溶剂计算。
[0082]
步骤(2)
⑤
和
⑥
中所述的反应的时间为8~12h;优选为12h。
[0083]
步骤(2)
⑤
中所述的分离纯化为采用硅胶柱层析进行分离纯化。
[0084]
所述的硅胶柱层析为在100~200目硅胶柱中进行色谱分离。
[0085]
所述的硅胶柱层析采用二氯甲烷和甲醇的混合溶剂为洗脱剂进行梯度洗脱;其中,二氯甲烷和甲醇的体积比为40:1。
[0086]
步骤(2)
⑤
中所述的中间体ii的结构式如式ⅲ所示:
[0087][0088]
式ⅲ中:r3为甲基或丁烷磺酸基。
[0089]
步骤(2)
⑥
中所述的中间体1和1,4
‑
丁磺酸内酯的摩尔比为1:1。
[0090]
步骤(2)
⑥
中所述的邻二氯苯的用量为按每毫摩尔中间体1配比1.5~2ml邻二氯苯计算。
[0091]
步骤(2)
⑥
中所述的分离纯化为采用硅胶柱层析进行分离纯化。
[0092]
所述的硅胶柱层析为在100~200目硅胶柱中进行色谱分离。
[0093]
所述的硅胶柱层析采用二氯甲烷和甲醇的混合溶剂为洗脱剂进行梯度洗脱;其中,二氯甲烷和甲醇的体积比为10:1。
[0094]
步骤(3)中所述的中间体ii、醛类配体化合物和醋酸钾的摩尔比为1:1~5:0.2~5;优选为1:1.2:1。
[0095]
步骤(3)中所述的反应的时间为1~5h;优选为1.5h。
[0096]
步骤(3)中所述的哌啶的用量为按每毫摩尔中间体ii配比0.3~0.6ml哌啶计算。
[0097]
步骤(3)中所述的有机溶剂的用量为按每毫摩尔中间体ii配比10~50ml有机溶剂计算。
[0098]
所述的制备荧光探针化合物的方法,在步骤(3)之后还可以将得到的荧光探针化合物经硅胶柱层析进一步纯化的步骤。
[0099]
所述的硅胶柱层析为在100~200目硅胶柱中进行色谱分离。
[0100]
所述的硅胶柱层析采用二氯甲烷和甲醇的混合溶剂为洗脱剂进行梯度洗脱;其中,二氯甲烷和甲醇的体积比为10~50:1。
[0101]
本发明相对于现有技术具有如下的优点及效果:
[0102]
(1)由于喹啉类荧光探针具有很多的优势,本发明合成了一种新型喹诺啉类化合物,是以6
‑
二甲氨基
‑1‑
甲基喹啉作为母体结构的一类化合物,即n
‑
甲基喹啉作为强的吸电子基团,乙烯共轭结构作为连接桥,—nr1(r2)作为供电子基团,r3为甲基或丁磺酸基,而r4作为该类荧光探针的结构修饰位点进行结构改造,在已有的标记aβ蛋白的荧光探针中尚未发现报道。该类探针以喹啉乙烯衍生物作为荧光团,基于“d
‑
π
‑
a”的构型设计β淀粉样蛋白的靶向荧光探针。该类探针在与β淀粉样蛋白结合后荧光信号明显增强,发射波长会出现蓝移现象。该类探针具有特异性靶向β淀粉样蛋白,发红光,stock’s位移大,与aβ蛋白结合后信号强的特点。
[0103]
(2)本发明合成的喹诺啉类化合物可以作为荧光探针,该类荧光探针具有发射波长长,stock位移大,特异性检β淀粉样蛋白和对粘度具有很好的响应,2
‑
取代芳乙烯基喹啉类衍生物在与阿尔兹海默症患者脑内的β淀粉样蛋白结合后,荧光信号明显增强,对于阿尔兹海默症诊疗探针的发展具有很重要的指导意义。
[0104]
(3)本发明合成的喹诺啉类化合物不仅可以靶向标记aβ蛋白,而且对组织细胞中的粘度较为敏感,同时,aβ蛋白和粘度都与阿尔兹海默症有很紧密的联系,因此,可将其用于标记aβ蛋白,检测线粒体内粘度的变化(作为线粒体粘度响应探针)以及用于早期阿尔兹海默症的诊断。
附图说明
[0105]
图1为本发明中的荧光探针的合成路线图(图中,a:hcl:h2o=1:1;b:ch3i,etoh,or 1,4
‑
丁烷磺酸内酯(1,4
‑
butane sultone);c:r4
‑
cho,哌啶(piperidine),ch3cook)。
[0106]
图2为本发明中的荧光探针的化学结构式。
[0107]
图3为本发明中的荧光探针与β淀粉样蛋白的荧光光谱图。
具体实施方式
[0108]
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
[0109]
实施例1荧光探针化合物的制备(荧光探针的合成路线见图1,化学结构式见图2)
[0110]
一、化合物1的合成步骤;
[0111]
首先配制盐酸溶液(hcl:h2o=1:1,v/v)250ml,搅拌均匀,加入n,n
‑
二甲基
‑
1,4
‑
对苯二胺5.8g(42.6mmol),待搅拌均匀后加入巴豆醛7ml,混匀后再向反应液中加入30ml的甲苯,在氩气保护、115℃条件下回流反应7h。薄层层析法确认反应完全,停止反应,静置至室温。首先去除上层甲苯溶液,然后冰水浴条件下用naoh饱和溶液调ph至中性,再加入等体积的dcm至少萃取三次,最后用硅胶柱层析分离纯化(硅胶100~200目;石油醚:乙酸乙酯=20:1,v/v),得到黄色固体3.47g,即化合物1(中间体1),产率为43.76%。
[0112][0113]
核磁氢谱表征:
[0114]1h nmr(400mhz,chloroform
‑
d)δ7.91(dd,j=14.3,8.9hz,2h),7.36(dd,j=9.3,2.8hz,1h),7.18(d,j=8.4hz,1h),6.81(d,j=2.9hz,1h),3.07(s,6h),2.70(s,3h).
[0115]
二、化合物2的合成步骤;
[0116]
称取2.60g(13.96mmol)化合物1溶于20ml乙醇中,置于150ml密封管中,滴加碘甲烷(ch3i)4.862g(34.25mmol),密封。79℃条件下密封反应12h。有大量黄色固体颗粒析出,直接减压旋蒸除去溶剂,然后硅胶柱层析纯化(硅胶粉100~200目;二氯甲烷:甲醇=40:1,v/v),得化合物2(中间体2),为橙黄色固体(1.148g),产率为25.06%。
[0117][0118]
核磁氢谱表征:
[0119]1h nmr(400mhz,dmso
‑
d6)δ8.73(d,j=8.6hz,1h),8.35(d,j=9.7hz,1h),7.86(d,j=8.6hz,1h),7.77(dd,j=9.9,3.0hz,1h),7.27(d,j=3.0hz,1h),4.36(s,3h),3.13(d,j=1.2hz,6h),2.95(s,3h).
[0120]
三、荧光探针的合成步骤
[0121]
(1)qm1荧光探针合成步骤:
[0122]
称取化合物2为0.305g(0.929mmol),5
‑
溴
‑
2甲醛呋喃0.360g(2.06mmol),醋酸钾40mg(0.26mmol)置于10ml乙醇中,然后滴加200μl的哌啶,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有深红色固体析出,抽滤,无水乙醇洗涤,干燥,得红色固体qm1 26mg,产率为5.77%。
[0123][0124]
核磁氢谱表征:
[0125]1h nmr(400mhz,dmso
‑
d6)δ8.69(d,j=9.1hz,1h),8.35(d,j=9.8hz,1h),8.27(d,j=9.1hz,1h),7.84(d,j=15.8hz,1h),7.73(dd,j=9.8,3.0hz,1h),7.47(d,j=15.7hz,1h),7.27(d,j=2.9hz,1h),7.14(d,j=3.6hz,1h),6.90(d,j=3.5hz,1h),4.46(s,3h),3.15(s,6h).
[0126]
(2)qm2荧光探针的合成步骤:
[0127]
化合物2称取0.107g(0.326mmol),5
‑
溴
‑2‑
醛基噻吩0.228g(1.19mmol),醋酸钾22mg(0.224mmol)溶解于10ml的乙醇溶液中,再滴加哌啶150μl,密闭条件下80℃反应1h。点板监控反应进程,待反应完成后静置至室温,有黑色固体析出,将黑色固体用硅胶柱固体柱层(硅胶100~200目;二氯甲烷:甲醇=40:1,v/v),得纯的产物78.5mg,产率48.04%。
[0128][0129]
核磁氢谱表征:
[0130]1h nmr(400mhz,dmso
‑
d6)δ8.69(d,j=9.1hz,1h),8.30(dd,j=28.1,9.5hz,2h),8.14(d,j=15.7hz,1h),7.77
–
7.69(m,1h),7.57
–
7.45(m,2h),7.41(t,j=2.9hz,1h),7.26(s,1h),4.45(s,3h),3.14(d,j=2.0hz,6h).
[0131]
(3)qm3荧光探针的合成步骤:
[0132]
化合物2称取0.098g(0.298mmol),3
‑
甲氧基
‑4‑
羟基苯甲醛0.095g(0.624mmol),醋酸钾28mg(0.285mmol)溶解于6ml的乙醇溶液中,再滴加哌啶100μl,密闭条件下80℃反应
2h。点板监控反应进程,待反应完成后静置至室温,有绿色固体析出,抽滤,洗涤,干燥,得到绿色固体产物82mg,产率59.52%。
[0133][0134]
核磁氢谱表征:
[0135]1h nmr(400mhz,dmso
‑
d6)δ8.26(d,j=9.2hz,1h),8.17
–
8.09(m,1h),8.06(d,j=9.6hz,1h),7.88(d,j=14.8hz,1h),7.48(dd,j=9.6,2.9hz,1h),7.33
–
7.25(m,2h),7.17
–
7.06(m,2h),6.53(d,j=8.3hz,1h),4.22(d,j=2.2hz,3h),3.80(s,3h),3.07(d,j=2.1hz,6h).
[0136]
(4)qm4荧光探针的合成步骤:
[0137]
化合物2称取0.098g(0.298mmol),3
‑
甲氧基
‑6‑
羟基苯甲醛0.236g(1.551mmol),醋酸钾45mg(0.458mmol)溶解于8ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应2h。点板监控反应进程,待反应完成后静置至室温,有固体析出,抽滤,洗涤,干燥得固体产物55mg,产率39.92%。
[0138][0139]
核磁氢谱表征:
[0140]1h nmr(400mhz,dmso
‑
d6)δ8.39(d,j=9.0hz,1h),8.15(t,j=9.0hz,2h),8.06(d,j=15.2hz,1h),7.90(d,j=15.2hz,1h),7.56(d,j=9.7hz,1h),7.17(d,j=2.8hz,1h),7.09(s,1h),6.85(dd,j=9.1,3.0hz,1h),6.63(d,j=9.2hz,1h),4.27(s,3h),3.73(s,3h),3.09(s,6h).
[0141]
(5)qm5荧光探针的合成步骤:
[0142]
化合物2称取0.131g(0.399mmol),4
‑
羟基苯甲醛0.118g(0.966mmol),醋酸钾50mg(0.509mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有黑色固体析出,抽滤,洗涤,干燥的黑色固体产物33mg,产率19.13%。
[0143][0144]
核磁氢谱表征:
[0145]1h nmr(400mhz,dmso
‑
d6)δ8.65(d,j=8.8hz,1h),8.31(t,j=7.3hz,2h),7.98(d,j=15.6hz,1h),7.80(d,j=8.1hz,2h),7.69(d,j=9.5hz,1h),7.61(d,j=15.6hz,1h),7.26(s,1h),6.90(d,j=8.0hz,2h),4.45(s,3h),3.13(s,6h).
[0146]
(6)qm6荧光探针的合成步骤:
[0147]
化合物2称取0.112g(0.341mmol),3
‑
羟基苯甲醛0.110g(0.901mmol),醋酸钾50mg(0.509mmol)溶解于8ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有黑色固体析出,抽滤,洗涤,干燥的黑色固体产物98mg,产率66.48%。
[0148][0149]
qm6荧光探针的核磁氢谱表征
[0150]1h nmr(400mhz,dmso
‑
d6)δ8.71(d,j=8.9hz,1h),8.35(dd,j=9.5,4.3hz,2h),7.90(d,j=16.0hz,1h),7.82
–
7.68(m,2h),7.33
–
7.21(m,4h),6.89(d,j=7.3hz,1h),4.49(s,3h),3.15(s,6h).
[0151]
(7)qm7荧光探针的合成步骤:
[0152]
化合物2称取0.112g(0.662mmol),2,4
‑
二羟基苯甲醛0.194g(1.405mmol),醋酸钾60mg(0.611mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。tlc监控反应进程,待反应完成后静置至室温,有深红色固体析出,抽滤,洗涤,干燥的深红色固体产物102mg,产率34.37%。
[0153][0154]
qm7荧光探针的核磁氢谱表征:
[0155]1h nmr(400mhz,dmso
‑
d6)δ9.89(s,1h),9.24(s,1h),8.55(s,1h),8.23(s,2h),8.03(d,j=15.2hz,1h),7.67(d,j=19.6hz,2h),7.50(d,j=8.2hz,1h),7.24(s,1h),6.39(d,j=13.2hz,2h),4.36(s,3h),3.21
–
2.94(m,6h).
[0156]
(8)qm8荧光探针的合成步骤:
[0157]
化合物2称取0.090g(0.274mmol),对甲基苯甲醛0.158g(1.315mmol),醋酸钾30mg(0.611mmol)溶解于7ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有黑色固体析出,抽滤,洗涤,干燥的暗红色固体产物20mg,产率16.96%。
[0158][0159]
qm8荧光探针的核磁氢谱表征:
[0160]1h nmr(400mhz,dmso
‑
d6)δ8.71(d,j=8.9hz,1h),8.35(d,j=9.3hz,2h),7.99(d,j=15.9hz,1h),7.86
–
7.77(m,3h),7.76
–
7.67(m,1h),7.35(d,j=7.8hz,2h),7.28(d,j=2.6hz,1h),4.50(d,j=1.7hz,3h),3.15(d,j=1.8hz,6h),2.39(s,3h).
[0161]
(9)qm9荧光探针的合成步骤:
[0162]
化合物2称取0.092g(0.275mmol),4
‑
乙酰氨基苯甲醛0.093g(0.570mmol),醋酸钾50mg(0.509mmol)溶解于7ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有红色固体析出,抽滤,洗涤,干燥的红色固体产物20mg,产率16.96%。
[0163][0164]
qm9荧光探针的核磁氢谱表征:
[0165]1h nmr(400mhz,dmso
‑
d6)δ10.25(s,1h),8.69(d,j=9.1hz,1h),8.34(d,j=9.6hz,2h),7.98(d,j=15.8hz,1h),7.88(d,j=8.4hz,2h),7.77
–
7.69(m,4h),7.27(s,1h),4.48(s,3h),3.14(d,j=2.2hz,6h),2.10(d,j=2.3hz,3h).
[0166]
(10)qm10荧光探针的合成步骤:
[0167]
化合物2称取0.130g(0.396mmol),4
‑
(1
‑
四氢吡咯)苯甲醛0.127g(0.724mmol),醋酸钾30mg(0.509mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应结束后,减压旋转蒸发至原体积的1/3,静置10min,抽滤,无水乙醇洗涤,干燥。最后得墨绿色固体44mg,产率为13.95%。
[0168][0169]
qm10荧光探针的核磁谱图表征:
[0170]1h nmr(400mhz,dmso
‑
d6)δ8.53(d,j=9.1hz,1h),8.27(dd,j=25.2,9.3hz,2h),8.01(d,j=15.5hz,1h),7.77(d,j=8.3hz,2h),7.62(dd,j=9.7,2.6hz,1h),7.45(d,j=15.5hz,1h),7.22(s,1h),6.65(d,j=8.3hz,2h),4.39(d,j=2.1hz,3h),3.37(d,j=4.8hz,4h),3.11(d,j=2.1hz,6h),2.00(q,j=4.3hz,4h).
[0171]
13
c nmr(101mhz,dmso
‑
d6)δ151.64,150.20,149.35,146.13,140.46,131.88,131.75,129.38,122.76,122.02,120.48,120.03,112.40,112.12,106.79,47.85,40.10,39.11,25.40.
[0172]
(11)qm11荧光探针的合成步骤:
[0173]
化合物2称取0.115g(0.350mmol),4
‑
(4
‑
羟基哌啶
‑1‑
基)苯甲醛(cas:79421
‑
44
‑
6)0.129g(0.629mmol),醋酸钾50mg(0.509mmol)溶解于8ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有黑色固体析出,抽滤,洗涤,干燥,得到黑色固体产物43mg,产率23.84%。
[0174][0175]
qm11荧光探针的核磁氢谱表征:
[0176]1h nmr(400mhz,dmso
‑
d6)δ8.59(d,j=9.1hz,1h),8.29(dd,j=16.1,9.4hz,2h),7.99(d,j=15.5hz,1h),7.77(d,j=8.4hz,2h),7.65(d,j=9.8hz,1h),7.54(d,j=15.7hz,1h),7.24(s,1h),7.04(d,j=8.4hz,2h),4.76(d,j=4.3hz,1h),4.42(s,2h),3.77(d,j=15.3hz,2h),3.12(s,6h),1.82(d,j=9.5hz,2h),1.44(d,j=10.6hz,2h).
[0177]
(12)qm12荧光探针的合成步骤:
[0178]
化合物2称取0.108g(0.329mmol),4
‑
(4
‑
甲基哌嗪)苯甲醛0.244g(1.194mmol),醋酸钾60mg(0.611mmol)溶解于7ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,有红色固体析出,抽滤,洗涤,干燥,得到红色固体产物102mg,产率60.26%。
[0179][0180]
qm12荧光探针的核磁谱图表征:
[0181]1h nmr(400mhz,dmso
‑
d6)δ8.60(d,j=9.1hz,1h),8.29(dd,j=13.6,9.4hz,2h),7.98(d,j=15.7hz,1h),7.79(d,j=8.4hz,2h),7.66(dt,j=9.8,2.2hz,1h),7.57(d,j=15.7hz,1h),7.24(t,j=2.2hz,1h),7.04(d,j=8.4hz,2h),4.43(s,3h),3.36(t,j=4.9hz,4h),3.12(d,j=1.6hz,6h),2.45(t,j=4.9hz,4h),2.24(s,3h).
[0182]
13
c nmr(101mhz,dmso
‑
d6)δ153.04,151.24,149.40,145.09,140.83,131.85,131.19,129.71,125.15,122.33,120.64,120.16,114.52,114.31,106.50,54.80,47.06,46.22,40.63,40.21.
[0183]
(13)qm13荧光探针的合成步骤:
[0184]
化合物2称取0.221g,(0.673mmol),6
‑
硝基胡椒醛(cas:712
‑
97
‑
0)0.257g(1.317mmol),醋酸钾90mg(0.917mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。tlc监控反应进程,待反应完成后静置至室温,有红色固体析出,抽滤,洗涤,干燥的红色固体产物64mg,产率18.82%。
[0185][0186]1h nmr(400mhz,dmso
‑
d6)δ9.30(s,1h),8.82(d,j=9.0hz,1h),8.47(d,j=9.9hz,1h),8.30(d,j=9.6hz,1h),7.86(d,j=9.9hz,1h),7.69(s,1h),7.28(d,j=2.4hz,1h),7.01(d,j=1.7hz,1h),6.21(s,2h),4.71(s,3h),3.19(d,j=1.7hz,6h).
[0187]
(14)qm14荧光探针的合成步骤
[0188]
化合物2称取0.115g(0.350mmol),4
‑
醛基吡啶0.166g(1.550mmol),醋酸钾50mg(0.509mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。tlc监控反应进程,待反应完成后静置至室温,产物通过硅胶柱层析纯化(硅胶粉100~200目),流动相为二氯甲烷:甲醇=50:1(v/v),最后得深红色固体产物18mg,产率12.32%。
[0189][0190]
qm14荧光探针的核磁氢谱表征:
[0191]1h nmr(400mhz,dmso
‑
d6)δ8.83
–
8.71(m,3h),8.38(dd,j=21.4,9.4hz,2h),8.11(d,j=15.2hz,1h),7.92(d,j=15.6hz,1h),7.85(d,j=4.8hz,2h),7.80(d,j=9.8hz,1h),7.30(d,j=3.1hz,1h),4.55(d,j=2.2hz,3h),3.17(d,j=2.1hz,6h).
[0192]
(15)qm15荧光探针的合成步骤
[0193]
化合物2称取0.113g(0.344mmol),2
‑
醛基吡咯0.120g(1.262mmol),醋酸钾30mg(0.305mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,抽滤,四氢呋喃洗涤三次,最后得绿色固体产物24mg,产率17.21%。
[0194][0195]
qm15荧光探针的核磁氢谱表征:
[0196]1h nmr(400mhz,dmso
‑
d6)δ11.97(s,1h),8.54(d,j=9.1hz,1h),8.24(dd,j=15.8,9.4hz,2h),7.95(d,j=15.5hz,1h),7.64(d,j=9.6hz,1h),7.43(d,j=15.5hz,1h),7.31(s,1h),7.23(s,1h),6.76(s,1h),6.32(d,j=3.3hz,1h),4.36(s,3h),3.12(s,6h).
[0197]
(16)qm16荧光探针的合成步骤
[0198]
化合物2称取0.228g(0.695mmol),n
‑
乙基咔唑
‑3‑
甲醛(cas:7570
‑
45
‑
8;分子式c
15
h
13
no)0.338g(1.514mmol),醋酸钾30mg(0.305mmol)溶解于10ml的乙醇溶液中,再滴加
哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,抽滤,获得的固体产物不纯,再采用硅胶柱层析纯化(硅胶粉100~200目),二氯甲烷:甲醇=20:1(v/v),最后得深红色固体产物50mg,产率13.48%。
[0199][0200]
qm16荧光探针的核磁氢谱表征:
[0201]1h nmr(400mhz,dmso
‑
d6)δ8.77(s,1h),8.66(d,j=9.1hz,1h),8.40(d,j=9.1hz,1h),8.35
–
8.17(m,3h),8.05(d,j=8.6hz,1h),7.85(d,j=15.7hz,1h),7.75(d,j=8.7hz,1h),7.72
–
7.64(m,2h),7.57
–
7.48(m,1h),7.32(t,j=7.4hz,1h),7.23(d,j=2.9hz,1h),4.52(s,3h),4.49(d,j=6.9hz,2h),3.13(s,6h),1.36(t,j=7.1hz,3h).
[0202]
(17)qm17荧光探针的合成步骤
[0203]
化合物2称取0.153g,(0.466mmol),2
‑
氯
‑5‑
醛基吡啶0.128g(0.904mmol),醋酸钾20mg(0.203mmol)溶解于10ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,抽滤,无水乙醇洗涤三次,干燥称量,最后得固体产物56mg,产率26.60%。
[0204][0205]
qm17荧光探针的核磁氢谱表征:
[0206]1h nmr(400mhz,dmso
‑
d6)δ8.87(s,1h),8.78(d,j=8.9hz,1h),8.49(d,j=8.4hz,1h),8.36(dd,j=19.1,9.2hz,2h),8.02(s,2h),7.75(dd,j=22.4,8.9hz,2h),7.29(s,1h),4.54(s,3h),3.16(d,j=1.6hz,6h).
[0207]
(18)qm18荧光探针的合成步骤
[0208]
化合物2称取0.106g(0.323mmol),4
‑
氰基苯甲醛0.100g(0.763mmol),醋酸钾50mg(0.509mmol)溶解于8ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,抽滤,无水乙醇洗涤三次,干燥称量,最后得固体产物59mg,产率41.39%。
[0209][0210]
qm18荧光探针的核磁氢谱表征:
[0211]1h nmr(400mhz,dmso
‑
d6)δ8.78(d,j=8.9hz,1h),8.37(dd,j=16.3,9.4hz,2h),8.11(d,j=8.0hz,2h),8.05
–
7.96(m,4h),7.82
–
7.74(m,1h),7.29(d,j=2.5hz,1h),4.54
(d,j=2.0hz,3h),3.16(d,j=2.0hz,6h).
[0212]
(19)qm19荧光探针的合成步骤
[0213]
化合物2称取0.107g(0.325mmol),2
‑
羧基苯甲醛0.095g(0.633mmol),醋酸钾50mg(0.509mmol)溶解于8ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,抽滤,无水乙醇洗涤三次,干燥称量,最后得固体产物33mg,产率22.06%。
[0214][0215]
qm19荧光探针核磁氢谱结构表征:
[0216]1h nmr(400mhz,dmso
‑
d6)δ8.84(d,j=16.0hz,1h),8.67(d,j=8.9hz,1h),8.31(d,j=9.8hz,1h),8.06(d,j=9.0hz,1h),7.95
–
7.88(m,1h),7.78
–
7.66(m,2h),7.54(d,j=15.9hz,1h),7.40(dd,j=5.8,3.0hz,2h),7.24(d,j=3.1hz,1h),4.46(d,j=2.0hz,3h),3.13(d,j=1.9hz,6h).
[0217]
(20)qm20荧光探针的合成步骤
[0218]
化合物2称取0.060g(0.183mmol),对二甲氨基苯甲醛0.099g(0.664mmol),醋酸钾60mg(0.611mmol)溶解于8ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,抽滤,无水乙醇洗涤三次,干燥称量,最后得红色固体产物72mg,产率85.64%。
[0219][0220]
qm20荧光探针的核磁谱图结构表征:
[0221]1h nmr(400mhz,dmso
‑
d6)δ8.54(d,j=9.1hz,1h),8.27(dd,j=21.8,9.5hz,2h),8.00(d,j=15.6hz,1h),7.82
–
7.73(m,2h),7.62(dd,j=9.8,3.0hz,1h),7.48(d,j=15.6hz,1h),7.22(d,j=3.0hz,1h),6.84
–
6.76(m,2h),4.40(s,3h),3.11(s,6h),3.05(s,6h).
[0222]
13
c nmr(101mhz,dmso
‑
d6)δ152.59,151.44,151.44,149.28,149.28,145.75,145.74,140.50,140.50,131.79,131.47,129.43,123.07,122.03,120.47,120.03,112.69,112.18,106.65,40.16,39.20.
[0223]
(21)qm21荧光探针的合成步骤
[0224]
化合物2称取0.234g(0.713mmol),对二甲氨基肉桂醛0.425g(2.425mmol),醋酸钾60mg(0.611mmol)溶解于25ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。点板监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,固体颗粒柱层析纯化
(硅胶粉100~200目),二氯甲烷:甲醇=40:1(v/v),最后得红色固体产物76mg,产率21.96%。
[0225][0226]
qm21荧光探针的核磁谱图结构表征:
[0227]1h nmr(400mhz,dmso
‑
d6)δ8.55(d,j=9.1hz,1h),8.23(d,j=9.5hz,2h),7.89(dd,j=14.7,10.2hz,1h),7.64(dd,j=9.8,2.9hz,1h),7.47(d,j=8.5hz,2h),7.28
–
7.20(m,2h),7.18
–
7.06(m,2h),6.75(d,j=8.4hz,2h),4.34(s,3h),3.12(s,6h),3.00(s,6h).
[0228]
13
c nmr(101mhz,dmso
‑
d6)δ151.72,150.58,149.42,146.63,143.49,140.62,131.90,129.73,129.55,124.00,122.38,120.47,120.12,119.23,112.52,112.35,106.53,40.34,39.08.
[0229]
(22)qm22荧光探针的合成步骤:
[0230]
①
称取4
‑
二甲氨基肉桂醛0.749g(4.274mmol),与18
‑
冠
‑6‑
醚220mg(0.832mmol)和(1,3
‑
二氧戊环
‑2‑
基)甲基三苯基溴化膦2.276g(5.302mmol)溶于30ml的无水四氢呋喃中,氩气条件下反应,再将氰化钠0.550g(22.916mmol)加入当上述溶液中,室温条件下搅拌反应1h。然后加入20ml水淬灭反应物,用乙酸乙酯萃取,减压旋蒸浓缩至残渣,将残渣溶解于含有10%(w/v)草酸的四氢呋喃溶液15ml中,继续室温条件搅拌12h反应。反应结束后用饱和碳酸氢钠溶液调ph至碱性,会有大量固体盐析出,抽滤除去盐,滤液用乙酸乙酯萃取,有机溶剂中加入无水硫酸镁干燥,接着减压旋蒸得固体残渣,残渣用200~300目硅胶柱纯化(石油醚:乙酸乙酯=30:1,v/v)得0.132g纯产物,产率为15.34%。
[0231][0232]
中间体dapdea的核磁氢谱结构表征:
[0233]1h nmr(400mhz,dmso
‑
d6)δ9.51(d,j=8.1hz,1h),7.44(dd,j=13.8,9.6hz,3h),7.13
–
6.92(m,2h),6.72(d,j=8.6hz,2h),6.15(dd,j=14.9,8.2hz,1h),2.98(s,6h).
[0234]
②
化合物2称取0.088g(0.268mmol),中间体dapdea0.053g(0.263mmol),醋酸钾60mg(0.611mmol)溶解于6ml的乙醇溶液中,再滴加哌啶200μl,密闭条件下80℃反应1.5h。tlc监控反应进程,待反应完成后静置至室温,产物会从溶液中析出,反应液抽滤,无水乙醇洗涤三次,干燥,称量得黑色固体产物76mg,产率55.45%。
[0235][0236]
qm22荧光探针的核磁谱图表征:
[0237]1h nmr(400mhz,dmso
‑
d6)δ8.55(d,j=9.1hz,1h),8.23(dd,j=9.6,4.1hz,2h),
7.83(dd,j=14.7,11.0hz,1h),7.65(dd,j=9.8,3.0hz,1h),7.43(d,j=8.5hz,2h),7.27
–
7.18(m,2h),7.08
–
6.83(m,3h),6.83
–
6.68(m,3h),4.34(s,3h),3.12(s,6h),2.97(s,6h).
[0238]
13
c nmr(101mhz,dmso
‑
d6)δ151.14,150.30,149.46,145.74,144.63,140.62,139.86,131.95,130.11,129.89,129.74,129.15,124.52,124.10,122.48,120.57,120.23,120.19,112.45,106.41,40.26,39.86,39.17.
[0239]
(23)qs
‑
1荧光探针的合成步骤:
[0240]
①
称取化合物1 1.20g(6.44mmol),1,4
‑
丁磺酸内酯0.90g(6.61mmol),溶于10ml的邻二氯苯中,于120℃的密闭条件下反应12h,待反应结束。硅胶柱层析纯化(硅胶粉100
‑
200目)(二氯甲烷:甲醇=10:1,v/v),最后得产物(中间体qs)0.632g,产率为30.44%。
[0241][0242]
中间体qs的核磁氢谱表征:
[0243]1h nmr(400mhz,dmso
‑
d6)δ8.71(d,j=8.7hz,1h),8.45(d,j=9.8hz,1h),7.85(d,j=8.6hz,1h),7.75(dd,j=9.7,3.2hz,1h),7.25(d,j=3.3hz,1h),5.76(s,3h),4.36(t,j=5.1hz,2h),3.12(s,6h),1.85(t,j=7.3hz,2h),1.57(dt,j=15.5,7.9hz,2h),1.44(p,j=7.0hz,2h).
[0244]
②
中间体qs称取1.136g(0.422mmol),n
‑
乙基咔唑
‑3‑
甲醛0.225g(1.008mmol),醋酸钾55mg(0.560mg),将其溶于6ml的无水乙醇中,然后滴加200ul的哌啶,在耐压管中80℃加热反应2h。反应结束后静置至室温,有固体析出,抽滤,洗涤,干燥,产物不纯,硅胶柱层析((硅胶粉100~200目,二氯甲烷:甲醇=20:1,v/v)浓缩旋转得红色固体0.109g,产率为48.95%。
[0245][0246]
qs
‑
1荧光探针的核磁氢谱表征:
[0247]1h nmr(400mhz,dmso
‑
d6)δ8.54(d,j=9.8hz,1h),8.45(d,j=8.8hz,1h),8.17(s,1h),8.01(d,j=7.8hz,1h),7.77(dd,j=9.9,3.1hz,1h),7.62(d,j=8.2hz,1h),7.57(d,j=12.1hz,1h),7.53
–
7.43(m,3h),7.27(d,j=8.0hz,1h),7.23
–
7.13(m,2h),6.99(d,j=12.0hz,1h),5.00(s,2h),4.11(q,j=5.3hz,2h),3.14(s,6h),2.57(t,j=7.3hz,2h),1.94
–
1.85(m,2h),1.29(t,j=7.0hz,3h),1.06(t,j=7.0hz,2h).
[0248]
(24)qs
‑
2荧光探针的合成步骤:
[0249]
称取上述制备的中间体qs 1.156g(0.484mmol),4
‑
吡咯苯甲醛0.140g(0.799mmol),醋酸钾103mg(1.050mg),将其溶于10ml的无水乙醇中,然后滴加200μl的哌啶,在耐压管中80℃加热反应2h。反应结束后静置至室温,有固体析出,固体颗粒抽滤完硅胶柱层析(硅胶粉100~200目,二氯甲烷:甲醇=20:1,v/v),得红色固体0.104g,产率为44.80%。
[0250][0251]
qs
‑
1荧光探针的核磁氢谱表征:
[0252]1h nmr(400mhz,dmso
‑
d6)δ8.52(d,j=9.1hz,1h),8.30(dd,j=19.4,9.7hz,2h),8.06(d,j=22.9hz,2h),7.84(d,j=8.6hz,2h),7.46(d,j=15.6hz,1h),7.22(d,j=3.0hz,1h),6.66(d,j=8.6hz,2h),4.94(t,j=8.1hz,2h),3.57(s,6h),3.11(s,4h),2.56(dt,j=12.7,6.7hz,2h),2.00(td,j=5.8,5.2,3.3hz,4h),1.34
–
1.10(m,4h).
[0253]
(25)qm
‑
sf
‑
1荧光探针的合成步骤:
[0254]
①
先将对甲氧基苯硼酸0.602g(3.962mmol)和四(三苯基膦)钯(pd(pph3)4)0.346g(0.2994mmol)溶于20ml甲苯中。同时称量5
‑
溴
‑2‑
甲醛噻吩0.650g(3.402mmol)和2m k2co
3 2ml加入到16ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于100℃的油浴锅中回流反应5h,tlc监控反应进程。待反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(石油醚/乙酸乙酯(pe:ea)=10:1,v/v),旋干溶剂得白色固体粉末(中间体sf
‑
1)0.164g,产率为22.14%。
[0255][0256]
中间体sf
‑
1的核磁氢谱表征:
[0257]1h nmr(400mhz,chloroform
‑
d)δ9.88(d,j=0.8hz,1h),7.74(dd,j=3.9,0.8hz,1h),7.66
–
7.62(m,2h),7.32(dd,j=4.0,0.8hz,1h),7.01
–
6.94(m,2h),3.88(d,j=0.8hz,3h).
[0258]
②
称量化合物2 0.081g(0.247mmol),中间体sf
‑
1 0.094g(0.431mmol),醋酸钾89mg(0.907mmol)溶于10ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件下密闭反应30min,有大量红色固体析出,将其抽滤,洗涤,干燥,得红色固体产物71mg,产率为54.39%。
[0259][0260]
qm
‑
sf
‑
1荧光探针的核磁谱图表征:
[0261]1h nmr(400mhz,dmso
‑
d6)δ8.64(d,j=9.1hz,1h),8.34
–
8.17(m,3h),7.72
–
7.64(m,4h),7.56(d,j=3.8hz,1h),7.42(d,j=15.5hz,1h),7.23(d,j=3.1hz,1h),7.04(d,j=8.3hz,2h),4.44(s,3h),3.82(s,3h),3.13(s,6h).
[0262]
13
c nmr(101mhz,dmso
‑
d6)δ160.34,150.07,149.62,148.73,141.25,132.06,130.23,127.59,125.97,124.73,122.91,120.87,120.36,117.16,115.23,106.25,55.84,40.59,39.44.
[0263]
(26)qm
‑
sf
‑
2荧光探针的合成步骤:
[0264]
①
先将对叔丁基苯硼酸0.628g(3.527mmol)和pd(pph3)
4 0.326g(0.282mmol)溶于20ml甲苯中。同时称量5
‑
溴
‑2‑
甲醛噻吩0.638g(3.339mmol)和2m k2co
3 2ml加入到16ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于100℃的油浴锅中回流反应5h,tlc监控反应进程。反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(pe:ea=20:1)旋干溶剂得白色固体粉末0.750g,产率为87.02%。
[0265][0266]
中间体sf
‑
2核磁氢谱的结构表征:
[0267]1h nmr(400mhz,chloroform
‑
d)δ9.88(s,1h),7.73(d,j=3.9hz,1h),7.63
–
7.59(m,2h),7.48
–
7.43(m,2h),7.37(d,j=3.9hz,1h),1.35(s,9h).
[0268]
②
称量化合物2 0.120g(0.366mmol),中间体sf
‑
2 0.152g(0.623mmol),醋酸钾156mg(1.589mmol)溶于8ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件下密闭反应1.5h,有大量红色固体析出,将其抽滤,洗涤,干燥,得红色固体产物19mg,产率为9.36%。
[0269][0270]
qm
‑
sf
‑
2荧光探针的核磁氢谱结构表征:
[0271]1h nmr(400mhz,dmso
‑
d6)δ8.67(d,j=9.1hz,1h),8.32(dd,j=9.5,6.0hz,2h),8.23(d,j=15.6hz,1h),7.70(td,j=7.2,6.5,3.7hz,4h),7.65(d,j=3.9hz,1h),7.53
–
7.45(m,3h),7.25(d,j=3.0hz,1h),4.46(s,3h),3.14(s,6h),1.32(s,9h).
[0272]
(27)qm
‑
sf
‑
3荧光探针的合成步骤:
[0273]
①
先将苯硼酸0.540g(4.429mmol)和pd(pph3)
4 0.417g(0.361mmol)溶于20ml甲苯中。同时称量5
‑
溴
‑2‑
甲醛噻吩0.849g(4.444mmol)和2m k2co
3 2ml加入到18ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于100℃的油浴锅中回流反应5h,tlc监控反应进程。反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(pe:ea=20:1,v/v),旋干溶剂得白色固体粉末0.630g,产率为75.54%。
[0274][0275]
中间体sf
‑
3的核磁氢谱结构表征:
[0276]1h nmr(400mhz,chloroform
‑
d)δ9.89(s,1h),7.74(d,j=3.9hz,1h),7.71
–
7.63(m,2h),7.49
–
7.33(m,4h).
[0277]
②
化合物2称取0.120g(0.365mmol),中间体sf
‑
3 0.120g(0.637mmol),醋酸钾45mg(0.457mmol)溶于10ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件下密闭反应1h,有固体析出,将其抽滤,洗涤,干燥,得红色固体产物79mg,产率为43.42%。
[0278][0279]
qm
‑
sf
‑
3荧光探针的核磁谱图表征:
[0280]1h nmr(400mhz,dmso
‑
d6)δ8.67(d,j=9.1hz,1h),8.31(dd,j=9.5,4.5hz,2h),8.23(d,j=15.6hz,1h),7.80
–
7.66(m,5h),7.55
–
7.45(m,3h),7.45
–
7.36(m,1h),7.24(d,j=3.0hz,1h),4.46(s,3h),3.13(s,6h).
[0281]
13
c nmr(101mhz,dmso
‑
d6)δ149.64,149.44,148.25,141.13,139.87,136.49,134.15,133.20,130.17,129.75,129.22,126.00,125.82,122.78,120.69,120.25,117.49,106.08,40.40,39.78.
[0282]
(28)qm
‑
sf
‑
4荧光探针的合成步骤:
[0283]
①
先将对氟苯硼酸0.732g(5.231mmol)和pd(pph3)
4 0.594g(0.514mmol)溶于40ml甲苯中。同时称量5
‑
溴
‑2‑
甲醛噻吩1.113g(5.826mmol)和2m k2co
3 4ml加入到30ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于100℃的油浴锅中回流反应5h,tlc监控反应进程。反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(pe:ea=50:1,v/v)旋干溶剂得白色固体粉末1.041g,产率为96.42%。
[0284][0285]
中间体sf
‑
4化合物核磁氢谱的结构表征:
[0286]1h nmr(400mhz,chloroform
‑
d)δ9.89(s,1h),7.73(d,j=3.9hz,1h),7.70
–
7.60(m,2h),7.34(d,j=3.9hz,1h),7.19
–
7.08(m,2h).
[0287]
②
称量化合物2 0.225g(0.685mmol),中间体sf
‑
4 0.146g(0.708mmol),醋酸钾150mg(1.528mmol)溶于150ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件下密闭反应1.5h,有固体析出,将其抽滤,洗涤,干燥,得深红色固体产物200mg,产率为56.53%。
[0288][0289]
qm
‑
sf
‑
4荧光探针的核磁谱图表征:
[0290]1h nmr(400mhz,dmso
‑
d6)δ8.66(d,j=9.1hz,1h),8.31(dd,j=9.5,5.6hz,2h),8.21(d,j=15.6hz,1h),7.85
–
7.75(m,2h),7.75
–
7.62(m,3h),7.49(d,j=15.6hz,1h),7.33(t,j=8.8hz,2h),7.23(d,j=2.9hz,1h),4.45(s,3h),3.13(s,6h).
[0291]
13
c nmr(101mhz,dmso
‑
d6)δ161.43,149.68,149.50,147.02,141.19,139.92,136.43,134.13,131.92,130.22,129.85,128.18,128.10,125.96,122.84,120.73,120.29,117.58,116.84,116.62,106.10,40.54,39.48.
[0292]
(29)qm
‑
sf
‑
5荧光探针的合成步骤:
[0293]
①
先将对二甲胺基溴苯0.618g(3.089mmol)和pd(pph3)
4 0.303g(0.262mmol)溶于20ml甲苯中。同时称量5
‑
硼酸
‑2‑
甲醛噻吩0.452g(2.898mmol)和2m k2co
3 3ml加入到16ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于100℃的油浴锅中回流反应5h,tlc监控反应进程。反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(pe:ea=30:1,v/v),旋干溶剂得白色固体粉末0.200g,产率为29.84%。
[0294][0295]
中间体sf
‑
5化合物的核磁氢谱结构表征:
[0296]1h nmr(400mhz,chloroform
‑
d)δ9.82(s,1h),7.68(d,j=3.9hz,1h),7.59
–
7.50(m,2h),7.25(d,j=8.5hz,1h),6.78
–
6.67(m,2h),3.03(s,6h).
[0297]
②
称量化合物2 0.151g(0.460mmol),中间体sf
‑
5 0.107g(0.460mmol),醋酸钾102mg(1.039mmol)溶于10ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件下密闭反应3h,有黑色固体析出,将其抽滤,洗涤,干燥,得黑色固体产物0.130g,产率为52.19%。
[0298][0299]
qm
‑
sf
‑
5荧光探针的核磁氢谱结构表征:
[0300]1h nmr(400mhz,dmso
‑
d6)δ8.59(d,j=9.1hz,1h),8.30
–
8.23(m,2h),8.20(d,j=15.3hz,1h),7.69
–
7.59(m,2h),7.56(d,j=8.4hz,2h),7.44(d,j=3.9hz,1h),7.30(d,j=15.5hz,1h),7.21(d,j=3.0hz,1h),6.75(d,j=8.5hz,2h),4.40(s,3h),3.12(s,6h),2.98(s,6h).
[0301]
(30)qm
‑
sf
‑
6荧光探针的合成步骤:
[0302]
①
先将对氰基苯硼酸0.582g(3.95mmol)和pd(pph3)
4 0.408g(0.353mmol)溶于20ml甲苯中。同时称量5
‑
溴
‑2‑
甲醛噻吩0.804g(4.20mmol)和2m k2co
3 2ml加入到16ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于100℃的油浴锅中回流反应5h,tlc监控反应进程。反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(pe:ea=20:1,v/v),旋干溶剂得白色固体粉末1.65g(湿)。
[0303][0304]
中间体sf
‑
6化合物的核磁氢谱表征:
[0305]1h nmr(400mhz,chloroform
‑
d)δ9.94(s,1h),7.79(d,j=1.5hz,1h),7.78
–
7.75(m,2h),7.75
–
7.69(m,2h),7.50(d,j=4.0hz,1h).
[0306]
②
称量化合物2 0.139g(0.423mmol),中间体sf
‑
6 0.124g(0.587mmol),醋酸钾101mg(1.029mmol)溶于10ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件
下密闭反应3h,反应液旋干至固体,200~300目硅胶柱层析(二氯甲烷:甲醇=30:1,v/v),得红褐色固体产物123mg,产率为55.55%。
[0307][0308]
qm
‑
sf
‑
6荧光探针的核磁谱图表征:
[0309]1h nmr(400mhz,dmso
‑
d6)δ8.68(d,j=9.1hz,1h),8.32(t,j=8.9hz,2h),8.22(d,j=15.6hz,1h),7.93(s,4h),7.89(d,j=4.0hz,1h),7.80(d,j=3.9hz,1h),7.72(dd,j=9.8,2.9hz,1h),7.59(d,j=15.6hz,1h),7.24(d,j=3.0hz,1h),4.47(s,3h),3.14(s,6h).
[0310]
13
c nmr(101mhz,dmso
‑
d6)δ149.41,149.16,145.38,141.75,141.12,137.16,135.75,133.67,133.43,131.79,130.25,128.08,126.21,122.84,120.61,120.25,119.06,118.39,110.71,105.94,49.07,40.14.
[0311]
(31)qm
‑
sf
‑
nph3荧光探针的合成步骤:
[0312]
①
先将4
‑
硼酸三苯胺(cas:201802
‑
67
‑
7)0.769g(2.66mmol)和pd(pph3)
4 0.255g(0.221mmol)溶于17ml甲苯中。同时称量5
‑
溴
‑2‑
甲醛噻吩0.570g(2.72mmol)和2m k2co
3 2ml加入到16ml的乙醇中,再将后者加入到前者甲苯溶液中。抽去反应瓶中的空气,通入氩气至反应瓶中。将其置于80℃的油浴锅中回流反应2.5h,tlc监控反应进程。反应结束后减压旋干至滤渣,用200~300目硅胶粉柱层析(pe:ea=50:1,v/v)旋干溶剂得黄色固体粉末0.793g,产率为83.87%。
[0313][0314]
中间体sf
‑
nph3化合物的核磁氢谱结构表征:
[0315]1h nmr(400mhz,chloroform
‑
d)δ9.88(s,1h),7.73(d,j=4.0hz,1h),7.59
–
7.50(m,2h),7.35
–
7.29(m,5h),7.19
–
7.06(m,8h).
[0316]
②
称量化合物2 0.122g(0.372mmol),中间体sf
‑
nph3 0.132g(0.371mmol),醋酸钾130mg(1.325mmol)溶于10ml的无水乙醇中,搅拌均匀,再滴加哌啶200μl混匀,于80℃条件下密闭反应1.5h,有固体析出,将其抽滤,洗涤,干燥,得黑色固体产物0.143g,产率为57.90%。
[0317][0318]
qm
‑
sf
‑
nph3荧光探针的核磁氢谱结构表征:
[0319]1h nmr(400mhz,dmso
‑
d6)δ8.64(d,j=9.1hz,1h),8.31(d,j=4.7hz,1h),8.30
–
8.17(m,2h),7.73
–
7.62(m,4h),7.56(d,j=3.9hz,1h),7.47
–
7.32(m,5h),7.24(d,j=2.9hz,1h),7.18
–
7.06(m,6h),7.00(d,j=8.7hz,2h),4.44(s,3h),3.13(s,6h).
[0320]
实施例2
[0321]
(1)aβ聚集体的制备;
[0322]
将购买的aβ1
‑
42聚集体蛋白(购买于强耀生物科技有限公司)溶解于1%(v/v)氨水中,浓度为100μm,37℃下连续孵育一周,即得aβ1
‑
42聚集体。
[0323]
(2)荧光光谱的测定
[0324]
对实施例1中获得的31种荧光探针进行荧光光谱的测定:在含有1μm荧光探针分子的pbs缓冲液溶液(ph 7.4,10mm)中,分别加入步骤(1)中孵育后得到的aβ1
‑
42聚集体,按aβ1
‑
42聚集体蛋白与荧光探针的摩尔比为10:1(10倍当量)加入,同时以加入等量pbs缓冲液溶液(ph 7.4,10mm)为对照,使用荧光分光光度计记录测量其激发光谱和发射光谱。
[0325]
荧光探针与β淀粉样蛋白(aβ1
‑
42聚集体)的荧光光谱如图3所示。
[0326]
荧光探针的激发波长和发射波长如表1所示。
[0327]
表1 31种荧光探针的激发波长和发射波长汇总
[0328]
[0329][0330]
表中:
[0331]
λex:探针的激发波长;
[0332]
λem1:探针的最大发射波长;
[0333]
λem2:探针与aβ聚集体结合后的最大发射波长。
[0334]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1