一种辛酸酰化修饰抗菌肽及其应用
本发明涉及基因工程及生物制剂技术领域,具体地说,涉及一种辛酸酰化修饰抗菌肽及其应用。
背景技术:
抗生素的滥用导致了耐药真菌和耐药细菌出现,尤其是超级真菌等,已经对多种抗生素产生了耐药性并严重威胁着人类健康。虽然酮康唑、氟康唑等传统的抗真菌药物具有一定的治疗效果,但它们更容易诱导真菌产生耐药性,并对人体产生一定的副作用。因此,迫切需要开发一种新型的低毒高效抗真菌药物。
抗菌肽几乎存在于所有的动物体内,构成了动物机体的第一道防线。通常,抗菌肽通过扰乱菌体的膜稳定性,导致菌体内容物泄露而发挥抗菌活性,抗菌肽的二级结构对生物学活性有至关重要的影响,抗菌肽在水环境中为无规则构象,当抗菌肽进入到膜环境中时,伴随着二级结构的变化菌膜发生破裂进而菌株死亡。与抗生素相比,这种物理破膜方式不易使菌体产生耐药性。因此,抗菌肽也成为理想的抗生素替代物。尽管目前有大量的抗菌肽从动物体内分离,但是天然的抗菌肽存在活性差,毒性高的缺点,尤其是对真菌的抗菌活性不足。因此,有必要进行人工肽设计研究,以解决天然抗菌肽的缺陷。
技术实现要素:
基于天然抗菌肽所存在的缺点,发明的目的是提供一种可有效抗真菌和细菌的肽。以解决抗生素引起的真菌耐药性问题。
为了实现本发明的发明目的,本发明的技术方案如下:
一种抗菌肽,所述抗菌肽的氨基酸序列如seqidno.1所示。
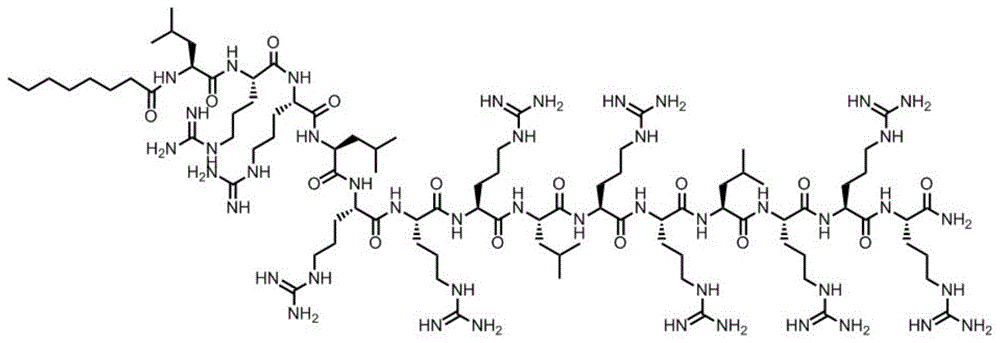
二级结构对抗菌肽活性的发挥扮演着重要的作用,在所有已知二级结构中,α-螺旋结构占主导地位。七肽重复序列是α-螺旋结构的基本和简化形式,通常简写为(abcdefg)n,是以a和d位置疏水性氨基酸侧链的氢键作用稳定结构。这种重复模式对抗菌肽活性发挥及毒性的平衡具有重要作用。本发明的肽为辛酸酰化修饰的抗菌肽,其模拟天然蛋白质中α-螺旋二级结构氨基酸的排布规则,以亮氨酸和精氨酸分别提供疏水性和阳离子性,以七肽重复序列“abcdefg”为模板,将此序列重复两次,保证了充足的电荷量,然后将序列n末端进行辛酸酰化修饰,c末端酰胺化,得到本发明的抗菌肽(c8lr),其序列为c8-lrrlrrrlrrlrrr-nh2(c8-leuargargleuargargargleuargargleuargargarg-nh2),分子量为2157.76。c8lr电荷量为11,10个精氨酸和c端酰胺化为肽提供了充足的电荷量,保证肽能够充分的与菌膜接触。4个亮氨酸和辛酸酰化n端修饰为肽提供了足够的驱动力,保证肽能插入菌膜中破坏菌株。该方法使多肽具有强烈的抗细菌和真菌活性,同时具备低溶血活性。
本发明将亮氨酸放置于a和d位置充当肽的疏水核心,使a和d位置亮氨酸之间形成氢键,以保证肽形成α-螺旋结构,合理利用了亮氨酸的强烈的α-螺旋倾向性和强疏水性。
由于阳离子是肽具备抗菌活性的必要条件。本发明选择精氨酸,并且将精氨酸放置于b,c,e,f和g位置。利用其胍基侧链,与两个脂质头基团的磷酸酯部分形成强力的双齿氢键,从而促进抗菌肽具备更深的膜插入能力。此外,本发明还将上述由精氨酸和亮氨酸组成的七肽序列模式重复两次,保证了肽序列具备10个正电荷,从而保证了序列具备充足的阳离子性,进而利于与真菌和细菌菌膜通过静电作用充分结合,提升杀灭效果。
本发明还将肽序列n末端用辛酸修饰,进一步增强了肽的疏水性和稳定性,将肽序列的c末端进行酰胺化,进一步增强了肽的阳离子性和稳定性。最终,形成了结构简单,且具备理想抗真菌、细菌效果的肽。
本发明同时考虑了肽的螺旋度、整体疏水性、两亲性及电荷数,并且对多项参数进行了平衡,创制了一种具有广谱抗菌活性,尤其是抗真菌活性的人工肽,其生物相容性好,抗菌效果佳,可解决病菌抗药性问题,且氨基酸序列短,易于创制,适于大规模推广。
本发明还提供:
上述抗菌肽在制备抗真菌制剂中的应用。
上述抗菌肽在制备抗细菌制剂中的应用。
其中,所述的制剂为药物或保健品。
上述抗菌肽在制备消毒剂中的应用。
上述抗菌肽在制备清洁剂中的应用。
上述抗菌肽在制备防腐剂中的应用。
一种产品,所述产品为药物、保健品、消毒剂、清洁剂或防腐剂,其特征在于,包含上述抗菌肽。
本发明的有益效果至少在于:
本发明的肽链短,化学方法合成简单,制备成本低廉,对得到的辛酸酰化修饰肽进行抗菌活性检测,发现肽具有抗真菌和抗细菌活性,其不易诱导细菌和真菌产生耐药性,对治疗真菌和细菌感染具有较高的应用价值。另外,对肽进行了溶血活性测试,发现肽溶血活性低,表明肽具备良好的生物相容性,治疗指数达到145.45,有较大的临床应用潜力。
附图说明
图1为本发明抗菌肽的结构示意图。
图2为本发明抗菌肽高效液相色谱图。图中,最高峰的出峰时间为14.860分钟。
图3为本发明抗菌肽质谱图。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
本实施例采用固相化学合成法合成本发明的抗菌肽(参见seqidno.1所示),肽结构如图1所示:
1、抗菌肽的制备从c端到n端逐一进行,通过多肽合成仪来完成。首先将fmoc-x(x是每个抗菌肽的c端第一个氨基酸)接入到wang树脂,然后脱去fmoc基团后得到x-wang树脂;再将fmoc-y-trt-oh(9-芴甲氧羧基-三甲基-y,y为每个抗菌肽c端第二个氨基酸);按照这个程序依次从c端合成到n端,直至合成完毕,得到脱去fmoc基团的侧链保护的树脂;
2、在上述得到的肽树脂中,加入切割试剂,20℃避光下反应2h,过滤;沉淀tfa(三氟乙酸)洗涤,将洗液与上述滤液混合,旋转蒸发仪浓缩,再加入10倍左右体积的预冷无水乙醚,-20℃沉淀3h,析出白色粉末物,以2500g离心10min,收集沉淀,再用无水乙醚洗涤沉淀,真空干燥,得到多肽,其中切割试剂由tfa、水和tis(三异丙基氯硅烷)按照质量比95:2.5:2.5混合而成;
3、使用0.2mol/l硫酸钠(磷酸调节至ph7.5)进行柱平衡30min,用90%乙腈水溶液溶解多肽,过滤,c18反相常压柱,采用梯度洗脱(洗脱剂为甲醇和硫酸钠水溶液按照体积比为30:70~70:30混合),流速为1ml/min,检测波为220nm,收集主峰,冻干;再利用反相c18柱进一步纯化,洗脱液a为0.1%tfa/水溶液;洗脱液b为0.1%tfa/乙腈溶液,洗脱浓度为25%b~40%b,洗脱时间为12min,流速为1ml/min,再同上收集主峰,冻干;
4、抗菌肽的鉴定:将上述得到的抗菌肽经过电喷雾质谱法分析,质谱图中显示的分子量(如图3抗菌肽质谱图所示)与理论分子量2157.76基本一致,抗菌肽的纯度大于95%(参见图2抗菌肽高效液相色谱图,色谱柱为kromasilc18-5(4.6×250mm,220nm,10μl),使用非线性梯度的水/乙腈(含0.1%三氟乙酸),流速为1.0ml/min)。
实施例2
肽的抗真菌活性的测定:利用微量稀释法测定实施例1制备得到的肽(c8lr)对真菌的最小抑菌浓度。用含有0.01%乙酸的0.2%胎牛血清白蛋白作为稀释液加入96孔板中,使用倍比稀释法依次配置系列梯度的本发明实施例1获得的抗菌肽溶液,使每个孔中的溶液体积为50μl。然后分别添加50μl的待测菌液(~103cfu/ml)于各孔中,培养基为含有mops的rpmi1640(ph=7.0)。分别设置阳性对照(含有菌液而不含有抗菌肽)和阴性对照(既不含菌液也不含肽)。于28℃恒温培养48h,然后用酶标仪在492nm处测定光吸收值,以数值大于0.1为菌株生长的判定标准,确定肽对真菌的最小抑菌浓度。试验设定两个平行,重复三次。结果见表1。在表1中,c.albicans10231购自北京百欧博伟生物技术有限公司,c.albicanscmcc(f)98001购自上海鲁微科技有限公司。
表1抗菌肽c8lr对真菌的抑菌活性(μm)
由表1可以看出,肽c8lr对白色念珠菌展现出极强的抑制作用,在2μm浓度下能完全抑制白色念珠菌的生长。
实施例3
肽的抗细菌活性的测定:利用微量稀释法测定实施例1制备得到的肽(c8lr)对细菌的最小抑菌浓度。用含有0.01%乙酸的0.2%胎牛血清白蛋白作为稀释液加入96孔板中,使用倍比稀释法依次配置系列梯度的抗菌肽溶液,使每个孔中的溶液体积为50μl。然后分别添加50μl的待测菌液(~105cfu/ml)于各孔中,培养基为mhb(ph=7.0)。分别设置阳性对照(含有菌液而不含有抗菌肽)和阴性对照(既不含菌液也不含肽)。于37℃恒温培养18h,然后用酶标仪在492nm处测定光吸收值,以数值大于0.1为菌株生长的判定标准,确定肽对细菌的最小抑菌浓度。试验设定两个平行,重复三次。结果见表2。在表2中,e.coli25922,s.aureus1882,s.aureus6538,s.epidermidis49134,s.typhimuriumsl1344,c.amalonaticus51459购自北京百欧博伟生物技术有限公司,e.colik88,e.colik99,s.aureus43300来源于中国兽医微生物菌种保藏管理中心。
表2抗菌肽c8lr对细菌的抑菌活性(μm)
由表2可以看出,肽c8lr对革兰氏阴性菌和革兰氏阳性菌保留了抗菌活性,表现出广谱抗菌活性,并且对耐甲氧西林金黄色葡萄球菌(s.aureus43300)也展现出抑菌活性,表明肽c8lr具备杀灭耐药菌的潜力。
实施例4
肽的溶血活性的测定:取1ml新鲜猪血红细胞,用pbs稀释10倍备用。用pbs作为稀释液加入96孔板中,使用倍比稀释法依次配置系列梯度的抗菌肽(实施例1制备得到的肽c8lr)溶液,使每个孔中的溶液体积为50μl。将50μl红细胞悬浮液加入含有肽的孔中,用0.1%曲拉通处理的红细胞悬浮液作为阳性对照,未处理的红细胞悬浮液作为阴性对照。随后将96孔板放入37℃培养箱中孵育1小时。以1000g离心力离心5min,从96孔板每个孔中吸取50μl上清液,将其转移至新的96孔板中,然后用酶标仪在570nm处测定光吸收值,用以下公式计算溶血率:
溶血率(%)=[(样品od570-阴性对照od570)/(阳性对照od570-阴性对照od570)]×100%。试验设定两个平行,重复三次。
抗菌肽c8lr的抗菌活性,溶血活性及治疗指数。结果见表3。
表3抗菌肽c8lr的抗菌活性,溶血活性及治疗指数
a最小溶血浓度代表引起猪红细胞10%溶血的浓度。
b治疗指数=最小溶血浓度/总几何平均数,最小溶血浓度>128,取256进行计算。
由表3可以看出,肽c8lr在128μm浓度下对红细胞没有明显的破坏作用,这表明肽具有良好的生物相容性。使用最小溶血浓度和最小抑菌浓度的几何平均数的比值计算其治疗指数,肽c8lr的治疗指数达到145.45(表3),表明其具有良好的生物相容性。
综合以上结果显示,肽c8lr对所有测试真菌和细菌都表现出强抑菌活性,并且具备低溶血活性,表明肽c8lr在治疗真菌和细菌引起的感染方面具有一定的临床应用潜力。
序列表
<110>中国农业大学
<120>一种辛酸酰化修饰抗菌肽及其应用
<130>khp201118825.8
<160>1
<170>siposequencelisting1.0
<210>1
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>1
leuargargleuargargargleuargargleuargargarg
1510
- 还没有人留言评论。精彩留言会获得点赞!