细胞分离装置及细胞分离方法和应用与流程
1.本发明涉及生物医学工程技术领域,特别涉及细胞分离装置及细胞分离方法和应用。
背景技术:
2.稀有细胞在血液和组织中含量极少但包含重要的遗传和表达信息,例如干细胞、循环内皮细胞、循环肿瘤细胞、母体中的胎儿有核红细胞和残留病变细胞等。检测和分析这些稀有细胞,是理解疾病进程和发育机制的关键,更有助于精准医疗实施。稀有细胞的检测与分析需要排除大量非目的细胞的干扰,否则极易造成无法检测或者误判的情况。因此,稀有细胞的分选和富集技术变得尤为关键,甚至是检测结果准确性的决定性因素。近年在该领域出现了众多分选富集手段,但各有利弊。目前主流的分选方法有两种:亲和性富集法和物理特性富集法。亲和性富集法主要是根据通过细胞表面特异性表达的蛋白质生物标志物分离靶细胞,包括正向捕获目标细胞的阳性富集法和负向去除非目的细胞的阴性富集法。物理特性富集法主要是根据目的细胞的大小、密度、力学和介电性能等物理特性进行分选。物理特性富集发包括离心、微流控技术、膜滤过滤分离技术、流体惯性聚焦、光压差分技术等,这类富集方法操作过程简单,捕获效率高,能够实现高通量富集,成本低,特别是其不依赖细胞表面抗原的表达。其中微流控技术以及膜过滤分选技术由于特征尺寸可精准控制,集成度高、通量高、可视化、重复性好等优点成为众多研究人员优先选择方案。
3.虽然微流控技术以及滤膜分选技术优点众多,但应用过程中大部分为外驱压力推动样本进行分选。目前大部分研究人员考虑到外驱压力的重要性,均采取类似恒压泵、注射泵,柱塞泵、蠕动泵等精准流速或压力控制设备作为样品驱动外置设备。在大部分分选装置中,细胞的分选是动态过程,目的细胞的截留必然造成滤膜的跨膜压差的提升,如此导致目的细胞受到的内部流体液压以及挤压力也会随之提升,然而此时外部控制设备依然按照原先设定好的参数运作,随着时间的推移,大量目的细胞的截留将会导致内部细胞所受外力急剧上升,当达到一定界限,截留下来的目的细胞会因无法承受巨大外力而破损或者分离出去,从而导致分选的遗漏以及其他检测结果的不理想。这也是目前大部分基于微孔滤膜分选方法无法保证细胞活性以及较高检出率的主要原因。这种问题迫使我们需要采取某些手段对细胞分选过程中微流控芯片或者滤器内部压力进行动态的监测及实时调控。
技术实现要素:
4.本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提供一种细胞分离装置及细胞分离方法和应用。该细胞分离装置,可以控制过滤过程中的实时压差,判断流程的时间节点,保护细胞不会因为压差过大而漏选以及损伤;基于该分离装置可以实现细胞的快速分离和检测。
5.具体而言,本发明所采取的技术方案如下。
6.本发明的一个方面的目的在于提供一种细胞分离装置,包括:
7.微流控芯片,包括上层芯片、滤膜和下层芯片;
8.抽吸器,所述抽吸器与所述微流控芯片连通;
9.控压组件,包括压力监测器和泄气阀,所述控压组件与所述微流控芯片连通;
10.泄气管路,所述泄气管路与所述微流体芯片连通,且所述控压组件设置在所述泄气管路上;
11.其中,
12.所述上层芯片设置有:与所述泄气管路连接的第一通孔,与所述抽吸器连接的第二通孔,用于连接样品容器的第三通孔;
13.所述下层芯片设置有:与所述第三通孔相对应的腔室;第一通道,所述第一通道的一端与所述上层芯片的第一通孔连通,另一端与所述腔室连通;第二通道,所述第二通道的一端与所述上层芯片的第二通孔连通,另一端与所述腔室连通;
14.所述滤膜设置于所述上层芯片的第三通孔和所述下层芯片的腔室之间。
15.在该细胞分离装置使用时,将含有待分离细胞的样品放入样品容器中,打开压力监测器,关闭泄气阀,启动抽吸器,使得下层芯片中的腔室、第一通道和第二通道处于负压状态,此时滤膜两侧存在压差,样品在压差作用下快速过滤,稀有细胞因为体积大留着样品容器中,滤液则经由第二通道被抽吸器抽出,实现了稀有细胞的快速分离。
16.压力监测器用于监测样本分离过程的实时压差,同时可以用来判断流程的时间节点。泄气阀用于保护目的细胞不会因为压差过大而漏选以及损伤,当压差超过某阈值时,泄气阀自动开启,从而提高目的细胞捕获效率以及活性率。例如,当气压陡升时,此时样品容器内样品几乎过滤完全,而腔室中滤液在表面张力的作用下,依然无法抽动。如果抽吸器继续提供负压,腔室内滤液因为无法突破液体表面张力,将会导致腔室内压差急剧上升,直到突破张力。此时巨大的压差就会导致捕获的目的细胞非常严重的丢失率和活性。因此需要及时打开泄气阀,使微流控芯片内部与空气直接连通,腔室内多余滤液将随气体从第一通道、腔室、第二通道到抽吸器内,期间腔室无任何超出细胞承受范围的压差。
17.根据本发明的一些实施方式,所述第三通孔的数量为一个或多个,可以是1、2、3、4或5等。增加第三通孔数量可以连接多个样品容器,从而增加每次处理样品的量,提高效率。
18.根据本发明的一些实施方式,所述第三通孔与所述样品容器通过螺纹连接。
19.根据本发明的一些实施方式,所述腔室的数量与所述第三通孔的数量相对应。腔室是滤液经由抽吸器抽出的暂存区,其深度可以根据实际情况进行确定。
20.根据本发明的一些实施方式,所述第一通孔的数量为一个或多个,可以是1、2、3、4或5等,其数量可以与所述第三通孔的数量一致,也可以不一致。第一通孔将微流控芯片内部与控压组件连接在一起,实现了对微流控芯片内部压力的监控和调节。
21.根据本发明的一些实施方式,所述泄气管路与所述第一通孔通过鲁尔锁连接。
22.根据本发明的一些实施方式,所述第二通孔的数量为一个或多个,可以是1、2、3、4或5等,其数量可以与所述第三通孔的数量一致,也可以不一致。第二通孔将微流控芯片内部与抽吸器连接在一起,滤液通过第二通孔从微流控芯片中被抽出。
23.根据本发明的一些实施方式,所述第二通孔通过抽吸管路与所述抽吸器连接。
24.根据本发明的一些实施方式,所述第二通孔与所述抽吸管路通过鲁尔锁连接。
25.根据本发明的一些实施方式,所述第一通道的数量为一个或多个,可以是1、2、3、4
或5等。所述第一通道的数量可以和所述腔室的数量一致,也可以不一致;
26.当所述第一通道的数量小于所述腔室的数量时,所述第一通道与所述腔室的其中一个连接,所述腔室之间通过第三通道相连,所述第二通道与所述腔室中的其中一个相连,从而实现微流控芯片内部的互通;
27.当所述第一通道的数量与所述腔室的数量一致时,所述第一通道的其中一个末端分别与所述腔室连接,另外一个末端可以相交连接同一个所述第一通孔,也可以不相交分别连接不同的所述第一通孔;
28.当所述第一通道的数量大于所述腔室的数量时,所述第一通道的其中一个末端与所述腔室连接,另外一个末端可以相交连接同一个所述第一通孔,也可以不相交分别连接不同的所述第一通孔。
29.根据本发明的一些实施方式,所述第二通道的数量为一个或多个,可以是1、2、3、4或5等。所述第二通道的数量可以和所述腔室的数量一致,也可以不一致;
30.当所述第二通道的数量小于所述腔室的数量时,所述第二通道与所述腔室的其中一个连接,所述腔室之间通过第三通道相连,所述第一通道与所述腔室的其中一个连接,从而实现微流控芯片内部的互通;
31.当所述第二通道的数量与所述腔室的数量一致时,所述第二通道的其中一个末端分别与所述腔室连接,另外一个末端可以相交连接同一个所述第二通孔,也可以不相交分别连接不同的所述第二通孔;
32.当所述第二通道的数量大于所述腔室的数量时,所述第二通道的其中一个末端与所述腔室连接,另外一个末端可以相交连接同一个所述第二通孔,也可以不相交分别连接不同的所述第二通孔。
33.根据本发明的一些实施方式,所述滤膜通过所述上层芯片的下表面和所述下层芯片的上表面的压紧贴合实现固定。
34.根据本发明的一些实施方式,所述上层芯片的下表面和所述下层芯片的上表面还设置有相互键合的硅胶膜。进一步地,所述键合可以是化学键合或热键合。通过硅胶膜之间的键合作用可以更大程度上保证上层芯片和下层芯片紧密贴合时的密封性。
35.根据本发明的一些实施方式,所述上层芯片和所述下层芯片的厚度为1~10mm。
36.根据本发明的一些实施方式,所述上层芯片和所述下层芯片的材质包括pdms、pc、pmma、coc、ps等。
37.根据本发明的一些实施方式,所述上层芯片与所述下层芯片可以进行可逆封装。
38.根据本发明的一些实施方式,所述上层芯片和所述下层芯片为注塑成型。
39.根据本发明的一些实施方式,所述样品容器为生物兼容性材料如pe。
40.根据本发明的一些实施方式,所述样品容器上端开口。
41.根据本发明的一些实施方式,所述第一通道和所述第二通道的直径为100μm~2mm;优选地,第一通道和第二通道对称分布在腔室两侧。
42.根据本发明的一些实施方式,所述滤膜为锥形滤膜。
43.根据本发明的一些实施方式,所述滤膜孔径范围为1μm~100μm。
44.根据本发明的一些实施方式,所述控压组件的控压范围为
‑
30kpa~30kpa。
45.根据本发明的一些实施方式,所述控压组件中还设置有用于接收信号和下达指令
的信号处理器。在微流控芯片过滤分选时,泄气阀关闭,微流控芯片下腔在抽吸器作用下形成负压。所述压力监测器实时检测过滤负压,信号处理器对采集信号做记录并做逻辑判断,判断条件成立后发出指令控制泄气阀工作方式。
46.根据本发明的一些实施方式,所述压力监测器实时检测所述微流控芯片的腔室中的压力,并将压力信号传递给所述信号处理器,所述信号处理器进行记录并做逻辑判断,判断条件成立后发出指令控制所述泄气阀的工作方式。
47.根据本发明的一些实施方式,所述信号逻辑判断为人为编辑函数,包括但不限于线性,非线性,拟合等数学模型。所述判断条件为人为编辑函数,包括但不限于线性,非线性,拟合等数学模型。所述泄气阀工作方式包括但不限于开阀,关阀,先开阀后关阀,先关阀后开阀等。
48.根据本发明的一些实施方式,所述压力监测器连接在所述泄气管路上。
49.根据本发明的一些实施方式,所述压力监测器通过三通接头分别与所述第一通孔和所述泄气阀连接;所述泄气阀与大气连通。控制泄气阀的工作方式,实现微流控芯片腔室与大气的气体交换,使腔室与大气达到压力平衡。
50.根据本发明的一些实施方式,所述压力监测器可以动态实时检测微流控芯片中腔室的压力,以此达到实时检测滤膜过滤压力目的。所述动态检测可以人为设置检测时间间距,所述检测时间间距可以包括等距时间设置,也可包括非等距时间设置。所述检测数据可以保存在数据端建立曲线,也可以只做信号处理器判断依据。
51.根据本发明的一些实施方式,所述压力监测器的数量为一个或多个;优选地,所述压力监测器的数量与所述第一通孔的数量相对应。
52.根据本发明的一些实施方式,所述泄气阀的数量为一个或多个;优选地,所述泄气阀的数量与所述压力监测器的数量相对应。泄气阀可以连接两个或者多个相对独立微流控芯片的内部空间,通过泄气阀工作,达到平衡两个独立空间气压作用。
53.根据本发明的一些实施方式,所述抽吸器为注射泵。
54.本发明的另一方面的目的在于提供一种利用上述细胞分离装置进行细胞分离的方法,包括如下步骤:
55.样品加入到样品容器中,打开压力监测器,关闭泄气阀,启动抽吸器;
56.滤液经由腔室、第二通道被抽吸器抽出;
57.其中,过滤过程中,压力监测器实时检测腔室压力,当压力高于预设阈值时,启动泄气阀工作。
58.根据本发明的一些实施方式,在过滤完成后,还包括向样品容器中加入缓冲液冲洗目的细胞的步骤。
59.根据本发明的一些实施方式,在过滤完成后,打开泄气阀,使腔室中的残留滤液被抽吸干净。
60.根据本发明的一些实施方式,当气压值陡升或超过
‑
1kpa时,打开泄气阀。
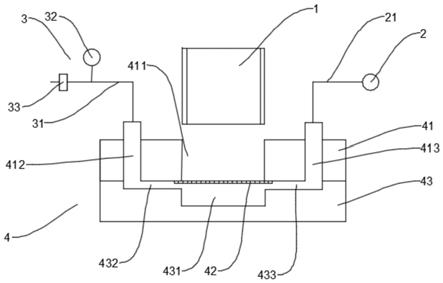
61.根据本发明的一些实施方式,在冲洗过程中,当气压值超过
‑
1kpa时,打开泄气阀。
62.本发明另一方面的目的在于提供一种如上所述的细胞分离装置或如上所述的细胞的分离方法用于细胞分离的用途。
63.本发明另一方面的目的在于提供一种如上所述的细胞分离装置或如上所述的细
胞分离的方法在细胞检测中的应用。
64.本发明另一方面的目的在于提供一种如上所述的细胞分离装置或如上所述的稀有细胞分离的方法在细胞计数中的应用。
65.本发明另一方面的目的在于提供一种如上所述的细胞分离装置或如上所述的稀有细胞分离的方法在微生物分离以及微生物检测中的应用。
66.本发明至少具有如下有益效果:
67.本发明提供的细胞分离装置可以实时监控微流控芯片内部压差,避免压差过大造成的细胞漏选或损伤,能够快速、高效的实现目的细胞的分离,提高了物理过滤的效率,增加了目的细胞分离的纯度,并且本发明的细胞分离装置还可以用来实现细胞的计数和检测,方法简单,成本低廉。
附图说明
68.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
69.图1为本发明一个实施例的结构示意图;
70.图2为本发明一个实施例的上层芯片和下层芯片的结构示意图;
71.图3为本发明一个实施例的上层芯片和下层芯片的结构示意图;
72.图4为本发明一个实施例的上层芯片和下层芯片的结构示意图。
73.其中,图中附图标记与部件名称之间的对应关系为:
74.样品容器1;抽吸器2;抽吸管路21;控压组件3;泄气管路31;压力监测器32;泄气阀33;微流控芯片4;上层芯片41;滤膜42;下层芯片43;第三通孔411;第一通孔412;第二通孔413;腔室431;第一通道432;第二通道433;第三通道434。
具体实施方式
75.下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
76.在本发明的描述中,需要理解的是,涉及到方位描述,例如上、下、前、后、左、右等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
77.在本发明的描述中,若干的含义是一个或者多个,多个的含义是两个以上,大于、小于、超过等理解为不包括本数,以上、以下、以内等理解为包括本数。如果有描述到第一、第二只是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。
78.本发明的描述中,除非另有明确的限定,设置、安装、连接等词语应做广义理解,所属技术领域技术人员可以结合技术方案的具体内容合理确定上述词语在本发明中的具体含义。
79.实施例1一种细胞分离装置
80.如图1~图4所示,本发明的一些实施例提供了一种细胞分离装置,包括:微流控芯片4,包括上层芯片41、滤膜42和下层芯片43;抽吸器2,抽吸器2与微流控芯片4连通;控压组件3,包括压力监测器32和泄气阀33,控压组件3与微流控芯片4连通;泄气管路31,泄气管路31与微流体芯片4连通,且控压组件3设置在泄气管路31上;其中,上层芯片41设置有:与泄气管路31连接的第一通孔412,与抽吸器2连接的第二通孔413,用于连接样品容器1的第三通孔411;下层芯片43设置有:与第三通孔411相对应的腔室431;第一通道432,第一通道432的一端与上层芯片41的第一通孔412连通,另一端与腔室431连通;第二通道432,第二通道432的一端与上层芯片41的第二通孔413连通,另一端与腔室431连通;滤膜42设置于上层芯片41的第三通孔411和下层芯片43的腔室431之间。
81.在该细胞分离装置使用时,将含有待分离细胞的样品放入样品容器1中,打开压力监测器32,关闭泄气阀33,启动抽吸器2,使得下层芯片43中的腔室431、第一通道432和第二通道433处于负压状态,此时滤膜42两侧存在压差,样品在压差作用下快速过滤,稀有细胞因为体积大留着样品容器1中,滤液则经由第二通道433被抽吸器2抽出,实现了稀有细胞的快速分离。
82.压力监测器32用于监测样本分离与检测过程的实时压差,同时可以用来判断流程的时间节点。泄气阀33用于保护目的细胞不会因为压差过大而漏选以及损伤,当压差超过某阈值时,泄气阀33自动开启,从而提高目的细胞捕获效率以及活性率。例如,当气压陡升时,此时样品容器1内样品几乎过滤完全,而腔室431中滤液在表面张力的作用下,依然无法抽动。如果抽吸器2继续提供负压,腔室431内滤液因为无法突破液体表面张力,将会导致腔室431内压差急剧上升,直到突破张力。此时巨大的压差就会导致捕获的目的细胞非常严重的丢失率和活性。因此需要及时打开泄气阀33,使微流控芯片4内部与空气直接连通,腔室431内多余滤液将随气体从第一通道432、腔室431、第二通道433到抽吸器2内,期间腔室431无任何超出细胞承受范围的压差。
83.进一步地,第三通孔411的数量为一个或多个,可以是1、2、3、4或5等。增加第三通孔411数量可以连接多个样品容器1,从而增加每次处理样品的量,提高效率。
84.进一步地,第三通孔411与样品容器1密封耦合即可,优选第三通孔411与样品容器1通过螺纹连接。
85.进一步地,腔室431的数量与第三通孔411的数量相对应。腔室431是滤液经由抽吸器2抽出的暂存区,其深度可以根据实际情况进行确定。
86.进一步地,第一通孔412的数量为一个或多个,可以是1、2、3、4或5等,其数量可以与第三通孔411的数量一致,也可以不一致。第一通孔412将微流控芯片4内部与控压组件3连接在一起,实现了对微流控芯片4内部压力的监控和调节。
87.进一步地,泄气管路31与第一通孔412通过鲁尔锁连接。
88.进一步地,第二通孔413的数量为一个或多个,可以是1、2、3、4或5等,其数量可以与第三通孔411的数量一致,也可以不一致。第二通孔413将微流控芯片4内部与抽吸器2连接在一起,滤液通过第二通孔413从微流控芯片4中被抽出。
89.进一步地,第二通孔413通过抽吸管路21与抽吸器2连接。
90.进一步地,第二通孔413与抽吸管路21通过鲁尔锁连接。
91.进一步地,第一通道432的数量为一个或多个,可以是1、2、3、4或5等。第一通道432
的数量可以和腔室431的数量一致,也可以不一致;当第一通道432的数量小于腔室431的数量时,腔室431之间还可以通过第三通道434进行连接,例如当第一通道432数量为1,腔室431数量为2时,第一通道432可以与其中一个腔室431相连,两个腔室431之间通过第三通道434相连,另一个腔室431则与第二通道433连接,从而实现微流控芯片4内部的互通。当第一通道432的数量与腔室431的数量一致时,例如当第一通道432数量为2,腔室431数量为2时,第一通道432的其中一个末端分别与两个腔室431连接,另外一个末端可以相交连接同一个第一通孔412,也可以不相交分别连接两个第一通孔412。当第一通道432的数量大于腔室431的数量时,例如当第一通道432数量为2,腔室431数量为1时,则第一通道432的其中一个末端与腔室431连接,另外一个末端可以相交连接同一个第一通孔412,也可以不相交分别连接两个第一通孔412。
92.进一步地,第二通道433的数量为一个或多个,可以是1、2、3、4或5等。第二通道433的数量可以和腔室431的数量一致,也可以不一致;当第二通道433的数量小于所述腔室431的数量时,腔室431之间还可以通过第三通道434进行连接,例如当第二通道433数量为1,腔室431数量为2时,第二通道433可以与其中一个腔室431相连,两个腔室431之间通过第三通道434相连,另一个腔室431则与第一通道432连接,从而实现微流控芯片4内部的互通。当第二通道433的数量与腔室431的数量一致时,例如当第二通道433数量为2,腔室431数量为2时,第二通道433的其中一个末端分别与两个腔室431连接,另外一个末端可以相交连接同一个第二通孔413,也可以不相交分别连接两个第二通孔413。当第二通道433的数量大于所述腔室431的数量时,例如当第二通道433数量为2,腔室431数量为1时,则第二通道433的其中一个末端与腔室431连接,另外一个末端可以相交连接同一个第二通孔413,也可以不相交分别连接两个第二通孔413。
93.进一步地,滤膜42通过上层芯片41的下表面和下层芯片43的上表面的压紧贴合实现固定。
94.进一步地,上层芯片41的下表面和所述下层芯片43的上表面还设置有相互键合的硅胶膜。进一步地,键合可以是化学键合或热键合。通过硅胶膜之间的键合作用可以更大程度上保证上层芯片41和下层芯片43紧密贴合时的密封性。
95.进一步地,上层芯片41和下层芯片43的厚度为1~10mm。
96.进一步地,上层芯片41和下层芯片43的材质包括pdms、pc、pmma、coc、ps等。
97.进一步地,上层芯片41与下层芯片43可以进行可逆封装。
98.进一步地,上层芯片41和下层芯片43为注塑成型。
99.进一步地,样品容器1为生物兼容性材料,例如pe。进一步地,样品容器1上端开口。
100.进一步地,第一通道432和所述第二通道433的直径为100μm~2mm;优选地,第一通道432和第二通道433对称分布在腔室431两侧。
101.进一步地,滤膜42为锥形滤膜;滤膜42孔径范围为1μm~100μm。
102.进一步地,控压组件3的控压范围为
‑
30kpa~30kpa。
103.进一步地,控压组件3中还设置有用于接收信号和下达指令的信号处理器。在微流控芯片4过滤分选时,泄气阀33关闭,微流控芯片4的腔室431在抽吸器作用下形成负压。压力监测器32实时检测过滤负压,信号处理器对采集信号做记录并做逻辑判断,判断条件成立后发出指令控制泄气阀33工作方式。
104.进一步地,压力监测器32实时检测微流控芯片4的腔室431中的压力,并将压力信号传递给信号处理器,信号处理器进行记录并做逻辑判断,判断条件成立后发出指令控制泄气阀33的工作方式。泄气阀33工作方式包括但不限于开阀,关阀,先开阀后关阀,先关阀后开阀等。
105.进一步地,信号逻辑判断为人为编辑函数,包括但不限于线性,非线性,拟合等数学模型。判断条件为人为编辑函数,包括但不限于线性,非线性,拟合等数学模型。
106.进一步地,压力监测器32连接在泄气管路31上。压力监测器32通过三通接头分别与第一通孔412和泄气阀33;泄气阀33与大气连通。控制泄气阀33的工作方式,实现微流控芯片4中腔室431与大气的气体交换,使腔室431与大气达到压力平衡。
107.进一步地,压力监测器32可以动态实时检测微流控芯片4中腔室431压力,以此达到实时检测滤膜过滤压力目的。动态检测可以人为设置检测时间间距,检测时间间距可以包括等距时间设置,也可包括非等距时间设置。检测数据可以保存在数据端建立曲线,也可以只做信号处理器判断依据。
108.进一步地,压力监测器32的数量为一个或多个;优选地,压力监测器32的数量与第一通孔412的数量相对应。
109.进一步地,泄气阀33的数量为一个或多个;优选地,泄气阀33的数量与压力监测器32的数量相对应。泄气阀33可以连接两个或者多个相对独立微流控芯片4内部空间,通过泄气阀33工作,达到平衡两个独立空间气压作用。
110.进一步地,抽吸器2为注射泵。
111.实施例2一种利用实施例1的细胞分离装置进行细胞分离的方法
112.打开压力监测器32,关闭泄气阀33,样品加入到样品容器1中,启动抽吸器2;
113.滤液经由腔室431、第二通道433被抽吸器2抽出;
114.其中,过滤过程中,压力监测器实时检测腔室压力,当压力高于预设阈值时,启动泄气阀工作。
115.以循环肿瘤细胞的分离为例:
116.样品加入到样品容器中,打开压力监测器,关闭泄气阀,启动抽吸器;
117.滤液经由腔室、第二通道被抽吸器抽出,当气压值陡升或超过
‑
1kpa时,打开泄气阀;
118.然后,向样品容器中加入pbs缓冲液清洗分离得到的循环肿瘤细胞,当气压值陡升或超过
‑
1kpa时,打开泄气阀;
119.实施例3实施例1细胞分离装置的一些工作过程
120.1、浸润过程:
121.打开压力监测器32,关闭泄气阀33,向样品容器1中加入2mlpbs,启动抽吸器2进行抽液(速度1ml/min),抽液1min后强停抽吸器2,开泄气阀33,等待30s,关泄气阀33。
122.2、捕获过程:
123.样品容器1中加入样本(5ml全血+5mliset),抽吸器2抽液(500μl/min),记录18min时间内泄气阀33端最高压力值pmax,判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待30s,抽吸器2强停,关泄气阀33。
124.3、捕获清洗过程:
125.样品容器1中加入2mlpbs,抽吸器2通过第二通孔413抽液(500μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33,重复清洗2次。
126.4、预处理过程:
127.将150μl预处理液加入到样品容器1中,预处理液孵育10min,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
128.5、预处理清洗过程:
129.将300μl pbs加入到样品容器1中,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
130.6、封闭过程:
131.将150μl封闭液加入到样品容器1中,封闭孵育30min,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
132.7、抗体过程:
133.抽吸器2先抽500μl空气(保证抗体不被稀释),再将170μl抗体加入到样品容器1中,抗体孵育60min,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
134.8、抗体清洗过程:
135.将300μl pbs加入到样品容器1中,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
136.9、染核过程:
137.将150μl染核试剂加入到样品容器1中,染核孵育5min,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
138.10、染核清洗过程:
139.将300μl pbs加入到样品容器1中,抽吸器2通过第二通孔413抽液(200μl/min),判断泄气阀33端压力值小于
‑
1kpa时,开泄气阀33,等待5s,抽吸器2强停,关泄气阀33。
140.上面结合附图对本发明的实施例作了详细说明,但是本发明不限于上述实施例,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1