一种β冠状病毒抗原、其制备方法和应用
一种
β
冠状病毒抗原、其制备方法和应用
1.本技术是申请号为202010581414.3、申请日为2020年6月23日、发明名称为“一种β冠状病毒抗原、其制备方法和应用”的中国专利申请的分案申请,其中该母案要求了申请号为202010085038.9、申请日为2020年2月10日的中国申请的本国优先权。
技术领域
2.本发明涉及生物医药技术领域,具体涉及一种β冠状病毒抗原、其制备方法和应用。
背景技术:
3.冠状病毒属于冠状病毒科冠状病毒属,是有囊膜的正链rna病毒,在所有rna病毒中其基因组最大,动物和人类都是冠状病毒的宿主。冠状病毒主要感染哺乳动物和鸟类的呼吸道和消化道,目前已知的有7种冠状病毒感染人,其中四种引起不严重的感冒 (hcov
‑
229e,hcov
‑
nl63,oc43和hku1)。对全球公共卫生威胁最大的有三种,分别是严重呼吸综合征冠状病毒(sars
‑
cov)、中东呼吸综合征冠状病毒(mers
‑
cov)以及新型冠状病毒(2019
‑
ncov),这三种都属于β冠状病毒。
4.中东呼吸综合征(mers)是由中东呼吸综合征冠状病毒(mers
‑
cov)感染所致的疾病。mers
‑
cov病毒和的sars病毒同属于beta
‑
冠状病毒亚属,却有着比sars
‑
cov更高的致死率。 mers
‑
cov可能通过气溶胶的形式传播,因此很难防控。在单峰驼的血清里能检测出mers
‑
cov的中和抗体,提示单峰驼是mers
‑
cov的中间宿主。目前世界上仍然没有疫苗和有效的治疗手段。因此,开发一种安全、有效的针对mers
‑
cov的疫苗十分紧迫和重要。
5.新型冠状病毒(2019
‑
ncov/sars
‑
cov
‑
2)可以通过呼吸道和飞沫途径在人与人之间传播,也存在通过空气和消化道传播的可能。传染源主要是感染了新型冠状病毒的患者,但是不排除无症状的感染者也是传播源的可能,感染该病毒后可能不会立即发病,病毒的潜伏期较长, 1
‑
14天,这对疾病的防控造成困难。新型冠状病毒进入人体后,和sars类似,通过血管紧张素转酶2(ace2)进入细胞,感染人体,导致病人出现发烧,干咳以及肌肉疼等临床症状,少数人还会出现鼻塞,咽痛,腹泻等症状,严重的患者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍,造成生命危险。暂时还没有特异性药物,也没有疫苗可以预防,只能使用对症支持治疗。
6.此外,一些其他的冠状病毒也引发许多严重的动物疾病,尤其对农业牲畜和宠物带来严重威胁。比如,猪传染性胃肠炎病毒(tgev)可以引发猪的严重腹泻,死亡率极高;其缺失病毒猪呼吸道冠状病毒(prcv)可以引起猪严重的呼吸道疾病;猫腹膜炎病毒(fipv)可引起猫腹膜炎和腹水聚集,致死率很高;犬冠状病毒(ccov)则可使犬发生不同程度的肠胃炎症状,传播快,难控制;猪流行性腹泻病毒(pedv)引起猪流行性腹泻等肠道疾病,容易在猪群里传播致死率很高。此外还有鼠、牛等冠状病毒。这些冠状病毒对人和动物的健康造成了严重的威胁。因此,开发针对冠状病毒的疫苗有着重要的意义。
7.表面刺突蛋白(s蛋白)是冠状病毒的主要中和抗原。mers
‑
cov、sars
‑
cov、 2019
‑
ncov的s蛋白的受体结合区(receptor binding domain,rbd)被认为是诱导机体产生中和抗体的最主要的抗原靶区域。rbd作为疫苗能够将机体刺激产生的中和抗体更加聚焦在针对病毒的受体结合,可以提高疫苗的免疫原性和免疫效率。mers
‑
cov通过 rbd与宿主细胞的受体(cd26,又名dpp4)结合而侵入细胞。此外,sars
‑
cov和 2019
‑
ncov都发现通过其rbd与宿主细胞受体hace2结合而进入细胞。
8.
技术实现要素:
9.发明目的
10.本发明的目的在于提供一种β冠状病毒抗原、其制备方法和应用。本发明实施例中基于mers二聚体rbd蛋白比单体rbd蛋白能更好的激发中和抗体的结论,尝试将两段编码相同或基本相同的单体rbd蛋白的核苷酸序列直接串联或通过连接段串联,所表达的两个相同或基本相同的单体rbd蛋白通过n端和c端的柔性区串联起来,结果显示该种方法可以很好地实现单链rbd二聚体的表达。相对于2个rbd单体简单通过其中的半胱氨酸以二硫键结合所形成的非单链形式的二聚体rbd蛋白而言,本发明实施例所得单链二聚体rbd蛋白不会因为二硫键的形成不稳定而导致生产过程中二聚体rbd蛋白含量不稳定,即避免以单体rbd形式为主,少有二聚体rbd形成的表达情况,从而使二聚体rbd表达稳定,形式均一,产量大大提高。相对于2个rbd单体简单通过其中的半胱氨酸以二硫键结合所形成的二聚体rbd蛋白而言,本发明实施例所表达的单链二聚体作为β冠状病毒抗原具有相当的免疫原性,该单链二聚体作为β冠状病毒抗原制备成的疫苗能够激发小鼠产生很高滴度的中和抗体。
11.解决方案
12.为实现本发明目的,本发明实施例提供了以下技术方案:
13.一种β冠状病毒抗原,其氨基酸序列包括:按照(a
‑
b)
‑
(a
‑
b)样式排列的氨基酸序列或(a
‑
b)
‑
c
‑
(a
‑
b)样式排列的氨基酸序列或(a
‑
b)
‑
(a
‑
b’)样式排列的氨基酸序列或 (a
‑
b)
‑
c
‑
(a
‑
b’)样式排列的氨基酸序列,其中:a
‑
b表示β冠状病毒的表面刺突蛋白的受体结合区的部分氨基酸序列或全部氨基酸序列,c表示连接氨基酸序列,a
‑
b’表示a
‑
b 中的氨基酸序列经取代、缺失或添加一个或多个氨基酸获得的氨基酸序列,a
‑
b’编码的蛋白质具有与a
‑
b所编码的蛋白质相同或基本相同的免疫原性,所述β冠状病毒抗原为单链二聚体结构。可选地,β冠状病毒的表面刺突蛋白的受体结合区的部分氨基酸序列为β冠状病毒的表面刺突蛋白的受体结合区的全部氨基酸序列的至少50%、60%、70%、80%、 90%、95%、99%。
14.上述β冠状病毒抗原在一种可能的实现方式中,所述β冠状病毒包括:严重呼吸综合征冠状病毒、中东呼吸综合征冠状病毒和2019新型冠状病毒(2019新型冠状病毒也可称为2019
‑
ncov或者sars
‑
cov
‑
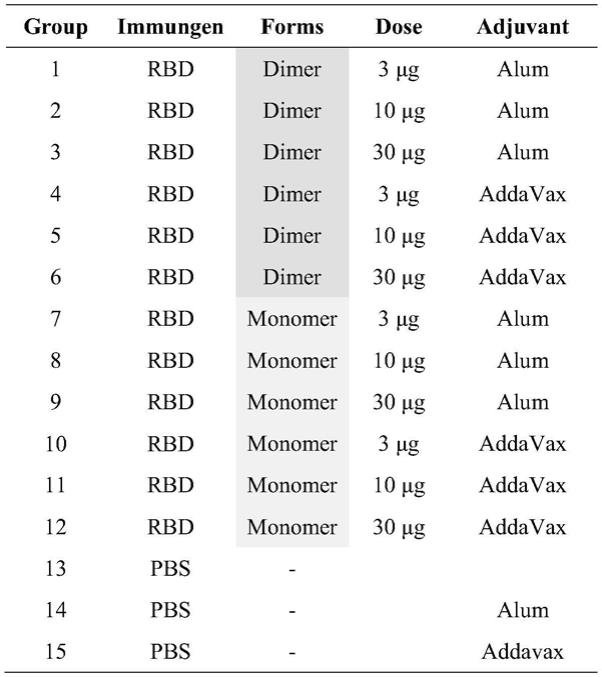
2)。
15.上述β冠状病毒抗原在一种可能的实现方式中,所述连接氨基酸序列包括:(ggs)
n
连接序列,其中n表示ggs的个数,n为≥1的整数;可选地,n为选自1
‑
10的整数;进一步可选地,n为选自1
‑
5的整数。ggs三个字母分别表示氨基酸g、g、s。
16.上述β冠状病毒抗原在一种可能的实现方式中,当β冠状病毒为中东呼吸综合征冠状病毒时,其表面刺突蛋白的受体结合区的部分氨基酸序列或全部氨基酸序列选自包括以下氨基酸序列的任意一种:
17.(1)seq id no:1,seq id no:2,或seq id no:3;
18.(2)在(1)中的氨基酸序列经取代、缺失或添加一个或多个氨基酸获得的氨基酸序列,该氨基酸序列编码的蛋白质具有与(1)所编码的蛋白质相同或基本相同的免疫原性;
19.可选地,其表面刺突蛋白的受体结合区的部分氨基酸序列包括seq id no:2。
20.其中:seq id no:1,seq id no:2,或seq id no:3序列均来源于mers
‑
covs蛋白(ncbi上的genbank:afs88936.1)的一部分,分别是mers
‑
cov s蛋白的rbd 的e367
‑
y606区域、e367
‑
n602区域、v381
‑
l588区域。
21.上述β冠状病毒抗原在一种可能的实现方式中,当β冠状病毒为中东呼吸综合征冠状病毒时,β冠状病毒抗原的氨基酸序列包括选自以下氨基酸序列的任意一种:
22.(1)通过ggsggs连接序列串联起来的2个重复seq id no:1氨基酸序列,即 e367
‑
y606
‑
ggsggs
‑
e367
‑
y606;
23.(2)通过ggs连接序列串联起来的2个重复seq id no:1氨基酸序列,即 e367
‑
y606
‑
ggs
‑
e367
‑
y606;
24.(3)直接串联的2个重复seq id no:1氨基酸序列,即e367
‑
y606
‑
e367
‑
y606。
25.(4)通过ggs连接序列串联起来的2个重复seq id no:2氨基酸序列,即e367
‑
n602
‑
ggs
‑
e367
‑
n602;
26.(5)直接串联的2个重复seq id no:2氨基酸序列,即e367
‑
n602
‑
e367
‑
n602;
27.(6)通过ggsggsggsggsggs连接序列串联起来的2个重复seq id no:3氨基酸序列,即v381
‑
l588
‑
ggsggsggsggsggs
‑
v381
‑
l588;
28.(7)通过ggsggsggsggs连接序列串联起来的2个重复seq id no:3氨基酸序列,即v381
‑
l588
‑
ggsggsggsggs
‑
v381
‑
l588;
29.(8)通过ggsggsggs连接序列串联起来的2个重复seq id no:3氨基酸序列,即v381
‑
l588
‑
ggsggsggs
‑
v381
‑
l588;
30.(9)通过ggs连接序列串联起来的2个重复seq id no:3氨基酸序列,即 v381
‑
l588
‑
ggs
‑
v381
‑
l588;
31.(10)直接串联的2个重复seq id no:3氨基酸序列,即v381
‑
l588
‑
v381
‑
l588;
32.可选地,β冠状病毒抗原的氨基酸序列包括直接串联的2个重复seq id no:2氨基酸序列,即e367
‑
n602
‑
e367
‑
n602。
33.上述β冠状病毒抗原在一种可能的实现方式中,当β冠状病毒为2019新型冠状病毒时,其表面刺突蛋白的受体结合区的部分氨基酸序列或全部氨基酸序列选自包括以下氨基酸序列的任意一种:
34.(1)seq id no:5,seq id no:6,或seq id no:7;
35.(2)在(1)中的氨基酸序列经取代、缺失或添加一个或几个氨基酸获得的氨基酸序列,该氨基酸序列编码的蛋白质具有与(1)所编码的蛋白质相同或基本相同的免疫原性;
36.可选地,其表面刺突蛋白的受体结合区的部分氨基酸序列包括seq id no:6。
37.其中:seq id no:5,seq id no:6,或seq id no:7序列均来源于2019
‑
ncov 的s蛋白序列(ncbi上的genbank:qhr63250)的一部分,分别是2019
‑
ncov s蛋 白的rbd的r319
‑
s530区域、r319
‑
k537区域、r319
‑
f541区域。
38.上述β冠状病毒抗原在一种可能的实现方式中,当β冠状病毒为2019新型冠状病毒
时,β冠状病毒抗原的氨基酸序列包括选自以下氨基酸序列的任意一种:
39.直接串联的2个重复seq id no:5氨基酸序列,即r319
‑
s530
‑
r319
‑
s530;
40.直接串联的2个重复seq id no:6氨基酸序列,即r319
‑
k537
‑
r319
‑
k537;
41.直接串联的2个重复seq id no:7氨基酸序列,即r319
‑
f541
‑
r319
‑
f541;
42.可选地,β冠状病毒抗原的氨基酸序列包括直接串联的2个重复seq id no:6氨基酸序列,即r319
‑
k537
‑
r319
‑
k537。
43.上述β冠状病毒抗原在一种可能的实现方式中,当β冠状病毒为严重呼吸综合征冠状病毒时,其表面刺突蛋白的受体结合区的部分氨基酸序列或全部氨基酸序列选自包括以下氨基酸序列的任意一种:
44.(1)seq id no:8;
45.(2)在(1)中的氨基酸序列经取代、缺失或添加一个或几个氨基酸获得的氨基酸序列,该氨基酸序列编码的蛋白质具有与(1)所编码的蛋白质相同或基本相同的免疫原性。
46.其中:seq id no:8序列来源于sars
‑
cov的s蛋白序列(ncbi上的genbank: aar07630)的一部分,是sars
‑
cov s蛋白的rbd的r306
‑
q523区域。
47.上述β冠状病毒抗原在一种可能的实现方式中,当β冠状病毒为严重呼吸综合征冠状病毒时,β冠状病毒抗原的氨基酸序列包括:直接串联的2个重复seq id no:8氨基酸序列,即r306
‑
q523
‑
r306
‑
q523。
48.上述β冠状病毒抗原在一种可能的实现方式中,编码通过ggsggs连接序列串联起来的2个重复seq id no:1氨基酸序列的核苷酸序列如seq id no:9所示;
49.编码通过ggs连接序列串联起来的2个重复seq id no:1氨基酸序列的核苷酸序列如seq id no:10所示;
50.编码直接串联的2个重复seq id no:1氨基酸序列的核苷酸序列如seq id no:11 所示;
51.编码通过ggs连接序列串联起来的2个重复seq id no:2氨基酸序列的核苷酸序列如seq id no:12所示;
52.编码直接串联的2个重复seq id no:2氨基酸序列的核苷酸序列如seq id no: 13所示;
53.编码通过ggsggsggsggsggs连接序列串联起来的2个重复seq id no:3氨基酸序列的核苷酸序列如seq id no:14所示;
54.编码通过ggsggsggsggs连接序列串联起来的2个重复seq id no:3氨基酸序列的核苷酸序列如seq id no:15所示;
55.编码通过ggsggsggs连接序列串联起来的2个重复seq id no:3氨基酸序列的核苷酸序列如seq id no:16所示;
56.编码通过ggs连接序列串联起来的2个重复seq id no:3氨基酸序列的核苷酸序列如seq id no:17所示;
57.编码直接串联的2个重复seq id no:3氨基酸序列的核苷酸序列如seq id no: 18所示;
58.编码直接串联的2个重复seq id no:5氨基酸序列的核苷酸序列如seq id no: 19所示;
59.编码直接串联的2个重复seq id no:6氨基酸序列的核苷酸序列如seq id no: 20所示;
60.编码直接串联的2个重复seq id no:7氨基酸序列的核苷酸序列如seq id no: 21所示;
61.编码直接串联的2个重复seq id no:8氨基酸序列的核苷酸序列如seq id no: 23所示。
62.本发明还提供了一种制备上述β冠状病毒抗原的方法,包括以下步骤:在编码上述β冠状病毒抗原的核苷酸序列的5’端加入编码信号肽的序列,3’端加上终止密码子,进行克隆表达,筛选正确的重组子,然后转染表达系统的细胞进行表达,表达后收集细胞上清,纯化得到β冠状病毒抗原。
63.上述方法在一种可能的实现方式中,所述表达系统的细胞包括为哺乳动物细胞、昆虫细胞、酵母细胞或细菌细胞,可选地;所述哺乳动物细胞包括293t细胞或cho细胞,所述细菌细胞包括大肠杆菌细胞。
64.本发明还提供了一种编码上述β冠状病毒抗原的核苷酸序列、一种包括上述核苷酸序列的重组载体、一种包括上述重组载体的表达系统细胞。
65.本发明还提供了一种上述β冠状病毒抗原、编码上述β冠状病毒抗原的核苷酸序列、包括上述核苷酸序列的重组载体、包括上述重组载体的表达系统细胞在制备β冠状病毒疫苗中的应用。
66.本发明还提供了一种β冠状病毒疫苗,包括上述β冠状病毒抗原和佐剂。
67.上述β冠状病毒疫苗在一种可能的实现方式中,所述佐剂选自铝佐剂、mf59佐剂或类mf59佐剂。
68.本发明还提供了一种β冠状病毒dna疫苗,其包括有:包含编码上述β冠状病毒抗原的dna序列的重组载体。
69.本发明还提供了一种β冠状病毒mrna疫苗,其包括有:包含编码上述β冠状病毒抗原的mrna序列的重组载体。
70.本发明还提供了一种β冠状病毒病毒载体疫苗,其包括有:包含编码上述β冠状病毒抗原的核苷酸序列的重组病毒载体;可选地,病毒载体选自以下的一种或几种:腺病毒载体、痘病毒载体、流感病毒载体、腺相关病毒载体。
71.有益效果
72.(1)本发明实施例β冠状病毒抗原中,基于mers二聚体rbd蛋白比单体rbd蛋白能更好的激发中和抗体的结论,进一步通过解析mers
‑
cov二聚体rbd蛋白的晶体结构,发现了mers二聚体rbd蛋白能够形成头并头的二聚体,因此发明人尝试将两段编码相同或基本相同的单体rbd蛋白的核苷酸序列直接串联或通过连接段串联,所得两个相同或基本相同的单体rbd蛋白通过n端和c端的柔性区串联起来,结果显示该种方法可以实现很好地实现单链二聚体的表达。相对于2个rbd单体简单通过其中的半胱氨酸以二硫键结合所形成的非单链形式的二聚体rbd蛋白而言,本发明实施例所得单链二聚体rbd蛋白不会因为二硫键的形成不稳定而导致生产过程中二聚体rbd蛋白含量不稳定,即避免以单体rbd形式为主,少有二聚体形成的表达情况,从而使二聚体rbd表达稳定,形式均一,产量大大提高。相对于2个rbd单体简单通过其中的半胱氨酸以二硫键结合所形成的非单链形式的二聚体rbd蛋白而
言,本发明实施例所表达的单链二聚体作为β冠状病毒抗原具有相当的免疫原性,该单链二聚体作为β冠状病毒抗原制备成的β冠状病毒疫苗能够激发小鼠产生很高滴度的中和抗体。
73.(2)本发明实施例β冠状病毒抗原中,通过对所包含的rbd不同区域氨基酸的选择,发现从如图14a中start的第一个氨基酸开始,到图14b中stop最后一个半胱氨酸之前的一个氨基酸为止是表达最优的构建,这样可以尽量避免末端未配对的半胱氨酸对蛋白表达和其稳定性的影响。
74.(3)本发明实施例β冠状病毒抗原中,通过对两段编码相同或基本相同的单体rbd 蛋白的核苷酸序列直接串联或通过连接段串联的选择,发现在不引入任何外源连接序列的情况下,即将两段编码相同或基本相同的单体rbd蛋白的核苷酸序列直接串联的情况下,表达量最高,且由于没有外源序列的加入,也最为安全。由于本发明实施例中获得各种单链二聚体rbd作为β冠状病毒抗原都有很好的免疫效果,所以关键在于产量。
75.(4)本发明实施例β冠状病毒抗原中,所涉及的头并头单链二聚体结构适用于严重呼吸综合征冠状病毒、中东呼吸综合征冠状病毒和2019新型冠状病毒。
附图说明
76.图1是实施例1中通过构建的载体pfastbac
‑
sp
‑
mers
‑
rbd(e367
‑
y606)所获得的rbd蛋白进行superdex200 hiload 16/60柱子(ge)分子筛层析时的紫外吸收图,以及收集紫外吸收图中的二聚体(dimer)峰和单体(monomer)峰获得的蛋白质在还原条件下(+dtt)或非还原条件下(
‑
dtt)进行sds
‑
page的电泳图。
77.图2是实施例2到实施例7中的免疫和mers
‑
cov攻毒策略图。
78.图3是实施例3结果,为实施例2中小鼠第三次免疫后按照图2中的免疫策略取血的血清中mers
‑
cov rbd特异性抗体igg滴度。其中:dimer表示使用的免疫源为 mers
‑
cov rbd二聚体,rbd monomer表示使用的免疫源为mers
‑
cov rbd单体, addavax表示使用了addavax佐剂,alum表示使用了铝佐剂,未表示佐剂的表示没有使用佐剂,3μg、10μg、30μg表示每一次免疫使用的免疫源的免疫量。显著性差异分析: ns,p>0.05;*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
79.图4是实施例5结果,为实施例2中小鼠第三次免疫后按照图2中的免疫策略取血的血清中mers
‑
cov假病毒90%中和抗体滴度。其中:dimer表示使用的免疫源为 mers
‑
cov rbd二聚体,rbd monomer表示使用的免疫源为mers
‑
cov rbd单体, addavax表示使用了addavax佐剂,alum表示使用了铝佐剂,未表示佐剂的表示没有使用佐剂,3μg、10μg、30μg表示每一次免疫使用的免疫源的免疫量。显著性差异分析: ns,p>0.05;***,p<0.001。
80.图5是实施例6结果,为实施例2中小鼠第三次免疫后按照图2中的免疫策略取血的血清中对mers
‑
cov真病毒(emc株)的50%中和抗体滴度结果图。其中:dimer表示使用的免疫源为mers
‑
cov rbd二聚体,addavax表示使用了addavax佐剂,alum表示使用了铝佐剂,未表示佐剂的表示没有使用佐剂,3μg、10μg、30μg表示每一次免疫使用的免疫源的免疫量。显著性差异分析:ns,p>0.05;***,p<0.001;****,p<0.0001。
81.图6是实施例7中按照图2中的免疫策略对第三次免疫后的小鼠滴鼻感染表达 hcd26(hdpp4)的腺病毒,5天后用mers
‑
cov攻毒,攻毒之后3天,取出小鼠的肺脏,组织匀浆用来检测病毒滴度(tcid
50
)的结果图。dimer表示使用的免疫源为mers
‑
cov rbd二聚体,
addavax表示使用了addavax佐剂,alum表示使用了铝佐剂,未表示佐剂的表示没有使用佐剂,3μg、10μg、30μg表示每一次免疫使用的免疫源的免疫量。显著性差异分析:ns,p>0.05;*,p<0.05;**,p<0.01;***,p<0.001;****, p<0.0001。
82.图7是实施例8检测疫苗对小鼠肺组织保护效果的病理结果。将实施例7中攻毒的小鼠在解剖后取出肺经过4%多聚甲醛固定、石蜡包埋、苏木精
‑
伊红染色和切片观察病理变化。其中addavax表示使用了addavax佐剂,alum表示使用了铝佐剂,3μg、10μg、 30μg表示每一次免疫使用的免疫源的免疫量。slight、mild和severe分别说明肺组织病变程度为轻微、中等和严重。
83.图8是实施例9中解析出的mers
‑
cov
‑
rbd dimer(e367
‑
y606)的结构。
84.图9a、图9b、图9c是实施例10中基于mers
‑
cov rbd
‑
dimer二聚体结构设计的单链rbd二聚体设计方案。
85.图10是实施例10中表达的mers
‑
rbd
‑
c1至mers
‑
rbd
‑
c10单链二聚体在还原 (+dtt)或非还原(
‑
dtt)的条件下进行western blot的结果图。其中rbd monomer为 mers
‑
cov rbd单体蛋白。
86.图11是实施例11中表达的mers
‑
rbd
‑
c5单链二聚体进行进行superdex200 hiload 16/60柱子(ge)分子筛层析时的紫外吸收图,以及纯化所得单链二聚体在还原(+dtt) 或非还原(
‑
dtt)的条件下下进行sds
‑
page的结果图。
87.图12是实施例12中小鼠免疫mers
‑
cov
‑
rbd单链二聚体和二硫键连接的非单链二聚体蛋白后,诱导产生的mers
‑
cov
‑
rbd特异性igg抗体滴度。其中sc
‑
dimer是单链二聚体,dimer是二硫键连接的非单链二聚体。显著性差异分析:ns,p>0.05;*,p<0.05; ***,p<0.001;****,p<0.0001。
88.图13是实施例12中小鼠免疫mers
‑
cov
‑
rbd单链二聚体和二硫键连接的非单链二聚体蛋白后,诱导产生的mers
‑
cov假病毒90%中和抗体滴度。其中sc
‑
dimer是单链二聚体,dimer是二硫键连接的非单链二聚体。显著性差异分析:ns,p>0.05;*,p<0.05; ****,p<0.0001。
89.图14a和图14b是实施例13中beta冠状病毒的受体结合区(rbd)的比对图,两张图中的序列连续,比对了以下几种β冠状病毒:
90.mers
‑
cov(afs88936),sars
‑
cov(aas00003),sars
‑
cov
‑
2(qhr63290), bat
‑
cov_hku5(abn10875),rousettus_bat
‑
cov(aog30822),bat
‑
cov_bm48
‑
31 (adk66841),bat
‑
cov_hku9(abn10911),bat_hp
‑
betacov(ail94216), sars
‑
related
‑
cov(apo40579),btrs
‑
beta
‑
cov(qdf43825),bat
‑
sars
‑
like
‑
cov (ato98231),sars
‑
like
‑
cov_wiv16(alk02457),bat
‑
cov(ari44804),btr1
‑
beta
‑
cov (qdf43815),hcov_hku1(azs52618),mcov_mhv1(acn89742),betacov_hku24 (aja91217),hcov_oc43(aar01015),betacov_erinaceus(agx27810)。
91.图15是实施例13中sars
‑
cov
‑
rbd二聚体或2019
‑
ncov
‑
rbd二聚体的结构模拟图以及设计的表达2019
‑
ncov
‑
rbd二聚体、2019
‑
ncov
‑
rbd单体和sars
‑
cov
‑
rbd二聚体的构建。
92.图16是实施例13中表达的几种关于sars
‑
cov
‑
rbd和2019
‑
ncov
‑
rbd的单链二聚体在还原(+dtt)或非还原(
‑
dtt)的条件下进行western blot的结果图。
93.图17是实施例14中2019
‑
ncov
‑
rbd
‑
c2抗原进行纯化时的紫外280nm吸光度图,以
及纯化所得单链二聚体在还原(+dtt)或非还原(
‑
dtt)的条件下进行sds
‑
page 的结果图。
94.图18是实施例14中sars
‑
cov
‑
rbd
‑
c1抗原进行纯化时的紫外280nm吸光度图,以及纯化所得单链二聚体在还原(+dtt)或非还原(
‑
dtt)的条件下进行sds
‑
page 的结果图。
95.图19为实施例15中小鼠三次免疫后(1免后19天,2免后14天,3免后14天) 分别收集的血清的2019
‑
ncov
‑
rbd特异性igg抗体滴度。其中:sc
‑
dimer表示使用的免疫源为ncov
‑
rbd单链二聚体,monomer表示使用的免疫源为ncov
‑
rbd单体。显著性差异分析:****,p<0.0001。
96.图20是实施例15中小鼠三次免疫后(1免后19天,2免后14天,3免后14天) 分别收集的血清的2019
‑
ncov假病毒90%中和抗体滴度。其中:sc
‑
dimer表示使用的免疫源为ncov
‑
rbd单链二聚体,monomer表示使用的免疫源为ncov
‑
rbd单体。显著性差异分析:ns,p>0.05;**,p<0.01;****,p<0.0001。
97.图21是实施例15中小鼠第二次免疫后(2免后14天)收集的血清的2019
‑
ncov真病毒(2020xn4276株)50%中和抗体滴度。其中:sc
‑
dimer表示使用的免疫源为ncov
‑
rbd 单链二聚体,monomer表示使用的免疫源为ncov
‑
rbd单体。
98.图22为实施例16中小鼠三次免疫后(1免后19天,2免后14天,3免后14天) 分别收集的血清的sars
‑
rbd特异性igg抗体滴度。其中:sc
‑
dimer表示使用的免疫源为 sars
‑
cov
‑
rbd单链二聚体,monomer表示使用的免疫源为sars
‑
cov
‑
rbd单体。显著性差异分析:ns,p>0.05;*,p<0.05;**,p<0.01;****,p<0.0001。
99.图23是实施例16中小鼠三次免疫后(1免后19天,2免后14天,3免后14天) 分别收集的血清的sars
‑
cov假病毒90%中和抗体滴度。其中:sc
‑
dimer表示使用的免疫源为sars
‑
cov
‑
rbd单链二聚体,monomer表示使用的免疫源为sars
‑
rbd单体。显著性差异分析:ns,p>0.05;*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001。
具体实施方式
100.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
101.另外,为了更好的说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在一些实施例中,对于本领域技术人员熟知的原料、元件、方法、手段等未作详细描述,以便于凸显本发明的主旨。
102.除非另有其它明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并未排除其它元件或其它组成部分。
103.名词解释
104.二硫键连接的非单链形式的rbd二聚体和rbd单体:将编码rbd单体的核苷酸序列插入载体,然后转染表达系统的细胞进行表达,表达后收集细胞上清,纯化得到rbd单体和二硫键连接的非单链形式的rbd二聚体,其中:二硫键连接的非单链形式的rbd二聚体中的2
个rbd单体简单通过其中的半胱氨酸以二硫键结合所形成的二聚体rbd。二硫键连接的非单链形式的rbd二聚体、非单链形式的二聚体rbd蛋白均具有相同的含义; rbd单体、单体rbd、单体rbd蛋白均具有相同的含义。
105.单链形式的rbd二聚体:将两段编码相同或基本相同的单体rbd的核苷酸序列直接串联或通过连接段串联,在该核苷酸序列的5’端加入编码信号肽的序列,3’端加上终止密码子,进行克隆表达,筛选正确的重组子,然后转染表达系统的细胞进行表达,表达后收集细胞上清,纯化得到重组蛋白,该蛋白含有两个rbd单体,两个rbd单体相同或基本相同,可以直接通过肽键连接在一起也可以通过一段连接序列(比如ggs、ggsggs 等)连接在一起,即为单链形式的rbd二聚体。本技术中单链rbd二聚体、rbd单链二聚体、单链二聚体、sc
‑
rbd dimer、single
‑
chain rbd dimer等均具有相同的含义。
106.实施例1:表达mers
‑
cov抗原的重组杆状病毒制备和rbd蛋白的表达纯化
107.将编码mers
‑
cov s蛋白(序列如genbank:afs88936.1)中的氨基酸rbd (e367
‑
y606)序列(如seq id no:1所示)的核苷酸序列(如seq id no:24所示) 3’端加上翻译终止密码子后克隆到包含gp67信号肽的pfastbac载体(pfastbac
‑
sp来自 invitrogen公司)的ecor i和xho i酶切位点之间,使得蛋白编码区在信号肽gp67序列的后面融合表达,用于目的蛋白的分泌,并且使目的蛋白c端带上6个组氨酸,得到载体 pfastbac
‑
sp
‑
mers
‑
rbd(e367
‑
y606),然后转染表达系统的细胞进行表达,表达后收集细胞上清,纯化。
108.所得rbd蛋白纯化过superdex200 hiload 16/60柱子(ge)进行分子筛层析之后,典型的蛋白纯化紫外吸收图如图1所示。有一个二聚体的峰(dimer)还有一个单体的峰(monomer)。取mers
‑
rbd蛋白在洗脱体积78ml附近的洗脱峰进行sds
‑
page分析。洗脱体积78ml附近的蛋白在非还原条件下(不加dtt)的情况下,大小约为60kd;而在还原条件下(加入dtt),大小约为30kd,证明该峰中所获得蛋白质是二聚体。取洗脱体积90ml附近的洗脱峰进行sds
‑
page分析,目的蛋白在非还原条件下(不加dtt) 和还原条件的情况下大小均约为30kd,证明该峰主要是rbd单体。以上获得为二硫键连接的非单链形式的rbd二聚体和rbd单体,以下实施例2
‑
实施例9中使用的二聚体或单体为本实施例中获得的二硫键连接的非单链形式的rbd二聚体和rbd单体。
109.实施例2:mers
‑
rbd蛋白免疫小鼠实验
110.mf59(以下使用的addavax是一种mf59
‑
like佐剂)和铝佐剂是sfda批准的两种常用佐剂,我们使用这两个佐剂作为疫苗组分对于后续的临床试验有着更直接的指导作用。体外中和试验是检测疫苗保护效果的经典方法。因此,我们将不同剂量的抗原分别与addavax佐剂和imject
tm
alum佐剂进行混合,进行免疫。免疫分组情况、各组使用的rbd类别、每1次免疫使用的rbd免疫量和佐剂情况如表1所示,空白格部分表示“无”。
111.将实施例1获得的mers
‑
rbd抗原(二聚体或单体)于生理盐水中稀释成所需浓度,并与佐剂进行分组乳化。然后对4
‑
6周龄的balb/c小鼠(平均体重15
‑
20g,下同)进行分组免疫,每组6只。
112.表1
[0113][0114]
免疫策略如图2,即通过大腿肌肉注射的方式,每只小鼠分别在第0天,第21 天,第42天接受3次疫苗免疫,每次100μl的接种体积。第56天(即三免后的第14 天),对小鼠进行尾部取血。小鼠血清通过静置后3000rpm离心10分钟获得,并与
‑
20℃冰箱保存,用于特异性抗体滴度检测和假病毒中和检测。
[0115]
实施例3:elisa实验检测疫苗诱导的特异性抗体滴度
[0116]
(1)将mers
‑
cov的rbd单体蛋白用elisa包被液(索莱宝,c1050)稀释至3 μg/ml,96孔elisa板(coring,3590)每孔加入100μl,4℃放置12小时。
[0117]
(2)倒掉包被液,加入pbs,洗一遍。使用pbs配制的5%脱脂牛奶作为封闭液,加入96孔板中,每孔100μl,封闭,室温放置1小时。封闭完后用pbs溶液洗一遍。
[0118]
(3)封闭期间稀释小鼠血清。血清样品也用封闭液稀释。血清样品从20倍起始梯度稀释。之后在elisa板中每孔加入100μl,阴性对照为加入封闭液,37度孵育2小时,之后使用pbst洗4遍。
[0119]
(4)加入使用封闭液1:2000稀释的偶联hrp的羊抗鼠二抗(abcam,ab6789), 37℃孵育1.5小时,之后pbst洗5
‑
6遍。加入tmb显色液显色,反应适当时间后加入2 m盐酸终止反应,在酶标仪上检测od450读值。抗体滴度值被定义为反应值大于2.5倍阴性对照值的血清最高稀释倍数。当最低稀释倍数(检测限)的反应值仍小于2.5倍背景值时,该样品的滴度定义为最低稀释倍数的一半即1:10。
[0120]
结果如图3所示,使用addavax佐剂3μg和10μg剂量下,rbd二聚体组和单体组诱导的抗体水平有显著差异,使用铝佐剂3μg、10μg和30μg剂量下,rbd二聚体组和单体组诱导的抗体水平有显著差异,且二聚体组诱导的抗体水平较高,显示出二聚体 rbd抗原激活小鼠
抗体反应的能力明显强于rbd单体疫苗。
[0121]
本发明实施例中所有的elisa实验的包被蛋白都使用的是mers
‑
cov的rbd单体蛋白。
[0122]
实施例4:mers
‑
cov假病毒的制备
[0123]
pnl43
‑
luci假病毒包装
[0124]
(1)细胞铺盘:转染前一天,用胰酶进行消化以收获对数期生长的293t细胞,计数,重新接种细胞于10cm培养皿中培养过夜,至18
‑
24h时细胞达到70
‑
90%汇合时,进行转染(不含抗生素)。
[0125]
(2)pei法进行质粒共转染:将共20μg质粒(hiv pnl4
‑
3.luc.re(invitrogen) 10μg,pcaggs
‑
mers
‑
s 10μg,这里pcaggs
‑
mers
‑
s是将编码mers的spike蛋白 (m1
‑
h1352)的dna序列插入到pcaggs载体的ecori和xhoi位点。)和40μl pei(2mg/ml) 分别溶于生理盐水或hbs中,终体积为500μl,混匀;静置5min后,将两者混合,再静置20min,将混合物逐滴加入到细胞培养皿中,4
‑
6h后,pbs洗涤细胞2次更换新鲜的无血清培养基。
[0126]
(3)收毒:转染48h后,收集细胞及上清,1000rpm低速离心10min去除细胞碎片,分装,于
‑
80℃保存,避免反复冻融造成病毒滴度下降。
[0127]
(4)感染:第一天,细胞铺板,培养过夜,至18
‑
24h时细胞达到80
‑
100%;
[0128]
第二天,pbs洗涤易感细胞去除血清,取病毒上清感染易感细胞,4
‑
6h换为含血清的培养基。根据实验需要,可在不同时间点测定luciferase值,参考promega公司 luciferase assay system protocol或dual luciferase reporter assay system protocol。将收取的病毒液按5倍比稀释,加入到96孔板中的huh7细胞(人肝癌细胞)中。感染4小时后,弃掉病毒液,pbs洗涤细胞2次,换为含10%血清的dmem完全培养基。48小时候,弃掉培养基,pbs洗涤2次,加入细胞裂解液。
‑
80℃冻融一次后,每孔取20μl利用glomax 96microplate luminometer(promega)检测荧光素酶活性值。通过reed
‑
muech 法计算tcid
50
。
[0129]
实施例5:免疫血清的假病毒中和实验
[0130]
实施例2中获得的血清倍比稀释,与100tcid
50
假病毒混合,37℃共孵育30 分钟。将混合液加入到已铺满huh7细胞的96孔板中。37℃孵育4小时后,弃掉病毒液,pbs洗涤细胞2次,换为含10%血清的完全培养基dmem。48小时后,弃掉培养液,pbs 洗涤细胞2次,加入细胞裂解液,检测荧光素酶活性值。假病毒表面带有刺突蛋白,假病毒感染细胞释放dna,表达荧光素酶,但不复制。如果有中和抗体存在的情况下,假病毒就无法感染细胞,则不表达荧光素酶。以此方法来检验血清的中和滴度。
[0131]
第三次免疫后免疫原性检测结果见图4。结果显示rbd二聚体(e367
‑
y606) 在三次免疫之后,无论addavax佐剂组还是铝佐剂组(+alum表示),都产生了中和抗体。特别是addavax佐剂10μg组的中和抗体nt
90
平均值可达1:1000以上(如图4所示)。而 rbd单体(e379
‑
e589)在三次免疫之后,除了2只小鼠有较弱的中和抗体产生,其余都检测不到(如图4所示)。假病毒中和实验证明了二聚体rbd诱导的中和抗体远比单体 rbd高。
[0132]
上述rbd单体(e379
‑
e589)通过以下方法获得:将编码mers
‑
cov s蛋白中的氨基酸(e379
‑
e589)序列(如seq id no:4所示)的核酸片段(如seq id no:25 所示)插入pfastbac
‑
sp的ecori和xhoi酶切位点,使得蛋白编码区在信号肽gp67序列的后面融合表
达,用于目的蛋白的分泌,并且使目的蛋白c端带上6个组氨酸,得到载体 pfastbac
‑
sp
‑
mers
‑
rbd(e379
‑
e589)
[0133]
实施例6:免疫血清的真病毒中和(emc株)
[0134]
使用三次免疫之后的血清,进行mers
‑
cov真病毒(emc株)的中和实验。实验结果如图5。结果显示,无论addavax佐剂还是铝佐剂,rbd二聚体都能诱导小鼠产生很高的中和抗体。最高的组(addavax佐剂10μgrbd二聚体)能达到ic50大于1:600。这结果通过mers
‑
cov真病毒中和实验证明二聚体rbd可以诱导小鼠产生较高的中和抗体。
[0135]
实施例7:攻毒保护实验
[0136]
实施例2中三次免疫后的小鼠,根据图2所示,第77天滴鼻感染表达hcd26 (hdpp4)的腺病毒。这样在肺部能够瞬时表达mers
‑
cov的受体hcd26,从而使得小鼠对mers
‑
cov易感(参照chi h等.dna vaccine encoding middle east respiratory syndromecoronavirus s1 protein induces protective immune responses in mice[j].vaccine,2017, 35(16):2069
‑
2075)。5天后用mers
‑
cov(emc株)攻毒(一次攻毒剂量5x105pfu)。攻毒之后3天,取出小鼠的肺脏,组织匀浆用来检测病毒滴度(tcid
50
),结果如图6所示。相比pbs对照组,疫苗组小鼠的肺组织的病毒量显著降低。其中addavax佐剂3μgrbd 二聚体组的病毒量较pbs组下降了近1000倍,显示出了很好的保护效果。这些结果显示, rbd二聚体作为疫苗有着非常显著的针对mers
‑
cov活毒攻毒的保护效果。
[0137]
实施例8:检测疫苗对小鼠肺组织的保护效果
[0138]
将实施例7中mers
‑
cov攻毒实验的小鼠肺组织使用4%多聚甲醛固定,之后经苏木精
‑
伊红染色,切片观察肺部的病例变化,结果如图7所示,所有对照组小鼠(即 pbs组)的肺组织呈现严重的间质性肺炎,肺泡炎,炎症细胞浸润以及支气管上皮细胞坏死(如图7)。而免疫组小鼠,无论是使用addavax还是alum作为佐剂都能够极大的缓解病毒攻毒引起的肺损伤,呈现出轻中度的肺损伤,肺泡清晰可见,较少有炎症细胞浸润。小量的肺部组织病变可能是由于一次攻毒剂量很大(5x105pfu)导致的。这些结果显示,rbd二聚体作为疫苗能够极大的缓解mers
‑
cov攻毒引起的肺部损伤。
[0139]
实施例9:mers
‑
rbd二聚体晶体结构解析
[0140]
按照实施例1的方法,表达rbd(e367
‑
y606)蛋白。纯化后收集二聚体蛋白峰。蛋白浓缩到10mg/ml,蛋白与结晶池液按照体积比1:1的比例进行混合,再通过蛋白结晶筛选液体工作站(ttp labtech)进行蛋白质晶体筛选。在18℃生长,获得可用于衍射的晶体。晶体在上海同步辐射中心(ssrf)收集,最终获得的衍射数据。数据通过hkl2000软件分析,利用mers
‑
rbd单体的结构为模板(pdb:4kqz),通过分子置换法最终解析出mers
‑
rbd dimer的结构。如图8所示。
[0141]
实施例10:基于mers
‑
rbd二聚体结构设计单链rbd二聚体(sc
‑
rbd dimer)
[0142]
基于图8的mers
‑
rbd晶体结构,rbd两个亚基的n端(n’)和c端(c’)处于之中头对头的排列形式。n端与c端各有一段看不见的柔性序列(如图9a)。因此,我们设计通过两个亚基之间串联起来,获得单链rbd二聚体(sc
‑
rbd dimer)。
[0143]
第一种设计(如图9a)包括:
[0144]
(1)在两个重复串联的(e367
‑
y606)序列之间加入2个ggs连接序列,得到mers
‑
rbd
‑
c1(简称c1),编码该氨基酸序列的核苷酸序列为seq id no:9;
[0145]
(2)在两个重复串联的(e367
‑
y606)序列之间加入1个ggs连接序列,得到 mers
‑
rbd
‑
c2(简称c2),编码该氨基酸序列的核苷酸序列为seq id no:10;
[0146]
(3)两个重复(e367
‑
y606)序列直接串联,得到mers
‑
rbd
‑
c3(简称c3),编码该氨基酸序列的核苷酸序列为seq id no:11。
[0147]
第二种设计(如图9b)为了避免c端603位的半胱氨酸(c603)对表达的影响,构建截到n602,包括:
[0148]
(4)在两个重复的串联的(e367
‑
n602)序列之间加入1个ggs连接序列,得到 mers
‑
rbd
‑
c4(简称c4),编码该氨基酸序列的核苷酸序列为seq id no:12;
[0149]
(5)两个重复的(e367
‑
n602)序列直接串联,得到mers
‑
rbd
‑
c5(简称c5),编码该氨基酸序列的核苷酸序列为seq id no:13。
[0150]
第三种设计(如图9c)直接表达结构可见序列,通过不同长度的连接序列连接起来,包括:
[0151]
(6)在两个重复的串联的(v381
‑
l588)序列之间加入5个ggs连接序列,得到 mers
‑
rbd
‑
c6(简称c6),编码该氨基酸序列的核苷酸序列为seq id no:14;
[0152]
(7)在两个重复的串联的(v381
‑
l588)序列之间加入4个ggs连接序列,得到 mers
‑
rbd
‑
c7(简称c7),编码该氨基酸序列的核苷酸序列为seq id no:15;
[0153]
(8)在两个重复的串联的(v381
‑
l588)序列之间加入3个ggs连接序列,得到 mers
‑
rbd
‑
c8(简称c8),编码该氨基酸序列的核苷酸序列为seq id no:16;
[0154]
(9)在两个重复的串联的(v381
‑
l588)序列之间加入1个ggs连接序列,得到 mers
‑
rbd
‑
c9(简称c9),编码该氨基酸序列的核苷酸序列为seq id no:17;
[0155]
(10)把两个重复的(v381
‑
l588)直接串联起来,得到mers
‑
rbd
‑
c10(简称c10),编码该氨基酸序列的核苷酸序列为seq id no:18。
[0156]
将编码以上mers
‑
rbd
‑
c1到c10的核苷酸序列的5’端加上编码mers
‑
s蛋白自身信号肽(mihsvfllmflltptes)的核苷酸序列,3’端加上编码6个组氨酸的核苷酸序列后,再在3’端加上终止密码子,所得核苷酸序列插入到pcaggs载体ecori和 xhoi酶切位点之间,其起始密码子上游含有kozak序列gccacc。以上质粒转染293t细胞, 48小时后,取上清,目的蛋白n端带有信号肽,通过蛋白印迹法(western blot)检测目的蛋白的表达,结果如图10所示。结果显示除了c2,其余构建均有表达。无论是还原 (+dtt)还是非还原(
‑
dtt)的条件下,蛋白都在二聚体的大小左右(50
‑
60kda)。其中c4和c5的表达量最高。考虑到c5构建没有引入外源连接序列,完全是mers
‑
cov 自身的序列,因此对于临床使用更有优势、更安全。我们就进一步评价mers
‑
rbd
‑
c5 作为疫苗的效果。
[0157]
实施例11:哺乳动物表达mers
‑
cov rbd单链二聚体(sc
‑
rbd dimer)与蛋白纯化
[0158]
使用哺乳动物293t细胞表达mers
‑
rbd
‑
c5。质粒转染293t细胞之后,进行表达并收获上清。细胞上清通过0.22μm的滤膜过滤,除去细胞碎片。将细胞培养上清液挂镍亲和柱(histrap),4度过夜。以缓冲液a(20mm tris,150mm nacl,ph8.0)洗涤树脂,以除去非特异结合蛋白。最后目的蛋白以缓冲液b(20mm tris,150mm nacl, ph 8.0,300mm咪唑)从树脂上洗脱下来,并以10k截留(10cutoff)浓缩管将洗脱液浓缩至5ml以内。再通过superdex200 hiload 16/60柱子(ge)进行分子筛层析进行进一步的目的蛋白纯化。分子筛层析缓冲液为20mm tris,150mm nacl,ph8.0。经过分子筛层析,只在洗脱体积80ml附近有1个主峰。收集
进行sds
‑
page分析。sds
‑
page 的结果可见,mers
‑
rbd
‑
c5蛋白显示1条明显的蛋白带,在55
‑
72kd之间,是rbd二聚体的大小。证明获得了mers
‑
rbd单链二聚体,如图11所示。同时我们也使用实施例10中的方法,即293t细胞表达纯化了非单链形式的mers rbd二聚体,用于和sc
‑
rbddimer作比较。
[0159]
实施例12:mers
‑
cov rbd单链二聚体(sc
‑
rbd dimer)蛋白免疫小鼠实验将实施例11获得的mers
‑
rbd单链二聚体抗原于生理盐水中稀释,并与佐剂进行分组乳化。然后对4
‑
6周龄的balb/c小鼠进行分组免疫,每组6只小鼠,另外,一组小鼠免疫pbs作为阴性对照。一组小鼠免疫293t细胞表达的非单链形式的二聚体。通过大腿肌肉注射的方式,每只小鼠分别在第0天,第21天和第42天接受3次疫苗免疫,每次100μl的接种体积(含10μg免疫源)。1免后19天,2免14天和3免后14天,对小鼠进行眼眶取血。小鼠血清通过静置后3000rpm离心10分钟获得,并于
‑
20℃冰箱保存,用于特异性抗体检测和假病毒中和检测。
[0160]
通过elisa实验检测小鼠血清的特异性抗体滴度,实验方法见实施例3,结果如图12所示,rbd
‑
sc
‑
dimer组小鼠和二硫键连接的非单链rbd
‑
dimer组(dimer表示)小鼠都能被诱导产生抗体反应,sc
‑
dimer组的滴度均值比dimer组高,在三次免疫后二者有显著差异(*,p<0.05)。此结果表明,sc
‑
dimer和二硫键连接的非单链rbd
‑
dimer一样具有很好的免疫原性。
[0161]
假病毒中和实验参照实施例5进行。结果如图13所示,sc
‑
dimer组小鼠和二硫键连接的非单链rbd
‑
dimer组(dimer表示)小鼠都能被诱导产生抗体反应,sc
‑
dimer组的滴度均值比dimer组高,在第一次免疫和第二次免疫后二者有显著差异(图13)。在三次免疫后sc
‑
dimer组小鼠的假病毒中和滴度均值已经大于1:1000。此结果预示着用 sc
‑
dimer分开发的疫苗具有很大的临床开发潜力。
[0162]
实施例13、单链rbd二聚体技术在其他冠状病毒疫苗中的应用
[0163]
为了验证这一思路是否能应用于所有其他冠状病毒的疫苗设计,我们将19种常 见的beta冠状病毒的受体结合区(rbd)进行了比较,如图14a和图14b。所有的beta 冠状病毒rbd都在mers
‑
cov的c603位置呈现保守的半胱氨酸,如图14b。我们选 取了2019
‑
ncov(以下简称ncov)和sars
‑
cov两种冠状病毒来进行验证。根据 sars
‑
rbd的结构(pdb:3d0g),通过pymol软件,我们将sars
‑
rbd的晶体结构 建模到分辨率的mers
‑
rbd二聚体晶体结构中。得到如图15的模拟 sars
‑
rbd二聚体结构。我们发现和mers
‑
rbd二聚体一样,sars
‑
rbd的二聚体也 以头并头形式存在(如图15)。由于新冠状病毒2019
‑
ncov与sars
‑
cov的rbd区域 同源性高达75%以上,我们预计2019
‑
ncov的rbd二聚体形成这种头并头的形式。考 虑到之前mers
‑
cov里面二聚体较单体能诱导更高滴度的中和抗体,我们因此考虑仍 然用单链二聚体(sc
‑
dimer)的方式来设计疫苗。首先,以2019
‑
ncov的s蛋白序列为 基础,我们设计了3种单链二聚体(sc
‑
dimer)的构建,如图15:(1)两个r319
‑
s530 串联,命名为ncov
‑
rbd
‑
c1(编码该氨基酸序列的核苷酸序列为seq id no:19); (2)两个r319
‑
k537串联,命名为ncov
‑
rbd
‑
c2(编码该氨基酸序列的核苷酸序列为 seq id no:20);(3)两个r319
‑
f541串联,命名为ncov
‑
rbd
‑
c3(编码该氨基酸 序列的核苷酸序列为seq id no:21);(4)另外单体构建为r319
‑
f541,命名为 ncov
‑
rbd
‑
c4(编码该氨基酸序列的核苷酸序列为seq id no:22)。此外,还构 建了sars
‑
cov的单链二聚体,两个r306
‑
q523串联到一起,如图14a和图14b,命 名为sars
‑
cov
‑
rbd
‑
c1(编码该氨基酸序列的核苷酸序列为seq id no:23)。
[0164]
将编码以上ncov
‑
rbd
‑
c1到c4的核苷酸序列和编码sars
‑
cov
‑
rbd
‑
c1的核苷酸序列(seq id no:23)的5’端加上编码mers
‑
s蛋白自身信号肽 (mihsvfllmflltptes)的核苷酸序列;3’端加上编码6个组氨酸的核苷酸序列后,再在3’端加上终止密码子,插入到pcaggs载体ecori和xhoi酶切位点,其起始密码子上游含有kozak序列gccacc。以上质粒转染293t细胞,48小时后,取上清,通过蛋白印迹法(western blot)检测目的蛋白的表达。表达结果如图16。结果显示在2019
‑
ncov 的几种抗原设计中ncov
‑
rbd
‑
c2的表达最高。而sars
‑
cov
‑
rbd
‑
c1的构建蛋白表达量也很高。
[0165]
以上结果说明,beta冠状病毒的单链二聚体设计,从图14a的第一个氨基酸(标记为start)开始,到图14b最后一个半胱氨酸(标记为stop)之前的一个氨基酸为止是表达最优的构建。
[0166]
实施例14、2019
‑
ncov
‑
rbd单链二聚体抗原和sars
‑
cov
‑
rbd单链二聚体抗原的表达纯化
[0167]
哺乳动物293t细胞表达ncov
‑
rbd
‑
c2。质粒转染293t细胞之后,收获上清。细胞上清通过0.22μm的滤膜过滤,除去细胞碎片。将细胞培养上清液挂镍亲和柱 (histrap),4度过夜。以缓冲液a(20mm tris,150mm nacl,ph8.0)洗涤树脂,以除去非特异结合蛋白。最后目的蛋白以缓冲液b(20mm tris,150mm nacl,ph 8.0,300 mm咪唑)从树脂上洗脱下来,并以10k截留(10cutoff)浓缩管将洗脱液浓缩至5ml 以内。再通过superdex200 hiload 16/60柱子(ge)进行分子筛层析进行进一步的目的蛋白纯化。分子筛层析缓冲液为20mm tris,150mm nacl,ph8.0。经过分子筛层析,只在洗脱体积80ml附近有1个主峰。收集进行sds
‑
page分析。sds
‑
page的结果显示, ncov
‑
rbd
‑
c2蛋白显示1条明显的蛋白带,在48
‑
63kd之间,是rbd二聚体的大小。证明获得了2019
‑
ncov
‑
rbd单链二聚体,如图17。纯度在95%以上。该结果表明,这样的构建能够获得足量、高纯度的2019
‑
ncov单链二聚体蛋白。
[0168]
以相同的方法表达和纯化了2019
‑
ncov单体rbd蛋白(由ncov
‑
rbd
‑
c4构建表达获得)、sars
‑
cov单体rbd蛋白(sars
‑
cov rbd r306
‑
f527,氨基酸序列和编码其氨基酸序列的核苷酸序列如seq id no:26和seq id no:27所示)和sars
‑
cov单链二聚体蛋白(由sars
‑
cov
‑
rbd
‑
c1构建表达获得)。
[0169]
sars
‑
cov单链二聚体蛋白结果如图18所示,可见经过分子筛层析,只在洗脱体积80ml附近有1个主峰。收集进行sds
‑
page分析,由图18可见sars
‑
cov
‑
rbd
‑
c1 目的蛋白分子量在在55
‑
72kd之间,是rbd二聚体的大小。证明获得了sars
‑
rbd单链二聚体,如图18,且具有很高的纯度。
[0170]
实施例15:2019
‑
ncov
‑
rbd单链二聚体蛋白免疫小鼠实验
[0171]
将实施例14获得的2019
‑
ncov
‑
rbd单链二聚体和2019
‑
ncov
‑
rbd单体于pbs 溶液中稀释,并与addavax佐剂进行分组乳化。然后对6
‑
8周龄的balb/c小鼠(平均体重15
‑
20g,下同)进行分组免疫,每组8只小鼠。通过大腿肌肉注射的方式,每只小鼠分别在第0天,第21天和第42天接受3次疫苗免疫,每次100μl的接种体积(含10μg 免疫源)。分别在1免19天,2免14天和3免14天,对小鼠进行采血。小鼠血清通过静置后3000rpm离心10分钟获得,并于
‑
20℃冰箱保存,用于特异性抗体检测和假病毒中和检测。
[0172]
通过elisa实验检测小鼠血清的2019
‑
cov rbd特异性抗体滴度,实验方法见实施例3,结果如图19所示,单链二聚体rbd(标记sc
‑
dimer)和单体rbd(标记monomer) 都能诱导
小鼠产生抗体反应,每次免疫后单链二聚体rbd组的滴度均值都比单体rbd组高(10
‑
100倍提高),且每次免疫后二者都有显著差异(图19)。三次免疫后单链二聚体rbd诱导小鼠产生的抗体水平高达约1:106。此结果表明,单链二聚体形式的rbd抗原比单体形式的rbd抗原免疫原性更强,作为潜在的新冠病毒疫苗具有极大潜力。
[0173]
2019
‑
ncov假病毒中和实验方法参照实施例5进行。结果如图20所示,一次免疫后,仅单链二聚体rbd(标记sc
‑
dimer)组诱导产生了中和抗体,单体rbd(标记 monomer)和pbs组都检测不到中和抗体,单链二聚体rbd组与单体rbd组中和抗体滴度有显著差异(图20)。第二次和第三次免疫后,单链二聚体rbd和单体rbd都能诱导小鼠产生中和抗体,每次免疫后单链二聚体rbd组的中和抗体滴度均值都比单体rbd组高(10
‑
100倍提高),且每次免疫后二者都有显著差异(图20)。三次免疫后单链二聚体rbd诱导小鼠产生的中和抗体水平高达约1:104。此结果表明,单链二聚体rbd抗原相比单体rbd抗原能够诱导小鼠产生更高的中和抗体水平,在应用中单链二聚体rbd抗原具有很高的优势。
[0174]
使用二次免疫之后的血清,进行2019
‑
ncov真病毒(2020xn4276株)的中和实验。实验结果见图21。结果显示,rbd二聚体能诱导小鼠产生很高的新冠病毒中和抗体,最高的中和nt50能大于4096,nt50 最低的一只鼠数值是512。而rbd单体组的8只鼠,仅2只检测出新冠病毒中和抗体, nt50较低,分别是128和256。此结果表明二聚体rbd可以诱导小鼠产生较高的新冠病毒中和抗体。
[0175]
实施例16:sars
‑
rbd单链二聚体蛋白免疫小鼠实验
[0176]
将实施例14获得的sars
‑
rbd单链二聚体和sars
‑
rbd单体于pbs溶液中稀释,并与addavax佐剂进行分组乳化。然后对6
‑
8周龄的balb/c小鼠进行分组免疫,每组6 只小鼠。通过大腿肌肉注射的方式,每只小鼠分别在第0天,第2天和第42天接受3 次疫苗免疫,每次100μl的接种体积(含10μg免疫源)。分别在1免19天,2免14天和3免14天,对小鼠进行采血。小鼠血清通过静置后3000rpm离心10分钟获得,并与
‑
20℃冰箱保存,用于特异性抗体检测和假病毒中和检测。
[0177]
通过elisa实验检测小鼠血清的sars
‑
rbd特异性抗体滴度,实验方法见实施例 3,结果如图22所示,单链二聚体rbd(标记sc
‑
dimer)和单体rbd(标记monomer) 都能诱导小鼠产生抗体反应,每次免疫后单链二聚体rbd组的滴度均值都比单体rbd组高,在第二次和第三次免疫后二者都有显著差异(图22)。三次免疫后二聚体rbd诱导小鼠产生的抗体水平高达约1:106。此结果表明,二聚体形式的rbd抗原比单体形式的 rbd抗原免疫原性更强。
[0178]
sars
‑
cov假病毒中和实验方法参照实施例5进行。结果如图23所示,两次免疫后,二聚体rbd(标记sc
‑
dimer)组和单体rbd(标记monomer)组都诱导产生了中和抗体,但是二聚体rbd组滴度值更高,二者相比具有显著差异(图23)。第三次免疫后,二聚体rbd组的中和抗体滴度均值仍然比单体rbd组高,且具有显著差异(图23)。三次免疫后二聚体rbd诱导小鼠产生的中和抗体水平高于1:103。此结果表明,二聚体 rbd抗原相比单体rbd抗原能够诱导小鼠产生更高的中和抗体水平,在应用中二聚体 rbd抗原具有很高的优势。
[0179]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和
范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1