一种寡肽、活性肽组合物及其在制备具有抗炎作用的产品中的应用的制作方法
1.本发明涉及生物医学技术领域,具体涉及一种寡肽、活性肽组合物及其在制备具有抗炎作用的产品中的应用。
背景技术:
2.炎症是一种由各种外界刺激诱发的适应性反应,是正常机体、细胞对病原体、病毒等异物最基本保护性反应之一,是多种生理和病理过程的基础,可在发生感染、创伤、中毒性或自身免疫损伤组织中产生。炎症过程也是对毒素、入侵病原体和过敏原以及受损组织进行免疫反应的第一步。
3.皮肤是人体最大的保护性器官,作为人体与环境的界面,皮肤形成了强大的屏障来抵抗外界刺激的伤害。在特异性皮炎、衰老及皮肤干燥等屏障功能受损的炎症性疾病中,皮肤为抵抗感染提供了第一道免疫防护线,因此,增强皮肤屏障防护功能非常重要。皮肤的免疫反应对于宿主抵抗病原微生物至关重要,但是免疫失调会导致皮肤产生慢性炎症,从而导致持续的细胞损伤和各种皮肤疾病。
4.脂多糖(lipopolysaccharide)(英文简写lps)是革兰氏阴性细菌细胞壁外壁的组成成分,是由脂质和多糖构成的物质;而脂多糖进入体内后可引起机体发生炎症反应;然而诱发细胞炎症的原因有很多,大多数抗炎药物并不具有抗脂多糖(lps)导致的细胞炎性损伤。
5.因此,开发一种具有抗脂多糖(lps)导致的细胞炎性损伤作用的药物,具有重要的意义。
技术实现要素:
6.鉴于此,本发明首先提供一种全新结构的寡肽以及活性肽组合物,经进一步研究表明,所述的寡肽以及活性肽组合物具有抗脂多糖(lps)导致的细胞炎性损伤作用。
7.本发明的详细技术方案如下:
8.本发明的第一方面提供一种寡肽,其具有式ⅰ所示的结构:
[0009][0010]
式ⅰ所示结构的活性环肽命名为双歧杆菌寡肽
‑
α(简写为ht
‑
1);其氨基酸序列为
phe
‑
ser
‑
thr
‑
his
‑
gly
‑
gly(如seq id no.1所示)。
[0011]
所述的双歧杆菌寡肽
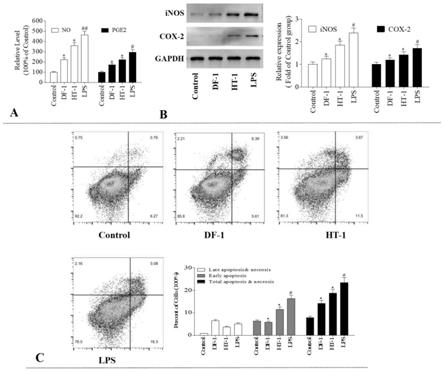
‑
α可以从双歧杆菌中分离得到;也可以按照实施例中的方法制备得到。
[0012]
本发明的第二方面提供一种活性肽组合物,其包含式ⅰ所示结构的寡肽,以及式ⅱ所示结构的活性环肽;
[0013][0014]
式ⅱ所示结构的活性环肽命名为啤酒酵母菌环肽
‑
β(简写为df
‑
1);其氨基酸序列为cycle
‑
[trp
‑
leu
‑
his
‑
val]。其未成环的线性氨基酸序列可以为序列表中的seq id no.2所示的氨基酸序列。
[0015]
所述的啤酒酵母菌环肽
‑
β可以从啤酒酵母菌中分离获得;也可以按照实施例中的方法制备得到。
[0016]
优选地,式ⅰ所示结构的寡肽与式ⅱ所示结构的活性环肽的摩尔比为1~8:1~8。
[0017]
进一步优选地,式ⅰ所示结构的寡肽与式ⅱ所示结构的活性环肽的摩尔比为1~3:1~3。
[0018]
本发明的第三方面提供一种寡肽或活性肽组合物在制备具有抗炎作用的产品中的应用。
[0019]
优选地,所述的寡肽或活性肽组合物在制备具有抗脂多糖(lps)导致的细胞炎性损伤作用的产品。
[0020]
优选地,所述的产品为化妆品、护肤品、食品、保健品或药物。
[0021]
进一步优选地,所述化妆品或护肤品包括乳液、霜膏、凝胶、水剂、油剂、粉剂或面膜。
[0022]
进一步优选地,所述食品、保健品或药物的形式包括片剂、胶囊、粉剂、颗粒剂、丸剂、糖浆剂、溶液剂、混悬剂或气雾剂。
[0023]
有益效果:本发明提供了一种全新结构的双歧杆菌寡肽
‑
α;实验表明,所述的双歧杆菌寡肽
‑
α和啤酒酵母菌环肽
‑
β均能够抑制lps暴露导致的hacat细胞炎性损伤及凋亡;且啤酒酵母菌环肽
‑
β的活性要优于双歧杆菌寡肽
‑
α。由于啤酒酵母菌环肽
‑
β的活性要优于双歧杆菌寡肽
‑
α,因此,我们进一步提供了啤酒酵母菌环肽
‑
β与双歧杆菌寡肽
‑
α形成的活性肽组合物,以提高双歧杆菌寡肽
‑
α的活性。根据上述活性可知:本发明所述的双歧杆菌寡肽
‑
α、啤酒酵母菌环肽
‑
β及其组合物具有抗脂多糖(lps)导致的细胞炎性损伤作用;因此,可以将双歧杆菌寡肽
‑
α、啤酒酵母菌环肽
‑
β及其组合物作为活性物质用于化妆品、护肤品、
食品、保健品或药物中,起到抗炎作用。此外,本发明所述的双歧杆菌寡肽
‑
α以及啤酒酵母菌环肽
‑
β可以从双歧杆菌以及啤酒酵母菌中分离得到,来源丰富;且双歧杆菌寡肽
‑
α和啤酒酵母菌环肽
‑
β为小分子化合物,制备工艺简单、操作方便,制得的双歧杆菌寡肽
‑
α以及啤酒酵母菌环肽
‑
β纯度高,有利于其在食品、药品、保健品和化妆品中的应用。
附图说明
[0024]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例的附图,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0025]
图1是ht
‑
1的质谱图。
[0026]
图2是ht
‑
1的高效液相色谱测定结果图。
[0027]
图3是df
‑
1的质谱图。
[0028]
图4是df
‑
1的高效液相色谱测定结果图。
[0029]
图5是ht
‑
1及df
‑
1抑制lps诱导的hacat细胞炎性细胞因子及粘附分子的表达结果图。其中,图5a是ht
‑
1及df
‑
1的浓度对细胞活性物的影响图;图5b是ht
‑
1及df
‑
1抑制lps刺激诱发的il
‑
6,il
‑
8,tnf
‑
α,il
‑
1β分泌实验结果图;图5c是ht
‑
1及df
‑
1对lps诱导的icam
‑
1及vcam
‑
1表达的影响结果图。
[0030]
图6是ht
‑
1及df
‑
1抑制lps诱导的hacat细胞凋亡实验结果图。其中,图6a是ht
‑
1及df
‑
1对hacat细胞no及pge2的分泌影响实验结果图;图6b是ht
‑
1及df
‑
1对hacat细胞inos及cox
‑
2的表达影响实验结果图;图6c是ht
‑
1及df
‑
1对hacat细胞的凋亡实验结果图。
[0031]
图7是ht
‑
1及df
‑
1抑制lps诱导的hacat细胞nf
‑
κb信号通路及nlrp3炎症小体激活实验结果图。其中图7a是ht
‑
1及df
‑
1对hacat细胞nf
‑
κb信号通路的实验结果图;其中图7b是ht
‑
1及df
‑
1对nlrp3炎症小体激活实验结果图。
具体实施方式
[0032]
下面将结合实施例对本发明技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0033]
实施例1双歧杆菌寡肽
‑
α及啤酒酵母菌环肽
‑
β的分离
[0034]
将50g双歧杆菌用500ml乙酸乙酯和2000ml水混合均匀,超声20min,静置后萃取得到水相层,多次重复萃取过程,将水相层进行真空低温冻干,再经制备型hplc进行制备分离,得到双歧杆菌寡肽
‑
α(ht
‑
1)。
[0035]
将50g啤酒酵母菌用500ml乙酸乙酯和2000ml水混合均匀,超声20min,静置后萃取得到水相层,多次重复萃取过程,将水相层进行真空低温冻干,再经制备型hplc进行制备分离,得到啤酒酵母菌环肽
‑
β(df
‑
1)。
[0036]
上述制备型hplc的制备条件为:以0.1%三氟乙酸水溶液为流动相a,以0.1%三氟乙酸的乙腈溶液为流动相a,流动相a:流动相b=50:50,测波长为310μm。由图2和图4可以看
出双歧杆菌寡肽
‑
α(ht
‑
1)及啤酒酵母菌环肽
‑
β(df
‑
1)出峰时间分别为11.203min和12.458min。
[0037]
实施例2双歧杆菌寡肽
‑
α(ht
‑
1)及啤酒酵母菌环肽
‑
β(df
‑
1)化学合成
[0038]
(1)取100mg fmoc
‑
tyr wang resin置于固相合成管中,加入n,n
‑
二甲基甲酰胺(dmf)后静置30分钟使树脂充分溶胀,滤去溶剂,再加入哌啶dmf溶液,振荡后滤出溶剂。将fmoc
‑
ser
‑
oh、1
‑
羟基苯并三唑、o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸酯溶于dmf中,在加入n,n
‑
二异丙基乙胺混匀后避光即已被活化,并加入树脂中,25℃下氮气吹动搅拌2小时,经抽滤后用dmf和二氯甲烷依次洗涤并抽干溶剂。重复上述步骤,将活化好的fmoc
‑
leu
‑
oh、fmoc
‑
his
‑
oh、fmoc
‑
leu
‑
oh、fmoc
‑
his
‑
oh、fmoc
‑
gly
‑
oh依次加入树脂中,25℃下氮气吹动搅拌,反应完全后洗涤树脂,将得到的滤液进行旋蒸并得到沉淀,经冷冻干燥后即可得到双歧杆菌寡肽
‑
α(ht
‑
1),其氨基酸序列为tyr
‑
ser
‑
leu
‑
his
‑
leu
‑
his
‑
gly。
[0039]
(2)取100mg fmoc
‑
trp wang resin置于固相合成管中,加入n,n
‑
二甲基甲酰胺(dmf)后静置30分钟使树脂充分溶胀,滤去溶剂,再加入哌啶dmf溶液,振荡后滤出溶剂。将fmoc
‑
leu
‑
oh、1
‑
羟基苯并三唑、o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸酯溶于dmf中,在加入n,n
‑
二异丙基乙胺混匀后避光后即已被活化,并加入树脂中,25℃下氮气吹动搅拌2小时,经抽滤后用dmf和二氯甲烷依次洗涤并抽干溶剂。重复上述步骤,将活化好的fmoc
‑
his
‑
oh、fmoc
‑
val
‑
oh依次加入树脂中,25℃下氮气吹动搅拌2小时,反应完全后洗涤树脂得粗肽x
‑
1,接着将x
‑
1用tfa溶液切除树脂得到游离的
‑
oh端,水浴40℃下减压蒸除tfa得到的固体加入乙酸乙酯中,并与等摩尔量的对硝基酚混合,以dcc为缩合剂制备得到对硝基酚活性酯x
‑
2,接着将x
‑
2用哌啶dmf溶液脱除保护基fmoc,游离出n端,除去多余溶剂得粗肽固体后加入碱na2co3,,溶剂二氧六环,配成10
‑3‑
10
‑4稀溶液,在25℃下反应5小时即可,有机相水浴40℃下旋蒸除去溶剂并经冷冻干燥后即可得到啤酒酵母菌环肽
‑
β(df
‑
1),其氨基酸序列为cycle
‑
[trp
‑
leu
‑
his
‑
val]。
[0040]
将上述双歧杆菌寡肽
‑
α(ht
‑
1)及啤酒酵母菌环肽
‑
β(df
‑
1)利用质谱对其进行测定,其中质谱测定条件为esi正离子模式毛细管电压3kv,锥孔电压50v,萃取电压5v,脱溶剂温度350℃,雾化气流350l/h;高效液相色谱测定条件为采用boston green ods
‑
aq色谱柱(250*4.6mm),以0.1%三氟乙酸水溶液为流动相a,以0.1%三氟乙酸的乙腈溶液为流动相a,流动相a:流动相b=50:50,流速为1ml/min,检测波长为310μm,进样量10μl。
[0041]
根据质谱数据(见图1),826.4213是[m+h]
+
离子,751.3910为y6离子,614.3317为y5离子,501.2470为y4离子,463.2436为b4离子,251.1508为y2离子,213.0988为b2离子,110.0712为[his
‑
cooh+h]
+
离子,从图1的质谱图可以确定,双歧杆菌寡肽
‑
α(ht
‑
1)的氨基酸序列为tyr
‑
ser
‑
leu
‑
his
‑
leu
‑
his
‑
gly,即式ⅰ所示结构;
[0042]
根据质谱数据(见图3),536.2996是[m+h]
+
离子,437.2296是[m
‑
val+h2o+h]
+
离子,419.2199是[m
‑
leu+h2o+h]
+
离子,300.1713是[trp
‑
leu
‑
2h2o+h]
+
离子,251.1502是[leu
‑
his
‑
2h2o+h]
+
离子,159.0919是[trp
‑
cooh+h]
+
离子,110.0720是[his
‑
cooh+h]
+
离子,86.0981是[leu
‑
cooh+h]
+
离子。最终可以确定啤酒酵母菌环肽
‑
β(df
‑
1)的氨基酸序列为cycle
‑
[trp
‑
leu
‑
his
‑
val],即式ⅱ所示结构。
[0043]
实验例
[0044]
为了评估本发明双歧杆菌寡肽
‑
α(ht
‑
1)和啤酒酵母菌环肽
‑
β(df
‑
1)及其组合的
生物活性,进行如下效果实施例。
[0045]
永生化角质形成细胞系hacat细胞培养于细胞培养箱中,37℃、5%co2(dmem培养基)。lps浓度为1μm刺激12h,结束后,pbs洗涤细胞,弃去pbs,重新加入dmem培养基或含ht
‑
1或df
‑
1(20μm)培养基继续培养24h。cck8方法检测细胞活力,收集细胞和培养液。
[0046]
ht
‑
1或df
‑
1对hacat细胞活力的影响试验中,将实验分为4组:正常对照组(control);lps组;ht
‑
1 20μm组(lps+ht
‑
1 20μm);df
‑
1 20μm组(lps+df
‑
1 20μm)。每个处理条件3个复孔,重复实验3次。正常对照组不接受lps刺激,lps组、ht
‑
1 20μm组、df
‑
1 20μm组则分别接受lps刺激。cck8检测细胞活力。
[0047]
将实验分为4组:正常对照组(control);lps组;ht
‑
1 20μm组(lps+ht
‑
120μm);df
‑
1 20μm组(lps+df
‑
1 20μm)。每个处理条件3个复孔,重复实验3次。正常对照组不接受lps刺激,lps组、ht
‑
1 20μm组、df
‑
1 20μm组则分别接受lps刺激。hacat细胞按实验设计处理后,收集细胞及细胞上清液;参考elisa试剂盒操作说明书检测il
‑
6,il
‑
8,tnf
‑
α,il
‑
1β的水平;参考elisa试剂盒操作说明书检测mmps含量变化情况。
[0048]
hacat细胞按实验设计处理后,收集细胞,在室温下于2000g离心3min。细胞在预冷1
×
pbs中悬浮,2000g离心3min,洗涤细胞。annexin v
‑
fitc/pi双染色实验按照制造商的说明进行。流式细胞仪检测细胞凋亡,所有实验至少重复3次。
[0049]
hacat细胞按实验设计处理后,收集细胞,用预冷的pbs洗2次,加入50μl细胞裂解液,4℃静置30min。10000r/min离心15min,取上清提取总蛋白,用bca法进行蛋白定量。总蛋白经sds
‑
page分离后,转移至pvdf膜上。用5%脱脂奶粉室温封闭2h。随后加入一抗,4℃轻摇过夜,用tbst洗3次,加入相应的二抗,室温孵育1h,漂洗3次。
[0050]
实验结果如下:
[0051]
从图5a实验结果数据中可以看出,ht
‑
1及df
‑
1浓度低于1250μm时对细胞活性物显著影响。如图5b所示,与control组相比,lps刺激使hacat分泌il
‑
6,il
‑
8,tnf
‑
α,il
‑
1β显著增加,而ht
‑
1及df
‑
1极大的抑制了lps刺激诱发的il
‑
6,il
‑
8,tnf
‑
α,il
‑
1β分泌;如图5c所示,lps刺激诱导了icam
‑
1及vcam
‑
1的表达。为了研究ht
‑
1及df
‑
1对lps诱导的icam
‑
1及vcam
‑
1表达的影响,我们检测了ht
‑
1及df
‑
1对lps诱导的icam
‑
1及vcam
‑
1表达的影响。结果显示,lps刺激使hacat细胞icam
‑
1及vcam
‑
1表达均显著增加,而ht
‑
1及df
‑
1可抑制lps诱导的icam
‑
1及vcam
‑
1表达。
[0052]
如图6a所示,lps刺激导致细胞no及pge2分泌显著增加,而经ht
‑
1及df
‑
1处理后lps刺激导致的hacat细胞no及pge2分泌受到明显抑制。进一步的,如图6b所示,lps刺激导致hacat细胞inos及cox
‑
2表达显著增加,而经ht
‑
1及df
‑
1处理后lps刺激导致的hacat细胞inos及cox
‑
2表达增加受到明显抑制。如图6c所示,lps刺激导致细胞凋亡增加,而经ht
‑
1及df
‑
1处理后hacat细胞凋亡率明显下降。由此可见,ht
‑
1及df
‑
1可通过减轻lps刺激诱发的hacat细胞凋亡发挥抗炎活性及保护作用。
[0053]
如图7a所示,lps刺激可显著上调p
‑
ikk
‑
α、p
‑
ikk
‑
β及p
‑
iκb的表达,而ht
‑
1及df
‑
1处理显著抑制了lps刺激导致的p
‑
ikk
‑
α、p
‑
ikk
‑
β及p
‑
iκb表达,表明ht
‑
1及df
‑
1通过抑制nf
‑
κb信号通路激活来抑制lps刺激导致的hacat细胞炎性损伤。
[0054]
进一步的,如图7b所示,lps刺激可显著上调nlrp3、asc及caspase
‑
1的表达,说明lps暴露显著激活nlrp3炎症小体,进而导致炎性损伤。而ht
‑
1及df
‑
1处理显著抑制了lps刺
激导致的nlrp3、asc及caspase
‑
1表达,表明ht
‑
1及df
‑
1通过抑制nlrp3炎症小体激活来抑制lps刺激导致的hacat细胞炎性损伤。
[0055]
通过上述机理实验结果可知:双歧杆菌寡肽
‑
α(ht
‑
1)和啤酒酵母菌环肽
‑
β(df
‑
1)可以抑制lps暴露导致的hacat细胞炎性损伤及凋亡;且啤酒酵母菌环肽
‑
β(df
‑
1)的作用要优于双歧杆菌寡肽
‑
α(ht
‑
1)。由此可见,本发明所述的双歧杆菌寡肽
‑
α、啤酒酵母菌环肽
‑
β及其组合具有抗脂多糖(lps)导致的细胞炎性损伤作用。
[0056]
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1