检测HNRNPM表达的试剂在制备诊断和/或预后判断肝癌中的应用及药物组合物
检测hnrnpm表达的试剂在制备诊断和/或预后判断肝癌中的应用及药物组合物
技术领域
1.本发明属于生物医药技术领域,具体涉及一种检测hnrnpm表达的试剂在制备诊断和/ 或预后判断肝癌中的应用及药物组合物。
背景技术:
2.在全世界范围内,肝癌(hepatocellular carcinoma,hcc)在所有癌症导致的死亡中占第二位,而且其发病率和死亡率都呈逐年上升趋势。hcc是一种侵袭性的恶性肿瘤,由于肿瘤发生发展过程中所涉及的多种病因和肿瘤的异质性,而且往往其诊断时就处于晚期的特点,所以hcc患者总体预后较差。尽管目前手术是治疗hcc最有效的方案之一,但是根治性术后的患者仍有70%左右在5年内仍会复发,所以hcc的总体生存率很低。与其他实体瘤一样,hcc 的基因组特征之一是编码和非编码rna转录组的整体失调。事实上,hcc的肿瘤特异性转录组与临床特征相关,提示转录组的改变可能驱动肿瘤的发生。作为转录后基因调控机制之一,可变剪接(alternative splicing,as)能使单个基因产生多个mrna变体和不同的蛋白亚型,从而在肿瘤的增殖、凋亡、血管生成、耐药和转移等生物学行为中可能有不同甚至相反的作用。此外,as通常受剪接因子(splicing factor,sf)的调节,剪接失调的主要原因是sf的表达或活性异常。目前已有多项研究表明sf及其调控的剪切事件与多种癌症的增殖、转移、侵袭和耐药相关。因此,了解hcc的转录后修饰对于理解其癌症的发生发展至关重要。这可能会为未来hcc的新治疗靶点开发提供一些新思路。
3.为了进一步探索sf的蛋白特性,我们继续关注胚胎肝脏发育和hcc中差异表达的sf。根据先前对胚胎肝脏发育的研究,结合临床hcc标本中的基因表达谱和tcga的系统分析,最终确定了一种剪切因子hnrnpm,它属于hnrnp家族的蛋白,具有癌胚属性,在核内发挥关键因子的剪切作用。多项研究表明它能促进实体瘤的增殖、耐药和侵袭转移,提示可能是一个重要的促癌因子,然而,hnrnpm在肝细胞肝癌中的生物学功能及作用机制尚不明确。
技术实现要素:
4.针对现有技术中的不足,本发明提供了一种与肝癌发生发展相关的,且具备癌胚属性的分子标志物hnrnpm和一种肝癌的诊断产品,通过检测分子标志物的表达水平来判断患者是否患有肝癌的风险,并且提供一种治疗肝癌的药物组合物,通过特异性的下调分子标志物来治疗肝癌。
5.为达到上述目的,本发明的解决方案是:
6.检测癌胚蛋白hnrnpm表达的试剂在制备诊断和/或预后判断肝癌的产品中的应用。
7.在本发明的优选实施例中,试剂选自特异性扩增癌胚蛋白hnrnpm的引物,引物的上游链序列为:5'
‑
ctaacgcgagtgtatctcgag
‑
3'(seq id no.1),下游链序列为: 5'
‑
cgctcccggctgcctccttgg
‑
3'(seq id no.2)。
8.一种用于诊断和/或预后判断肝癌的产品,该产品包括通过测序技术、核酸杂交技术、核酸扩增技术检测癌胚蛋白hnrnpm的表达水平的试剂,该产品包括但不限于试剂、试剂盒、芯片、试纸、高通量测序平台。该产品为能够对肝细胞癌的发生、发展产生治疗、缓解、抑制、调节的有益作用的产品。
9.另外,本发明还发现高表达hnrnpm的患者更容易合并微血管癌栓和多发肿瘤,因此,优选地,该产品还能够用于降低肝细胞癌的合并疾病的发生率;肝细胞癌的合并疾病包括微血管癌栓和多发肿瘤。
10.在本发明的优选实施例中,试剂包括用于检测表达癌胚蛋白hnrnpm高低中所使用的试剂。
11.在本发明的优选实施例中,试剂选自特异性扩增癌胚蛋白hnrnpm的引物,引物的上游链序列为:5'
‑
ctaacgcgagtgtatctcgag
‑
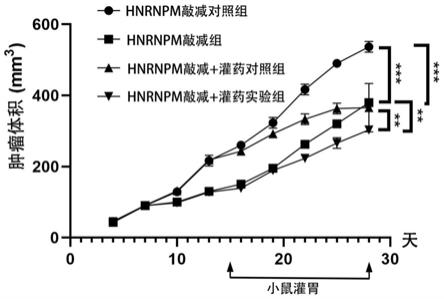
3'(seq id no.1),下游链序列为: 5'
‑
cgctcccggctgcctccttgg
‑
3'(seq id no.2)。
12.一种制备预防或治疗肝癌的药物组合物,该药物组合物包括活性成分、与活性成分配伍的其他药类以及药学上可接受的载体和/或辅料。
13.在本发明的优选实施例中,药物组合物通过下调分子标志物hnrnpm的表达来治疗肝癌,即该药物组合物具有下调hnrnpm基因的表达、转录、或其表达产物的功能。
14.在本发明的优选实施例中,活性成分包括hnrnpm抑制剂。
15.在本发明的优选实施例中,活性成分还包括以hnrnpm或其转录本为靶序列且能够抑制 hnrnpm表达或转录的干扰分子;干扰分子选自短发夹rna(shrna)、小干扰rna、双链核糖核酸(dsrna)、微小rna和反义核酸中的一种以上。
16.本发明鉴定了hnrnpm是一种促进hcc的发生发展的蛋白。在hcc组织中hnrnpm高表达与预后不良相关。在体内外抑制hnrnpm的表达均能抑制肝癌的生长和转移。还发现 hnrnpm在胚胎肝组织中高表达,在成人肝表达沉默,同时在肝癌组织重新高表达。总之,结果表明hnrnpm在hcc中是一种癌胚蛋白,同时也是促瘤因子,是hcc潜在的预后指标和治疗靶点。
17.本发明的抑制剂可以通过本领域任何已知的方式配制药物组合物来使用。这种药物组合物包含活性成分,加上一种或多种药物可接受的载体、稀释剂、填充剂、结合剂及其它赋形剂,这依赖于给药方式及所设计的剂量形式。本领域枝术人员已知的治疗惰性的无机或有机的载体包括但不限于乳糖、玉米淀粉或其衍生物、滑石、植物油、蜡、脂肪、多羟基化合物例如聚乙二醇、水、蔗糖、乙醇、甘油,诸如此类,各种防腐剂、润滑剂、分散剂、矫味剂、保湿剐、抗氧化剂、甜味剂、着色剂、稳定剂、盐、缓冲液诸如此类也可加入其中,这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味,在这种药物组合物中可以使用的制剂可是其原始化合物本身的形式,或任选地使用其药物学可接受的盐的形式,本发明的抑制剂可以单独给药,或以各种组合给药,以及与其它治疗药剂一起结合形式给药。如此配制的组合物根据需要可选择本领域技术人员已知的任何适当的方式把抑制剂或激活剂进行给药。使用药物组合物时,是将安全有效量的本发明的抑制剂施用于人,其中口服安全有效量通常至少约100微克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
18.本发明的药物组合物可根据需要制备成各种剂型,包括但不限于,经皮、粘膜、鼻、口颊、舌下或经口使用的片剂、溶液剂、颗粒剂、贴剂、膏剂、胶囊剂、气雾剂或栓剂。
19.本发明的药物组合物的施用途径不受限制,只要它能发挥期望的治疗效果或预防效果即可,包括但不限于静脉内、腹膜内、动脉内、口服、肌肉内、皮下。在某些情况下,可以系统地给药。在某些情况下是局部地给药。
20.本发明的药物组合物的剂量不受限制,只要获得期望的治疗效果或者预防效果即可,可以依据症状、性别、年龄等来恰当地确定。本发明的治疗药物或预防药物的剂量可以使用如对疾病的治疗效果或者预防效果作为指标来确定。
21.一种癌胚蛋白hnrnpm在筛选预防或治疗肝癌的潜在物质中的应用。
22.由于采用上述方案,本发明的有益效果是:
23.本发明在确诊肝癌患者之前进行检测hnrnpm表达分子,从而提前进行预测患癌风险,该分子高表达提示肝癌风险高;同时在肝癌患者术前检测hnrnpm分子表达也可预测肝癌患者术后的生存,术前检测hnrnpm分子表达越高,其术后肝癌患者预后越差;针对hnrnpm 的干扰分子和蛋白抑制剂组合可显著抑制肝癌的发生和发展,从而起到良好的抗癌效果。
附图说明
24.图1为本发明的实施例1中hnrnpm在胚胎、肝癌中的表达情况示意图(图1a和图1b 为hnrnpm在小鼠肝胚胎发育的表达情况,图1c和图1d为hnrnpm在胚胎肝、成人肝中的表达情况,图1e
‑
1g为hnrnpm在肝癌和癌旁中的表达情况,图1h和图1i为hnrnpm的表达在预后中的情况)。
25.图2为本发明的实施例2中hnrnpm在对照组和hnrnpm敲减组的表达示意图。
26.图3为本发明的实施例3中敲减hnrnpm抑制小鼠肝癌原位肿瘤的示意图。
27.图4为本发明的实施例4中hnrnpm抑制剂与下调hnrnpm表达的慢病毒协同示意图。
具体实施方式
28.本发明提供了一种检测hnrnpm表达的试剂在制备诊断和/或预后判断肝癌中的应用及药物组合物。
29.本发明通过研究发现:与hnrnpm表达相关的细胞功能改变包括细胞的生长和运动,本发明还运用hnrnpm特异性短发夹结构rna分别在肝癌细胞中瞬时敲除hnrnpm并进行了体外细胞迁移和侵袭实验,结果显示敲低hnrnpm可以抑制肝癌细胞的迁移和侵袭;因此,优选地,利用对hnrnpm基因或其表达产物具有抑制作用的功能产品,可以抑制肝癌细胞的增殖、迁移和侵袭。
30.本发明另外通过构建异种移植和原位种植小鼠模型,观察发现,降低hnrnpm的表达可以显著抑制皮下肿瘤和肝脏原位肿瘤的大小和重量。因此,优选地,该功能产品用于抑制肝细胞癌的生长和转移。
31.临床样本:240例肝癌以及癌旁组织的组织芯片,该样本来自复旦大学附属中山医院行根治性肝癌切除手术的病人,经病人签署知情同意书后,术后组织标本立即用3.7%甲醛缓冲液固定,480例石蜡包埋。然后,制备5μm连续切片用于hnrnpm的免疫组化实验。经复旦大学中山医院终止妊娠患者知情同意,取胎儿肝组织。复旦大学生物医学伦理委员会授
予伦理同意。
32.细胞系:人肝癌细胞系hcclm3、mhcc97h(mhcc97系列细胞,具有相同遗传背景,不同肺转移潜能)均由复旦大学附属中山医院建立、保存。人肝癌细胞系plc/prf/5和hepg2 购自中科院上海细胞所由该中山医院保存。wrl68(人永生化,非转化肝细胞系)由上海比奥生物科技有限公司获得。
33.统计方法:至少三个独立实验的结果显示为平均值
±
标准偏差。使用graphpad prism软件 (8.0版)进行统计分析。当仅分析两组时,使用两次student t检验评估组之间的差异;当比较两组以上时,通过单因素方差分析。进行了gehan
‑
breslow
‑
wilcoxon检验,以分析hnrnpm 蛋白表达与总生存时间之间的相关性。
34.以下结合实施例对本发明作进一步的说明。
35.实施例1:
36.一、材料方法
37.1.hnrnpm在hcc中的表达及其与临床病理特征之间的关系。
38.收集约240例临床标本,应用免疫组化方法检测hnrnpm表达情况,根据标本对应的临床资料及预后情况,分析hnrnpm表达与临床病理特征及病人预后的关系。
39.1.1、免疫组织化学(ihc)染色
40.肝癌组织样品采集自复旦大学附属中山医院。将组织在10%中性福尔马林中固定过夜,进行脱水,然后包埋在低熔点石蜡中。连续切下4μm厚的组织切片,并固定在硅化的玻片上。免疫组织化学染色使用抗生蛋白链菌素
‑
过氧化物酶偶联方法。将每个组织切片去石蜡,再水化,浸入抗原修复溶液中,在100℃下煮沸10min,然后与过氧化物酶抑制剂一起孵育。用正常山羊血清阻断非特异性结合后,将组织切片与以下一抗在4℃孵育过夜:抗hnrnpm(no. sc
‑
33652,santa cruz);所有抗体以1:50的稀释度使用。
41.1.2、实时定量pcr
42.使用试剂盒(takara,usa)提取了本发明中使用的细胞系总rna,使用all
‑
in
‑
onetmqpcrmix(genecopoeiatm,rockville,maryland,usa)进行实时pcr分析基因表达。通过 bioradcfx96进行检测,并使用bio
‑
rad管理软件(bio
‑
rad,hercules,ca)进行分析。将基因表达水平用管家基因gapdh的表达水平进行标准化,并且每个样品评估了三次。hnrnpm 和gapdh的引物购自生工生物工程(上海)股份有限公司。
43.2、实验结果
44.2.1.首先在前期的小鼠肝脏胚胎发育组织测序中还发现小鼠胚胎肝脏中的hnrnpm的表达高于小鼠成年期的肝脏组织,即图1a和图1b显示hnrnpm在小鼠胚胎肝脏发育模型中,随着肝脏发育成熟,hnrnpm表达逐渐下降。同时在公共geo数据库 (https://www.ncbi.nlm.nih.gov/geo/)继续分析hnrnpm的表达情况,发现在另外一个队列 (gse57824)中,hnrnpm在胚胎肝脏组织表达同样显著高于成年期小鼠肝脏组织。为了检测人的胚胎肝组织和人正常肝组织hnrnpm表达情况,q
‑
pcr和western blot实验发现人胚胎肝组织的hnrnpm无论在基因表达水平还是蛋白表达水平均显著高于成人肝组织(图1c 和图1d)。为了进一步探索hnrnpm在hcc组织的表达情况,我们用240例hcc和癌旁组织芯片做免疫组化实验,用60例hcc和癌旁组织做q
‑
pcr实验,如图1e至图1g所示,hnrnpm 在hcc组织的表达无论是基因水平还是蛋白表达水平都显著高于癌旁组织。此外,图1h和图1i所示,在
tcga和肝癌芯片数据中做了预后分析之后,发现高表达的hnrnpm跟肝癌的预后显著相关(p<0.05),即高表达的hnrnpm跟肝癌患者的不良预后显著相关;*p<0.05, **p<0.01,***p<0.001;配对t检验。
45.表1 240例hcc患者总生存率分析
46.47.[0048][0049]
表2 240例hnrnpm表达量与患者临床病理特点之间的相关性分析
[0050]
[0051][0052]
hnrnpm与临床基本病理特征之间的关系,如表2所示,hnrnpm的表达与年龄(p=0.03)、微血管浸润(p=0.025)、肿瘤大小(p<0.001)、肿瘤个数(p<0.001)、术前afp值(p=0.007) 以及肿瘤分级(p<0.001)显著相关。如表1所示,多因素回归分析发现高表达的hnrnpm是缩短hcc患者总体生存期独立预测危险因素。
[0053]
实施例2:
[0054]
肝癌细胞系中敲减hnrnpm分子能抑制肝癌的增殖迁移和侵袭
[0055]
1.实验过程
[0056]
1.1.构建慢病毒和细胞感染
[0057]
用购买自上海吉凯基因科技有限公司的慢病毒载体 (u6
‑
sh
‑
hnrnpm
‑
egfp
‑
ires
‑
puromycin)来感染细胞以建立hnrnpm敲低细胞系。通过 0.8μg/ml的聚乙烯用重组慢病毒转导单位感染hcc细胞,两周后使用2ug/ml嘌呤霉素选择稳定细胞,再通过qrt
‑
pcr和蛋白质印迹评估rna干扰的效率。
[0058]
1.2.细胞迁移和侵袭测定
[0059]
用transwell小室(becton dickinson,franklin lakes,nj)进行细胞迁移实验。将含有3
×
10
4 hcc细胞的200μl无血清dme细胞悬液接种在transwell的上室中,并将400μl含有20%fbs 的培养基添加到下室中。迁移穿过膜的细胞被固定并染色后,光学显微镜下随机计数三个视野。
[0060]
用浸有基质胶(becton dickinson,franklin lakes,nj)的bd biocoat基质胶侵袭小室(bdbiosciences)进行细胞侵袭实验,将含有3
×
104hcc细胞的200μl无血清dme细胞悬液接种在transwell的上室中,并将300μl含有20%的fbs的培养基添加到下室中。孵育后,迁移穿过膜的细胞被固定并染色,在光学显微镜下随机计数三个视野。
[0061]
1.3.细胞活力和集落形成测定
[0062]
使用细胞计数试剂盒
‑
8(cck
‑
8;keygen biotech,中国江苏)测定细胞活力。将hcc细胞以3
×
103个细胞每孔的密度接种在96孔板中,每孔使用100μl细胞悬液。培养72h后,使用酶标仪在490nm处测量吸光度。每个实验进行六次重复,总共进行三个独立实验。然后计算细胞活力的平均百分比。为了进行集落形成实验,将hcc细胞以每孔500个细胞的密度接种在6孔板中,并培养在完全生长培养基中直至形成肉眼可见的菌落(约两周)。使用组织固定液固定细胞集落,用1%的结晶紫染色并计数。所有实验均独立进行了三次。
[0063]
1.4.细胞划痕实验
[0064]
铺板:肝癌细胞消化后进行细胞计数,将1
×
106个细胞铺入六孔板中,吹打均匀。划痕:用100μl枪头在六孔板底部轻划“井”字,pbs漂洗3遍冲净死细胞,加2ml无血清dmem 培养基,放入5%的co2,37℃恒温培养箱培养。拍照:于划痕0h、24h、48h时用倒置显微镜观察并拍摄划痕两端细胞的位移情况。
[0065]
1.5.细胞凋亡
[0066]
以每孔2
×
105个细胞接种于6孔培养板中。用0.25%胰酶(无edta)消化细胞,至细胞可以被枪头轻轻吹打下来时,加入细胞培养液终止消化,轻轻吹打下所有的贴壁细胞,收集到流式管内。1500rpm,5min离心收集1
×
106个细胞,弃上清。设置a阴性对照管和b样品管。加入annexinv染料,室温,避光孵育10min。
[0067]
a.阴性对照管:1x buffer液120μl;b.样品管:120μl的1x buffer液和5μl的annexinv染料。样品管加入5μl碘化丙啶(pi)染料,上机检测。
[0068]
1.6.细胞周期
[0069]
以每孔2
×
105个细胞接种于6孔培养板中。用0.25%胰酶(无edta)消化细胞,至细胞可以被枪头轻轻吹打下来时,加入细胞培养液终止消化,轻轻吹打下所有的贴壁细胞,收集到流式管内。1500rpm,5min离心收集1
×
106个细胞,去上清。加入1ml的pbs混匀后,
1500rpm, 5min离心,去上清。加入300μl的pbs重悬细胞后,逐滴缓慢加入700μl预冷无水乙醇
‑
4℃冰箱固定过夜。次日将酒精固定后的细胞混匀吹散后,每管加入3ml的pbs重悬,1800rpm, 5min离心,去上清。加1ml的pbs重悬,1500rpm,5min离心,去上清。细胞沉淀混匀后,每管加入10μl的rna酶(10ug/ml)以及100μl的pbs,37℃水浴锅内孵育半小时。每管加入20μl(250μg/ml)pi重悬后,用350目尼龙膜过滤细胞悬液,待检测。
[0070]
2.实验结果
[0071]
利用shrna来高效稳定地沉默hnrnpm分子的表达,并进行体内外功能实验。如图2a 显示出在mrna和蛋白水平hnrnpm的敲减效率,即用hnrnpm
‑
shrna沉默该分子在 mhcc97h细胞系中的表达后,通过qpcr(左)和蛋白质印记(右)检测hnrnpm表达水平; ***p<0.001,student’s检验。图2b显示,hnrnpm靶向shrna(hnrnpm
‑
shrna)或对照shrna (control
‑
shrna)转染肝癌细胞,并进行细胞存活实验,流式检测细胞凋亡(图2c和图2d) 和周期实验(图2e和图2f),细胞迁移实验(图2g和图2h)和细胞侵袭实验(图2i和图 2j),体外cck8实验证明敲减hnrnpm后的mhcc97h肝癌细胞增殖显著受到抑制 (p<0.0001)。流式细胞仪检测发现,敲减hnrnpm后,mhcc97h细胞凋亡显著增加(图2c 和图2d),同样,在细胞周期方面,敲减hnrnpm也能够显著抑制复制期的细胞比例(图2e 和图2f)。如图2g和图2h所示,划痕实验证明hnrnpm的表达下降能够抑制mhcc97h肝癌细胞的迁移,细胞侵袭实验提示,hnrnpm的表达下降同样能够显著抑制肝癌细胞的侵袭 (图2i和图2j,p<0.001)。
[0072]
实施例3:
[0073]
敲减hnrnpm能抑制小鼠肝癌原位肿瘤的增殖和转移
[0074]
1.实验过程
[0075]
1.1.动物实验
[0076]
所有动物实验均按照《实验动物的护理和使用指南》(nih出版物第80
‑
23号,1996年修订)和复旦大学制定的《动物实验机构伦理准则》进行。在复旦大学附属中山医院实验动物房内,动物饲养在无病原体的条件下。如图3a所示,将2只4周龄的balb/c雌性裸鼠皮下注射0.1ml含有1
×
106个细胞的细胞悬液。4周后皮下瘤长成后,剪碎该肿瘤组织,并在2组各6只裸鼠肝脏内种植剪碎的肝癌组织,继续养4周,用卡尺测量每个肿瘤的长度(l)、宽度(w)和高度(h),并且按照如下公式计算肿瘤体积(v):v=πlwh/6。实验结束时,人道处死小鼠,切除肿瘤并拍照,测量不同组小鼠的肿瘤重量。对肝表面的肿瘤结节进行计数,并切除后包埋在石蜡中。
[0077]
2.实验结果
[0078]
如图3b和图3c所示,通过稳定高效敲减hnrnpm的mhcc97h细胞株和对照组种植到两只裸鼠的皮下。经过28天后,处死小鼠并取出皮下瘤。将两个不同组的皮下瘤各自切除成多个黄豆粒大小的肿瘤块,然后在另外12只裸鼠的肝脏原位种植一粒黄豆大小的肿瘤块。继续观察28天后,处死12只裸鼠,如图3d和图3f所示,种植敲减hnrnpm组的肝脏肿瘤大小和重量显著低于对照组,而且对照组在肝脏的肿瘤转移数量也明显多于敲减组,裸鼠皮下注射hcc细胞,慢病毒介导下调hnrnpm表达组荷瘤体积小于对照组,**p<0.01,***p<0.001, student’s检验。
[0079]
实施例4:
[0080]
hnrnpm抑制剂在小鼠体内对hcc生长的影响
[0081]
将带有sh
‑
hnrnpm和sh
‑
control慢病毒感染mhcc97h细胞,对4周龄,balb/c雌性裸鼠进行皮下原位注射。2周后,再将所有裸鼠分为两组,按40mg/kg/d im1(来自美国 medchemexpress生物科技公司)灌胃给药,连续给药2周。分别于皮下注射2周和4周后观察并检测裸鼠体内肿瘤大小,来评估hnrnpm及其抑制剂im1在小鼠体内对hcc生长影响。
[0082]
在上述基础上,口服hnrnpm抑制剂im1(sh
‑
hnrnpm im1)(小鼠灌胃),能显著抑制皮下成瘤大小,其中与基因敲减hnrnpm联合应用组,荷瘤体积进一步得到抑制,如图4所示,即口服hnrnpm抑制剂im1能显著抑制裸鼠皮下成瘤体积,且与下调hnrnpm表达的慢病毒协同应用,能进一步抑制肿瘤生长。
[0083]
综上可知:
[0084]
1.hnrnpm作为一个新型癌胚蛋白,可能成为hcc早期诊断的新型分子标记物。
[0085]
2.hnrnpm的蛋白表达水平水平能判断hcc病人的预后,即hnrnpm表达与患者预后呈负相关。
[0086]
3.采用基因手段下调hnrnpm表达,能抑制裸鼠体内肝癌细胞的增殖。
[0087]
4.hnrnpm抑制剂im1能达到与基因技术一样的肝癌抑制作用,且二者联合应用具有协同抗癌效果。
[0088]
上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1