用于鉴定扬麦16及其衍生品种灌浆速率的KASP引物组及应用的制作方法
用于鉴定扬麦16及其衍生品种灌浆速率的kasp引物组及应用
技术领域
1.本申请涉及小麦育种领域,特别是一组用于鉴定扬麦16及其衍生品种灌浆速率的kasp引物组及其应用。
背景技术:
2.长江中下游麦区是我国最大的稻麦轮作区,稻麦总产量占全国的1/3以上。上世纪90年代开始,该麦区水稻机插秧和直播面积不断扩大,造成水稻收获期不断推迟,导致小麦播期逐步推迟。小麦迟播一方面导致冬前生长严重不足,不利于形成壮苗和大穗,另一方面导致灌浆期缩短,粒重降低,同时增加灌浆期遭遇高温的风险,最终产量下降,一般减产750~900kg
·
hm
‑2,严重迟播田块减产超过30%。因此,培育和种植籽粒灌浆速率高的小麦品种,是解决当前生产上粒重下降、产量降低等问题的主要手段之一。
3.灌浆速率是指每天每千粒小麦干物质的增长量,一般以“克”表示;若以每天每粒小麦干物质的增长量就以“毫克”表示。灌浆速率目前主要采用大田检测;每个品种种一个小区,每个小区在开花期选择开花时期、穗型大小一致且无病虫害的单穗50个,挂牌标记,花后10天开始取样,以后每隔5天在固定时间取样1次,直至收获。每次每个小区取10个单穗,剥取籽粒,在105℃下烘30分钟杀青,80℃烘16小时~18小时至恒重,称重计数,折算成千粒重。灌浆速率用每天每粒小麦增长重量表示,单位为毫克
·
(粒
·
天)
‑1(参见文献:“王文文,兰进好,田纪春.小麦籽粒灌浆速率及粒重qtl初步研究[j].中国农学通报,2012,28(36):63
‑
70.”;“苗永杰,阎俊,赵德辉,等.黄淮麦区小麦主栽品种粒重与籽粒灌浆特性的关系[j].作物学报,2018,44(2):260
‑
267.”;“朱冬梅,王慧,刘大同,等.小麦籽粒灌浆与脱水特性研究[j].中国农业科学,2019,52(23):4251
‑
4261.”)。而现有方法存在如下弊病:(1)受环境影响较大,自然条件下遇到高温或者阴雨天气时取样时间无法固定,易造成工作量较大,来不及取样。(2)一开始虽然选择了开花时期、穗型大小一致且无病虫害的单穗50个,挂牌标记,但是小麦的病害在整个生育期均会发生,灌浆期间会有赤霉病等穗部病害,一旦感染,严重影响籽粒重量,造成无法准确测定和计算灌浆速率。因此,通过人工测定上述表型(每天每粒小麦增长重量)计算灌浆速率的可靠性、稳定性、时效性和准确性低。
[0004]
扬麦16是江苏省主推的优质高产抗病中筋小麦主栽品种,是以当地品种扬麦158优系(91f138)为母本,扬90
‑
30为父本,采用大群体目标性状优先选择的方法而成。扬麦16具有耐迟播、早熟、灌浆速度快等特点,以该品种为亲本已经育成了一批适于长江中下游麦区种植的小麦新品种,是我国小麦育种的重要亲本,扬麦16的衍生品种主要包括扬麦16、扬麦23、扬麦26、扬麦28、农麦126、农麦156和江丰麦1号等。其中2006年以来通过国家或江苏省审定的品种已达至少12个。扬麦16作为新一代骨干亲本,对选育耐迟播、早熟、灌浆速度快小麦新品种具有重要的价值。然而在育种中,亲本之一的性状在后代不断的人工和环境的选择中不一能稳定遗传,故必须经过检测后代是否携带亲本优良性状的基因型才能判断扬麦16及其衍生品种与其他亲本杂交后代的灌浆速率高低。通过选择特异性引物并将其应用于扬麦16及其衍生品种为亲本之一的灌浆速率分子标记选择育种中,可以有效提高小麦
杂交育种早世代灌浆快慢选择的有效性。目前,针对扬麦16及衍生品种灌浆速率检测的引物尚未见报道。
技术实现要素:
[0005]
针对上述问题,为了快速鉴定扬麦16及其衍生品种灌浆速率特性,并能使扬麦16携有的控制灌浆速率的基因/位点在以扬麦16为亲本的小麦育种中得到可靠应用,本申请根据灌浆快慢品种之间存在的序列差异,设计了一个一般在实验室可操作、易于分辨的kasp引物组,并将其应用于小麦灌浆速率的分子标记辅助育种中。通过选择特异性分子标记并将其应用于以扬麦16及衍生品种的灌浆速率分子标记辅助育种中,可以有效提高小麦杂交育种早世代灌浆速率选择的效率。
[0006]
本发明的目的是这样实现的:
[0007]
首先,本申请提供了一对用于鉴定扬麦16及其衍生品种的灌浆速率的kasp引物组,该kasp引物组包括:核苷酸序列如seq id no.1所示的引物1,核苷酸序列如seq id no.2所示的引物2,核苷酸序列如seq id no.3所示的引物3。
[0008]
其次,本申请还提供了核苷酸序列如seq id no.1—seq id no.3所示的kasp引物组在鉴定扬麦16及其衍生品种灌浆速率中的应用。
[0009]
进一步而言,上述kasp引物组在鉴定扬麦16及其衍生品种灌浆速率中的应用是指,以待测小麦基因组dna为模板,核苷酸序列如seq id no.1—seq id no.3所示的kasp引物组为引物进行pcr扩增,然后利用多功能酶标仪检测pcr扩增产物并进行基因分型,以检测待测小麦基因组对应snp位点的基因型,若基因分型结果显示待测小麦基因分型与扬麦16相同,则证明该待测小麦基因分型为a,反之,则证明待测小麦基因分型为g,含有等位基因a的小麦灌浆速率高于含有等位基因g的小麦。
[0010]
本申请首次发现小麦6a染色体上的ax109456529分子标记中的snp位点(a/g)与灌浆速率的相关性,并将其转化为成简易、高通量的kasp(kompetitive allele specific pcr,http://www.lgcgroup.com/kasp)标记(polymarker,http://polymarker.tgac.ac.uk/)y16
‑
gf
‑
kasp引物组,利于区分优势等位基因(a)和非优势等位基因(g)。
[0011]
进一步而言,上述pcr扩增是指,pcr反应体系:浓度为30ng/μl的待测小麦dna模板2μl、引物工作液0.08μl、kaspmaster mix 2.5μl、无菌超纯水补充至5μl;所述引物工作液包括:30μl核苷酸序列如seq id no.1所示的引物1(100μm)、12μl核苷酸序列如seq id no.2所示的引物2(100μm)、12μl核苷酸序列如seq id no.3所示的引物3(100μm)、以无菌超纯水补充至100μl;pcr反应程序;第一步,95℃预变性15min;第二步,95℃变性20s、65
–
57℃(每个循环下降1℃)60s,共9个循环;第三步,95℃变性20s、57℃复性1min,32个循环。
[0012]
第三,本申请还提供了上述kasp引物组所特异性扩增的分子标记ax109456529,该分子标记的核苷酸序列如seq id no.4所示,且该核苷酸序列自5’端起第36位碱基为snp位点,存在a/g等位基因。
[0013]
第四,本申请还提供了一种用于检测扬麦16及其衍生品种灌浆速率的pcr检测试剂盒;具体而言,该pcr检测试剂盒包括核苷酸序列如seq id no.1所示的引物1,核苷酸序列如seq id no.2所示的引物2,以及核苷酸序列如seq id no.3所示的共用引物3。
[0014]
进一步而言,本申请提供的用于检测扬麦16及其衍生品种灌浆速率的pcr检测试剂盒包括:浓度为30ng/μl的待测小麦dna模板2μl、引物工作液0.08μl、kasp master mix 2.5μl、无菌超纯水补充至5μl;所述引物工作液包括:30μl核苷酸序列如seq id no.3所示的引物1(100μm)、12μl核苷酸序列如seq id no.2所示的引物2(100μm)、12μl核苷酸序列如seq id no.3所示的引物3(100μm)、菌超纯水补充至100μl。
[0015]
本申请中,灌浆速率高与灌浆速率低的品种是指,相同的生态环境下,相同生态类型区域内,在同一播期下,开花期一致的小麦品种,灌浆速率高的品种,籽粒干物质积累达到最高的时间会较灌浆速率低的品种早,即成熟期早。(参见文献“朱冬梅,王慧,刘大同,等.小麦籽粒灌浆与脱水特性研究[j].中国农业科学,2019,52(23):4251
‑
4261”)。
[0016]
本申请中,术语“扬麦16及其衍生品种”是指以扬麦16号为亲本之一繁育的品种,如扬麦16、扬麦23、扬麦26、扬麦28、农麦126、农麦156和江丰麦1号等,其部分品系遗传谱系如下表1所示:
[0017]
表1扬麦16及其衍生品种系谱
[0018][0019]
本发明的有益在于:针对扬麦16及其衍生品种设计用于检测灌浆速率高低的kasp引物组,通过该引物组对小麦基因组dna进行pcr扩增,若kasp分型结果显示分子标记ax109456529的基因型与扬麦16相同,则证明该待测小麦基因分型为a,反之,则证明待测小麦基因分型为g,含有等位基因a的小麦灌浆速率高于含有等位基因g的小麦。该pcr检测方法快速而直观获得小麦品种灌浆快慢结果,适用于大规模育种筛查,可以有效提高小麦杂交育种早世代灌浆速率选择的有效性,结果非常直观,不需要通过测序或者比较条带的大小。
附图说明
[0020]
图1为分子标记ax109456529的侧翼核苷酸序列snp位点示意图。
[0021]
图2为实施例1中ax109456529对应的kasp标记验证部分四交ril家系的灌浆高低基因型扩增检测结果。
[0022]
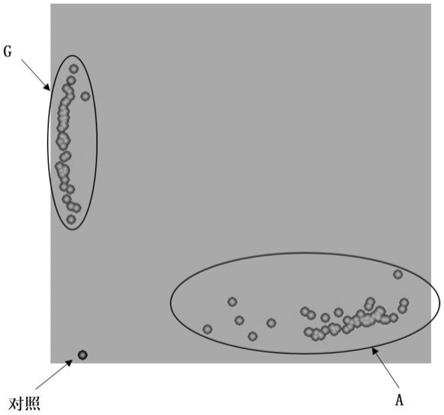
图3为实施例2中扬麦16及其衍生品种ax109456529对应的kasp标记扩增检测结果;
[0023]
采用多功能酶标仪对pcr扩增产物进行扫描,fam激发波长为485nm,发射波长为
520nm;vic激发波长为535nm,发射波长为556nm,系统参比荧光rox激发波长为575nm,发射波长为610nm。采用kluster caller软件对扫描数据进行分析,根据分析结果按照如下确定灌浆速率位点连锁的snp标记ax109456529的基因型:部分待测小麦扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置,即证明其基因型为a,其中包括扬麦16及其衍生品种(扬麦16、扬麦23、扬麦26、扬麦28、农麦126、农麦156、江丰麦1号);部分待测小麦扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置,证明其基因型为g,是其他非扬麦16的衍生品种(宁麦9号、宁麦13、宁麦15、宁麦19、宁麦24、扬麦15、扬辐麦9号、扬辐麦3048),左下角显示为黑色的样本为空白对照。
具体实施方式
[0024]
实施例中涉及的小麦品种由江苏里下河地区农业科学研究所小麦研究室提供、小麦灌浆速率测定方法参见朱冬梅等文章《小麦籽粒灌浆与脱水特性研究》(中国农业科学,2019,52(23):4251
‑
4261)中所公开的内容。
[0025]
dna提取试剂盒购自天根生化科技有限公司,型号dp305。
[0026]
以下实施例中,小麦灌浆速率测定方法参见朱冬梅等文章《小麦籽粒灌浆与脱水特性研究》(中国农业科学,2019,52(23):4251
‑
4261)。
[0027]
实施例1筛选与扬麦16相关的控制灌浆速率qtl位点并设计特异性引物
[0028]
本实施例利用将灌浆特性差异明显的4个小麦亲本镇麦168(zhenmai 168,zm168)和扬麦20(yangmai 20,ym20)、扬麦16(yangmai 16,ym16)和扬麦22(yangmai 22,ym22)两两成对杂交(zm168
×
ym20、ym16
×
ym22),产生2对双亲本杂交种,将2对双亲本杂交种f1再成对杂交产生四亲本杂交种(zm168/ym20//ym16/ym22),四亲本杂交种通过单粒传法加代,自交6代,建成158个家系构成的四交ril群体用于qtl定位。
[0029]
将四交ril群体在2018年10月25日种植于江苏里下河地区农业科学研究所湾头试验基地,并参照文献《小麦籽粒灌浆与脱水特性研究》(朱冬梅等,中国农业科学,2019,52(23):4251
‑
4261)对四交ril群体进行了灌浆速率测定。利用植物基因组dna提取试剂盒(天根dp305)提取dna,采用中国农业科学院作物科学研究所与中玉金公司合作开发的小麦15k snp芯片对试验材料进行基因组扫描,采用gapl软件(http://www.isbreeding.net)进行四交ril群体的连锁作图和qtl定位分析,最终发现扬麦16灌浆速率位点位于3a、6a和4d,其中6a上的位点位于ax109934896—ax110152115标记之间,物理位置是615038.714kp(“扬麦16籽粒灌浆速率相关性状的qtl定位(小麦15k snp)芯片法”,胡文静等,《麦类作物学报》40(8):915
‑
920)。
[0030]
申请人进一步利用这两个标记的侧翼序列进行kasp标记开发,然而设计获得的引物是染色体非特异性(chromosome_nonspecific),检测结果显示跟原始15k snp芯片检测结果差异很大;引物在四交ril群体和自然群体中验证的效果较差,无法真正实现利用基因型能检测小麦品种的灌浆高低,推测一是因为这两个标记的侧翼序列本身特异性较差,二是15k snp的标记密度较低,原始标记本身只有1.5万个,覆盖的基因组不全面,只能在一定范围内定位qtl位点,而且目标位点的物理位置和遗传位置都不够准确,区间较大,故认为该两个标记所在序列无法实现kasp引物开发利用。
[0031]
故申请人对亲本进行重测序、660k芯片(66万个snp差异标记)检测等大量序列分析、比对、筛选差异标记以及预实验,发现6a上与初定位结果相距560.541kb的614478.173kp位置处的snp标记ax109456529分子标记的侧翼序列具有较好的特异性,snp对应变异的类型是a/g,因此将其转化为成简易、高通量的kasp(kompetitive allele specific pcr,http://www.lgcgroup.com/kasp)标记(polymarker,http://polymarker.tgac.ac.uk/)y16
‑
gf
‑
kasp引物组。
[0032]
kasp标记y16
‑
gf
‑
kasp引物组的获得:snp标记ax109456529的侧翼核苷酸序列如seq id no.4及附图1所示,seq id no.4中,第36位碱基即为snp位点,为a或g;其snp位点如附图1所示,“[a/g]”表示该snp标记的两种多态性单核苷酸a或g,即在实际小麦材料中该位置碱基为a或g。
[0033]
本实施例针对该snp位点设计y16
‑
gf
‑
kasp引物组,包括核苷酸序列如seq id no.1所示的引物1,核苷酸序列如seq id no.2所示的引物2,以及核苷酸序列如seq id no.3所示的引物3。其中引物1作为共用引物,为上游引物,引物2和引物3为下游引物。上游引物(引物1)保证了pcr扩增的6a染色体特异性,下游引物(引物2和引物3)的3’末端为标记ax109456529的等位变异碱基a/g的互补碱基t/c,为便于检测,下游引物5’端设计时连接有荧光标签(如fam/vic/hex等)的序列。
[0034]
应用kasp标记y16
‑
gf
‑
kasp进行pcr检测;
[0035]
1、kasp标记引物工作液的制备:
[0036]
分别取上游引物(核苷酸序列如seq id no.1所示的引物1)30μl(100μm),取下游引物(核苷酸序列如seq id no.2所示的引物2和seq id no.3所示的引物3)各12μl(100μm),用无菌超纯水补充至100μl;充分混匀,作为kasp标记的引物工作液,备用;
[0037]
pcr扩增反应体系:待测小麦dna模板2μl(约30ng/μl)、引物工作液0.08μl、kaspmaster mix 2.5μl(lgc公司,kbs
‑
1016
‑
002),用无菌超纯水补充至5μl。
[0038]
pcr反应程序:第一步,95℃预变性15min;第二步,95℃变性20s、65
–
57℃(每个循环下降1℃)60s,共9个循环;第三步,95℃变性20s、57℃复性1min,32个循环;10℃保存。实验同时设置反应体系中不添加模板dna的空白对照(ntc),每个板设置1个或多个空白对照。
[0039]
以待测小麦基因组dna为模板(采用ctab法从小麦幼苗中提取待测小麦基因组dna,具体如文献“stacey j,isaac p g.isolation of dna from plants.methods mol.biol.1994,28:9
–
15.”中公开的方法),采用如上pcr体系进行pcr扩增,获得pcr扩增产物。pcr反应在s1000
tm thermal cycler pcr仪(bio
‑
rad laboratories inc.)上进行,用多功能酶标仪(pherastar plus,bmg labtech,germany)对pcr扩增产物进行扫描读取荧光值。fam激发波长为485nm,发射波长为520nm;vic激发波长为535nm,发射波长为556nm,系统参比荧光rox激发波长为575nm,发射波长为610nm。采用kluster caller软件(kbioscience)进行基因分型,根据分析结果确定灌浆速率位点连锁的snp标记ax109456529的基因型。
[0040]
在158个家系构成的四交ril群体中随机选取72个家系连同四个亲本进行扩增检测,检测结果和对应的表型如表2、表3和图2所示。
[0041]
表2 72个家系和亲本的灌浆速率平均值和kasp分型结果
[0042][0043]
表3携带ax109456529不同基因型的部分ril家系的灌浆速率平均值t测验结果
[0044][0045]
表3所示利用excel 2019的双样本t测验72个ril家系的基因型和表型,结果表明:镇麦168和扬麦16基因型为a,扬麦22和扬麦20的基因型为g,72个家系中基因型为a的家系比基因型为g的家系灌浆速率平均值高16.06%,在p<0.01水平上有显著差异,说明上述kasp标记y16
‑
gf
‑
kasp的引物组及基因型检测体系可以应用于灌浆速率分子标记辅助育种中(表3统计方法为本领域常规方法,具体也可以参见文献“盖钧镒,《试验统计方法》,中国农业出版社,2000年9月”中公开的内容)。
[0046]
图2中,a为与扬麦16相同的优势等位变异a(蓝色);g为与与扬麦22和扬麦20相同的非优势等位变异g(红色),左下角显示为黑色的样本为空白对照。综上表2和图2的结果,说明kasp标记开发成功,可进一步应用于育种材料检测,利于区分优势等位基因和非优势等位基因。
[0047]
进一步分别对以下小麦品种进行检测,这些品种均属于长江中下游生态区的小麦品种,相同播期下开花期无显著差异:
[0048]
1)扬麦16及其衍生品种:扬麦16、扬麦23、扬麦26、扬麦28、农麦126、农麦156、江丰麦1号;
[0049]
2)非扬麦16衍生品种:宁麦9号、宁麦13、宁麦15、宁麦19、宁麦24、扬麦15、扬麦20、扬辐麦9号、扬辐麦3048。
[0050]
检测结果如图3所示,可见,扬麦16及其衍生品种小麦扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(a),即证明这些小麦在分子标记ax109456529侧翼核苷酸序列(如seq id no.4及附图1所示)的第36位碱基(snp位点)的基因型为a,而非扬麦16衍生品种小麦扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置(g),与扬麦16分型不同,则证明这些小麦在该snp位点的基因型为g;基因型为a的小麦的灌浆速率高于基因型为g的小麦品种。图3中左下角显示为黑色的样本为空白对照。
[0051]
实施例2田间实验
[0052]
本实施例进一步利用传统的小麦生理成熟后灌浆速率测定方法进行验证实施例1获得的kasp引物组:
[0053]
实验方法:2017年10月25日、2018年10月25日和2019年10月25日于江苏里下河地区农业科学研究所湾头试验基地,每个品种种一个小区,于小麦开花期在每个小区选择开花时期、穗型大小一致且无病虫害的单穗50个,挂牌标记,花后10天开始取样,以后每隔5天在固定时间取样1次,直至收获。每次每个小区取10个单穗,剥取籽粒,在105℃下烘30分钟杀青,80℃烘16小时~18小时至恒重,称重计数,折算成千粒重。灌浆速率用每天每粒小麦增长重量表示,单位为毫克
·
(粒
·
天)
‑1,三年试验取平均值。
[0054]
灌浆速率测定值的转化:采用本领域常规方法,即用logistic方程y=k/(1+ae
‑
bx
)对籽粒灌浆进程进行拟合,方程中x为开花后时间,y为该时间点相应的千籽粒干重,a、b为
方程对不同材料所确定的参数,k(毫克
·
粒
‑1)为拟合理论千粒重,e指自然对数函数的底数。对该方程一阶求导,可得籽粒灌浆速率方程,并可得到籽粒灌浆相关性状的三个特征参数:最高灌浆速率(毫克
·
(粒
·
天)
‑1);灌浆持续时间(天);籽粒平均灌浆速率(毫克
·
(粒
·
天)
‑1)(具体也可以参见文献“苗永杰,阎俊,赵德辉,等.黄淮麦区小麦主栽品种粒重与籽粒灌浆特性的关系[j].作物学报,2018,44(2):260
‑
267.”及文献“王瑞霞,张秀英,伍玲,等.不同生态环境下小麦籽粒灌浆速率及千粒重qtl分析[j].作物学报,2008,34(10):1750
‑
1756.”中所公开的灌浆速率测定方法)。
[0055]
表4供试品种的3年平均灌浆速率值和y16
‑
gf
‑
kasp分型结果
[0056][0057][0058]
灌浆速率测定结果如上表4所示。上述灌浆快的品种灌浆速率平均值分别为1.66毫克/(粒
·
天)(扬麦16)、1.54毫克/(粒
·
天)(扬麦23)、1.63毫克/(粒
·
天)(扬麦26)、1.49毫克/(粒
·
天)(扬麦28)、1.48毫克/(粒
·
天)(农麦126)、1.51毫克/(粒
·
天)(农麦156)、1.53毫克/(粒
·
天)(江丰麦1号),他们均为扬麦16及其衍生品种;而上述灌浆速率低的品种的灌浆速率分别为1.39毫克/(粒
·
天)(宁麦9号)、1.44毫克/(粒
·
天)(宁麦13)、1.42毫克/(粒
·
天)(宁麦15)、1.38毫克/(粒
·
天)(宁麦19)、1.33毫克/(粒
·
天)(宁麦24)、1.41毫克/(粒
·
天)(扬麦15)、1.42毫克/(粒
·
天)(扬麦20)、1.35毫克/(粒
·
天)(扬
辐麦9号)、1.36毫克/(粒
·
天)(扬辐麦3048),他们均为非扬麦16衍生品种,为灌浆速率低的品种,这与实施例1中pcr检测结果相同,验证了kasp引物组基因分型的准确性。
[0059]
表5携带ax109456529不同基因型的供试品种的灌浆速率平均值t测验结果
[0060][0061]
表5利用excel 2019的双样本等方差假设t测验结果表明:基因型为a的品种比基因型为g的品种灌浆速率平均值高11.51%,在p<0.01水平上有显著差异,说明上述kasp标记y16
‑
gf
‑
kasp的引物组及基因型检测体系可以应用于以扬麦16及衍生品种为亲本之一的灌浆速率分子标记辅助育种中(表3统计方法为本领域常规方法,具体也可以参见文献“盖钧镒,《试验统计方法》,中国农业出版社,2000年9月”中公开的内容)。
[0062]
由上述实验结果可以得出:通过引物1、引物2、引物3对小麦基因组dna进行pcr扩增,可以直接通过kasp分型判断是否携带扬麦16灌浆速率高的基因,检测方法操作简单,检测结果非常直观,检测效果明显有效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1