用于鉴定柑橘大实蝇的LAMP引物组及其应用
用于鉴定柑橘大实蝇的lamp引物组及其应用
技术领域
1.本发明属于生物技术领域,具体涉及用于鉴定柑橘大实蝇的lamp引物组及其应用。
背景技术:
2.柑橘大实蝇bactrocera minax(enderlein),隶属于双翅目(diptera)实蝇科(tephritidae)寡毛实蝇属bactrocera大实蝇亚属tetradacus,是严重危害柑橘的害虫之一。随着国内柑橘种植面积增加与柑橘类水果贸易日益频繁,柑橘大实蝇发生范围和危害不断扩大。
3.柑橘大实蝇专性寄生柑橘类果树,其幼虫在被害果内取食囊瓣,个别也能取食种子,为害后期果实内呈絮状。幼虫可在囊瓣间辗转纵横蛀食。早期产卵孵化的幼虫数量较多,导致被害果未熟先黄,造成落果、腐烂。该虫不仅严重降低柑橘的产量和品质,而且也大大挫伤农民种植柑橘的积极性,同时消费者在购买到被蛀食果实后,使消费者的恐慌心理,造成严重经济损失。柑橘大实蝇主要通过幼虫在蛀果内随水果贸易传播,成虫也具有一定的飞行能力,具有一定传播能力。因此,如何有效快速、准确地鉴别柑橘大实蝇,对于柑橘类水果贸易领域的害虫监测和植物检疫领域的害虫鉴定等,显得尤为重要。
4.目前柑橘大实蝇的鉴定方法主要采用传统的形态学鉴定和分子鉴定技术。柑橘大实蝇与蜜柑大实蝇形态相似,幼虫的鉴定缺少明显的鉴定特征,柑橘大实蝇成虫与蜜柑大实蝇成虫的区分鉴定,雌虫可依靠产卵器特征区分,但雄虫的鉴定仅有胸部鬃毛作为鉴别特征,需要专业的形态学知识储备,形态学鉴定困难。现有的pcr分子鉴定技术虽然可实现快速、准确的鉴定,但需昂贵的仪器设备,鉴定成本高,不适于在基层部门中推广应用。
5.环介导等温扩增(loop-mediated isothermal amplification,lamp)是利用一种具有链置换活性和瀑布式核酸扩增功能的bst dna聚合酶,在等温条件下进行核酸的变性和自动循环的链置换核酸扩增反应。lamp针对靶序列的6个区域设计4条特异引物,利用具备链置换功能的dna聚合酶在恒定温度下不断复制扩增dna。为了提高反应效率,可在反应体系中添加两条环引物,使之分别与茎环结构结合,启动链置换合成,循环复制。lamp是一种简便高效的核酸恒温扩增技术,可以在短时间内大量扩增反应产物,具更高灵敏度,且操作简便,无需特殊仪器,检测结果可由肉眼观察判断,适于基层部门推广应用。lamp中,引物是决定检测结果灵敏度和特异性的关键因素。
技术实现要素:
6.本发明要解决的技术问题是如何有效快速、准确地鉴定柑橘大实蝇。
7.为了解决上述技术问题,本发明首先提供了用于鉴定或辅助鉴定柑橘大实蝇的引物组。
8.本发明提供的用于鉴定或辅助鉴定柑橘大实蝇的引物组由引物-f3、引物-b3、引物-fip和引物-bip组成;
9.所述引物-f3为如下a1)或a2):
10.a1)序列表中序列1所示的单链dna分子;
11.a2)将序列1经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列1具有相同功能的单链dna分子;
12.所述引物-b3为如下a3)或a4):
13.a3)序列表中序列2所示的单链dna分子;
14.a4)将序列2经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列2具有相同功能的单链dna分子;
15.所述引物-fip为如下a5)或a6):
16.a5)序列表中序列3所示的单链dna分子;
17.a6)将序列3经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列3具有相同功能的单链dna分子;
18.所述引物-bip为如下a7)或a8):
19.a7)序列表中序列4所示的单链dna分子;
20.a8)将序列4经过一个或几个核苷酸的取代和/或缺失和/或添加且与序列4具有相同功能的单链dna分子。
21.上述引物组中,所述引物-f3、所述引物-b3、所述引物-fip和所述引物-bip的摩尔比为1:1:8:8。
22.为了解决上述技术问题,本发明又提供了上述引物组的新用途。
23.本发明提供了上述引物组在如下b1)-b4)中任一种中的应用:
24.b1)鉴定或辅助鉴定柑橘大实蝇;
25.b2)鉴定或辅助鉴定待测实蝇是否为柑橘大实蝇;
26.b3)检测或辅助检测待测样本是否含有柑橘大实蝇;
27.b4)区分或辅助区分柑橘大实蝇与其它实蝇。
28.为了解决上述技术问题,本发明还提供了含有上述引物组的试剂盒;
29.所述试剂盒的功能为如下c1)-c4)中任一种:
30.c1)鉴定或辅助鉴定柑橘大实蝇;
31.c2)鉴定或辅助鉴定待测实蝇是否为柑橘大实蝇;
32.c3)检测或辅助检测待测样本是否含有柑橘大实蝇;
33.c4)区分或辅助区分柑橘大实蝇与其它实蝇。
34.进一步的,所述试剂盒还包括用于检测柑橘大实蝇的其他试剂。在本发明中,所述用于检测柑橘大实蝇的其他试剂为warm start lamp 2
×
master mix或warm start colorimetric lamp 2
×
master mix。
35.更进一步的,所述试剂盒还包括阴性对照(如无菌超纯水)和阳性对照(如柑橘大实蝇的基因组dna)。
36.上述试剂盒的制备方法也属于本发明的保护范围。
37.所述试剂盒的制备方法可为如下d1)或d2):
38.d1)将上述引物组中的各条引物分别单独包装;
39.d2)将上述引物组中的各条引物按比例混合在一起。
40.所述d2)中,将所述引物组中的所述引物-f3、所述引物-b3、所述引物-fip和所述引物-bip按照摩尔比为1:1:8:8的比例混合在一起。
41.为了解决上述技术问题,本发明还提供了一种鉴定或辅助鉴定待测实蝇是否为柑橘大实蝇的方法。
42.本发明提供的鉴定或辅助鉴定待测实蝇是否为柑橘大实蝇的方法为如下s1)或s2):
43.所述s1)包括如下步骤:提取待测实蝇的核酸,以待测实蝇核酸为模板,采用上述引物组进行环介导等温扩增;环介导等温扩增反应结束后通过检测反应产物电泳后是否呈现梯状条带判断待测实蝇是否为柑橘大实蝇:若反应产物电泳后呈现梯状条带,则待测实蝇为或候选为柑橘大实蝇;若反应产物电泳后无梯状条带,则待测实蝇不为或候选不为柑橘大实蝇;
44.所述s2)包括如下步骤:提取待测实蝇的核酸,以待测实蝇核酸为模板,采用上述引物组进行环介导等温扩增;完成环介导等温扩增后,通过观察反应体系颜色判断待测实蝇是否为柑橘大实蝇:若反应体系呈黄色,则待测实蝇为或候选为柑橘大实蝇;若反应体系呈粉色,则待测实蝇不为或候选不为柑橘大实蝇。
45.为了解决上述技术问题,本发明还提供了一种检测或辅助检测待测样本是否含有柑橘大实蝇的方法。
46.本发明提供的检测或辅助检测待测样本是否含有柑橘大实蝇的方法为如下t1)或t2):
47.所述t1)包括如下步骤:提取待测样本的核酸,以待测样本核酸为模板,采用上述引物组进行环介导等温扩增;环介导等温扩增反应结束后通过检测反应产物电泳后是否呈现梯状条带判断待测样本是否含有柑橘大实蝇:若反应产物电泳后呈现梯状条带,则待测样本含有或候选含有柑橘大实蝇;若反应产物电泳后无梯状条带,则待测样本不含有或候选不含有柑橘大实蝇;
48.所述t2)包括如下步骤:提取待测样本的核酸,以待测样本核酸为模板,采用上述引物组进行环介导等温扩增;完成环介导等温扩增后,通过观察反应体系颜色判断待测样本是否含有柑橘大实蝇:若反应体系呈黄色,则待测样本含有或候选含有柑橘大实蝇;若反应体系呈粉色,则待测样本不含有或候选不含有柑橘大实蝇。
49.为了解决上述技术问题,本发明最后提供了一种区分或辅助区分柑橘大实蝇与其它实蝇的方法。
50.本发明提供的区分或辅助区分柑橘大实蝇与其它实蝇的方法为如下u1)或u2):
51.所述u1)包括如下步骤:提取待测实蝇的核酸,以待测实蝇核酸为模板,采用上述引物组进行环介导等温扩增;环介导等温扩增反应结束后通过检测反应产物电泳后是否呈现梯状条带判断待测实蝇是否为柑橘大实蝇:若反应产物电泳后呈现梯状条带,则待测实蝇为或候选为柑橘大实蝇;若反应产物电泳后无梯状条带,则待测实蝇为或候选为其它实蝇;
52.所述u2)包括如下步骤:提取待测实蝇的核酸,以待测实蝇核酸为模板,采用上述引物组进行环介导等温扩增;完成环介导等温扩增后,通过观察反应体系颜色判断待测实蝇是否为柑橘大实蝇:若反应体系呈黄色,则待测实蝇为或候选为柑橘大实蝇;若反应体系
呈粉色,则待测实蝇为或候选为其它实蝇。
53.上述任一所述方法中,所述环介导等温扩增反应体系具体可为体系1,总体积为25μl,由12.5μl warm start lamp 2
×
master mix、1μl dna模板、9μl引物混合物和2.5μl无菌超纯水组成。
54.上述任一所述方法中,所述环介导等温扩增反应体系具体可为体系2,总体积为25μl,由12.5μl warm start colorimetric lamp 2
×
master mix、1μl dna模板、9μl引物混合物和2.5μl无菌超纯水组成。
55.上述任一所述方法中,所述环介导等温扩增反应条件可为:63-67℃(如63-65℃、65-67℃、63℃、65℃或67℃)恒温50min。
56.所述引物混合物即上述引物组中的各条引物组成的混合物。所述引物-f3和所述引物-b3在体系1或体系2中的终浓度均具体可为0.2μm,所述引物-fip和所述引物-bip在体系1或体系2中的终浓度均具体可为1.6μm。
57.上述任一所述方法中,所述核酸为基因组dna。
58.上述任一所述应用或试剂盒或方法中,所述待测实蝇具体可为待测实蝇的卵、幼虫、蛹和/或成虫。
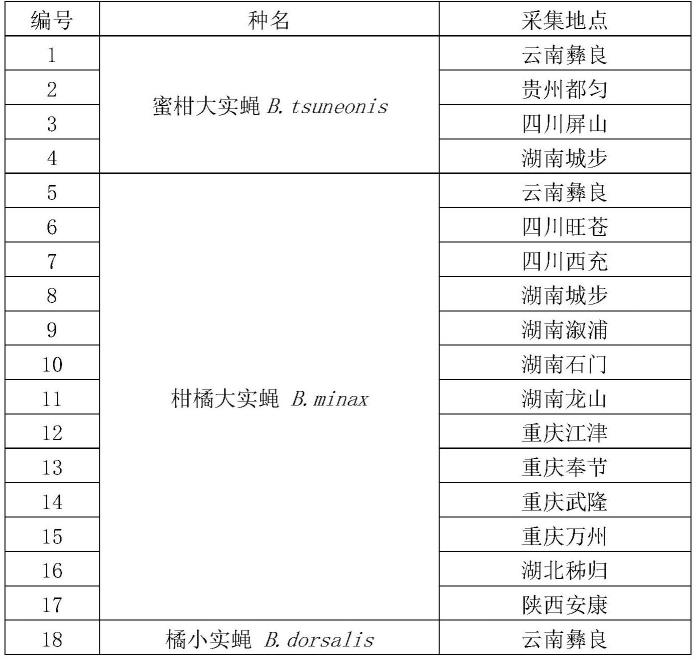
59.上述任一所述应用或试剂盒或方法中,所述待测样本包括柑橘大实蝇可为害的各种柑橘类水果,如甜橙、京橘、酸橙、红橘、柚子、柠檬、香橼和佛手等。
60.上述任一所述应用或试剂盒或方法中,所述其它实蝇可为如下实蝇中的至少一种:蜜柑大实蝇b.tsuneonis、橘小实蝇b.dorsalis。
61.上述任一所述应用或试剂盒或方法中,所述柑橘大实蝇b.minax可为来自不同地理种群的柑橘大实蝇b.minax,包括来自云南彝良、四川旺苍、四川西充、湖南城步、湖南溆浦、湖南石门、湖南龙山、重庆江津、重庆奉节、重庆武隆、重庆万州、湖北秭归、陕西安康的柑橘大实蝇b.minax。
62.本发明基于环介导等温扩增技术,建立了柑橘大实蝇的快速鉴定方法,针对柑橘大实蝇的coi基因dna条形码片段特异区段的6个区域,设计4条特异性引物,通过对反应体系和反应条件的优化,根据ph值指示剂在反应过程中因为反应体系的ph变化,由粉色变为黄色的特点,建立lamp分子鉴定技术及可视化检测方法,有效避免了开盖操作带来的检测环节中可能产生的样品阳性污染。本发明针对柑橘大实蝇鉴定的环介导等温扩增技术可以实现对柑橘大实蝇的卵、幼虫/成虫个体的快速鉴定,具有快速、高效、特异性强、灵敏度高、成本低、操作简便、无需特殊仪器的优点,适用于现场,易于在基层推广,能够为柑橘大实蝇的防控提供可靠技术依据,对植物检疫及柑橘类水果贸易具有重要意义。
附图说明
63.图1为实施例1中步骤一引物组bm1和bm2的检测结果。
64.图2为实施例2中步骤二可视化检测结果。
65.图3为实施例3中特异性的部分检测结果。
66.图4为实施例4中灵敏度的部分检测结果。
具体实施方式
67.以下的实施例便于更好地理解本发明,但并不限定于本发明。
68.下述实施例中的实验方法,如无特殊说明,均为常规方法。
69.下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂公司购买得到的。
70.下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
71.下述实施例中的血液/细胞/组织基因组dna提取试剂盒为天根公司的产品,产品目录号为dp304。warm start lamp 2
×
master mix和warm start colorimetric lamp 2
×
master mix均为new england biolabs公司的产品,产品目录号分别为e1700s和e1800s。
72.下述实施例中的供试实蝇样品的编号、种名和采集地点信息见表1。所有供试实蝇样品在供试前均使用dna条形分子鉴定方法进行了鉴定。
73.表1
[0074][0075]
实施例1、用于鉴定柑橘大实蝇的引物组与试剂盒的获得
[0076]
一、用于鉴定柑橘大实蝇的引物组的筛选
[0077]
1、以柑橘大实蝇线粒体基因组中的coi基因dna条形码序列作为靶基因,设计并合成用于鉴定柑橘大实蝇的引物组bm1和引物组bm2。各个引物组的引物序列详见表2。
[0078]
表2
[0079][0080][0081]
2、采用血液/细胞/组织基因组dna提取试剂盒提取实蝇样品的基因组dna,得到实蝇样品的基因组dna。
[0082]
实蝇样品为表1中编号为3的蜜柑大实蝇、编号为6的柑橘大实蝇、编号为18的橘小实蝇。
[0083]
3、以实蝇样品的基因组dna为模板,采用引物组bm1或引物组bm2进行环介导等温扩增,得到扩增产物。
[0084]
反应体系为25μl,由12.5μl warm start lamp 2
×
master mix、1μl dna模板、引物混合物和无菌超纯水组成。引物混合物即引物组中的各条引物组成的混合物。反应体系中,外引物f3和外引物b3的终浓度均为0.2μm,内引物fip和内引物bip的终浓度均为1.6μm。
[0085]
反应条件:65℃50min。
[0086]
4、将扩增产物进行2%琼脂糖凝胶电泳。
[0087]
按照上述方法,将模板替换为无菌超纯水,其它步骤均不变,作为阴性对照。
[0088]
引物组bm1和bm2的检测结果见图1。其中左图为引物组bm1,右图为引物组bm2。m为dna marker,1为柑橘大实蝇,2为蜜柑大实实蝇,3为橘小实蝇,n为无菌超纯水。
[0089]
结果表明,仅引物组bm1在鉴定柑橘大实蝇时呈典型梯状条带且阴性对照不出现条带。由此可见,仅引物组bm1可以鉴定柑橘大实蝇。
[0090]
二、用于鉴定柑橘大实蝇的试剂盒的制备
[0091]
用于鉴定柑橘大实蝇的试剂盒包括引物组bm1。
[0092]
实施例2、实施例1制备的试剂盒在鉴定待测实蝇是否为或候选为柑橘大实蝇中的应用
[0093]
一、通过琼脂糖凝胶电泳结果鉴定待测实蝇是否为或候选为柑橘大实蝇
[0094]
1、采用血液/细胞/组织样品基因组dna提取试剂盒提取待测实蝇的基因组dna,得到待测实蝇的基因组dna。
[0095]
2、以待测实蝇的基因组dna为模板,采用引物组bm1进行环介导等温扩增,得到扩增产物。
[0096]
反应体系为25μl,由12.5μl warm start lamp 2
×
master mix、1μl dna模板、9μl引物混合物和2.5μl无菌超纯水组成。引物混合物即引物组bm1中的各条引物组成的混合物。反应体系中,外引物f3和外引物b3的终浓度均为0.2μm,内引物fip和内引物bip的终浓度均为1.6μm。
[0097]
反应条件:65℃50min。
[0098]
3、将扩增产物进行2%琼脂糖凝胶电泳。
[0099]
按照上述方法,将模板替换为无菌超纯水,其它步骤均不变,作为阴性对照。
[0100]
按照上述方法,将模板替换为柑橘大实蝇的基因组dna,其它步骤均不变,作为阳性对照。
[0101]
4、根据电泳结果进行如下判断:
[0102]
阳性对照呈典型梯状条带且阴性对照没有条带时,如果待测实蝇呈典型梯状条带,则待测实蝇为或候选为柑橘大实蝇;如果待测实蝇不呈典型梯状条带(如没有条带),则待测实蝇不为或候选不为柑橘大实蝇;
[0103]
阳性对照不呈典型梯状条带或阴性对照有条带时,待测实蝇的鉴定结果无效。
[0104]
二、可视化鉴定待测实蝇是否为或候选为柑橘大实蝇
[0105]
1、采用血液/细胞/组织样品基因组dna提取试剂盒提取待测实蝇的基因组dna,得到待测实蝇的基因组dna。
[0106]
2、以待测实蝇的基因组dna为模板,采用引物组bm1进行环介导等温扩增。
[0107]
反应体系为25μl,由12.5μl warm start colorimetric lamp 2
×
master mix、1μl dna模板、9μl引物混合物和2.5μl无菌超纯水组成。引物混合物即引物组bm1中的各条引物组成的混合物。反应体系中,外引物f3和外引物b3的终浓度均为0.2μm,内引物fip和内引物bip的终浓度均为1.6μm。
[0108]
反应条件:65℃50min。
[0109]
按照上述方法,将模板替换为无菌超纯水,其它步骤均不变,作为阴性对照。
[0110]
按照上述方法,将模板替换为柑橘大实蝇的基因组dna,其它步骤均不变,作为阳性对照。
[0111]
3、完成步骤2后,肉眼观察反应体系的颜色,然后进行如下判断:
[0112]
阳性对照的反应体系呈黄色且阴性对照的反应体系呈粉色时,如果待测实蝇的反应体系呈黄色,则待测实蝇为或候选为柑橘大实蝇;如果待测实蝇的反应体系呈粉色,则待测实蝇不为或候选不为柑橘大实蝇;
[0113]
阳性对照的反应体系不呈黄色或阴性对照的反应体系不呈粉色时,待测实蝇的鉴定结果无效。
[0114]
本发明的发明人采用步骤二的方法鉴定待测实蝇是否为柑橘大实蝇。待测实蝇分别为表1中编号3的蜜柑大实蝇、编号为5的柑橘大实蝇、编号为6的柑橘大实蝇、编号为10的柑橘大实蝇、编号为13的柑橘大实蝇、编号为16的柑橘大实蝇、编号为17的柑橘大实蝇和编号为18的橘小实蝇。
[0115]
部分结果见图2(1-8依次为编号为6的柑橘大实蝇、编号为10的柑橘大实蝇、编号为13的柑橘大实蝇、编号为5的柑橘大实蝇、编号为16的柑橘大实蝇、编号为17的柑橘大实蝇、编号为3的蜜柑大实蝇和编号为18的橘小实蝇,n为阴性对照)。结果表明,不同地理种群
的柑橘大实蝇的反应体系均呈黄色,蜜柑大实蝇实蝇和橘小实蝇的反应体系均呈粉色。
[0116]
实施例3、特异性实验
[0117]
待测实蝇1为编号为5的柑橘大实蝇。
[0118]
待测实蝇2为编号为6的柑橘大实蝇。
[0119]
待测实蝇3为编号为7的柑橘大实蝇。
[0120]
待测实蝇4为编号为8的柑橘大实蝇。
[0121]
待测实蝇5为编号为9的柑橘大实蝇。
[0122]
待测实蝇6为编号为10的柑橘大实蝇。
[0123]
待测实蝇7为编号为11的柑橘大实蝇。
[0124]
待测实蝇8为编号为12的柑橘大实蝇。
[0125]
待测实蝇9为编号为13的柑橘大实蝇。
[0126]
待测实蝇10为编号为14的柑橘大实蝇。
[0127]
待测实蝇11为编号为15的柑橘大实蝇。
[0128]
待测实蝇12为编号为16的柑橘大实蝇。
[0129]
待测实蝇13为编号为17的柑橘大实蝇。
[0130]
待测实蝇14为编号为1的蜜柑大实蝇。
[0131]
待测实蝇15为编号为2的蜜柑大实蝇。
[0132]
待测实蝇16为编号为3的蜜柑大实蝇。
[0133]
待测实蝇17为编号为4的蜜柑大实蝇。
[0134]
待测实蝇18为编号为18的橘小实蝇。
[0135]
各个待测实蝇分别进行如下步骤:
[0136]
1、采用血液/细胞/组织样品基因组dna提取试剂盒提取待测实蝇的基因组dna。
[0137]
2、以步骤1提取的待测实蝇的基因组dna为模板,采用引物组bm1进行环介导等温扩增,得到扩增产物。
[0138]
反应体系为25μl,由12.5μl warm start lamp 2
×
master mix、1μl dna模板、9μl引物混合物和2.5μl无菌超纯水组成。引物混合物即引物组bm1中的各条引物组成的混合物。反应体系中,外引物f3和外引物b3的终浓度均为0.2μm,内引物fip和内引物bip的终浓度均为1.6μm。
[0139]
反应条件:65℃50min。
[0140]
3、将扩增产物进行2%琼脂糖凝胶电泳。
[0141]
按照上述方法,将模板替换为无菌超纯水,其它步骤均不变,作为阴性对照。
[0142]
按照上述方法,将模板替换为柑橘大实蝇的基因组dna,其它步骤均不变,作为阳性对照。
[0143]
部分检测结果见图3(1-18依次为待测实蝇1-待测实蝇18,n为阴性对照)。结果表明,待测实蝇为柑橘大实蝇的时候,均呈典型梯状条带;待测实蝇为非柑橘大实蝇的时候,均没有条带(即不呈典型梯状条带);阴性对照也没有条带。
[0144]
由此可见,采用引物组bm1鉴定柑橘大实蝇具有良好的特异性。
[0145]
实施例4、灵敏度实验
[0146]
1、采用血液/细胞/组织样品基因组dna提取试剂盒提取柑橘大实蝇的基因组dna。
[0147]
2、取柑橘大实蝇的基因组dna,用无菌水进行梯度稀释,得到柑橘大实蝇的基因组dna浓度分别为10.0ng/μl、1.0ng/μl、1.0
×
10-1
ng/μl、1.0
×
10-2
ng/μl、1.0
×
10-3
ng/μl、1.0
×
10-4
ng/μl的稀释液。
[0148]
3、以步骤2得到的稀释液为模板,采用引物组bm1进行环介导等温扩增,得到扩增产物。
[0149]
反应体系为25μl,由12.5μl warm start lamp 2
×
master mix、1μl dna稀释液(1μl稀释液中含有柑橘大实蝇的基因组dna为10.0ng、1.0ng、1.0
×
10-1
ng、1.0
×
10-2
ng、1.0
×
10-3
ng或1.0
×
10-4
ng)、9μl引物混合物和2.5μl无菌超纯水组成。引物混合物即引物组bm1中的各条引物组成的混合物。反应体系中,外引物f3和外引物b3的终浓度均为0.2μm,内引物fip和内引物bip的终浓度均为1.6μm。
[0150]
反应条件:65℃50min。
[0151]
4、将扩增产物进行2%琼脂糖凝胶电泳。
[0152]
按照上述方法,将模板替换为无菌超纯水,其它步骤均不变,作为阴性对照。
[0153]
按照上述方法,将模板替换为柑橘大实蝇的基因组dna,其它步骤均不变,作为阳性对照。
[0154]
如果呈典型梯状条带,表明反应体系中的相应基因组含量可以被检测出来。如果不呈典型梯状条带(如没有条带),表明反应体系中的相应基因组含量不能被检测出来。
[0155]
部分检测结果见图4(1-6的dna模板浓度依次为:10.0ng/μl、1.0ng/μl、1.0
×
10-1
ng/μl、1.0
×
10-2
ng/μl、1.0
×
10-3
ng/μl、1.0
×
10-4
ng/μl,n为阴性对照)。结果表明,引物组bm1鉴定柑橘大实蝇的灵敏度为1.0ng/μl。
[0156]
由此可见,采用引物组bm1鉴定柑橘大实蝇具有较高的灵敏度。
[0157]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1