一种靶向降解Hsp90蛋白的化合物及其制备方法与应用
本发明涉及抗肿瘤药物制备领域,具体涉及一种靶向降解hsp90蛋白的化合物及其制备方法与应用。
背景技术:
热休克蛋白90(heatshockprotein90,hsp90)在机体内主要功能是参与维持一些蛋白质的正确折叠,使得蛋白能够形成生理功能所需构象,从而在调节蛋白合成与降解平衡及蛋白定位中发挥重要作用。由hsp90参与折叠的蛋白统称为“客户”蛋白质。目前报道的hsp90客户蛋白有400多种,这些客户蛋白中包括跨膜酪氨酸激酶(her/neu、egfr、met、igf21r),亚稳信号蛋白(akt、raf21、ikk),成熟信号蛋白(p53、kit、flt3、v2src),嵌合信号蛋白(npm2alk、bcr2abl),甾体激素受体,细胞周期调节因子(cdk4、cdk6)等,这些蛋白大多与肿瘤的发生和演进有着密切的关系,并且在恶性肿瘤中处于过度表达或持续激活状态。因此,hsp90抑制后能诱导许多癌基因蛋白的降解,可以同时干预癌症进展的多条途径,起到比较好的抗肿瘤效果。因此,hsp90也成为了比较好的癌症靶点。
虽然hsp90抑制剂经过几十年的发展,已经取得众多突破,近三十年间有超过30个候选药物进入临床实验,目前hsp90抑制剂也已经进入第二代的研究,但是到目前为止仍然没有一个上市的药物。其中,efungumab曾两度向欧盟提交上市申请,终因产品的安全性及质量问题未获通过。另外,synta公司用于治疗nsclc的明星产品sta-9090,前期研究都表现出了极具潜力的治疗效果,原本以为是最有希望上市的hsp90抑制剂,但在临床三期试验中,基本没有表现出治疗有效性(pfs:4.2vs4.3m)。此外,进入临床3期的17-agg和17-dmag均因脱靶毒性而不得不终止临床。biib021是第一个口服生物可利用的hsp90抑制剂,其在小鼠肿瘤模型中始终显示出功效。它的合成比较简单是其另一个优点。然而,biib021在小鼠实验过程中需要高剂量(60-120mgkg-1天-1)才能起到作用。在人类中,即使biib021的剂量可能较低,但治疗患者仍然需要每天两次100毫克或每周三次450毫克,而且高剂量容易出现脱靶毒性,这就大大限制了其运用。因此对于靶向hsp90的降解剂,提高其抗癌活性并降低其毒性是研究的方向。
技术实现要素:
基于以上问题的发现,发明人提出了一种靶向降解hsp90蛋白的化合物及其制备方法与应用,该化合物采用的是双功能分子结构,通过protac(proteolysis-targetingchimeras)技术,即利用细胞内负责清除残次蛋白的泛素化降解系统,达到靶向降解目标蛋白的新技术。该类分子的一端的结构靶向结合e3连接酶crbn,另外一端的结构靶向结合hsp90蛋白,两端的结构通过链(linker)相连接,形成一个完整的化合物分子,该化合物通过e3连接酶crbn泛素化目标蛋白并引导目标蛋白进入蛋白酶体降解系统,实现对目标蛋白的特异性降解作用。
该化合物可在多种乳腺癌细胞中特异性降解hsp90蛋白,并且相比于hsp90抑制剂biib021,其具有更强的体外抑制乳腺癌细胞增殖活性。同时,传统hsp90小分子抑制剂并不能影响hsp90蛋白的含量,这也使得这些抑制剂未能起到理想的效果,而基于protac技术的hsp90蛋白降解剂,即使停药之后,肿瘤细胞也需要一定时间来恢复核内hsp90蛋白的含量。因此在抗肿瘤领域有潜在的应用价值。
为此,本发明一方面提出了如式ⅰ所示的一种靶向降解hsp90蛋白的化合物:
x-y-z式ⅰ
其中,x表示hsp90(heatshockprotein90,hsp90)蛋白的配体,z表示e3连接酶crbn的配体,y表示连接x和z的链。
所述x为式ⅱ-1,所述z为式ⅱ-2所示的化合物:
所述y为式ⅲ-1所示的化合物:
各f分别独立地为0-6之间的整数
各g分别独立地为0-6之间的整数
各h分别独立地为0-6之间的整数
各b,c,d分别独立地为键,
各a,e分别独立地为键,
具体来说,所述靶向降解hsp90蛋白的化合物可以是以下任意一种:
此时,
此时,
此时,
此时,
此时,
此时,
此时,
此时,
此时,
此时,
另一方面,本发明提供了上述靶向降解hsp90蛋白的化合物的制备工艺,路线图如下:
其中a为o或c,n为0-6的整数
再一方面,本发明提供上述靶向降解hsp90蛋白的化合物用于制备治疗或预防肿瘤的药物的用途。所述肿瘤包括乳腺癌或者卵巢癌。
附图说明
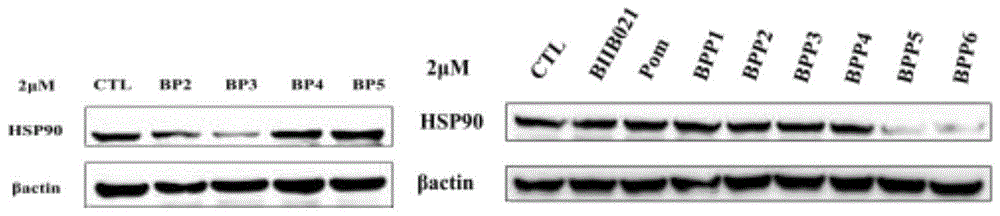
图1所合成化合物对hsp90的降解作用,其中化合物bp3、bpp5、bpp6在2μm时可显著降解乳腺癌细胞mcf-7内hsp90蛋白水平。
图2化合物bp3对乳腺癌细胞mcf-7胞内hsp90蛋白降解的作用,呈“钩效应”。
图3先加入放线菌酮(chx)抑制新mrna合成后,化合物bp3在2μm、5μm时对乳腺癌细胞mcf-7胞内hsp90的降解更加显著,且呈现时间依赖性,说明bp3是降解了已合成的hsp90蛋白,而不是抑制新的hsp90的生成。
图4化合物bp3的核磁共振谱图。
具体实施方式
下面将进一步详细描述本发明的实施例,所述实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1式1-1所示的化合物的制备
将2-(2,6-二氧代哌啶-3-基)-4-氟异二氢吲哚-1,3-二酮(0.36mmol,100mg),炔丙基胺盐酸盐(0.36mmol,32.95mg)溶于无水n-甲基-2-吡咯烷酮(8ml)中,加入diea(1.44mmol,186.10mg),搅拌均匀。在90℃下反应12小时后用水淬灭反应。将混合物用饱和nacl水溶液洗涤一次,用etoac萃取。将有机层用无水na2so4干燥,减压旋干,得到粗产物,通过硅胶柱色谱法进一步纯化(dcm:meoh=100:1)得到一种pomalidomide炔衍生物。
在室温下,将4-氯-5-碘-7-(4-甲氧基-3,5-二甲基吡啶-2-甲基)-7h-吡咯并[2,3-d]嘧啶-2-胺(100.0mg,0.22mmol),pd(pph3)4(12.71mg,0.011mmol,0.05eqi),cμi(4.19mg,0.022mmol,0.1eqi)和et3n(加入0.15ml,57mmol,5eqi),溶于dmso(10ml)溶液中,接着加入pomalidomide炔衍生物(89.02mg,0.28mmol,1.3eqi)。在n2保护下,75℃反应4h后用水淬灭反应。用etoac萃取,依次用饱和nacl水溶液、纯水洗涤。将有机层用无水na2so4干燥,减压旋干,得到粗产物,通过硅胶柱色谱法进一步纯化(dcm:meoh=100:1)得到产物。1hnmr(400mhz,dmso-d)δ11.15(s,1h),8.05(s,1h),7.67(dd,j=8.6,7.1hz,1h),7.36(s,1h),7.30(d,j=8.5hz,1h),7.14(d,j=7.0hz,1h),7.06(t,j=6.2hz,1h),6.74(s,2h),5.29(s,2h),5.10(dd,j=12.8,5.4hz,1h),4.44(d,j=6.1hz,2h),3.74(s,3h),2.91(ddd,j=17.3,14.0,5.4hz,1h),2.66-2.55(m,2h),2.26(s,3h),2.21(t,j=8.0hz,1h),2.17(s,3h).[m+h]+628.25。
实施例2式1-2所示的化合物的制备(方法参照制备工艺流程图和实施例1,实施例2-10需要根据相应接枝基团的不同调整原料)
1hnmr(400mhz,dmso-d6)δ11.12(s,1h),8.06(s,1h),7.58(t,j=7.8hz,1h),7.27-7.17(m,2h),7.04(d,j=7.1hz,1h),6.79(t,j=6.3hz,1h),6.73(s,2h),5.27(s,2h),5.06(dd,j=12.9,5.4hz,1h),3.73(s,3h),3.58(q,j=6.7hz,2h),2.95-2.81(m,1h),2.75(t,j=6.7hz,2h),2.62-2.43(m,3h),2.25(s,3h),2.16(s,3h),2.07-1.96(m,1h).[m+h]+642.40(核磁共振图谱见图4)。
实施例3式1-3所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,dmso-d6)δ11.12(s,1h),8.07(s,1h),7.57(t,j=7.8hz,1h),7.28(s,1h),7.15(d,j=8.6hz,1h),7.03(d,j=7.1hz,1h),6.73(s,2h),6.67(t,j=6.2hz,1h),5.29(s,2h),5.06(dd,j=12.7,5.4hz,1h),3.73(s,3h),3.48(q,j=6.8hz,3h),2.88(ddd,j=17.1,13.7,5.3hz,1h),2.62-2.53(m,2h),2.25(s,3h),2.17(s,3h),2.02(td,j=8.2,7.1,3.5hz,2h),1.86(q,j=6.8hz,2h).[m+h]+656.30。
实施例4式1-4所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,dmso-d6)δ11.11(s,1h),8.06(s,1h),7.53(t,j=7.8hz,1h),7.24(s,1h),7.13(d,j=8.6hz,1h),6.99(d,j=7.0hz,1h),6.71(s,2h),6.61(t,j=6.0hz,1h),5.27(s,2h),5.06(dd,j=12.9,5.4hz,1h),3.73(s,3h),2.88(ddd,j=17.5,14.1,5.4hz,1h),2.62-2.53(m,1h),2.48(d,j=6.7hz,1h),2.25(s,3h),2.17(d,j=8.2hz,3h),2.08-1.95(m,2h),1.75(q,j=7.3hz,2h),1.62(t,j=7.4hz,2h),1.47(q,j=7.2hz,1h).[m+h]+670.30。
实施例5式1-5所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,dmso-d6)δ11.12(s,1h),8.05(s,1h),7.55(s,1h),7.26(dd,j=8.6,2.5hz,1h),7.17(d,j=8.6hz,1h),7.00(d,j=7.0hz,1h),6.77(s,2h),6.65(t,j=6.0hz,1h),5.29(s,2h),5.05(dd,j=12.7,5.4hz,1h),4.45(s,2h),3.76(d,j=5.5hz,1h),3.73(s,3h),3.55(q,j=5.6hz,2h),2.88(ddd,j=16.7,13.7,5.3hz,1h),2.61-2.55(m,2h),2.26(s,3h),2.16(s,3h),2.01(ddd,j=11.5,6.1,3.6hz,2h).[m+h]+671.25。
实施例6式1-6所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,chloroform-d)δ9.31(s,1h),8.25(s,1h),7.45(t,j=7.8hz,1h),7.37(d,j=10.2hz,1h),7.12-7.04(m,2h),6.89(d,j=8.5hz,1h),6.50(t,j=5.7hz,1h),5.32(s,2h),5.23(s,1h),4.92(dd,j=12.0,5.4hz,1h),4.43(s,2h),3.79(dd,j=5.8,3.5hz,2h),3.73(s,3h),3.71(d,j=4.3hz,2h),3.46(q,j=5.4hz,2h),2.84(ddd,j=22.3,12.8,3.5hz,2h),2.74(dd,j=17.4,3.3hz,1h),2.24(s,3h),2.19(s,3h),2.11(dd,j=12.7,4.5hz,3h).[m+h]+715.25。
实施例7式1-7所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,chloroform-d)δ8.95(s,1h),8.25(s,1h),7.45(t,j=7.8hz,1h),7.36(d,j=2.3hz,1h),7.13(dd,j=8.5,2.5hz,1h),7.07(d,j=7.1hz,1h),6.89(d,j=8.6hz,1h),6.49(t,j=5.7hz,1h),5.36-5.33(m,1h),5.32(s,2h),4.92(dd,j=11.9,5.4hz,1h),4.41(s,2h),3.77(dd,j=6.2,3.5hz,2h),3.75(s,3h),3.72(t,j=5.3hz,2h),3.68(s,3h),3.46(t,j=5.4hz,2h),2.93-2.68(m,3h),2.34(t,j=7.5hz,3h),2.25(s,3h),2.19(s,3h),2.15-2.07(m,1h).[m+h]+760.25。
实施例8式1-8所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,chloroform-d)δ8.77(s,1h),8.27(s,1h),7.50-7.43(m,1h),7.36(s,1h),7.14(d,j=2.5hz,1h),7.08(d,j=7.5hz,1h),6.91(t,j=9.2hz,1h),6.49(s,1h),5.35(d,j=5.3hz,2h),5.33(s,1h),4.91(dd,j=11.9,5.1hz,1h),4.41(s,2h),3.76(s,3h),3.67-3.71(m,4h),3.67(d,7h),3.46(t,2h),2.81(m,3h),2.54(t,3h),2.26(s,3h),2.19(s,3h),2.12(m,1h).[m+h]+804.25。
实施例9式1-9所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,chloroform-d)δ8.79(s,1h),8.26(s,1h),7.47(q,j=7.2hz,1h),7.36(s,1h),7.14(d,j=2.5hz,1h),7.09(dd,j=4.9,2.2hz,1h),6.91(dd,j=8.5,6.6hz,1h),6.49(q,j=4.9hz,1h),5.41-5.34(m,1h),5.32(s,2h),4.97-4.87(m,1h),4.41(s,2h),4.27(s,3h),3.75(d,j=3.4hz,3h),3.72(q,j=5.3hz,5h),3.67(s,7h),3.46(p,j=5.2hz,2h),2.80(dddd,j=29.7,26.2,14.4,7.5hz,3h),2.33(t,j=7.5hz,3h),2.26(s,3h),2.18(s,3h),2.11(dd,j=10.2,5.4hz,1h).[m+h]+848.30。
实施例10式1-10所示的化合物的制备(方法参照实施例1)
1hnmr(400mhz,chloroform-d)δ8.71(s,1h),8.22(s,1h),7.48(t,j=7.8hz,1h),7.36(s,1h),7.10(s,2h),6.91(d,j=8.5hz,1h),6.49(t,j=5.7hz,1h),5.35(s,1h),5.07(s,2h),4.91(dd,j=12.0,5.3hz,1h),4.41(s,2h),3.75(d,j=6.7hz,3h),3.66(s,5h),3.65(s,9h),3.64(s,5h),3.46(q,j=5.4hz,2h),2.93-2.69(m,3h),2.33(t,j=7.5hz,3h),2.25(s,3h),2.19(s,3h),2.11(dd,j=10.7,5.3hz,1h).[m+h]+892.45。
实施例11性能检验试验
1.实验组的设置:
组1.阳性对照组:biib021和泊马度胺
组2.实施例1-10所得化合物
2.样品处理:
受试化合物以及阳性对照药物biib021和泊马度胺的配置:称取适量的受试化合物粉末,溶解于dmso中,使得终浓度为10mmol/l,10μl/管,-20℃避光保存,临用解冻,按所需浓度稀释。
rpmi1640培养液:每袋rpmi1640粉剂先溶于约800ml双蒸水,加入1.5gnahco3,2.5g葡萄糖,0.11g丙酮酸钠,充分溶解,用双蒸水补充至1000ml。0.22μm微孔滤膜过滤除菌,等量分装,4℃保存备用。使用前加入10%胎牛血清,1×双抗。
dmem培养液:每袋dmem粉剂先溶于约800ml双蒸水,加入1.5gnahco3,2.5g葡萄糖,0.11g丙酮酸钠,充分溶解,用双蒸水补充至1000ml。0.22μm微孔滤膜过滤除菌,等量分装,4℃保存备用。使用前加入10%胎牛血清,1×双抗。
pbs缓冲液(ph7.4):称取nacl8.0g,kcl0.2g,na2hpo4·12h2o1.44g,kh2po4·12h2o0.24g,溶于900ml双蒸水中,hcl调节ph至7.4,用双蒸水定容至1000ml,高压灭菌,室温储存。
3、免疫印迹分析检测细胞的蛋白表达量
(1)于10%的分离胶中(主要成份为ddh2o,30%聚丙烯酰胺,1.5mtris-hcl(ph8.8)或1.0mtris-hcl(ph6.8),10%sds,10%过硫酸铵,temed),每孔蛋白上样量约40μg,100v恒压电泳,待溴酚蓝快跑到凝胶底部时结束电泳。
(2)转膜:电泳结束后,拆卸玻璃板取出凝胶,切去浓缩胶,再依目的蛋白分子量的大小对分离胶适当剪切后泡于预冷转膜液中以免变干,同时将滤纸与海绵也泡于预冷转膜液中。裁剪一块与凝胶大小相仿的pvdf膜于甲醇中浸泡2min使膜活化,再按以下排列顺序制作“三明治”:负极上依次叠放1块海绵垫、2张滤纸、凝胶、pvdf膜、2张滤纸、一块海绵垫。注意:pvdf膜贴于凝胶上之后必须赶走气泡。接着按正确的正负电极方向安装好电泳槽进行湿转,四周放上冰块进行降温,调整电流为恒流200ma(1.5h)。
(3)封闭:转膜结束后将pvdf膜先于tbst中清洗5min,再放入5%的封闭液中于脱色摇床上封闭0.5-1h。
(4)抗体孵育:将一抗用封闭液或者一抗稀释液按1:500-1:1000稀释后覆盖于pvdf膜上于室温下孵育2h或4℃过夜,然后用tbst清洗三次,每次5min。将二抗按1:5000稀释后,在摇床上与pvdf膜于室温下孵育1h,再用tbst清洗三次,每次5min。
(5)化学发光,显影,定影:将a和b两试剂等体积混合,滴加到imagestation4000mm成像仪上,然后把pvdf膜正面朝下覆盖在ecl试剂上,按成像仪的操作说明进行曝光,得到蛋白条带结果。
4、本发明小分子化合物对hsp90的降解活性如下:
在对不同来源的肿瘤细胞系或正常细胞中,经化合物bp3、bpp5、bpp6处理4h后,蛋白质免疫印迹结果分析,如图1所示,与阳性对照药biib021相比可以明显观察到化合物bp3、bpp5、bpp6对hsp90蛋白的降解效果。由上述测试结果可以看出,化合物bp3、bpp5、bpp6能在一定浓度下降解hsp90。同时,化合物bp3、bpp5、bpp6在mcf-7乳腺癌细胞株中相比于biib021显示出了较强的细胞增殖抑制作用(见图2-3)。
5、本发明化合物对不同来源的肿瘤细胞系的半数抑制率:
不同肿瘤细胞系:实验选取人源乳腺癌细胞系:mcf-7、mda-mb-231、mx-1,以便考察化合物bp3对不同来源的肿瘤细胞系的半数抑制率活性。将细胞株培养于含10%胎牛血清、青霉素100iμ/ml和链霉素100μg/ml的rpmi1640培养液中。细胞置于37℃,5%co2饱和湿度培养箱中培养,取对数生长期的细胞用于实验。取对数生长期的细胞株,按4×104个/ml接种于96孔培养板中,每孔180μl。
实验组分别加入不同浓度的药物20μl,对照组不加药,每组设3个平行孔,37℃培养48h。加入5mg/ml的mtt溶液20μl/孔,继续培养4h后,去除上清液,加入150μldmso,微量振荡仪振荡10min,用酶标仪在570nm波长处测吸光度(od值)。根据吸光度计算细胞生长抑制率[细胞生长抑制率=(对照组od-实验组od)/对照组od×100%],并用logit法计算ic50值,实验重复3次,取平均值。
表1hsp90降解剂对肿瘤细胞增殖活性的抑制作用(化合物处理48h,化合物的ic50(μm))
- 还没有人留言评论。精彩留言会获得点赞!