一种全血核酸提取用裂解结合液及其试剂盒和应用的制作方法
本发明属于生物技术领域,涉及一种全血核酸提取用裂解结合液,还涉及到应用该裂解结合液制备的核酸提取的试剂盒。
背景技术:
核酸是一切生物体的遗传物质,广泛存在于所有动植物、微生物体内,包括脱氧核糖核酸(rna)和核糖核酸(dna)两类。随着分子生物学技术广泛应用于生物医学及其相关领域,核酸的提取及纯化技术也得到进一步的发展。核酸的提取主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分离。核酸提取和纯化是核酸检测的关键环节,核酸提取的效率和纯度对下游核酸检测起至关重要的作用。
自1869年miescher首次成功发现并分离出dna,以及1957年meselsonm等首次采用密度梯度离心法分离dna以来,报道了多种核酸提取方法,如:如酚氯仿法、离心柱提取法、玻璃粉吸附法、碱裂解法和etbr-cscl梯度离心法。许多研究者在核酸的提取方法上进行了不懈的探索,对核酸的各种材料和试剂进行了改进,十二烷基磺酸钠、酚、脲和胍盐等各种试剂纷纷被应用到核酸提取实验中,各种用于核酸提取的商品化试剂盒也应运而生。这些传统提取方法可从不同组织样本中分离出dna和rna,但这些技术中包含沉淀和离心等操作步骤,其所需的生物样本量较大,且提取的步骤较为繁杂、费时费力,得率也不高,难以实现自动化操作,另外,大部分的传统方法中还需要用到有毒化学试剂,对操作人员的健康具有潜在危害,因此,伴随着分子生物学以及高分子材料学的发展,从液相系统中分离核酸的传统技术逐渐被以固相载体为基础的新方法所取代,目前常见固相材料有硅胶、玻璃颗粒、硅藻土、阴离子交换载体等。但这些固相法通常需采取数次快速离心、真空抽滤等步骤来实现分离,而且对于样本需求量大,耗费样品较多,不便于高通量、自动化操作,严重限制了在临床基因诊断领域的应用。而磁珠法运用纳米磁珠可特异性的识别和高效结合核酸分子,在外加磁场和胍盐的作用下,能从血液、组织和病原微生物等样本中分离出核酸,可用于临床疾病的诊断。磁珠法便于自动化、操作简便、提取时间短、安全无毒。
随着分子生物学技术的发展,为满足高通量处理样本和获得高质量核酸的实验要求,核酸提取分离技术也更趋向于简便快捷、高质量、高纯度和高通量发展,核酸质量的好坏直接决定了后续实验的成败。近年来分子诊断技术快速发展,随着基因测序等技术的成熟,成本进一步降低,在临床上的应用也越来越普遍。分子诊断检测的样本类型多达数十种,而处理后产物适用的检测项目也涵盖了荧光定量pcr、基因测序、基因芯片、生物质谱等各类分子生物学技术平台。然而,无论是哪一类检测项目,准确的检验结果无疑依赖于高质量的标本及标本前处理过程。因此临床分子诊断自动化趋势将逐步在国内临床实验室成为主导,而自动化首先将在目前手工操作较普及且对结果影响最大的核酸提取上实现。
采用磁珠提取法,核酸提取率和提取纯度主要受提取液的影响,如裂解液、结合液、洗涤液和洗脱液等,若提取样品的量和纯度不太高,不但不能有效的检出,甚至影响检测结果,甚至不能完全满足后续的实验要求。在为申请号201110124322.3一种增强的磁珠法核酸提取方法中也对传统的磁珠法核酸提取进行了改进,因当前的磁珠法核酸提取方法有两方面不足:首先是rna的提取效率较低,其次是核酸提取步骤繁多,裂解与结合分为两步,磁珠在裂解完成之后才能加入溶液中结合核酸,不利于全自动化应用。该发明将样本的核酸裂解与核酸磁珠结合一步完成,游离的rna在裂解液中高浓度盐和异丙醇作用下吸附到磁珠表面,最后通过磁力作用使离心管内磁珠紧贴于离心管壁,吸弃离心管内溶液,从而达到裂解和结合的目的。该发明在于核酸提取仅需4个步骤,分别是裂解与结合、清洗1、清洗2、洗脱,而前3个步骤都是通过加入异丙醇增强了溶液中磁珠吸附核酸的作用,从而增强了磁珠法核酸提取的效率,其裂解结合时,生物样品、异丙醇与裂解液的体积比为1:1:2。并且在应用于rna提取时提供了一种高效提取rna的方法。使得裂解与结合一步完成,在应用于自动化核酸提取时每一步骤的反应试剂可以预先灌装入该步骤对应的反应舱内,使该发明更适用于全自动化应用。但是异丙醇对眼、呼吸道的黏膜有刺激作用,能损伤视网膜及视神经,挥发性吸入时给人带来恶心难受感觉。其毒性、麻醉性以及对上呼吸道黏膜的刺激都比乙醇强。接触高浓度蒸气出现头痛、倦睡以及眼、鼻、喉刺激症状。食入或吸入大量的蒸汽可引起面红、头疼、精神抑郁、恶心、昏迷等。
技术实现要素:
有鉴于此,本发明的目的在于克服现有技术的缺陷,提供一种基于磁珠的全血核酸提取用裂解结合液,以及包含该裂解结合液的试剂盒,并提供一种全血核酸提取的方法,以实现快速、高通量、自动化地提取核酸。
为达到上述目的,本发明提供如下技术方案:
1.一种全血核酸提取用裂解结合液,所述裂解结合液由以下物质组成:盐酸胍,碘化钠,edta,表面活性剂,tris-hcl,sds,np-40,水。
进一步,所述裂解结合液由以下物质组成:2-5m盐酸胍,0.5-2m碘化钠,5-20mmedta,0.1-1mtris-hcl,表面活性剂20-30%,np-401-2%,sds0.1-0.5%,余量为水,所述表面活性剂为tritonx-100或/和tween-20。
进一步,所述裂解结合液还包括3%-8%磁珠。
进一步,所述裂解结合液由以下物质组成:3m盐酸胍,0.5m碘化钠,15mmedta,10%tritonx-100,10%tween20,0.2mtris-hcl,5%磁珠,0.1%sds,1%np-40,余量为水。
2.以上任意项所述的全血核酸提取用裂解结合液在制备核酸提取的试剂或试剂盒中的应用。
3.含有以上任意项所述的全血核酸提取用裂解结合液的全血核酸提取试剂盒,所述全血核酸提取试剂盒包括裂解结合液、蛋白酶k溶液、洗涤缓冲液和洗脱缓冲液。
进一步,洗涤缓冲液包括洗涤缓冲液1和洗涤缓冲液2,洗涤缓冲液1由以下组分组成:1-3m盐酸胍,0.1-1mnaac,ph值6.0-6.5,30-60%乙醇溶液;洗涤缓冲液2为70-85%乙醇水溶液。
进一步,洗脱缓冲液由以下组分组成:1-5mmedta,5-20mmtris-hcl,ph值7.5-8。
所述蛋白酶k溶液,蛋白酶k浓度为10-30mg/ml。
4.提取全血核酸的提取方法,提取方法的具体步骤如下:
1)在生物样品中加入裂解结合液和蛋白酶k溶液,在20-85℃裂解5-15min,生物样品释放出核酸,在裂解结合液下与磁珠结合,在外部磁场作用下,磁珠聚集,形成磁珠-核酸复合物,收集磁珠-核酸复合物;
2)向磁珠-核酸复合物中加入洗涤缓冲液,洗涤去除磁珠-核酸复合物上的杂质,在外部磁场作用下,收集洗涤后的磁珠-核酸复合物;
3)向洗涤后的磁珠-核酸复合物中加入洗脱缓冲液,55℃-85℃洗脱3-8min可将结合在磁珠上的核酸洗脱下来,即得到提取的核酸。
进一步,洗涤缓冲液包括洗涤缓冲液1和洗涤缓冲液2,分别用洗涤缓冲液1和洗涤缓冲液2洗涤一次。
进一步,洗涤缓冲液1由以下组分组成:1-3m盐酸胍,0.1-1mnaac,ph值6.0-6.5,30-60%乙醇溶液;洗涤缓冲液2为70-85%乙醇水溶液。
进一步,洗脱缓冲液由以下组分组成:1-5mmedta,5-20mmtris-hcl,ph值7.5-8。
所述蛋白酶k溶液,蛋白酶k浓度为10-30mg/ml。
进一步,所述生物样品包括组织、细胞、全血、血浆、血清、体液、拭子洗液。
本发明的有益效果在于:本发明提供的裂解结合液可进行边裂解边吸附,减少了操作步骤,且不含有机溶剂,进而和仪器相结合可进行自动化提取,可批量化处理样本。磁珠法提取核酸,与硅胶膜吸附柱法相比提取效率低,多采用裂解与结合分两步进行,即需要裂解完后再加磁珠结合核酸,不利于自动化核酸提取应用,而磁珠法提取核酸的主要优势在于自动化,如果不自动化或自动化成本高相比于其他方法无优势。本发明通过研究裂解液的裂解性能实验,调整各试剂组成和配比,经过发明人的大量实验改进,获得了高效提取核酸的裂解液配方。可以保证所提取全血的核酸纯度好,浓度高,比对照试剂提取的核酸条带更清晰明亮,提取效率更高。
且裂解结合液中所用组分摒弃了传统磁珠法核酸提取中所用的有机溶剂异丙醇,保障所提取的核酸样品中不存在对酶有抑制作用的有机溶剂,也给核酸提取用户避免吸入异丙醇机会,增加良好的实验体验感。
应用本发明提供的裂解结合液制备的全血核酸提取试剂盒提取核酸时,全部核酸提取过程仅需3个步骤,完成特定核酸提取时间短,克服了现有磁珠法核酸提取方法步骤繁多的缺点;裂解与结合步骤一步完成,减少了操作步骤,该方法更适用于全自动化核酸提取应用;加大样本处理量和样本处理速率,快速高通量提取出生物样品中的核酸,这在临床应用时尤其能发挥技术优势和效能,减轻临床工作人员单调枯燥乏味的反复操作步骤。全血核酸提取试剂盒成本低,核酸提取方法简单,提取的核酸完成纯度高,可以直接进行pcr等分子生物学实验研究及临床检测。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
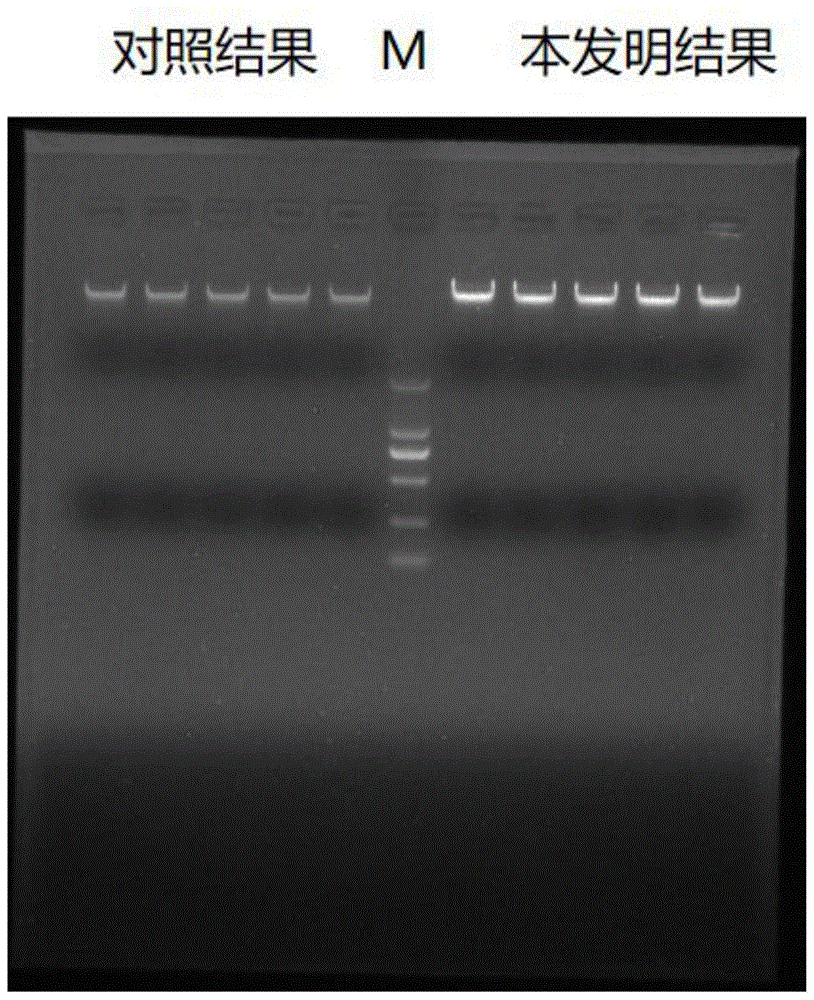
图1为本发明试剂提取全血核酸的电泳结果与对照试剂提取全血核酸的电泳结果;
图2为实施例1提取的核酸的荧光定量pcr结果。
具体实施方式
下面将结合附图及实施例对本发明的技术方案做进一步说明。所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
1)取edta抗凝血200ul置于离心管内,向离心管内加入裂解缓冲液600ul,10-30mg/ml蛋白酶k溶液20ul,65℃加热混匀3分钟,再将离心管置于磁力架上,磁力分离20s,弃上清;
其中,所述裂解缓冲液内加入的成分分别是:盐酸胍3m,碘化钠0.5m,edta15mm,tritonx-10010%(v/v),tween2010%(v/v),tris-hcl0.2m,纳米磁珠5%(w/v),sds0.1%(w/v),np-401%(w/v),其余成分为水,裂解缓冲液的ph值调至7.0。
2)继续向所述离心管中加入600ul的洗涤缓冲液1,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸弃上清;
其中,所述洗涤缓冲液1中加入的成分分别是:2m盐酸胍,naac0.3m,40%(v/v)乙醇溶液;其余成分为水,洗涤缓冲液的ph值调至6.2;
3)继续向所述离心管中加入600ul的洗涤缓冲液2,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸弃上清;所述洗涤缓冲液2为75%(v/v)乙醇水溶液;
4)最后向离心管中加入100ul的洗脱缓冲液,65℃加热混匀5分钟后将离心管置于磁力架上,磁力分离20s,将上清液转移至另一洁净无酶的离心管中,在-20℃温度下保存即可得到最终提取纯化的全血基因组dna溶液。
所述洗脱缓冲液含edta2mm,tris-hcl8mm,ph值调至8。
对照试剂选用qiaampdnabloodminikit提取的样本量为200ul,洗脱体积为100ul。
提取完成后,分别取全血基因组dna溶液5ul做1%琼脂糖凝胶电泳,结果如图1所示。本发明试剂提取全血核酸的电泳结果与对照试剂提取全血核酸的电泳结果相比,条带更清晰明亮,提取效率更高。
qiaampdnabloodminikit试剂盒利用了硅胶膜的选择吸附特性,样品中的核酸可以特异性结合到qiaamp的硅胶膜上,通过两次洗涤可以将pcr抑制剂,如:二价阳离子和蛋白完全去除,最后结合在离心柱上的纯核酸可用水或试剂盒中的缓冲液进行洗脱收集。
实施例2
将实施例1中提取后的本发明试剂和对照试剂,分别取2ul做靶标为β-珠蛋白的荧光定量pcr,结果表1和图2所示。
表1本发明试剂和对照试剂全血基因组荧光pcr结果
实施例3
从廊坊当地医院采集edta抗凝全血样本(采集者自愿的原则)10例。取200ul全血样置于离心管内,向离心管内加入裂解缓冲液600ul,20mg/ml蛋白酶k溶液20ul,60℃加热混匀5分钟,再将离心管置于磁力架上,磁力分离20s,弃上清;
2)继续向所述离心管中加入700ul的洗涤缓冲液1,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;洗涤缓冲液1为:2m盐酸胍,naac0.3m,40%乙醇溶液;其余成分为水,洗涤缓冲液的ph值调至6.2;
3)继续向所述离心管中加入700ul的洗涤缓冲液2,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸弃上清;洗涤缓冲液2为75%(v/v)乙醇水溶液;
4)最后向离心管中加入100ul的洗脱缓冲液,80℃加热混匀5分钟后将离心管置于磁力架上,磁力分离20s,将上清液转移至另一洁净的离心管中,在-20℃温度下保存即可得到最终提取纯化的人基因组核酸溶液。
其中,本发明实施例3中使用的所述裂解缓冲液、洗涤缓冲液和洗脱缓冲液与实施例1中使用的相同,即采用的试剂盒与实施例1中的试剂盒相同。
本发明也可用试剂盒配合自动化仪器,快速高通量地提取出全血样本的核酸,使用自动核酸提取仪,程序如下表2:
表2
提取完成后,取上述核酸2ul作为模板,反应液18ul,总反应体积20ul,采用市售cyp2c19药物代谢酶基因多态性检测试剂盒,利用abi7500荧光定量pcr仪进行扩增检测并将同份样本利用qiaampdnabloodminikit提取的核酸样本,进行一代测序比对一致性,检测结果见下表3。结果本发明试剂盒提取核酸检测cyp2c19的三个位点的30个样本基因型与测序结果一致率为100%。
表3本发明试剂盒提取核酸检测cyp2c19基因型
实施例4与传统方法添加结合液的对比数据
1、用本发明的方法,直接裂解并结合后进行核酸的洗涤和洗脱。
将edta抗凝血200ul置于离心管内(设置3个平行样),向离心管内加入裂解缓冲液600ul,30mg/ml蛋白酶k溶液20ul,65℃加热混匀3分钟;
继续向离心管中加入600ul的洗涤缓冲液1,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸上清;再向离心管中加入600ul的洗涤缓冲液2,混匀1分钟后将离心管置于磁力架上,磁力分离20s,吸弃上清;
最后向离心管中加入100ul的洗脱缓冲液,80℃加热混匀5分钟后将离心管置于磁力架上,磁力分离20s,将上清液转移至另一洁净的离心管中,得到最终提取纯化的核酸溶液,在-20℃温度下保存即可。
其中,所述裂解缓冲液包括盐酸胍3m,碘化钠0.5m,edta15mm,tritonx-10010%,tween2010%,tris-hcl0.2m,纳米磁珠5%,sds0.1%,np-401%,其余成分为水,裂解缓冲液的ph值调至7.0。
洗涤缓冲液1包括2m盐酸胍,naac0.3m,40%乙醇溶液;其余成分为水,洗涤缓冲液的ph值调至6.2。
洗涤缓冲液2为70%乙醇水溶液。
洗脱缓冲液包括edta1mm,tris-hcl10mm,ph值8;
所述纳米磁珠为超顺磁性氧化硅纳米磁性微珠,直径为500nm。
2、采用传统的方法,先进行裂解,后加异丙醇作为结合液进行结合,再进行核酸的洗涤和洗脱。裂解缓冲液:碘化钠2m,盐酸胍3m,edta10mm,tween-205%,纳米磁珠5%,sds2%。
3、按照申请号为201110124322.3中增强的磁珠法核酸提取方法中提及的进行操作,5m盐酸胍、异硫氰酸胍、碘化钠、碘化钾:裂解液的其组成分包括:1~2%tritonx-100,1~2%壬基酚聚氧乙烯醚(np40),1~2%吐温20tween-20,10~20mmtris—hcl,1-2mmedta,ph7-8,且生物样品、异丙醇与裂解液的体积比为1:1:2。
提取完用紫外分光光度计检测提取纯度和浓度,结果见下表4。
表4:
如表4中所示,利用本发明方法和添加结合液的结果,提取的纯度在1.7-2.1之间符合要求,但提取的浓度远远低于本发明的结果。
最后说明的是,以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明的要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种定量药粉取用盒的制作方法
- 一种层粘连蛋白(ln)测试试剂盒及其测试方法
- 一种抗核糖体P蛋白抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种阿胶胶液半成品或成品中驴、牛源性成分的定量检测方法、组合物及试剂盒的制作方法
- 一种抗PM-Scl抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗LKM-1抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种抗SLA/LP抗体IgG的磁微粒化学发光定量测定试剂盒及制备和检测方法
- 一种快速定量检测h-fabp的时间分辨荧光免疫层析试剂及制备方法
- 一种定量检测液体样品中汞离子的方法及试剂盒的制作方法
- 一种轴抑制蛋白2基因突变检测试剂及应用