双马来酰亚胺化合物及其制造方法与流程
本发明涉及一种双马来酰亚胺化合物及其制造方法。
背景技术:
近年来,伴随着电子设备的小型化、高性能化的发展,在多层印刷布线板中,对布线提出了微细化和高密度化的要求。进一步,由于在下一代产品中,需要面向高频带的材料,且作为降低噪音的对策,必须降低传输损耗,因此,需要开发介电特性优异的绝缘材料。
作为用于多层印刷布线板的绝缘材料,已知有在专利文献1和专利文献2中所公开的、包含环氧树脂、特定的酚醛类固化剂、苯氧基树脂、橡胶粒子以及聚乙烯醇缩醛树脂等的环氧树脂组合物。但是,已知在这些材料中,已不能满足用于作为以关键词5g为代表的高频带用途。相对于此,在专利文献3中虽公开了一种包含环氧树脂、活性酯化合物以及含有三嗪甲酚酚醛清漆树脂的环氧树脂组合物对低介电损耗角正切化为有效,但即使是该材料,其在作为用于高频用途上也需要更低的介电化。
另一方面,在专利文献4中,虽被公开有作为非环氧类的材料,且由具有长链烷基的含有双马来酰亚胺树脂和固化剂的树脂组合物所形成,并且低介电特性优异的树脂膜,但是,由于其实质上为具有长链烷基的双马来酰亚胺树脂与硬质的低分子的芳香族类马来酰亚胺的组合,因此,其相容性差、且容易发生特性的不均匀性和固化的不均匀性,并且很难实现在基板用途上所要求的100℃以上的高玻璃化转变温度(tg)。
另外,在近年来的研究中,已知上述具有长链烷基的双马来酰亚胺树脂,在树脂设计上若试图高tg化时,则介电特性恶化,而若改善介电特性时,则低tg化,处于两难的处境中。另外,还发现,若试图高tg化时,即使为具有同样长链烷基的双马来酰亚胺树脂,其树脂之间彼此也会产生凝集或分离,并且树脂彼此之间的相容性也变劣。
进一步,在专利文献5和专利文献6中,公开了将由芳香族四羧酸和为油酸等的不饱和脂肪酸的二聚体的二聚酸所衍生的二聚二胺和脂环式二胺作为原料的聚酰亚胺。但是,该聚酰亚胺难以在单独固化时使用,且与其它树脂的相容性也差。另外,由于在固化时聚酰亚胺进行闭环脱水,因此,例如,在与金属箔粘附使用的情况下,该使用条件下会导致产生膨胀。
现有技术文献
专利文献
[专利文献1]:日本特开2007-254709号公报
[专利文献2]:日本特开2007-254710号公报
[专利文献3]:日本特开2011-132507号公报
[专利文献4]:国际公开第2016/114287号公报
[专利文献5]:日本特开2017-119361号公报
[专利文献6]:日本特开2019-104843号公报
技术实现要素:
发明要解决的问题
因此,本发明的目的在于,提供一种双马来酰亚胺化合物,所述双马来酰亚胺组合物与其它树脂的相容性良好,并且能够高tg化。
解决问题的方法
为解决所述问题,本发明人们反复进行了深入研究的结果发现,下述双马来酰亚胺组合物能够达到上述目的,从而完成了本发明。
<1>
一种双马来酰亚胺化合物,所述双马来酰亚胺化合物以下述式(1)表示。
(在式(1)中,a独立地表示为含有环状结构的四价的有机基团。b独立地为碳原子数6~200的二价烃基。q独立地为以下述式(2)表示的具有环己烷骨架的碳原子数6~60的二价的脂环式烃基。w为b或q。n为1~100,m为0~100。另外,由n和m所括起来的各重复单元的顺序不受限定,其键合方式可以为交替,也可以为嵌段,还可以为无规。
(在式(2)中,r1、r2、r3以及r4独立地为氢原子或碳原子数1~5的烷基,x1和x2分别为0~4的数。))
<2>
如<1>所述的双马来酰亚胺化合物,其特征在于,
其中,在所述式(1)中的a为以下述结构式所表示的四价的有机基团中的任一种。
(在上述结构式中未键合取代基的键合端与在式(1)中形成环状酰亚胺结构的羰基碳键合。)
<3>
如<1>或<2>所述的双马来酰亚胺化合物,其特征在于,
其中,所述式(1)的双马来酰亚胺化合物的数均分子量为3000~50000。
<4>
如<1>~<3>中任一项所述的双马来酰亚胺化合物,其特征在于,
在所述式(1)的双马来酰亚胺化合物中,由n和m所括起来的各重复单元的键合方式为嵌段。
<5>
如<1>~<4>中任一项所述的双马来酰亚胺化合物,
其中,在所述式(1)中的b为以下述结构式(3-1)~(5)表示的二价烃基中的一种以上。
(在上述式中,n1和n2分别为5~30的数,其可以相同也可以不同,n3和n4分别为4~24的数,其可以相同也可以不同。r独立地表示为氢原子或碳原子数为4~40的直链或支链的烷基或烯基。)
<6>
一种<1>~<5>中任一项所述的双马来酰亚胺化合物的制造方法,其特征在于,
其具有工序a、工序b以及工序c:
所述工序a为用以下述式(6)表示的酸酐和以下述式(7)表示的脂环式二胺来合成酰胺酸且对其进行闭环脱水的工序;
(在式(6)中,a为含有环状结构的四价有机基团。)
(在式(7)中,r1、r2、r3以及r4独立地为氢原子或碳原子数1~5的烷基,x1和x2分别为0~4的数。)
所述工序b为在该工序a之后,用在所述工序a中所得到的反应物和以下述式(8)表示的二胺来合成酰胺酸,并对其进行闭环脱水的工序;
h2n-b-nh2(8)
(在式(8)中,b为碳原子数6~200的二价烃基。)
所述工序c为在该工序b之后,通过使用在所述工序b中所得到的反应物和马来酸酐来合成马来酰胺酸,且通过对其进行闭环脱水从而对分子链的末端进行封端的工序。
<7>
一种<1>~<5>中任一项所述的双马来酰亚胺化合物的制造方法,其特征在于,
其具有工序a’、工序b’以及工序c’:
所述工序a’为用以下述式(6)表示的酸酐和以下述式(8)表示的二胺进来合成酰胺酸且对其进行闭环脱水的工序;
(在式(6)中,a为含有环状结构的四价的有机基团。)
h2n-b-nh2(8)
(在式(8)中,b为碳原子数6~200的二价烃基。)
所述工序b’为在该工序a’之后,用在所述工序a’中所得到的反应物和以下述式(7)表示的脂环式二胺来合成酰胺酸且对其进行闭环脱水的工序;
(在式(7)中,r1、r2、r3以及r4独立地为氢原子或碳原子数1~5的烷基,且x1和x2分别为0~4的数;
所述工序c’为在该工序b’之后,通过用在所述工序b’中所得到的反应物和马来酸酐来合成马来酰胺酸,并通过闭环脱水从而对分子链的末端进行封端的工序。
发明的效果
本发明的双马来酰亚胺化合物,特别是具有脂环式骨架的双马来酰亚胺化合物,由于其与结构不同的树脂具有优异的相容性,因此,容易与其它的树脂并用,并且通过补充相互的性能,从而容易引导出良好的性能。另外,若为本发明的双马来酰亚胺化合物、特别是具有脂环式骨架的双马来酰亚胺化合物,则能够提供一种在成形为膜状或基板状时固化性和物性的偏差小、且可形成具有高玻璃化转变温度(tg)的固化物的双马来酰亚胺树脂组合物。
附图说明
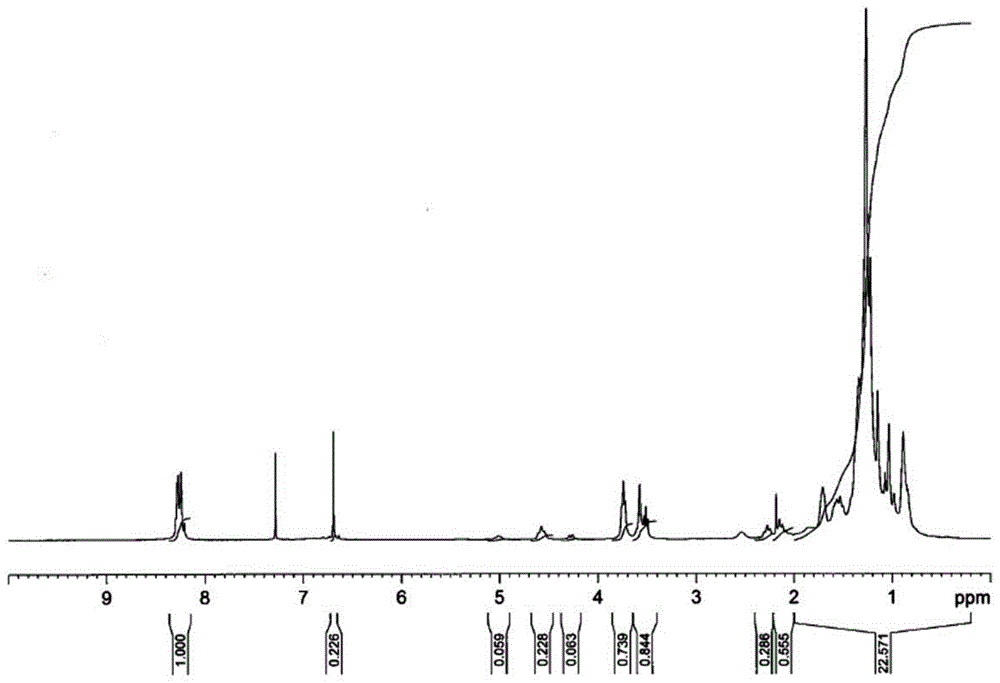
图1为已在合成例1中所合成的双马来酰亚胺化合物的1h-nmr谱图。
图2为已在合成例1中所合成的双马来酰亚胺化合物的ir谱图。
具体实施方式
以下,对本发明进行详细地说明。
本发明的双马来酰亚胺化合物为以下述式(1)表示的双马来酰亚胺化合物。
(在式(1)中,a独立地表示含有环状结构的四价的有机基团。b独立地为碳原子数6以上的二价烃基。q独立地为以下述式(2)表示的具有环己烷骨架的碳原子数6~60的二价的脂环式烃基。w为b或q。n为1~100,m为0~100。另外,由n和m所括起来的各重复单元的顺序不受限定,其键合方式可以为交替,也可以为嵌段,还可以为无规。
(在式(2)中,r1、r2、r3以及r4独立地为氢原子或碳原子数1~5的烷基,x1和x2分别为0~4的数。))
在此,在所述式(1)中,a独立地表示含有环状结构的四价的有机基团,其中,优选为以下述结构式表示的四价有机基团中的任一种。
(上述结构式中未键合取代基的键合端为与在式(1)中形成环状酰亚胺结构的羰基碳键合的键合端。)
另外,在所述式(1)中,b独立地为碳原子数6~200、优选为碳原子数8~100、更优选为碳原子数10~50的二价烃基。其中,优选为,所述二价烃基中的一个以上的氢原子,被碳原子数6~200个、优选为碳原子数8~100个碳原子、更优选为碳原子数10~50个的烷基或烯基取代的支链二价烃基。作为支链二价烃基,可以为饱和脂肪族烃基和不饱和烃基中的任一种,也可以在分子链的中途具有脂环式结构或具有芳香族环结构。作为所述支链二价烃基,具体说来,可列举为被称之为二聚体二胺的来自两末端二胺的烃基。需要说明的是,所说的二聚二胺为由油酸等的不饱和脂肪酸的二聚体所衍生出的化合物。
作为所述二价烃基的具体例,可列举为由以下述结构式(3-1)~(5)所表示的二价烃基中的一种以上。
在此,n1和n2分别为5~30的数、优选为5~15的数、更优选为6~10的数,其可以为相同也可以不同。另外,n3和n4分别为4~24的数、优选为4~12的数、更优选为5~10的数,其可以为相同也可以不同。另外,r独立地表示为氢原子或碳原子数为4~40、优选碳原子数为5~20、更优选碳原子数为6~15的直链或支链的烷基或烯基。作为r的具体例,可列举为氢原子或丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、月桂基、硬脂基,以及它们的结构异构体等。
作为所述式(3-1)~(5)的具体例,可列举如下的结构。
另外,在所述式(1)中,q独立地为以下述式(2)表示的具有环己烷骨架的碳原子数6~60、优选碳原子数8~30、更优选碳原子数10~20的二价的脂环式烃基。
(在式(2)中,r1、r2、r3以及r4独立地为氢原子或碳原子数1~5的烷基,x1和x2分别为0~4的数。)
在此,作为r1、r2、r3以及r4的具体例,可列举为氢原子、甲基、乙基、正丙基、异丙基、正丁基、异丁基以及叔丁基等。在它们当中,优选为氢原子和甲基。需要说明的是,r1、r2、r3以及r4可以为相同,也可以为不同。
另外,所述x1和x2分别为0~4的数、优选为0~2的数。需要说明的是,x1和x2可以为相同,也可以为不同。
另外,在所述式(1)中,作为q的具体例,可列举如下的结构
在所述式(1)中,w为b或q。关于所述w,可依其后述的制造方法的不同来决定选择任一种中的结构单元。
此外,在所述式(1)中,n为1~100、优选为1~50、更优选为1~40。另外,m为0~100、优选为1~50、更优选为1~40。
作为本发明的双马来酰亚胺化合物的数均分子量(mn),对其没有特别地限制,其优选为3000~50000、更优选为3500~30000、进一步优选为4000~20000。若在该范围内,在将本发明的双马来酰亚胺化合物与树脂组合物进行配合时,其粘度不会变得过高,而且该树脂组合物的固化物具有高强度。
在本说明书中所提及的数均分子量(mn),是指将在下述条件下通过gpc测定的聚苯乙烯作为标准物质的数均分子量。
[gpc测定条件]
展开溶剂:四氢呋喃
流量:0.6ml/min
柱:tskguardcolumsuperh-l
tskgelsuperh4000(6.0mmi.d.×15cm×1)
tskgelsuperh3000(6.0mmi.d.×15cm×1)
tskgelsuperh2000(6.0mmi.d.×15cm×2)
(均由tosohcorporation制造)
柱温度:40℃
试样注入量:20μl(试样浓度:0.5质量%-四氢呋喃溶液)
检测器:差示折射计(ri)
在以本发明的式(1)所表示的双马来酰亚胺化合物中,由式(1)中的n和m所括起来的各重复单元的顺序不受限定,其键合方式可以为交替,也可以为嵌段,还可以为无规,但优选为嵌段键合。
<双马来酰亚胺化合物的制造方法>
对本发明的双马来酰亚胺化合物的制造方法没有特别地限制,例如,可以通过在以下所示的2种方法进行有效地制造。
制造方法1
作为一种制造方法,其为具有工序a、工序b以及工序c的双马来酰亚胺化合物的制造方法。所述工序a为用以下述式(6)表示的酸酐和以下述式(7)表示的脂环式二胺来合成酰胺酸且对其进行闭环脱水的工序;
(在式(6)中,a与所述式(1)所表示者相同。)
(式(7)中,r1、r2、r3、r4以及x1和x2与所述式(1)所表示者相同。)
所述工序b为在该工序a之后,用在所述工序a中所得到的反应物和以下述式(8)表示的二胺来合成酰胺酸且对其进行闭环脱水的工序;
h2n-b-nh2(8)
(在式(8)中,b与所述式(1)所表示者相同。)
所述工序c为在该工序b之后,使用在所述工序b中所得到的反应物和马来酸酐来合成马来酰胺酸,并通过闭环脱水用马来酰亚胺基对分子链的末端进行封端的工序。
制造方法2
作为另一种制造方法,其为具有工序a’、工序b’以及工序c’的双马来酰亚胺化合物的制造方法。所述工序a’为以所述式(6)和以所述式(8)表示的二胺来合成酰胺酸且对其进行闭环脱水的工序;
所述工序b’为在该工序a’之后,用在所述工序a’中所得到的反应物和以下述式(7)表示的脂环式二胺来合成酰胺酸且对其进行闭环脱水的工序;
所述工序c’为在该工序b’之后,使用在所述工序b’中所得到的反应物和马来酸酐来合成马来酰胺酸,并通过闭环脱水对分子链的末端进行封端的工序。
虽然表示了上述二种的制造方法,但作为基本的流程,其为通过历经用四羧酸二酐和二胺来合成酰胺酸,并对其进行闭环脱水的工序a(或工序a’);然后,再历经在工序a(或工序a’)之后,添加与先前工序a(或工序a’)不同的二胺来合成酰胺酸,并进一步进行闭环脱水的工序b(或工序b’);并且历经在工序b(或工序b’)之后,使马来酸酐反应,从而合成马来酰胺酸,最后再通过闭环脱水,用马来酰亚胺基对分子链末端进行封端的工序c(或工序c’),从而能够得到双马来酰亚胺化合物的流程。上述二种制造方法的不同点主要仅是投入的二胺种类的顺序不同。
在以上二种制造方法中,各工序可大致分为酰胺酸或马来酰胺酸的合成反应和闭环脱水反应这两步,并在以下对其进行详细地说明。
在工序a(或工序a’)中,首先,通过使初始特定的四羧酸二酐与特定的二胺发生反应来合成酰胺酸。该反应通常在有机溶剂(例如,非极性溶剂或高沸点非质子性极性溶剂)中,且在室温(25℃)~100℃的条件下进行反应。
接下来,在90~120℃的条件下进行反应后,且将由缩合反应所副产的水从体系中除去的同时进行酰胺酸的闭环脱水反应。为了促进闭环脱水反应,也可以添加有机溶剂(例如,非极性溶剂、高沸点非质子性极性溶剂等)和酸催化剂。
作为有机溶剂,可列举甲苯、二甲苯、苯甲醚、联苯、萘、n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)等。它们既可以单独使用1种,也可以并用2种以上。另外,作为酸催化剂,可列举硫酸、甲磺酸以及三氟甲磺酸等。它们既可以单独使用1种,也可以并用2种以上。
四羧酸二酐与二胺的摩尔比,其优选为四羧酸二酐/二胺=1.01~1.50/1.0、更优选为四羧酸二酐/二胺=1.01~1.35/1.0。通过以该比例进行配合,其结果,能够合成在两末端含有酰亚胺基的共聚物。
在工序b(或工序b’)中,首先,通过将由工序a(或工序a’)所得到的在两末端含有酰亚胺基的共聚物与特定的二胺发生反应来合成酰胺酸。该反应通常在有机溶剂(例如,非极性溶剂或高沸点非质子性极性溶剂)中,且在室温(25℃)~100℃条件下进行。
同样,在95~120℃的条件下进行反应后,且在将由缩合反应所副产的水从体系中除去同时,继续进行酰胺酸的闭环脱水反应。为了促进闭环脱水反应,也可以添加有机溶剂(例如,非极性溶剂、高沸点非质子性极性溶剂等)和酸催化剂。
作为有机溶剂,可列举甲苯、二甲苯、苯甲醚、联苯、萘、n,n-二甲基甲酰胺(dmf)、二甲基亚砜(dmso)等。它们既可以单独使用1种,也可以并用2种以上。另外,作为酸催化剂,可列举硫酸、甲磺酸以及三氟甲磺酸等。它们既可以单独使用1种,也可以并用2种以上。
两末端含有酰亚胺基的共聚物与二胺的摩尔比,其优选为1.0:1.6~2.5、更优选为1.0:1.8~2.2。
在工序c(或工序c’)中,通过将由工序b(或工序b’)中所得到的在两末端含有氨基的二胺与马来酸酐在室温
若为通过这样的制造方法而得到的双马来酰亚胺化合物,由于其具有嵌段共聚物结构,因此,可以使所合成树脂的相容性均匀,且能够提高所合成树脂的相容性。
在两末端含有氨基的二胺与马来酸酐的摩尔比,其优选为1.0:1.6~2.5、更优选为1.0:1.8~2.2。
本发明的化合物的精制方法可为常规方法,也可以使用再沈降法等。
[实施例]
以下,示出实施例、参考例以及比较参考例,对本发明进行详细地说明,但本发明并不被限制在以下的实施例。需要说明的是,在以下的实施例、参考例以及比较参考例中,其[室温]的含义为25℃。
[实施例1](双马来酰亚胺化合物的制造,反应式1)
将37.25g(0.219摩尔)的异佛尔酮二胺和76.94g(0.35摩尔)的均苯四甲酸二酐以及350g的甲苯,投入在具有搅拌机、迪安-斯塔克管、冷却冷凝器以及温度计的2l玻璃四颈烧瓶中,并通过将混合物在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌4小时,从而合成了嵌段共聚物。
然后,将116.88g(0.219摩尔)的priamine-1075(croda制造,含有以下述式(3’)~(5’)表示的二聚二胺的二胺化合物:h2n-c36h70-nh2(平均组成式))添加在装有已冷却至室温的嵌段共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌4小时,从而合成了两末端二胺体。
在将装有所得到的两末端二胺体溶液的烧瓶冷却至室温之后,再添加18.88g(0.193摩尔)的马来酸酐,并通过再次加热,且在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌15小时,并用300g水洗涤5次,从而得到了双马来酰亚胺化合物的清漆。然后,通过将该清漆滴加在3000g的异丙醇(ipa)中以实施再沉降工序,并通过除去溶剂使其干燥,从而得到了目标产物的深褐色固体。由所得到的生成物的1h-nmr和ir的光谱可知,其为具有以下述反应式1的式(9)表示的结构的双马来酰亚胺化合物1(数均分子量:8000)。将1h-nmr光谱表示在图1,将ir光谱表示在图2。
(反应式1)
h2n-c36h70-nh2表示为priamine-1075。
m≈3,n≈1(分别为平均值)
1h-nmr(400mhz,cdcl3)δ0.80-2.00(烷基,100h)、2.05-2.25(-ch2-ch2-ch2-,m,-6h)、3.47-3.63(-n-ch2-ch2-,m,12h)、3.65-3.85(-n-ch2-ch2-,m,12h)、4.26(-ch-ch2-c-,d,1h)、4.59(-n-ch-ch2-,t,4h)、5.05(-n-ch-ch2-,br,1h)、7.06-7.14(来自芳香族环,8h)、6.70(来自马来酰亚胺,s,16h)、8.15-8.36(来自芳香族环,m,4h)
[实施例2](双马来酰亚胺化合物的制造、反应式2)
将89.41g(0.525摩尔)的异佛尔酮二胺和76.94g(0.35摩尔)的均苯四甲酸二酐以及350g的甲苯投入在具有搅拌机、迪安-斯塔克管、冷却冷凝器以及温度计的2l玻璃四颈烧瓶中,并通过将混合物在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌4小时,从而合成了嵌段共聚物。
然后,将116.88g(0.219摩尔)的priamine-1075(croda制造,二胺化合物:h2n-c36h70-nh2(平均组成式))添加在装有已冷却至室温的嵌段共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌4小时,从而合成了两末端二胺体。
在将装有所得到的两末端二胺体溶液的烧瓶冷却至室温之后,再添加18.88g(0.193摩尔)的马来酸酐,并通过再次加热,且在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌15小时,并用300g的水洗涤5次,从而得到了双马来酰亚胺化合物的清漆。然后,通过将该清漆滴加在2000g的ipa中以实施再沉降工序,并通过除去溶剂使其干燥,从而得到了目标产物的深褐色固体。由所得到的生成物的1h-nmr和ir的光谱可知,其为具有以下述反应式2的式(10)所表示的结构的双马来酰亚胺化合物2(数均分子量:8500)。
(反应式2)
h2n-c36h70-nh2表示为priamine-1075。
m≈5,n≈1(分别为平均值)
[实施例3](双马来酰亚胺化合物的制造,反应式3)
将31.13g(0.219摩尔)的1,3-双氨基甲基环己烷和76.94g(0.35摩尔)的均苯四甲酸二酐以及350g的甲苯,投入在具有搅拌机、迪安-斯塔克管、冷却冷凝器以及温度计的2l玻璃四颈烧瓶中,并通过将混合物在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌4小时,从而合成了嵌段共聚物。
然后,将116.88g(0.219摩尔)的priamine-1075(croda制造,二胺化合物:h2n-c36h70-nh2(平均组成式))添加在装有已冷却至室温的嵌段共聚物溶液的烧瓶中,并通过在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌4小时,从而合成了两末端二胺体。
在将装有所得到的两末端二胺体溶液的烧瓶冷却至室温之后,再添加18.88g(0.193摩尔)的马来酸酐,并通过再次加热,且在80℃条件下搅拌3小时,从而合成了酰胺酸。然后,直接将其升温至110℃,且在蒸馏出所副产的水分的同时搅拌15小时,并用300g的水洗涤5次,从而得到了双马来酰亚胺化合物的清漆。然后,通过将该清漆滴加在2000g的ipa中以实施再沉降工序,并通过除去溶剂使其干燥,从而得到了目标产物的深褐色固体。由所得到的生成物的1h-nmr和ir的光谱可知,其为具有以下述反应式3的式(11)所表示的结构的双马来酰亚胺化合物3(数均分子量:7600)。
(反应式3)
h2n-c36h70-nh2表示为priamine-1075。
m≈3,n≈1(分别为平均值)
双马来酰亚胺化合物
(bmi-1):以下述式表示的含有直链亚烷基的双马来酰亚胺化合物(bmi-1500,designermoleculesinc.制造,比较参考例用)
(bmi-2):以下述式表示的含有直链亚烷基的双马来酰亚胺化合物(bmi-3000,designermoleculesinc.制造,比较参考例用)
(bmi-3):以下述式表示的含有直链亚烷基的双马来酰亚胺化合物(bmi-2500,designermoleculesinc.制造,比较参考例用)
(bmi-4):4,4’-二苯基甲烷双马来酰亚胺(bmi-1000:日本大和化成股份有限公司制造,比较参考例用)
[参考例1~3,比较参考例1~4]
将在实施例1~实施例3中合成的双马来酰亚胺化合物1~3和bmi-1~4的双马来酰亚胺化合物各100g和1g过氧化二枯基配合在金属制的培养皿中,并将该培养皿置于100℃的加热板上,并混合10分钟,从而制备了双马来酰亚胺树脂组合物。
相容性
<与ppe树脂的相容性>
将在上述制备的各双马来酰亚胺树脂组合物20g和末端甲基丙烯酸改性聚苯醚树脂(sa9000-111,sabic制造,分子量4000)20g以及甲苯40g配合在100ml的透明玻璃瓶中,并在80℃条件下加热混合了30分钟。然后,将其冷却至室温并确认了外观。将各评价结果记载在表1。
<与bmi-2的相容性>
将在上述制备的各双马来酰亚胺树脂组合物中配合了在实施例
固化性
<外观>
将在实施例1~3中合成的双马来酰亚胺化合物
<dsc>
另外,在下述条件下测定了上述固化性评价用的双马来酰亚胺树脂组合物的dsc,并将其放热峰的数目记载在表1。
[dsc测定条件]
测定装置:mettlertoledo公司制造dsc3+
试样重量:10mg(使用铝试样皿)
升温速度:10℃/min
气氛:空气
温度范围:25~300℃
<介电特性(相对介电常数、介电损耗角正切)>
使用真空压制机(nikko-materialsco.,ltd.制造),在150℃、5分钟的条件下,将在上述制备了的各双马来酰亚胺树脂组合物成形为厚度200μm的膜状,并在180℃条件下进行2小时后固化,从而制备了介电特性评价用膜状试样。然后,将网络分析仪(keysighttechnologies,inc.制备e5063-2d5)和带状线(keycom股份有限公司制备)与该试样进行连接,对所述膜在频率10ghz中的相对介电常数和介电损耗角正切进行了测定。将各测定结果记载在表1。
<玻璃化转变温度(tg)>
使用tainstruments制造的dma-800,对在上述所制备的各介电特性评价用膜状试样进行了玻璃化转变温度的测定。将各测定结果记载在表1。
[表1]
由表1所示可知,参考例1~3的双马来酰亚胺树脂化合物与比较参考例1~4的双马来酰亚胺树脂组合物的固化物相比较,其参考例1~3的双马来酰亚胺树脂化合物的玻璃化转变温度(tg)高。另外,在参考例1~3的双马来酰亚胺树脂化合物中所使用的双马来酰亚胺化合物与其它树脂的相容性良好。
[工业上的可利用性]
若为本发明的双马来酰亚胺化合物,则能够提供一种在成形为膜状和基板状时固化性和物性的偏差小、且可形成具有高玻璃化转变温度(tg)的固化物的双马来酰亚胺树脂组合物。另外,由于本发明的双马来酰亚胺化合物与其它结构不同的树脂的相容性优异,因此,在其与双马来酰亚胺树脂组合物进行配合时,容易与其它树脂并用,并且通过完善相互的性能,从而容易引导出更良好的性能。具体说来,本发明的双马来酰亚胺化合物,对用于将介电特性优异的绝缘材料作为必要条件的面向高频带的电子设备的多层印刷布线板的用途等为有用。
- 还没有人留言评论。精彩留言会获得点赞!