一种混合精斑提取工艺的制作方法
本发明属于dna提取技术领域,涉及一种混合精斑提取工艺。
背景技术:
强奸案中的女性阴道或内裤、床单上遗留的精斑是最常见的混合检材,经过消化女性成分,可得到单一的男性分型。目前,常应用chelex-100法获得精子dna,但操作复杂,耗时长,效率低,且dna提取量少,不利于案件的快速侦破,因此,有大量研究尝试对现有提取方法进行改进。
赵铁军(赵铁军.混合精斑dna三种提取方法的比较[j].法医学杂志,2004,020(004):237-237,239.)对chelex-100法进行改进,提出chelex-100二次处理法和chelex-100+有机法,chelex-100二次处理法为在chelex-100法基础上增加一次chelex-100消化过程;chelex-100+有机法为使用酚、氯仿和异戊醇混合液对chelex-100法获得的上清液进行抽提,再使用冰乙醇氯化钠溶液进行处理。上述两种方法均能提高dna的提取量和纯度,但仍存在操作复杂,耗时长以及效率低的问题。
李红霞(李红霞,陈晓晖.精斑检材的3种提取方法比较[j].中国法医学杂志,2007,22(005):323-324.)等对chelex-100法进行优化,使用磁珠法对chelex-100法获得的上清液进行抽提,能够显著提高dna的提取量并缩短操作时间,但操作复杂,且实验人员水平和环境变化都将影响分离效果,不利于推广使用。
综上所述,提供一种操作简单、耗时短且成本低的混合精斑提取工艺,对于法医学技术领域具有重要意义。
技术实现要素:
针对现有技术的不足和实际需求,本发明提供一种混合精斑提取工艺,所述混合精斑提取工艺能够高效分离检材中的女性成分和男性成分,获得高纯度的男性dna,且能在全自动移液工作站中自动化进行并可同时处理多个检材,操作简单,耗时短,效率高。
为达上述目的,本发明采用以下技术方案:
本发明提供一种混合精斑提取工艺,所述混合精斑提取工艺包括:
对检材进行一次裂解,收集一次沉淀,对一次沉淀进行二次裂解处理,收集二次沉淀,对二次沉淀进行三次裂解,收集上清液,获得含有男性dna的溶液。
本发明的混合精斑提取工艺中,首先对检材进行两次裂解消化女性成分,得到仅含有男性细胞的检材,能够缩短裂解处理周期并高效消化女性成分,避免残留的女性成分对后续分析男性dna的影响。
优选地,所述混合精斑提取工艺在全自动移液工作站中进行。
本发明中,在全自动移液工作站基础上开发混合精斑提取工艺,从而实现在全自动移液工作站中自动化进行混合精斑提取,可同时处理多个检材,降低了操作难度,缩短了提取时间,提高了处理效率以及检出纯目标男性的成功率,有利于快速侦破案件。
优选地,所述混合精斑提取工艺还包括分别对一次沉淀和二次沉淀进行清洗的步骤。
优选地,所述清洗的清洗液包括tris-cl、氯化钠和乙二胺四乙酸。
优选地,所述tris-cl在所述清洗液中的浓度为90~110mm,包括但不限于91mm、92mm、93mm、94mm、100mm、102mm、104mm、106mm或108mm。
优选地,所述氯化钠在所述清洗液中的浓度为18~22mm,包括但不限于18.2mm、18.5mm、19mm、19.5mm、20mm、21mm、21.2mm、21.4mm、21.6mm或21.8mm。
优选地,所述乙二胺四乙酸在所述清洗液中的浓度为9~11mm,包括但不限于9.2mm、9.4mm、9.6mm、10mm、10.2mm、10.4mm、10.6mm或10.8mm。
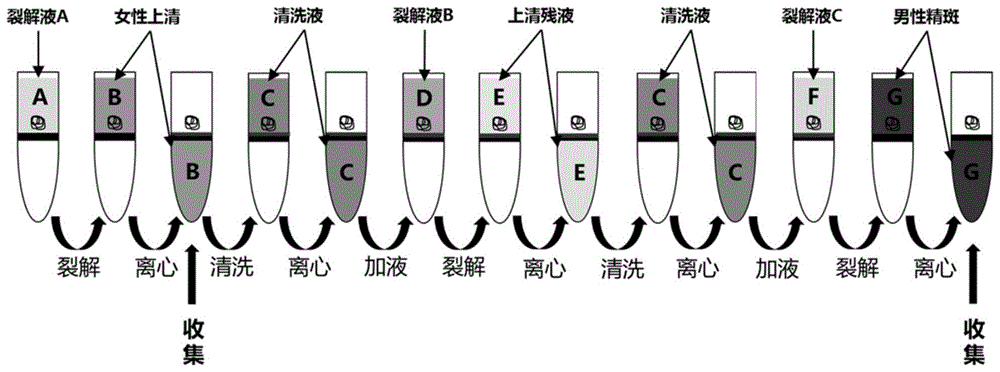
优选地,所述混合精斑提取工艺的提取流程如图1所示,包括以下步骤:
(1)将检材与包括tris-cl、氯化钠和十二烷基硫酸钠(sds)的裂解液混合,离心,收集沉淀;
(2)将步骤(1)得到的沉淀与所述清洗液混合,离心,收集沉淀;
(3)将步骤(2)得到的沉淀与包括tris-cl、氯化钠、乙二胺四乙酸(edta)、十二烷基硫酸钠、triton-x100、脱氧胆酸钠(deoxycholate)、氯化镁和氯化钙的裂解液混合,离心,收集沉淀;
(4)将步骤(3)得到的沉淀与所述清洗液混合,离心,收集沉淀;
(5)将步骤(4)得到的沉淀与包括tris-cl、氯化钠、十二烷基硫酸钠、盐酸胍、二硫苏糖醇和柠檬酸钠的裂解液混合,离心,收集上清液,获得含有男性dna的溶液。
本发明中,首先对检材进行两次裂解处理,彻底消化分离女性成分,随后继续对含有男性精子细胞的检材进行裂解,获得含有男性dna的溶液,既能缩短消化分离女性成分的周期,又能提高男性dna溶液的纯度。
优选地,步骤(1)所述tris-cl在所述裂解液中的浓度为90~110mm,包括但不限于91mm、92mm、93mm、94mm、100mm、102mm、104mm、106mm或108mm。
优选地,步骤(1)所述氯化钠在所述裂解液中的浓度为9~11mm,包括但不限于9.2mm、9.4mm、9.6mm、10mm、10.2mm、10.4mm、10.6mm或10.8mm。
优选地,步骤(1)所述十二烷基硫酸钠在所述裂解液中的质量百分比为1%~3%,包括但不限于1.2%、1.4%、1.6%、2%、2.2%、2.4%、2.6%或2.8%。
优选地,步骤(1)所述混合的温度为50~60℃,包括但不限于51℃、52℃、53℃、54℃、55℃、56℃、58℃或59℃。
优选地,步骤(1)所述混合的时间为20~40min,包括但不限于21min、22min、23min、25min、26min、28min或29min。
优选地,步骤(3)所述tris-cl在所述裂解液中的浓度为90~110mm,包括但不限于91mm、92mm、93mm、94mm、100mm、102mm、104mm、106mm或108mm。
优选地,步骤(3)所述氯化钠在所述裂解液中的浓度为18~22mm,包括但不限于18.2mm、18.5mm、19mm、19.5mm、20mm、21mm、21.2mm、21.4mm、21.6mm或21.8mm。
优选地,步骤(3)所述乙二胺四乙酸在所述裂解液中的浓度为9~11mm,包括但不限于9.2mm、9.4mm、9.6mm、10mm、10.2mm、10.4mm、10.6mm或10.8mm。
优选地,步骤(3)所述十二烷基硫酸钠在所述裂解液中的质量百分比为0.5%~1.5%,包括但不限于0.6%、0.7%、0.8%、1%、1.2%、1.3%或1.4%。
优选地,步骤(3)所述triton-x100在所述裂解液中的质量百分比为0.25%~0.75%,包括但不限于0.28%、0.3%、0.4%、0.5%、0.55%、0.6%、0.7%、0.72%或0.74%。
优选地,步骤(3)所述脱氧胆酸钠在所述裂解液中的质量百分比为0.25%~0.75%,包括但不限于0.28%、0.3%、0.4%、0.5%、0.55%、0.6%、0.7%、0.72%或0.74%。
优选地,步骤(3)所述氯化镁在所述裂解液中的浓度为18~22mm,包括但不限于18.2mm、18.5mm、19mm、19.5mm、20mm、21mm、21.2mm、21.4mm、21.6mm或21.8mm。
优选地,步骤(3)所述氯化钙在所述裂解液中的浓度为9~11mm,包括但不限于9.2mm、9.4mm、9.6mm、10mm、10.2mm、10.4mm、10.6mm或10.8mm。
优选地,步骤(3)所述混合的温度为50~60℃,包括但不限于51℃、52℃、53℃、54℃、55℃、56℃、58℃或59℃。
优选地,步骤(3)所述混合的时间为20~40min,包括但不限于21min、22min、23min、25min、26min、28min或29min。
优选地,步骤(5)所述tris-cl在所述裂解液中的浓度为90~110mm,包括但不限于91mm、92mm、93mm、94mm、100mm、102mm、104mm、106mm或108mm。
优选地,步骤(5)所述氯化钠在所述裂解液中的浓度为90~110mm,包括但不限于91mm、92mm、93mm、94mm、100mm、102mm、104mm、106mm或108mm。
优选地,步骤(5)所述十二烷基硫酸钠在所述裂解液中的质量百分比为0.5%~1.5%,包括但不限于0.6%、0.7%、0.8%、1%、1.2%、1.3%或1.4%。
优选地,步骤(5)所述盐酸胍在所述裂解液中的浓度为2~6mm,包括但不限于2.2mm、2.4mm、2.6mm、2.8mm、3mm、3.2mm、3.4mm、3.6mm或3.8mm。
优选地,步骤(5)所述二硫苏糖醇在所述裂解液中的浓度为3~7mm,包括但不限于3.1mm、3.2mm、3.6mm、3.8mm、4mm、5mm、6mm、6.2mm、6.4mm、6.6mm、6.8mm。
优选地,步骤(5)所述柠檬酸钠在所述裂解液中的浓度为45~55mm,包括但不限于46mm、48mm、49mm、50mm、52mm、53mm或54mm。
优选地,步骤(5)所述混合的温度为50~60℃,包括但不限于51℃、52℃、53℃、54℃、55℃、56℃、58℃或59℃。
优选地,步骤(5)所述混合的时间为20~40min,包括但不限于21min、22min、23min、25min、30min、36min、38min或39min。
优选地,所述混合精斑提取工艺还包括纯化dna的步骤。
优选地,所述纯化包括使用磁珠吸附dna,并进行清洗和洗脱,得到纯化的dna。
优选地,所述吸附的结合液包括异丙醇。
优选地,所述异丙醇的体积分数为80%~90%,包括但不限于81%、82%、83%、85%、86%、88%或89%。
优选地,所述洗脱的洗脱液包括tris-cl、氯化钠和乙二胺四乙酸。
作为优选的技术方案,所述混合精斑提取工艺包括以下步骤:
(1)在全自动移液工作站中,移液泵将包括tris-cl90~110mm、氯化钠9~11mm和十二烷基硫酸钠1%~3%的裂解液加入到检材中混合,50~60℃孵育20~40min,机械夹手将混合液移至离心机进行离心,收集沉淀;
(2)移液泵将步骤(1)得到沉淀与包括tris-cl90~110mm、氯化钠18~22mm和乙二胺四乙酸9~11mm的清洗液混合,机械夹手将混合液移至离心机进行离心,收集沉淀;
(3)移液泵将步骤(2)得到沉淀与包括tris-cl90~110mm、氯化钠18~22mm、乙二胺四乙酸9~11mm、十二烷基硫酸钠0.5%~1.5%、triton-x1000.25%~0.75%、脱氧胆酸钠0.25%~0.75%、氯化镁18~22mm和氯化钙9~11mm的裂解液混合,50~60℃孵育20~40min,机械夹手将混合液移至离心机进行离心,收集沉淀;
(4)移液泵将步骤(3)得到沉淀与包括tris-cl90~110mm、氯化钠18~22mm和乙二胺四乙酸9~11mm的清洗液混合,机械夹手将混合液移至离心机进行离心,收集沉淀;
(5)移液泵将步骤(4)得到沉淀与包括tris-cl90~110mm、氯化钠90~110mm、十二烷基硫酸钠0.5%~1.5%、盐酸胍2~6mm、二硫苏糖醇3~7mm和柠檬酸钠45~55mm的裂解液混合,50~60℃孵育20~40min,机械夹手将混合液移至离心机进行离心,收集上清液,获得含有男性dna的溶液;
(6)移液泵将步骤(5)得到的含有男性dna的溶液和体积分数为80%~90%的异丙醇溶液转移至结合板,机械夹手将结合板转移至磁吸板位进行磁珠吸附,随后移液泵将结合板中的溶液吸出并弃掉;
(7)移液泵将包括tris-cl、nacl、盐酸胍、异丙醇和乙醇的清洗液加入步骤(6)吸附后的结合板中进行清洗,随后进行磁珠吸附并弃掉清洗液;
(8)移液泵将乙醇加入步骤(7)吸附后的结合板中进行清洗,随后进行磁珠吸附并弃掉清洗液;
(9)移液泵将包括tris-cl、氯化钠和乙二胺四乙酸的洗脱液加入步骤(8)吸附后的结合板中进行洗脱,收集洗脱液,得到纯化的男性dna。
与现有技术相比,本发明具有以下有益效果:
(1)本发明的混合精斑提取工艺,首先对检材进行两次裂解消化女性成分,能够缩短裂解处理周期并高效消化女性成分,避免残留的女性成分对后续分析男性dna的影响;
(2)本发明的混合精斑提取工艺,能够实现在全自动移液工作站中自动化进行混合精斑提取,且可同时处理多个检材(1~24个),降低了操作难度,缩短了提取时间(缩短至3h以内),提高了处理效率,有利于快速侦破案件。
附图说明
图1为混合精斑提取工艺流程图;
图2为全自动移液工作站内部布局图,其中1为第一备用板位,2为振荡孵育器,3为移液泵,4为第一液槽位,5为第二液槽位,6为第一吸头位,7为第二吸头位,8为第二备用板位,9为磁吸板位,10为废弃物落料区,11为离心机,12为第一恒温孵育器,13为第二恒温孵育器,14为机械夹手,15为样本板分离区;
图3为耗材摆放示意图,其中16为第一液槽,17为第二液槽,18为1000μl枪头盒,19为50μl枪头盒,20为第一下层板,21为第二下层板,22为产物板,23为样本板,24为配平板,25为结合板;
图4为实施例1中提取的男性dna的str分型结果图;
图5为实施例2中提取的男性dna的str分型结果图;
图6为实施例3中提取的男性dna的str分型结果图;
图7为实施例4中提取的男性dna的str分型结果图;
图8为实施例5中提取的男性dna的str分型结果图;
图9为对比例1中提取的男性dna的str分型结果图;
图10为对比例2中提取的男性dna的str分型结果图。
具体实施方式
为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。
本发明实施例中,第一清洗液含有100mmtris-cl(ph7.5)、20mmnacl和10mmedta;裂解液c含有100mmtris-cl(ph7.5)、100mmnacl、1.0%sds、4m盐酸胍、5mmdtt和50mm柠檬酸钠(ph6.5);结合液为体积分数为80%的异丙醇;第二清洗液含有100mmtris-cl(ph7.5)、100mmnacl、5mmedta、1m盐酸胍、10%异丙醇和15%乙醇;第三清洗液为体积分数为75%乙醇;洗脱液含有10mmtris-cl(ph7.5)、10mmnacl和1mmedta。
实施例1
本实施例提供一种混合精斑提取工艺,所述提取工艺中全自动移液工作站(x-pure96plus硅珠/磁珠一体式dna提取定量工作站)内部布局如图2所示,耗材摆放示意图如图3所示,裂解液a含有100mmtris-cl(ph7.5)、10mmnacl和2.0%sds;裂解液b含有100mmtris-cl(ph8.0)、20mmnacl、10mmedta、1.0%sds、0.5%triton-x100、0.5%deoxycholate、20mmmgcl2和10mmcacl2,所述提取工艺包括以下步骤:
(1)按图3摆放相应试剂和耗材;
(2)将检材(阴棉)放置在样本板23的上层板内,并将样本板23放置在全自动移液工作站;
(3)移液泵3从第一液槽16种吸取裂解液a至样本板23的上层板中,56℃恒温孵育30min;
(4)孵育结束后,机械夹手14将样本板23和配平板24同时转移至离心机11进行固液分离;
(5)机械夹手14将第一下层板20夹取至第一恒温孵育器12;
(6)机械夹手14将样本板23从离心机11取出至样本板分离区15进行上下层板分离,机械夹手14将上层板转移至第一下层板20;
(7)移液泵3从第一液槽16吸取第一清洗液至样本板23的上层板中;
(8)机械夹手14将样本板23转移至振荡孵育器2中进行振荡清洗;
(9)清洗结束后机械夹手14将样本板23从振荡孵育器2转移离心机11进行固液分离;
(10)离心同时机械夹手14将样本板23的原下层板从样本板分离区15转移至第一恒温孵育器12,移液泵3将其中的液体(女性上清)转移至结合板25(a1-h2位置)待用;
(11)离心结束后,机械夹手14取出样本板23至样本板分离区15分离上下层板,机械夹手14将上层板转移至样本板23的原下层板(第一恒温孵育器12位置);
(12)移液泵3从第一液槽16吸取裂解液b至样本板23的上层板,56℃恒温孵育30min;
(13)孵育同时移液泵3将第一下层板20的清洗液废液吸取至废弃物落料区10进行丢弃;
(14)孵育结束后,机械夹手14将样本板23从第一恒温孵育器12转移离心机11进行固液分离;
(15)离心同时机械夹手14将第一下层板20从样本板分离区15转移至第一恒温孵育器12;
(16)离心结束后机械夹手14将样本板23从离心机11转移至样本板分离区15进行上下层板分离,机械夹手14将上层板转移至第一下层板20;
(17)移液泵3从第一液槽16吸取第一清洗液至样本板23的上层板中;
(18)机械夹手14将样本板23转移至振荡孵育器2中进行振荡清洗;
(19)清洗结束后机械夹手14将样本板23从振荡孵育器2转移离心机11进行固液分离;
(20)离心同时机械夹手14将样本板23的原下层板中清洗液废液吸取至废弃物落料区10进行丢弃;
(21)机械夹手14将样本板23的原下层板从样本板分离区15转移至第一备用板位1,将第二下层板21从第二备用板位8转移至第一恒温孵育器12;
(22)离心结束后机械夹手14将样本板23从离心机11取出至样本板分离区15,同时把上层板转移至第二下层板21;
(23)机械夹手14将第一下层板20从样本板分离区15转移至第二备用板位8;
(24)移液泵3从第二液槽17吸取裂解液c至样本板23的上层板中,56℃恒温孵育30min;
(25)孵育同时将样本板23的原下层板转移至第二备用板位8;
(26)孵育结束后,机械夹手14将样本板23从第一恒温孵育器12转移至离心机11进行固液分离;
(27)离心同时移液泵3从第二液槽17吸取结合液至结合板25(a1-h4)中;
(28)离心结束后机械夹手14将样本板23从离心机11转移至样本板分离区15进行上下层板分离,机械夹手14将上层板转移至第一下层板20(第二备用板位8);
(29)移液泵3将下层板2液体(男性沉淀)转移至结合板25(a3-h4)中;
(30)机械夹手14将结合板25转移至振荡孵育器2进行常温振荡结合10min;
(31)结合结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(32)吸附结束后移液泵3将结合板25中废液吸走并从废弃物落料口排弃;
(33)移液泵3从第二液槽17中吸取第二清洗液至结合板25(a1-h4);
(34)机械夹手14将结合板25转移至振荡孵育器2进行振荡清洗;
(35)清洗结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(36)吸附结束后移液泵3将结合板25中废液吸走并从废弃物落料口排弃;
(37)移液泵3从第二液槽17中吸取第三清洗液至结合板25(a1-h4);
(38)机械夹手14将结合板25转移至振荡孵育器2进行振荡清洗;
(39)清洗结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(40)吸附结束后移液泵3将结合板25中废液吸走并从废弃物落料口排弃;
(41)机械夹手14将结合板25从磁吸板位9转移至振荡孵育器2进行振荡加热烘干;
(42)烘干后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9;
(43)移液泵3从第二液槽17吸取洗脱液至结合板25(a1-h4)中;
(44)机械夹手14将结合板25从磁吸板位9转移至振荡孵育器2进行振荡加热洗脱;
(45)洗脱结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(46)吸附结束后移液泵3将结合板25中液体吸取按顺序转移至产物板22中,得到纯化的男性dna。
实施例2
与实施例1相比,区别仅在于所述裂解液a含有90mmtris-cl(ph7.5)、11mmnacl和1%sds;所述裂解液b含有110mmtris-cl(ph8.0)、18mmnacl、9mmedta、0.5%sds、0.75%triton-x100、0.25%deoxycholate、22mmmgcl2和11mmcacl2,其它与实施例1相同。
实施例3
与实施例1相比,区别仅在于所述裂解液a含有110mmtris-cl(ph7.5)、9mmnacl和3%sds;所述裂解液b含有90mmtris-cl(ph8.0)、22mmnacl、11mmedta、1.5%sds、0.25%triton-x100、0.75%deoxycholate、18mmmgcl2和9mmcacl2,其它与实施例1相同。
实施例4
为证明本发明混合精斑提取工艺的普适性,与实施例1相比,区别仅在于检材来源不同受害人,其它与实施例1相同
实施例5
为证明本发明混合精斑提取工艺的普适性,与实施例1相比,区别仅在于检材来源不同受害人(与实施例4检材来源亦不同),其它与实施例与1相同。
对比例1
本对比例提供一种混合精斑提取工艺,与实施例4相比,区别仅在于所述裂解液a含有50mmtris-cl(ph7.5)、10mmnacl和1%sds,并省略使用裂解液b进行裂解的步骤,所述提取工艺包括以下步骤:
(1)按图3摆放相应试剂和耗材;
(2)将检材放置在样本板23的上层板内,并将样本板23放置在全自动移液工作站;
(3)移液泵3从第一液槽16种吸取裂解液a至样本板23的上层板中,56℃恒温孵育30min;
(4)孵育结束后,机械夹手14将样本板23和配平板24同时转移至离心机11进行固液分离;
(5)机械夹手14将第一下层板20夹取至第一恒温孵育器12;
(6)机械夹手14将样本板23从离心机11取出至样本板分离区15进行上下层板分离,机械夹手14将上层板转移至第一下层板20;
(7)移液泵3从第一液槽16吸取第一清洗液至样本板23的上层板中;
(8)机械夹手14将样本板23转移至振荡孵育器2中进行振荡清洗;
(9)清洗结束后机械夹手14将样本板23从振荡孵育器2转移离心机11进行固液分离;
(10)离心同时机械夹手14将样本板23的原下层板从样本板分离区15转移至第一恒温孵育器12,移液泵3将其中的液体(女性上清)转移至结合板25(a1-h2位置)待用;
(11)离心结束后,机械夹手14取出样本板23至样本板分离区15分离上下层板,机械夹手14将上层板转移至样本板23的原下层板(第一恒温孵育器12位置);
(12)移液泵3从第二液槽17吸取裂解液c至样本板23的上层板中,56℃恒温孵育30min;
(13)孵育同时将样本板23的原下层板转移至第二备用板位8;
(14)孵育结束后,机械夹手14将样本板23从第一恒温孵育器12转移至离心机11进行固液分离;
(15)离心同时移液泵3从第二液槽17吸取结合液至结合板25(a1-h4)中;
(16)离心结束后机械夹手14将样本板23从离心机11转移至样本板分离区15进行上下层板分离,机械夹手14将上层板转移至第一下层板20(第二备用板位8);
(17)移液泵3将第二下层板21液体(男性沉淀)转移至结合板25(a3-h4)中;
(18)机械夹手14将结合板25转移至振荡孵育器2进行常温振荡结合10min;
(19)结合结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(20)吸附结束后移液泵3将结合板25中废液吸走并从废弃物落料口排弃;
(21)移液泵3从第二液槽17中吸取第二清洗液至结合板25(a1-h4);
(22)机械夹手14将结合板25转移至振荡孵育器2进行振荡清洗;
(23)清洗结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(24)吸附结束后移液泵3将结合板25中废液吸走并从废弃物落料口排弃;
(25)移液泵3从第二液槽17中吸取第三清洗液至结合板25(a1-h4);
(26)机械夹手14将结合板25转移至振荡孵育器2进行振荡清洗;
(27)清洗结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(28)吸附结束后移液泵3将结合板25中废液吸走并从废弃物落料口排弃;
(29)机械夹手14将结合板25从磁吸板位9转移至振荡孵育器2进行振荡加热烘干;
(30)烘干后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9;
(30)移液泵3从第二液槽17吸取洗脱液至结合板25(a1-h4)中;
(32)机械夹手14将结合板25从磁吸板位9转移至振荡孵育器2进行振荡加热洗脱;
(33)洗脱结束后机械夹手14将结合板25从振荡孵育器2转移至磁吸板位9进行磁珠吸附;
(34)吸附结束后移液泵3将结合板25中液体吸取按顺序转移至产物板22中,得到纯化的男性dna。
对比例2
本对比例提供一种现有技术中常用精斑提取工艺,所述工艺包括以下步骤:
(1)将检材(与实施例5检材来源相同)剪取至1.5ml离心管;
(2)向离心管中加入900μl裂解液a和100μl蛋白酶k(10mg/ml),于56℃孵育4h;
(3)10000rpm离心2min,用移液器小心移出固体样本;
(4)向固体样本中加入500μl第一清洗液,轻轻吹打数次;
(5)10000rpm离心2min,用移液器小心移除上清液体,注意留取50μl液体;
(6)重复步骤4~5;
(7)加入200~400μl裂解液a,加入终浓度为10mm的二硫苏糖醇溶液,56℃孵育30min;
(8)加入与裂解液a等体积的结合液和20μl磁珠,振荡孵育10min;
(9)将离心管置于磁力架进行磁吸,用移液器小心移走上清液;
(10)加入500μl第二清洗液,涡旋振荡清洗1min;
(11)将离心管置于磁力架进行磁吸,用移液器小心移走上清液;
(12)加入500μl第三清洗液,涡旋振荡清洗1min;
(13)将离心管置于磁力架进行磁吸,用移液器小心移走上清液;
(14)自然烘干;
(15)加入50~100μl洗脱液,65℃振荡孵育10min;
(16)将离心管置于磁力架进行磁吸,用移液器收集上清液即为提纯后精斑dna。
试验例定量检测
本试验例对实施例1-5和对比例1和2得到的男性dna进行扩增,并进行str分型检测,短片段重复序列(shorttandemrepeat,str)广泛存在于人类及哺乳动物的基因组中。对于一个特定的个体,染色体上某个特定位置的重复序列的重复次数是固定的,而对于不同的个体在同一位置处的重复次数不同,构成了人群中这些重复序列的多态性,通过对这种多态性的检测,就可以明确区分不同的个体。扩增分型结果如图4-图10所示。
由图4-图10可知,实施例1-5获得的男性dna能够扩增得到完整str分型,且没有女性分型背景的影响,说明本发明的混合精斑提取工艺能够高效提取男性dna;与实施例4相比,对比例1中省略了二次裂解的步骤,所得到的基因的分型结果出现女性分型的干扰(d6s1043(12)、d13s317(16)、d16s539(6)、csf1po(15)和vwa(19)),且男性分型部分位点丢失;与实施例5相比,对比例2为现有技术常用手动提取工艺,该工艺耗时长,男性分型部分位点丢失(d6s1043(20)、pentae(13)、csf1po(10)、vwa(17)、d12s391(18)和fga(19)),且所得分型的峰值(rfu:相对荧光强度)较低。
综上所述,本发明的混合精斑提取工艺,对检材进行两次裂解消化女性成分,能够缩短裂解处理周期并高效消化女性成分,避免残留的女性成分对后续分析男性dna的影响,同时,在全自动移液工作站基础上开发混合精斑提取工艺,可同时处理多个检材,降低了操作难度,缩短了提取时间,提高了处理效率以及检出纯目标男性的成功率,有利于快速侦破案件。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!