一种电转染永生化树突状细胞的方法与流程
1.本发明属于细胞电转化技术领域,尤其涉及一种电转染永生化树突状细胞的方法。
背景技术:
2.树突状细胞(dc)是哺乳动物免疫系统中功能最强大的抗原呈递细胞。作为免疫系统的哨兵,树突状细胞以相当低的频率存在于宿主生物和环境界面的组织中,即皮肤、粘膜和次级淋巴器官(banchereau j,steinman r m.dendritic cells and the control of immunity[j].nature,1998,392(6673):245
‑
252)。体内dc来源于造血祖细胞,如巨噬细胞/dc祖细胞(mdps),它们依次产生传统的dc前体细胞和单核细胞及其后代(geissmann f,manz m g,jung s,et al.development of monocytes,macrophages,and dendritic cells[j].science,2010,327(5966):656
‑
661.)。传统上,所有抗原提呈细胞都可以将外源性捕获的抗原作为mhc ii相关肽(对cd4+t细胞);所有抗原提呈细胞都可以将内源性抗原作为mhc i相关肽(对cd8+t细胞)。然而,树突状细胞可以完成常规呈递和交叉呈递,即将外源捕获的抗原呈递为mhc i相关肽,从而诱导更有效的cd4+和cd8+t细胞活性(dudekam,martin s,garg a d,et al.immature,semi
‑
mature,and fully mature dendritic cells:toward a dc
‑
cancer cells interface that augments anticancer immunity[j].frontiers in immunology,2013,4:438.;mempel t r,henrickson s e,von andrian u h.t
‑
cell priming by dendritic cells in lymph nodes occurs in three distinctphases[j].nature,2004,427(6970):154
‑
159.)。dc有潜力在抗肿瘤或抗病原体疫苗或作为自身免疫的调节剂领域用作治疗工具,某些时候需要对dc进行基因修饰。目前科学家们已经探索了几种将基因导入dc的策略,分为病毒和非病毒策略(humbert j m,halary f.viral and non
‑
viral methods to genetically modify dendritic cells[j].current gene therapy,2012,12(2):127
‑
136.)。与非病毒系统相比,病毒基因传递系统虽然通常更有效,但对其临床应用的安全性、生产“临床级”病毒储备和抗病毒反应的潜在增强仍是主要障碍。
[0003]
电穿孔(electroporation)是生物科学中常用的一种方法,它利用高压电击将dna、rna和蛋白质等分子导入细胞。电穿孔利用的是细胞膜充当不能传递电流(离子通道除外)的电容器这一事实,将膜置于高压电场下会导致膜暂时破裂,并形成大到足以让大分子以及小分子进入或离开细胞的孔洞,而细胞膜上的孔洞可在后续培养过程中自行恢复。核酸在体内具有已被证明的安全记录,并已用于病毒和肿瘤疫苗接种试验。临床级dna和rna可以快速且经济有效地大量生产,并且长期储存稳定。通过电穿孔进行dna或rna转染是一种可能适用于所有细胞类型的技术,与其他转染方法相比,使用非病毒载体的基因转移通常被认为是安全的,但其缺点是转染效率较低。
[0004]
电穿孔的一般步骤为将细胞与dna或rna混合后置于适当的电穿孔缓冲液中,并放入电击杯中。将电击杯连接到电源,细胞受到规定大小和持续时间的高压电脉冲。电击后
dna或rna穿过细胞膜孔洞进入细胞中,将细胞放入正常生长的培养基中,细胞膜上的孔洞可自行恢复。电穿孔设备通常使用两种不同的方法控制脉冲持续时间和电压,一种是使用电容放电系统来产生指数衰减的电流脉冲,另一种是产生真正的方波(或其近似值)。
[0005]
目前的电穿孔技术主要针对的常规细胞,对于永生化的树突状细胞并没有一种高效的电转染方法。
技术实现要素:
[0006]
有鉴于此,本发明的目的在于提供一种电转染永生化树突状细胞的方法,所述方法针对永生化树突状细胞,24h细胞存活率高,转染效率高。
[0007]
为了实现上述发明目的,本发明提供了以下技术方案:
[0008]
本发明提供了一种电转染永生化树突状细胞的方法,包括以下步骤:1)永生化树突状细胞用电转缓冲液重悬后与待转染的dna或rna混合、冰浴获得电转液;2)对所述电转液进行电击处理获得电击后的细胞,所述电击的电压为150~400v,所述电击的电极间距为2~4mm;所述电击的场强为750~1000v/cm;所述电击的时间为3~5ms;3)将所述电击后的细胞置于培养基中培养。
[0009]
优选的,所述重悬后的永生化树突状细胞的细胞密度为0.5~2
×
107cells/ml。
[0010]
优选的,所述待转染的dna为携带目标基因的dna质粒。
[0011]
优选的,所述携带目标基因的dna质粒在电转液中的浓度为10~40μg/ml。
[0012]
优选的,所述电转缓冲液选自rpmi 1640,opti
‑
mem,pbs,dmem和aimv中的一种。
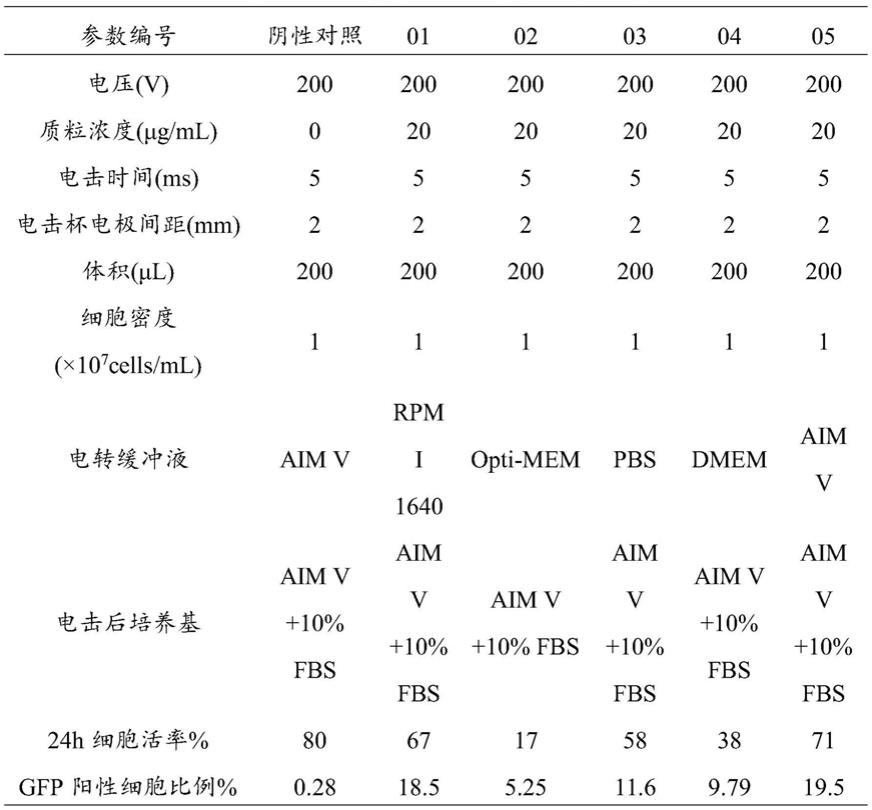
[0013]
优选的,步骤3)中所述培养基包括80%~95%体积百分含量的aim v和5%~20%体积百分含量的fbs。
[0014]
优选的,所述培养基的温度为30~40℃。
[0015]
优选的,步骤1)中所述永生化树突状细胞为对数生长期细胞。
[0016]
优选的,步骤1)中所述冰浴的时间为4~6min,所述冰浴的温度为0~10℃。
[0017]
优选的,步骤3)中所述电击后的细胞与培养基的体积比为1:5~15。
[0018]
本发明的有益效果:本发明提供的电转染永生化树突状细胞的方法,针对永生化树突状细胞,转染效率高;本发明实施例中将质粒dna通过btx电穿孔系统转入永生化dc细胞内,利用该质粒在细胞内能够表达gfp的特点,通过流式细胞术检测电穿孔后gfp阳性细胞比例评估转染效率,最高转染效率为48.4%,24h细胞存活率最高为88.5%;本发明提供的方法是针对永生化树突状细胞设计的,利用所述方法转染永生化树突状细胞,相比于转染其他细胞包括人急性t细胞白血病细胞系jurkat和外周血单个核细胞pbmc,转染效率更高。
附图说明
[0019]
图1为pmax质粒的结构图谱;
[0020]
图2为流式细胞术检测电击后24h转染效率(参数01
‑
05);
[0021]
图3为流式细胞术检测电击后24h转染效率(参数06
‑
14);
[0022]
图4为流式细胞术检测电击后24h转染效率(参数15
‑
17);
[0023]
图5为流式细胞术检测电击后24h转染效率(jurkat和pbmc)。
具体实施方式
[0024]
本发明提供了一种电转染永生化树突状细胞的方法,包括以下步骤:1)永生化树突状细胞用电转缓冲液重悬后与待转染的dna或rna混合、冰浴获得电转液;2)对所述电转液进行电击处理获得电击后的细胞,所述电击的电压为150~400v,所述电击的电极间距为2~4mm;所述电击的场强为750~1000v/cm;所述电击的时间为3~5ms;3)将所述电击后的细胞置于培养基中培养。
[0025]
在本发明中,永生化树突状细胞用电转缓冲液重悬后与待转染的dna或rna混合、冰浴获得电转液。
[0026]
本发明对所述永生化树突状细胞的来源和制备方法没有特殊限定,细胞为能够永生的树突状细胞即可;在本发明具体实施过程中,所述永生化树突状细胞的来源和制备方法参见中国专利cn201911397010.2记载。
[0027]
在本发明中,所述永生化树突状细胞优选为对数生长期细胞;本发明优选的将所述永生化树突状细胞进行培养至对数生长期,本发明对所述培养的培养基和方法没有特殊限定,采用本领域常规的细胞培养基和细胞培养方法即可。在本发明具体实施过程中,所述培养基包括90%体积的aim v培养基和10%体积的fbs,所述培养在5%co2,37℃恒温培养箱中进行。本发明在电转染细胞前24h,使用新鲜培养基调整细胞密度。在本发明中,所述对数生长期的永生化树突状细胞的密度优选为0.5~1.5
×
106cells/ml,更优选为1
×
106cells/ml。本发明在将所述永生化树突状细胞培养至对数生长期后,收集对数生长期的永生化树突状细胞;在本发明中,所述收集优选的采用离心的方式,所述离心的离心力优选为200~400g,更优选为300g,所述离心的时间优选为4~6min,更优选为5min。本发明在所述离心后,优选的用电转缓冲液清洗细胞,本发明对所述清洗的方法没有特殊限定,采用本领域常规细胞清洗方法即可。
[0028]
在本发明中,所述电转缓冲液优选的选自rpmi 1640,opti
‑
mem,pbs,dmem和aim v中的一种,更优选为aim v或rpmi 1640。本发明用所述电转缓冲液重悬清洗后的对数生长期的永生化树突状细胞;所述重悬后的永生化树突状细胞的细胞密度优选为0.5~2
×
107cells/ml,更优选为1
×
107cells/ml。
[0029]
本发明对所述待转染的dna或rna没有特殊限定,任意的dna和rna均可。在本发明具体实施过程中,所述待转染的dna优选为携带目标基因的dna质粒;本发明对所述质粒以及目标基因的种类没有限定,任意质粒和目标基因均可。当所述待转染的dna为携带目标基因的dna质粒时,所述携带目标基因的dna质粒在电转液中的终浓度优选为10~40μg/ml,更优选为15~30μg/ml,最优选为20μg/ml。
[0030]
本发明在将重悬后的永生化树突状细胞与待转染的dna或rna混合、冰浴获得电转液。在本发明中,所述冰浴的时间优选为4~6min,更优选为5min,所述冰浴的温度优选为0~10℃,更优选为4℃;在本发明具体实施过程中,所述冰浴优选的在4℃冰箱中进行。
[0031]
本发明在获得所述电转液后,对所述电转液进行电击处理获得电击后的细胞。在本发明中,所述电击优选的在电击杯中进行,所述电击杯优选的预冷后使用,所述预冷优选的在0~10℃进行,更优选的在4℃进行,在本发明具体实施过程中,所述预冷在4℃冰箱中进行。在本发明中,优选的将所述电转液转移到电击杯中进行电击处理;每一个电转杯中转入电转液的体积优选为100~400μl,更优选为200μl。在本发明中,将所述电转杯插入到电
穿孔仪槽上后,调整电击参数;所述电击参数如下:所述电击的电压为150~400v,所述电击的电极间距为2~4mm;所述电击的场强为750~1000v/cm,优选为875v/cm;所述电击的时间为3~5ms,优选为5ms。
[0032]
本发明在所述电击结束后,将所述电击后的细胞置于培养基中培养。在本发明中,所述培养基包括80%~95%体积百分含量的aim v和5%~20%体积百分含量的fbs,优选的包括88%~92%体积百分含量的aim v和8%~12%体积百分含量的fbs,最优选为90%体积百分含量的aim v和10%体积百分含量的fbs。在本发明中,所述培养基优选为预热后的培养基,所述培养基的温度优选为30~40℃,更优选为37℃。在本发明中,电击后的细胞与培养基的体积比优选为1:5~15,更优选为1:8~10,最优选为1:9。在本发明具体实施过程中,优选的将所述电击后的细胞立即转入培养基中进行培养。在本发明中,所述培养的温度优选为37℃,所述培养的co2体积浓度优选为5%;在本发明中,所述培养优选的在细胞培养箱中进行。
[0033]
在本发明具体实施过程中,为了检测电转染效率,采用包括gfp基因的质粒电转染所述永生化树突状细胞,然后通过流式细胞术检测gfp阳性细胞的比例即为电转染效率。在本发明中,在所述电击后的细胞培养24h后,收集、洗涤、重悬细胞,用流式细胞术检测gfp阳性细胞比例。在本发明中,所述收集优选的采用离心的方式,所述离心的离心力优选为200~400g,更优选为300g,所述离心的时间优选为4~6min,更优选为5min。本发明在所述离心后,优选的用pbs洗涤细胞,在所述洗涤后,再次用pbs重悬。本发明对所述流式细胞术检测的具体参数没有特殊限定,采用本领域常规的流式细胞术检测参数即可。
[0034]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0035]
实施例1
[0036]
生物材料:
[0037]
dna质粒:插入gfp基因的pmax质粒,结构图谱如图1所示,使用endofree plasmid maxi kit提取。质粒原始浓度:0.5~2mg/ml。
[0038]
培养基:
[0039]
rpmi 1640(rpmi 1640medium)
[0040]
opti
‑
mem(opti
‑
mem
tm i reduced serum medium)
[0041]
pbs(phosphate
‑
buffered saline)
[0042]
dmem(dulbecco's modified eagle's medium)
[0043]
aim v(aim v
tm medium)
[0044]
上述培养基的厂家是赛默飞thermofisher。
[0045]
永生化树突状细胞制备方法参见中国专利cn201911397010.2记载。
[0046]
检测不同电转缓冲液对电转染效率的影响,具体参数设置见表1。电击后将细胞置于37℃5%co2培养箱中培养24h,使用流式细胞术检测gfp阳性细胞比例,结果如图2所示:使用aim v和rpmi 1640作为电转缓冲液时,gfp阳性细胞比例最高,分别为19.5%和18.5%;而使用pbs和dmem作为电转缓冲液时,gfp阳性细胞比例仅为11.6%和9.79%,电转染效率降低50%。opti
‑
mem作为电转缓冲液时,电转染效率仅为5.25%。从电击后培养24h细胞活率来看,使用aim v和rpmi 1640作为电转缓冲液时细胞活率最高,超过60%。综合以
上结果可以看出,aim v和rpmi 1640作为电转缓冲液对细胞转染更有利。
[0047]
表1电击参数对电转染效率的影响
[0048][0049]
使用aim v培养基作为电转缓冲液,检测不同的电击电压、电击时间和电击后培养基的电转染效率,具体参数设置见表2。电击后将细胞置于37℃5%co2培养箱中培养24h,使用流式细胞术检测gfp阳性细胞比例,结果见图3;使用不同的电击参数电击细胞后,gfp阳性细胞比例显著增加,均大于30%。此外可以看出,相同电击电压和电击时间下,电击后培养基中血清浓度越高,gfp阳性细胞比例越高,电转染效率越高。除个别组细胞活率较低外(<60%),大部分参数组细胞活率均超过70%。
[0050]
表2电击参数设置
[0051]
[0052][0053]
进一步的,测定了电击细胞质粒混合物体积和电击杯电极间距对电转染效率的影响,具体参数设置见表3。电击后将细胞置于37℃5%co2培养箱中培养24h,使用流式细胞术检测gfp阳性细胞比例。增加电击杯电极间距的同时需要增加电击电压,以保证电场强度不变。结果如图4所示,可以看出,各组细胞活率和gfp阳性细胞比例变化不大。说明在电场强度相同的条件下,电击杯电极间距或细胞质粒混合物体积对转染效率的影响不显著。
[0054]
表3电击参数
[0055]
[0056][0057]
综上所述,针对永生化树突状细胞最优的电转染参数如表3中的15号参数记载:
[0058]
电压(v)
ꢀꢀ
175
[0059]
质粒浓度
ꢀꢀ
20μg/ml
[0060]
电击时间
ꢀꢀ
5ms
[0061]
电击杯电极间距
ꢀꢀ
2mm
[0062]
体积
ꢀꢀ
200μl
[0063]
细胞密度
ꢀꢀ1×
107cells/ml
[0064]
电转缓冲液
ꢀꢀ
aim v
[0065]
电击后培养基 aim v+10%fbs。
[0066]
对比例1
[0067]
jurkat和pbmc电转染实验
[0068]
jurkat是一种人急性t细胞白血病细胞系,可无限增殖,但细胞略小于永生化树突状细胞。外周血单个核细胞(peripheral blood mononuclear cell,pbmc)是外周血中具有单个核的细胞,包括淋巴细胞和单核细胞,一般仅可有限扩增数代,且细胞较小。使用实施例1中获得的最优电击参数对这两种细胞进行电转并检测电转染效率,结果如表4和图5所示。电击24h后,jurkat和pbmc细胞活率较高,但gfp阳性细胞比例较低,分别为8.64%和1.35%。说明实施例1中提供的最优电击参数适用于永生化树突状细胞,并不能在jurkat和pbmc细胞膜表面形成孔洞,不能有效地将dna转染至jurkat或pbmc细胞内。这也从侧面说明本发明中所述的永生化树突状细胞与其他细胞的细胞学特性存在差异,最优的电转染参数完全不同。
[0069]
表4 jurkat和pbmc电击参数及结果
[0070][0071]
由上述实施例可知,本发明提供的电转染永生化树突状细胞的方法,针对永生化树突状细胞,转染效率高。
[0072]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1