一种全身性EEPD1敲除的动物模型构建方法及其应用与流程
本发明涉及生物医药
技术领域:
,尤其涉及一种全身性eepd1敲除的动物模型构建方法及其应用。
背景技术:
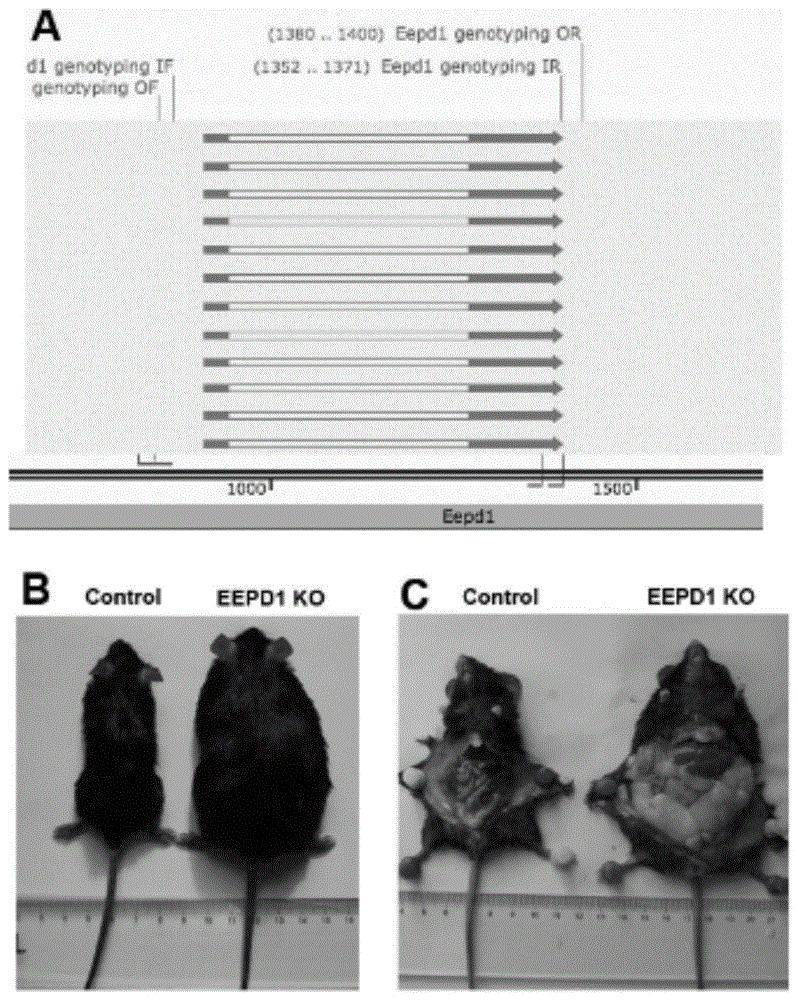
:crispr-cas9(clusteredregularlyinterspacedshortpalindromicrepeatscas9)即成簇规律间隔的短回文重复序列与cas9蛋白组成的系统是细菌抵御外来病毒侵染的免疫系统。现代生物学已将crispr-cas9系统广泛应用在基因编辑领域,是继锌指核酸酶(zinc-fingernuclease,zfn)、转录激活样效应物核酸酶(transcriptionactivator-likeeffectornucleases,talens)等技术后最为重要的基因改造技术,可以在基因敲入、基因敲除、基因激活、基因沉默、表观遗传修饰及3d基因结构改变中进行广泛的应用,具有设计灵活、成本低、操作简单、准确性高、可多位点同时打靶等优势,因而成为了目前最受欢迎的基因编辑工具。crispr-cas9基因编辑系统是包含单链rna的sgrna用与sgrna的5'端互补的序列将cas9蛋白引导至目标dna位点。cas9nuclease对目标dna序列的pam依赖性识别并在pam区上游3bp的特定位点启动dna切割。cas9nuclease生成的双链断裂可通过非同源末端连接(non-homologousendjoining,nhej)或同源重组定向修复(homologydirectedrepair,hdr)修复。随着细胞复制分裂并修复切口,在修复的过程可能产生错配,移码突变、缺失突变,最后筛选出错配纯合子达到基因编辑的目的。eepd1是dna损伤修复的重要调控因子,当dna复制叉停滞时,eepd1在停滞的dna复制叉处,促进5’端dna末端剪切,启动了同源重组,最终重新启动dna复制和稳定。除了在复制叉阻滞时充当重要的修复工具,eepd1也在dna复制叉难以修复时,直接剪切掉阻滞的复制叉,引导细胞死亡进程。因此eepd1被认为是dna稳定性的“守门员”(gatekeeper),是同源重组的重要工作元件。已有文献报道,代谢性疾病和心血管疾病发病过程中,引起不同程度的dna损伤,导致机体失衡产生不良后果。但是eepd1作为dna稳定修复因子在代谢性疾病和心血管疾病中的作用从未见揭示。我们的前期研究结果发现,eepd1基因在肥胖小鼠模型脂肪组织低表达,在心肌梗死小鼠模型心肌组织中高表达。为了进一步证明eepd1表达水平下降对代谢性疾病或心血管疾病发生发展的影响,需要构建eepd1基因敲除小鼠,并进行代谢性疾病模型或心血管疾病模型制作,为深入研究代谢性疾病或心血管疾病发生发展提供可靠的动物模型。技术实现要素:本发明的目的是针对现有技术中的不足,提供一种全身性eepd1敲除的动物模型构建方法及其应用。为实现上述目的,本发明采取的技术方案是:本发明的第一方面是提供一种引物组,包括:如seqidno:1和seqidno:2所示的第一对引物,以及如seqidno:3和seqidno:4所示的第二对引物。seqidno:1eepd1genotypingofcttcctcgacccttaagtcctgtaseqidno:2eepd1genotypingoratgctgagggccatcttctcgseqidno:3eepd1genotypingiftaacctcccgttcttttgtgcctseqidno:4eepd1genotypingirccggacactcatgagctgag本发明的第二方面是提供一种如上所述的引物组在基因敲除中的应用。本发明的第三方面是提供一种全身性eepd1敲除的动物模型构建方法,步骤包括:s1、将sgrna植入胚胎时期的小鼠受精卵,并利用受精卵进行基因型鉴定;s2、采用如权利要求1所述的引物组进行巢式pcr扩增,经过基因型鉴定,确定全身性eepd1敲除的雄鼠;s3、将确定全身性eepd1敲除的雄鼠和野生型雌鼠进行繁育,得到的子代再次进行繁育,最终得到遗传背景完全相同的全身性eepd1敲除的雄鼠,即为eepd1ko的动物模型。优选地,所述sgrna如seqidno:5-8所示。seqidno:5sg-rna1ctctatccccagagatccctseqidno:6sg-rna2acatcctggtgaatcaggagseqidno:7sg-rna3tggtgtaggggccaccaaacseqidno:8sg-rna4agcactctcccagttccctg优选地,所述巢式pcr扩增程序包括:1stofandor30cycle2ndifandir35cycle。本发明的第四方面是提供一种采用如上所述动物模型构建方法所得的动物模型。本发明的第五方面是提供一种如上所述的动物模型在筛选治疗代谢功能障碍药物中的应用。本发明采用以上技术方案,与现有技术相比,具有如下技术效果:本发明经由crispr/cas编辑建模,能保证低脱靶率的情况,是为一种更为便捷的方式,也是国内首个全身性eepd1敲除的动物模型;经过表型验证,该模型经高脂饮食等措施处理后,均表现出代谢功能障碍的表征;建立基因型和表现型都接近代谢功能障碍的动物模型,不但可以深入了解代谢功能障碍的致病过程和机制,而且还可以帮助筛选治疗代谢功能障碍的药物,进行进一步基因治疗的相关研究。附图说明图1为全身性eepd1敲除小鼠模型的基因型鉴定及对小鼠肥胖影响;其中,图1a为全身性eepd1敲除的构建模式图;图1b和图1c为全身性eepd1敲除小鼠与对照组小鼠相比呈现明显的肥胖。图2为基因型鉴定结果,其中纯合子包括:1,2,4,5,7,8,9,21,22,24,25,27,28,29,36,39,42,44,47,48,49,52,53,54;杂合子包括:6,11,12,13,14,15,16,18,19,20,30,31,33,37,38,45,46,50,51,56,57,58,59,60,61,63,65,66;野生型包括:3,10,17,23,26,31,34,35,40,41,43,55,62,64。图3为全身性eepd1敲除(eepd1ko)的小鼠出现显著的代谢功能障碍;其中,图3a为高脂连续喂养14周,eepd1ko的小鼠体重明显高于同周龄的野生型小鼠;图3b为在高脂喂养的后期(6-14w),eepd1ko的小鼠随机血糖明显高于对照组小鼠;图3c为葡萄糖耐受实验(gtt)显示eepd1ko的小鼠对葡萄糖的代谢率下降;图3d为胰岛素耐受实验(itt)显示eepd1ko的小鼠对胰岛素的敏感性下降;图3e和图3f为小鼠体成分分析仪分析显示eepd1ko的小鼠肌肉(e)和脂肪(f)成分均较对照组小鼠显著升高。*p<0.05vs.control。图4为eepd1ko小鼠心肌梗死表型显著:采用结扎左冠状动脉前降支的方法构建野生型小鼠和eepd1ko小鼠心肌梗死模型,梗死后两周采用心超测定小鼠心功能(a),ttc染色评估小鼠心肌梗死面积(b)。与野生型小鼠相比,eepd1-/-小鼠心肌收缩功能显著恶化(左室射血分数、左室短轴收缩率、每搏输出量更低),心室重构加剧(左心室显著增大,左室收缩/舒张末期内径及容积增加)(c);ttc染色显示eepd1-/-小鼠心肌梗死面积明显大于野生型小鼠。图5为eepd1ko小鼠与野生型小鼠相比,各生理生化指标的检验结果。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。实施例1:利用crispr-cas9技术构建全身性eepd1敲除(eepd1ko)的小鼠模型共设计四条sgrna(如seqidno:5-8所示),植入胚胎时期的小鼠受精卵,并利用受精卵进行基因型鉴定。如图1a所示,设计了两对引物进行巢式pcr扩增,经过基因型鉴定,如图2所示,将确定全身性eepd1敲除的雄鼠和c57bl/6野生型雌鼠进行繁育,得到的子代再次进行繁育,最终得到的遗传背景完全相同的全身性eepd1敲除的雄鼠,以用来下述实验。实施例2:eepd1全身性敲除对小鼠肥胖的影响采用高脂饮食(60%脂肪,20%碳水化合物,20%蛋白质)喂养16周后,与野生型小鼠相比,eepd1ko小鼠出现显著的体型肥胖(如图1b所示),肝脏变大变白,脂肪(皮下和内脏)增多(如图1c所示)。实施例3:eepd1全身性敲除(eepd1ko)的小鼠出现显著的代谢功能障碍3-1.eepd1ko小鼠与其同窝出生的对照组小鼠在8周龄时采用高脂饲料喂养,期间监测小鼠血糖、体重,如图3a和图3b所示,结果显示eepd1ko小鼠体重、随机血糖明显升高。3-2.如图3c和图3d所示的葡萄糖耐受实验(gtt)和胰岛素耐受实验(itt)的结果亦显示eepd1ko的小鼠对葡萄糖、胰岛素的耐受性下降。3-3.高脂喂养12周后,如图3e和图3f所示小鼠体成分分析(ct)显示eepd1ko的小鼠脂肪(fatmass)和肌肉(leanmass)均显著增多。由此提示eepd1ko的小鼠代谢功能明显受损。实施例4:eepd1具有促进肝脏糖脂代谢的生物学功能4-1.如图4a所示,观察eepd1ko和野生型小鼠的肝脏发现eepd1ko的小鼠肝脏体积明显增大,表面灰黄色改变,提示脂肪肝的形成。随后通过苏木素&伊红(he)染色和油红染色,发现eepd1ko的小鼠肝脏出现明显的脂质空泡、脂滴沉积。显然,免疫组织化学染色证实eepd1在肝组织内被敲除。肝脏大体观,he染色及油红染色等均证实eepd1ko后肝脏出现显著脂质沉积。4-2.分别提取两组小鼠肝脏组织总蛋白进行westernblot实验,如图4b所示,发现在eepd1ko的小鼠肝脏中,eepd1几乎检测不到,间接证实全身性敲除eepd1成功。磷酸化的ire1及perk水平均明显上调,磷酸化的eif2α也相应升高,表明内质网应激相关通路被激活,而atf6通路变化不显著。进一步检测发现,eepd1ko小鼠肝脏内糖异生关键酶pepck及g6pase显著升高,提示eepd1敲除后肝脏糖异生水平增强。以上所有结果表明,eepd1具有促进肝脏糖脂代谢的生物学功能。综上所述,本发明经由crispr/cas编辑建模,能保证低脱靶率的情况,是为一种更为便捷的方式,也是国内首个全身性eepd1敲除的动物模型;经过表型验证,该模型经高脂饮食等措施处理后,均表现出代谢功能障碍的表征;建立基因型和表现型都接近代谢功能障碍的动物模型,不但可以深入了解代谢功能障碍的致病过程和机制,而且还可以帮助筛选治疗代谢功能障碍的药物,进行进一步基因治疗的相关研究。以上所述仅为本发明较佳的实施例,并非因此限制本发明的实施方式及保护范围,对于本领域技术人员而言,应当能够意识到凡运用本发明说明书及图示内容所作出的等同替换和显而易见的变化所得到的方案,均应当包含在本发明的保护范围内。序列表<110>上海市第六人民医院上海市胸科医院<120>一种全身性eepd1敲除的动物模型构建方法及其应用<141>2021-02-05<160>8<170>siposequencelisting1.0<210>1<211>24<212>dna<213>artificialsequence<400>1cttcctcgacccttaagtcctgta24<210>2<211>21<212>dna<213>artificialsequence<400>2atgctgagggccatcttctcg21<210>3<211>23<212>dna<213>artificialsequence<400>3taacctcccgttcttttgtgcct23<210>4<211>20<212>dna<213>artificialsequence<400>4ccggacactcatgagctgag20<210>5<211>20<212>dna<213>artificialsequence<400>5ctctatccccagagatccct20<210>6<211>20<212>dna<213>artificialsequence<400>6acatcctggtgaatcaggag20<210>7<211>20<212>dna<213>artificialsequence<400>7tggtgtaggggccaccaaac20<210>8<211>20<212>dna<213>artificialsequence<400>8agcactctcccagttccctg20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1