一种新冠病毒重组蛋白包涵体的复性方法与流程
本发明属于生物技术领域,具体涉及一种新冠病毒重组蛋白包涵体的复性方法。
背景技术:
冠状病毒引起的新冠肺炎引起了全球关注,病原体被鉴定为sars-cov-2,抗疫的急切形势迫切需要一种有效的预防这种病毒的疫苗。作为感染过程中最关键的步骤,sars-cov-2使用其刺突蛋白受体结合域(rbd)与宿主细胞受体血管紧张素转化酶2(ace2)结合。所以rbd蛋白成为应急疫苗、治疗性抗体的研发和临床诊断的关键靶点。
蛋白质和多肽药物是生物制药行业的支柱,目前,市场上超过200个蛋白质药物正在进行临床前和临床试验。此类蛋白质药物主要以大肠杆菌为宿主菌以“重组蛋白”的形式进行表达和生产。但是在大肠杆菌中表达的目的蛋白常常以包涵体的形式沉积于细胞内,表现为无活性的不溶性聚集物,如何对包涵体蛋白进行高效率的复性以获得活性产品是生物工程产业化经常面临的一个难题。
目前常用的包涵体蛋白复性的技术主要有:透析复性、稀释复性、人工分子伴侣、柱色谱复性以及反胶团溶解复性等。上述各复性方法多少存在着种种问题,例如:透析复性将变性蛋白放入透析袋中,通过缓慢联系的降低变性剂的浓度实现蛋白复性,虽然操作简单但是耗时长,处理体积小,无法大规模工业化应用。人工分子伴侣的复性常用hsp家族蛋白和groes/groel等,人工分子伴侣能够显著提高蛋白复性率,但同时也会显著提高生产成本。柱色谱复性以及反胶团溶解复性需要材料和设备特殊、成本较高、不适用于制药工业的大量制备等,而且操作过程相对繁琐。而稀释复性虽然操作简单,器材试剂在应用于工艺生产时呈现出较好的经济性,但是稀释复性法需要包涵体蛋白在低浓度下进行,否则会导致蛋白在复性时会聚集沉淀,会回收率降低,重新浓缩困难,也不适用于工业化的生产。
技术实现要素:
针对现有技术存在的不足,本发明提供一种重组新冠蛋白包涵体的复性方法。
为达到上述目的,本发明采用以下技术方案:
一种新冠病毒重组蛋白包涵体的复性方法,其不同之处在于,包括以下步骤:
步骤s1:将新冠病毒重组蛋白包涵体溶解得到包涵体溶解产物;
步骤s2:将所述包涵体溶解产物进行柱层析纯化,得到纯化新冠病毒重组蛋白;
步骤s3:将纯化新冠病毒重组蛋白制备成新冠病毒重组蛋白溶液,所述新冠病毒重组蛋白溶液中,蛋白质的浓度为0.6mg/ml~1.0mg/ml,含尿素的浓度为4mol/l~4.5mol/l;
步骤s4:将所述新冠病毒重组蛋白溶液依次采用第一复性液及第二复性液进行梯度稀释复性,得到新冠病毒重组蛋白复性液;
步骤s5:将所述新冠病毒重组蛋白复性液进行后处理即得复性蛋白产品;
其中,所述第一复性液包括缓冲剂、1.5mol/l~2.5mol/l的尿素、0.5mmol/l~1.5mmol/l氧化型谷光苷肽及还原剂,所述第二复性液包括缓冲剂、0.5mmol/l~1.5mmol/l氧化型谷光苷肽及还原剂。
与现有技术相比,本发明的有益效果在于:本发明将包涵蛋白先纯化后复性,同时通过复性前溶液中的蛋白浓度与尿素浓度,采用含1.5mol/l~2.5mol/l的尿素的复性液与不含尿素的复性液进行梯度稀释复性,使蛋白回收率高达70%以上,纯度高85%以上,且本方法处理的蛋白产量高,方法简便,后期易于加工,利于工业化的生产。
进一步,所述步骤s3中,含蛋白质的浓度为1.0mg/ml,含尿素的浓度为4mol/l。
进一步,所述第一复性液及所述第二复性液中,所述氧化型谷胱甘肽与所述还原剂的浓度比为1:(3~6)。
进一步,所述第一复性液及所述第二复性液中,所述还原剂选自还原型谷胱甘肽、二硫苏糖醇或二硫赤藓糖醇中的一种或多种。
采用上述进一步技术方案的有益效果在于:通过选取上述成分中的一种或多种作为还原剂,与谷胱甘肽作为氧化-还原体系,尽量避免蛋白质在高浓度下产生聚集,提高回收率。
进一步,所述还原剂包括还原型谷胱甘肽。
进一步,所述还原剂包括必要还原剂组分及次要还原剂组分,所述必要还原剂组分为还原型谷胱甘肽,所述次要还原剂组分选自二硫苏糖醇或二硫赤藓糖醇种的一种或两种。
采取上述进一步技术方案的有益效果在于:还原剂为多种组分并存在还原型光谷甘肽时,其回收率可进一步提高至80%以上。
进一步,所述还原剂包括还原型谷胱甘肽、二硫苏糖醇及二硫赤藓糖醇,所述还原型谷胱甘肽、所述二硫苏糖醇及所述二硫赤藓糖醇的浓度比为(2~5):(1~3):1。
采取上述进一步技术方案的有益效果在于:通过复性液中采用还原型谷胱甘肽、二硫苏糖醇及二硫赤藓糖醇共同作为还原剂与氧化型谷胱甘肽构成氧化-还原体系时,其回收率提高至90%以上,纯度提高至90%。
进一步,所述第一复性液与所述第二复性液中还包括0.2mol/l~0.5mol/l的精氨酸及体积百分比为5%~10%的甘油;所述缓冲剂为tris-hcl,其浓度为40mmol/l~60mmol/l。
进一步,所述步骤s4中,将所述新冠病毒重组蛋白溶液以1ml/min~4ml/min的流速,在2℃~5℃条件下加入所述第一复性液中,直至所述新冠病毒重组蛋白溶液与所述第一复性液的体积比为1:(3~8),得到所述第一梯度复性液;往所述第一梯度复性液中在2℃~5℃条件下加入第二复性液,直至蛋白浓度稀释至1.5mol/l~2.5mol/l后,再复性48h以上。
采取上述进一步技术方案的有益效果在于:控制上述条件参数进行包涵体进行复性,更加利于工业生产效率,并可进一步提高蛋白回收率和产量。
进一步,将所述包涵体溶解产物稀释后加入镍螯合柱,然后加入洗脱液进行洗脱,得到含纯化新冠病毒重组蛋白的洗脱液,所述洗脱液包括40mmol/l~60mmol/l的tris-hcl,5mol/l~7mol/l的尿素,0.2mol/l~0.5mol/l的咪唑,体积百分比4%~10%的甘油。
采取上述进一步技术方案的有益效果在于:通过采用镍螯合柱进行柱层析,能提高后续复性的处理效率,在此步骤进行纯化,配合后续的复性处理后,后续无需再次进行纯化处理。
进一步,所述步骤s3中,将含纯化新冠病毒重组蛋白的洗脱液先浓缩至1mg/ml~3mg/ml,然后再加入溶解缓冲液调节尿素浓度,所述溶解缓冲液包括:40mmol/l~60mmol/l的tris-hcl,体积百分比4%~6%的甘油及0.5mmol/l~1.0mmol/l的β-巯基乙醇。
采取上述进一步技术方案的有益效果在于:将纯化后的蛋白先浓缩再加入溶解缓冲液调节尿素浓度,便可一次性的处理大量包涵体蛋白,在确保后续处理蛋白不聚集的前提下,使处理效率提高,提高工业经济性,同时采用本技术方案溶解缓冲液也可以降低在后续处理时产生的蛋白质聚集。
进一步,所述步骤s1中,将新冠病毒重组蛋白的包涵体加入溶解液后依次经过离心及真空过滤后收集澄清液,得到所述包涵体溶解产物,所述溶解液包括40mmol/l~60mmol/l的tris-hcl,80mmol/l~120mmol/l的nacl,8mmol/l~12mmol//l的β-巯基乙醇,6mol/l~8mol/l的盐酸胍。
采取上述进一步技术方案的有益效果在于:有效去除溶解液中的细胞碎片和一些不容杂质,可以达到初步提纯,过滤溶液澄清度较高,在后续操作中不会造成设备的堵塞和污染。
进一步,所述步骤s5中,将所述新冠病毒重组蛋白复性液先进行浓缩,然后在3℃~5℃条件下加入稀释液,最后浓缩至需要的浓度,即得复性蛋白产品。
进一步,所述稀释液为pbs溶液包括:0.1g/l~0.3g/l磷酸二氢钾,1.2g/l~1.5g/l磷酸氢二钠,5g/l~10g/l氯化钠,0.1g/l~0.3g/l氯化钾,体积百分比为3%~7%的甘油,ph为7.1~7.5。
进一步,将所述稀释液以1ml/min~4ml/min的流速与所述重组新冠蛋白复性液混合。
采取上述进一步技术方案的有益效果在于:缓慢稀释过程避免局部环境的改变造成复性好的蛋白变性又重新析出聚集。可以有效提高复性蛋白的回收率和复性效率。
进一步,所述新冠病毒重组蛋白为新冠病毒rbd重组蛋白,rbd重组蛋白编码的氨基酸序列如seq.no.1所示。
进一步,所述新冠病毒重组蛋白包涵体由新冠病毒rbd蛋白重组质粒转入大肠杆菌后,在大肠杆菌内诱导表达后获得。
附图说明
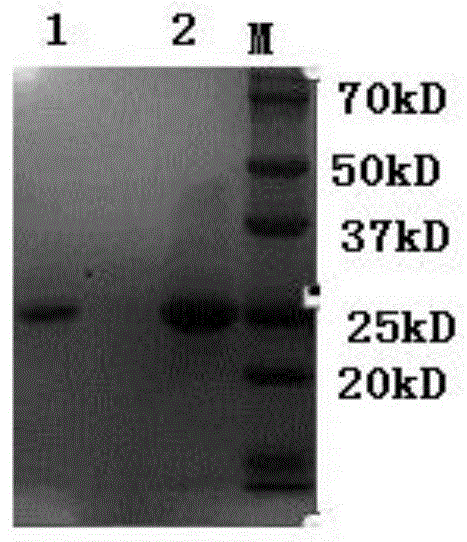
图1为实施例2复性后sds-page检测结果;
图2为实施例2纯化过纯化过程sds-page检测;
图3为实施例2不同批次的复性蛋白产品的特异性测试;
其中,图1中泳道1为新冠病毒重组蛋白复性液,泳道2为浓缩后的复性蛋白成品;
图2中泳道1为层析上样样本,泳道2为层析穿流液,泳道3~泳道5为层析洗杂液,泳道6为洗脱蛋白样本,m为marker。
图3中泳道1、泳道2及泳道3分别代表不同批次产品。
具体实施方式
下面结合具体实施例对本发明作进一步的详细说明,以使本领域的技术人员更加清楚地理解本发明。
以下实施例,仅用于说明本发明,但不止用来限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的情况下,所获得的其他所有实施例,都属于本发明的保护范围。
若未特别指明,本发明实施例中所用的实验试剂和材料等均可市售获得。
若未具体指明,本发明实施例中所用的技术手段均为本领域技术人员所熟知的常规手段。
实施例中,涉及各试剂的中英文的对照如下:
三(羟甲基)氨基甲烷:tris-hcl;
聚乙二醇辛基苯基醚:tritonx-100;
谷胱甘肽:gssg;
还原型谷胱甘肽:gsh;
l-精氨酸:l-argnine;
二硫苏糖醇:dtt;
二硫赤藓糖醇:det。
实施例1
本实施例提供新型冠状病毒rbd重组蛋白包涵体的获得方法,具体步骤如下:
1.1重组质粒的构建
首先采用序列如seq.no.2~seq.no.3的引物合成rbd蛋白,氨基酸编码如seq.no.1所示,其基因序列编码如seq.no.4所示,设计n端加入限制性内切酶bamhⅰ位点和6个组氨酸,以及c端加入限制性内切酶xhoⅰ酶切位点,通过pcr得到目的rbd基因目的片段。然后rbd基因目的片段和载体pet21a(+)分别用限制性内切酶bamhⅰ和xhoⅰ双酶切后,最后将酶切后的目的片段和pet21a(+)载体经过t4连接酶反应,转化克隆菌株e.colitop10感受态,涂布氨苄抗性平板37℃培养箱培养过夜,经过rcr筛选得到rbd重组菌株,提取重组菌株得到重组质粒pet21a-s-rbd。
1.2质粒转化大肠杆菌
重组质粒pet21a-s-rbd转化表达宿主感受态e.colibl21,涂布氨苄抗性平板,37℃培养箱过夜培养,挑取单菌落经过测序验证得到阳性表达菌株。
1.3包涵体蛋白的获得
将阳性表达菌株接种至10ml装有lb液体培养基的试管,37℃摇床过夜培养,次日按1:100接菌于lb培养基中(amp+)培养4h,菌体od值为0.6,加入不同终浓度iptg,25℃条件下诱导10h,7000×g离心20min收集沉淀,用lysisbuffer1(lysisbuffer1(bf1):50mmol/ltris-hcl,100mmol/lnacl,ph7.4,1%tritonx-100,2m尿素,体积百分比为5%甘油)复溶上一步离心沉淀。
将溶解后的待用菌液进行细胞破壁,设置破碎条件700bar,4℃,破碎两遍。7000rpm,25min,4℃离心,去上清,收集沉淀为包涵体蛋白,在离心时加入用50mmol/ltris,100mmol/lnacl充分重悬。
实施例2
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤如下:
(1)包涵体蛋白的溶解:将实施例1中获得的包涵体加入溶解液后进行离心,溶解时沉淀质量和液体的体积比为1:10,然后采用5um纤维素滤膜真空过滤后收集澄清液,得到包涵体溶解产物,溶解液包括50mmol//lph为9的tris-hcl,100mmol/l的nacl,10mmol/l的β-巯基乙醇,6mol/l的盐酸胍。
(2)包涵体蛋白的纯化,将包涵体溶解产物采用4倍体积的稀释液稀释后加入镍螯合柱,然后加入洗脱液进行洗脱,得到含纯化新冠病毒重组蛋白的洗脱液;此步骤中,稀释液包括:50mmol/lph为9.0的tris-hcl,100mmol/l的nacl,6m的尿素;洗脱液包括50mmol/l的ph为9.0的tris-hcl,6mol/l的尿素,0.5mol/l的咪唑,体积百分比5%的甘油。
(3)新冠病毒重组蛋白溶液的制备,将含纯化新冠病毒重组蛋白的洗脱液采用超滤膜包浓缩至1.5mg/ml,然后加入溶解缓冲液将尿素浓度调节至4mol/l,溶解缓冲液包括:50mmol/lph为9.0的tris-hcl,体积百分比为5%甘油,1mmol/lβ-巯基乙醇,此时蛋白质浓度为1mg/ml。
(4)新冠病毒重组蛋白的复性,将新冠病毒重组蛋白溶液用蠕动泵以3ml/min流速流加至第一复性液中,流加期间进行搅拌,直至新冠病毒重组蛋白溶液与第一复性液的体积比为1:5,然后用第二复性液再次稀释,直至将蛋白质浓度稀释至2m,在4℃条件下复性48小时,得到新冠病毒重组蛋白复性液;第一复性液包括:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,5mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油;第二复性液包括:50mmol/ltristris-hcl,100mmol/lnacl,0.4ml-argnine,5mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油。
(5)复性蛋白成品的制备:新冠病毒重组蛋白复性液用超滤膜包浓缩至二分之一体积,4℃条件下,复性蛋白溶液与pbs溶液按1:1稀释(0.24g/l磷酸二氢钾,1.44g/l磷酸氢二钠,8g/l氯化钠,0.2g/l氯化钾,体积百分比为5%甘油,ph7.4),pbs加入时用蠕动泵流加,流速4ml/min,用磁力搅拌器不断搅拌。搅拌24h以上后用超滤膜包浓缩至所需蛋白浓度,即得复性蛋白成品。
实施例3
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤如下:
(1)包涵体蛋白的溶解:将实施例1中获得的包涵体加入溶解液后进行离心,溶解时沉淀的质量和液体的体积比为1:10,然后采用5um纤维素滤膜真空过滤后收集澄清液,得到包涵体溶解产物,溶解液包括40mmol/lph为9.0的tris-hcl,80mmol/l的nacl,8mmol/l的β-巯基乙醇,6mol/l的盐酸胍。
(2)包涵体蛋白的纯化,将包涵体溶解产物采用4倍体积的稀释液稀释后加入镍螯合柱,然后加入洗脱液进行洗脱,得到含纯化新冠病毒重组蛋白的洗脱液;此步骤中,稀释液包括:40mmol/lph为9.0的tris-hcl,100mmol/l的nacl,6m的尿素;洗脱液包括40mmol/l的tris-hcl,6m的尿素,0.3mol/l的咪唑,体积百分比5%的甘油。
(3)新冠病毒重组蛋白溶液的制备,将含纯化新冠病毒重组蛋白的洗脱液采用超滤膜包浓缩至1mg/ml,然后加入溶解缓冲液将尿素浓度调节至4.5mol/l,此时,蛋白质浓度为0.67mg/ml;溶解缓冲液包括:40mmol/lph为9.0的tris-hcl,体积百分比为5%甘油,1mmol/lβ-巯基乙醇。
(4)新冠病毒重组蛋白的复性,将新冠病毒重组蛋白溶液用蠕动泵以3ml/min流速流加至第一复性液中,流加期间进行搅拌,直至新冠病毒重组蛋白溶液与第一复性液的体积比为1:3,然后用第二复性液再次稀释,直至将蛋白质浓度稀释至2m,在4℃条件下复性48小时,得到新冠病毒重组蛋白复性液;第一复性液包括:40mmol/lph为9的tris-hcl,100mmol/lnacl,2.5m尿素,0.4ml-argnine,5mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油;第二复性液包括:40mmol/lph为9的tris-hcl,100mmol/lnacl,0.4ml-argnine,3mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油。
(5)复性蛋白成品的制备:新冠病毒重组蛋白复性液用超滤膜包浓缩至二分之一体积,4℃条件下,复性蛋白溶液与pbs溶液按1:0.9稀释(0.25g/l磷酸二氢钾,1.5g/l磷酸氢二钠,8g/l氯化钠,0.2g/l氯化钾,体积百分比为5%的甘油,ph7.4),pbs加入时用蠕动泵流加,流速3ml/min,用磁力搅拌器不断搅拌。搅拌24h以上后用超滤膜包浓缩至所需蛋白浓度,即得复性蛋白成品。
实施例4
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤如下:
(1)包涵体蛋白的溶解:将实施例1中获得的包涵体加入溶解液后进行离心,溶解时沉淀的质量和液体体积比为1:10,然后采用5um纤维素滤膜真空过滤后收集澄清液,得到包涵体溶解产物,溶解液包括60mmol/lph为9的tris-hcl,120mmol/l的nacl,12mmol/l的β-巯基乙醇,7mol/l的盐酸胍。
(2)包涵体蛋白的纯化,将包涵体溶解产物采用4倍体积的稀释液稀释后加入镍螯合柱,然后加入洗脱液进行洗脱,得到含纯化新冠病毒重组蛋白包涵体的洗脱液;此步骤中,稀释液包括:60mmol/lph为9.0的tris-hcl,120mmol/l的nacl,7m的尿素;洗脱液包括60mmol/l的ph为9.0的tris-hcl,7mol/l的尿素,0.2mol/l的咪唑,体积百分比5%的甘油。
(3)新冠病毒重组蛋白溶液的制备,将含纯化新冠病毒重组蛋白的洗脱液采用超滤膜包浓缩至1.5mg/ml以上,然后加入溶解缓冲液将尿素浓度调节至4mol/l,溶解缓冲液包括:50mmol/lph为9.0的tris-hcl,体积百分比为5%甘油,1mmol/lβ-巯基乙醇,此时蛋白质浓度为0.86mg/ml。
(4)新冠重组病毒蛋白的复性,将新冠重组病毒蛋白溶液用蠕动泵以1ml/min的流速流加至第一复性液中,流加期间进行搅拌,直至新冠病毒重组蛋白包涵体缓冲液与第一复性液的体积比为1:5,然后用第二复性液再次稀释,直至将蛋白质浓度稀释至2m,在4℃条件下复性48小时,得到新冠病毒重组蛋白复性液;第一复性液包括:60mmol/lph为9的tris-hcl,120mmol/lnacl,2m尿素,0.4ml-argnine,5mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油;第二复性液包括:60mmol/ltris-hcl,120mmol/lnacl,0.5ml-argnine,6mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油。
(5)复性蛋白成品的制备:新冠病毒重组蛋白复性液用超滤膜包浓缩至二分之一体积,4℃条件下,复性蛋白溶液与pbs溶液按1:1.5稀释(0.24g/l磷酸二氢钾,1.44g/l磷酸氢二钠,8g/l氯化钠,0.2g/l氯化钾,体积5%甘油,ph7.4),pbs加入时用蠕动泵流加,流速为1ml/min,用磁力搅拌器不断搅拌。搅拌24h以上后用超滤膜包浓缩至所需蛋白浓度,即得复性蛋白成品。
实施例5
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例2,但与实施例2相比不同的是,将包涵体蛋白复性步骤中,第一复性液替换成:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,3mmol/lgsh,1mmol/ldtt,1mmol/ldte,1mmol/lgssg,质量百分比为5%的甘油;第二复性液包括:50mmol/ltris-hcl,100mmol/lnacl,0.4ml-argnine,4mmol/lgsh,1mmol/ldtt,1mmol/ldte,1mmol/lgssg,体积百分比为5%的甘油。
实施例6
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例2,但与实施例2相比不同的是,第一复性液替换成:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,2.78mmol/lgsh,1.67mmol/ldtt,0.55mmol/ldte,1mmol/lgssg,体积百分比为5%的甘油;第二复性液包括:50mmol/ltris-hcl,100mmol/lnacl,0.4ml-argnine,2.78mmol/lgsh,1.67mmol/ldtt,0.55mmol/ldte,1mmol/lgssg,体积百分比为5%的甘油。
实施例7
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例2,但与实施例2相比不同的是,第一复性液替换成:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,4mmol/lgsh,1mmol/ldtt,1mmol/lgssg,体积百分比为5%的甘油;第二复性液包括:50mmol/ltris-hcl,100mmol/lnacl,0.4ml-argnine,4mmol/lgsh,1mmol/ldtt,1mmol/ldte,1mmol/lgssg,体积百分比为5%的甘油。
实施例8
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例2,但与实施例2相比不同的是,第一复性液替换成:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,4mmol/lgsh,1mmol/ldte,1mmol/lgssg,体积百分比为5%的甘油;第二复性液包括:50mmol/ltris-hcl,100mmol/lnacl,0.4ml-argnine,4mmol/lgsh,1mmol/ldtt,1mmol/ldte,1mmol/lgssg,体积百分比为5%的甘油。
实施例9
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例3,但与实施例3相比不同的是,将包涵体蛋白复性步骤中,将第一复性液的流速调整为0.5ml/min。
实施例10
本实施例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例3,但与实施例3相比不同的是,将包涵体蛋白复性步骤中,将第一复性液的流速调整为4.5ml/min。
对比例1
本对比例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤如下:
(1)包涵体蛋白的溶解:将实施例1中获得的包涵体加入溶解液后进行离心,溶解时沉淀质量和液体体积比为1:10,然后采用5um纤维素滤膜真空过滤后收集澄清液,得到包涵体溶解产物,溶解液包括采用6mol/l尿素,加入10mmol/l二硫苏糖醇。
(2)包涵体蛋白缓冲液的制备,将包涵体蛋白溶解液采用超滤膜包浓缩至2mg/ml,然后加入溶解缓冲液将尿素浓度调节至4mol/l,溶解缓冲液包括:50mmol/lph为9.0的tris-hcl,质量百分比为5%甘油,1mmol/lβ-巯基乙醇,此时蛋白质浓度为0.7mg/ml。
(3)包涵体蛋白的复性,将包涵体蛋白缓冲液用蠕动泵以3ml/min流速流加至第一复性液中,流加期间进行搅拌,直至新冠病毒重组蛋白包涵体缓冲液与第一复性液的体积比为1:5,然后用第二复性液再次稀释,直至将蛋白质浓度稀释至2m,在4℃条件下复性48小时,得到新冠病毒重组蛋白复性液;第一复性液包括:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,5mmol/lgsh,1mmol/lgssg,质量百分比为5%的甘油;第二复性液包括:50mmol/ltristris-hcl,100mmol/lnacl,0.4ml-argnine,5mmol/lgsh,1mmol/lgssg,体积百分比为5%的甘油。
(4)复性蛋白的纯化及浓缩,制备镍柱,用双蒸水和缓冲液分别洗涤和平衡柱子,将上述复性液离心后,以30ml/min的流速过柱子,用含20mmol/l咪唑的缓冲液洗涤杂蛋白,用250mmol/l咪唑的缓冲液洗脱;
离子柱q柱或者sp柱对于复性成功的蛋白的富集,包括下列步骤:离子柱的实施是上述液体经透析后,过阴离子柱q柱,然后用另外添加300mmol/l氯化钠的溶液洗脱;
分子筛对于目标蛋白的进一步纯化:上述洗脱后的溶液进一步浓缩,浓缩到5mg/ml左右,上样1~2毫升经superdex200120毫升的柱子,5ml/min流速,收集吸收峰。
对比例2
本对比例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤如下:
(1)包涵体蛋白的溶解:将实施例1中获得的包涵体加入溶解液后进行离心,溶解时沉淀质量和液体体积比为1:10,然后采用5um纤维素滤膜真空过滤后收集澄清液,得到包涵体溶解产物,溶解液包括50mmol/lph为9的tris-hcl,100mmol/l的nacl,10mmol/l的β-巯基乙醇,6mol/l的盐酸胍。
(2)包涵体蛋白的纯化,将包涵体溶解产物采用4倍体积的稀释液稀释后加入镍螯合柱,然后加入洗脱液进行洗脱,得到含纯化新冠病毒重组蛋白包涵体的洗脱液;此步骤中,稀释液包括:50mmol/lph为9.0的tris-hcl,100mmol/l的nacl,6m的尿素;洗脱液包括50mmol/l的ph为9.0的tris-hcl,6m的尿素,0.5mol/l的咪唑,体积百分比5%的甘油。
(3)新冠病毒重组蛋白溶液的制备,将含纯化新冠病毒重组蛋白包涵体的洗脱液采用超滤膜包浓缩至1.5mg/ml,然后加入溶解缓冲液将尿素浓度调节至4mol/l,溶解缓冲液包括:50mmol/lph为9.0的tris-hcl,体积百分比为5%甘油,1mmol/lβ-巯基乙醇,此时蛋白质浓度为1.0mg/ml
(4)包涵体蛋白的复性,将新冠病毒重组蛋白溶液用蠕动泵以3ml/min流速流加至第一复性液中,流加期间进行搅拌,直至新冠病毒重组蛋白包涵体缓冲液与第一复性液的体积比为1:5,然后用第二复性液再次稀释,直至将蛋白质浓度稀释至2m,在4℃条件下复性48小时,得到新冠病毒重组蛋白复性液;第一复性液包括:50mmol/lph为9的tris-hcl,100mmol/lnacl,2m尿素,0.4ml-argnine,1mmol/ledta,体积百分比为0.1%tween-80,体积百分比为5%的甘油,1mmol/lβ-巯基乙醇;
第二复性液包括:50mmol/ltris-hcl,100mmol/lnacl,0.4ml-argnine,1mmol/ledta,体积百分比为0.1%tween-80,体积百分比为5%的甘油,1mmol/lβ-巯基乙醇。
(5)复性蛋白成品的制备:新冠病毒重组蛋白复性液用超滤膜包浓缩至二分之一体积,4℃条件下,复性蛋白溶液与pbs溶液按1:1稀释(0.24g/l磷酸二氢钾,1.44g/l磷酸氢二钠,8g/l氯化钠,0.2g/l氯化钾,5%甘油,ph7.4),pbs加入时用蠕动泵流加,流速4ml/min,用磁力搅拌器不断搅拌。搅拌24h以上后用超滤膜包浓缩至所需蛋白浓度,即得复性蛋白成品。
对比例3
本对比例提供新型冠状病毒rbd重组蛋白包涵体的复性方法,具体步骤参照实施例2,但与实施例2相比不同的是,在纯化包涵体蛋白缓冲液步骤中,加入溶解缓冲液将尿素浓度调至5m再进行后续步骤。
实施例12
12.1统计实施例2~实施例11的蛋白回收率,并检测蛋白纯度及蛋白活性。
回收率测试方法如下:所有实施例及对比例复性起始蛋白量为相同,通过不同实施例操作后,所得的蛋白成品量占起始量的比例为回收率。
纯度测试方法如下:将实施例及对比例成品样品分别进行sds-page检测,通过灰度扫描分析出目的蛋白的条带占单泳道灰度的比例为纯度。
检测结果如下表1所示。
表1包涵体蛋白复性效率及效果统计
从表1可以看出,本发明实施例与对比例1相比,采用先柱层析纯化后复性的工艺,其回收率与纯度相较于对比例1有较大提高。
本发明实施例与对比例2相比,将原有的氧化还原体系替换成edta、tween-80及β-巯基乙醇的复性液,结果显示,本发明的复性液体系相较于对比例2,在回收率上有较大提高。
本发明与对比例3相比,本发明将新冠病毒重组蛋白的尿素浓度调至5m,再进行后续的复性反应,结果显示,在同等复性条件及同等稀释条件下,本发明将此步骤中的尿素浓度控制在4.0m~4.5m,其纯度会有较大提高,进一步,将此步骤中的浓度控制在4.0m,可进一步提高回收率及纯度。
与此同时,发明人研究团队发现,在包涵体蛋白复性过程中,采用复性液对复性效果有明显的影响,同时采用gsh,dtt,dte与gssg共同构成氧化还原体系相较于双组分还原剂与单组分还原剂,复性后,其回收率与纯度最佳,双组份其次。
不仅如此,纯化包涵体蛋白缓冲液与复性液的混合速度也是影响复性的关键因素之一,流速越慢,蛋白回收率越高,但是低于1ml/min流速时,回收率提高便不太明显,不利于工业生产效率,高于4ml/min使,其回收率便会下降,因此将纯化包涵体蛋白缓冲液的流速控制1ml/min~4ml/min可以兼顾生产效率与回收率。
12.2按实施例2方法制备三个批次的产品进行western-blot测试,测试结果如图3所示,结果显示,三批次产品特异性测试结果相同,因此,本方法具有一定稳定性。
最后,以上仅为本发明的较佳实施方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>武汉糖智药业有限公司
<120>一种新冠病毒重组蛋白包涵体的复性方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>231
<212>prt
<213>冠状病毒(coronaviridaesarbecovirus)
<400>1
hishishishishishisglyserargvalglnprothrgluserile
151015
valargpheproasnilethrasnleucyspropheglygluvalphe
202530
asnalathrargphealaservaltyralatrpasnarglysargile
354045
serasncysvalalaasptyrservalleutyrasnseralaserphe
505560
serthrphelyscystyrglyvalserprothrlysleuasnaspleu
65707580
cysphethrasnvaltyralaaspserphevalileargglyaspglu
859095
valargglnilealaproglyglnthrglylysilealaasptyrasn
100105110
tyrlysleuproaspaspphethrglycysvalilealatrpasnser
115120125
asnasnleuaspserlysvalglyglyasntyrasntyrleutyrarg
130135140
leuphearglysserasnleulysprophegluargaspileserthr
145150155160
gluiletyrglnalaglyserthrprocysasnglyvalgluglyphe
165170175
asncystyrpheproleuglnsertyrglypheglnprothrasngly
180185190
valglytyrglnprotyrargvalvalvalleuserphegluleuleu
195200205
hisalaproalathrvalcysglyprolyslysserthrasnleuval
210215220
lysasnlyscysvalasnphe
225230
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggatcccatcaccatcatcatc22
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctcgagttagaagttcgcactt22
<210>4
<211>708
<212>dna
<213>冠状病毒(coronaviridaesarbecovirus)
<400>4
ggatcccatcaccatcatcatcatggtagccgtgttcagccgaccgaaagcattgttcgt60
tttccgaatatcaccaatctgtgtccgtttggcgaagtttttaatgcaacccgttttgca120
agcgtttatgcctggaatcgtaaacgtattagcaattgcgttgccgattatagcgttctg180
tataatagcgcaagcttcagcacctttaaatgctatggtgttagcccgaccaaactgaat240
gatctgtgttttaccaatgtgtatgccgatagctttgtgattcgtggtgatgaagttcgt300
cagattgcaccgggtcagaccggtaaaattgcagattataactataaactgccggatgat360
tttacgggttgtgttattgcatggaatagcaataacctggatagcaaagttggtggcaac420
tataactatctgtatcgcctgtttcgtaagagcaatctgaaaccgtttgaacgtgatatt480
agcaccgaaatttatcaggcaggtagcaccccgtgcaatggtgttgaaggttttaattgt540
tattttccgctgcagagctatggttttcagcctacctatggtgtgggtaatcagccgtat600
cgtgttgttgttctgtcatttgaactgctgcatgcaccggcaaccgtttgtggtccgaaa660
aaaagtaccaatctggtgaaaaacaagtgcgtgaacttctaactcgag708
- 还没有人留言评论。精彩留言会获得点赞!