厚朴酚衍生物及其制备方法和应用
1.本发明属于药物化学技术,尤其涉及厚朴酚衍生物及其制备方法,以及在制备抗肝癌及其转移药物中的用途。
背景技术:
2.据统计,近几年平均每年都有2000万人罹患癌症,近1000万人因癌症去世。在诸多癌症中,肝癌以百分之4.7的发病率排名第六,却以近乎2倍发病率的8.2 的死亡率排名第三,足见其致死性之强。因此,针对肝癌的药物开发便成了一项重要议题。现阶段肝癌的治疗存在局限性,无根本性治疗方法,远期疗效差,且容易复发。肝癌将势必影响老年人群的生活质量和平均寿命,给患者及其家庭和社会造成严重的经济负担。因此,研究新型抗肝癌药物具有重要意义。
技术实现要素:
3.发明目的:针对上述现有技术,本申请提供了一种厚朴酚衍生物及其制备方法,以及上述厚朴酚衍生物在抗癌制药方面的应用。
4.技术方案:本申请所述的一种厚朴酚衍生物,结构如式ⅰ所示:
[0005][0006]
其中,r为或甲基,其中r1为甲基、卤素、氢或甲氧基中的一种;r2为甲基、卤素、氢或甲氧基中的一种;r3为c1
‑
c4烷基、氢、甲氧基或卤素中的一种。
[0007]
进一步的,r1为氢,r2为氢,r3为氢、卤素、c1
‑
c4烷基中的一种。
[0008]
其中,所述c1
‑
c4烷基优选为甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基。
[0009]
或者,r1为氢,r3为氢,r2为氢、卤素、甲基、甲氧基中的一种。
[0010]
或者,r2为氢,r3为氢,r1为氢、卤素、甲基、甲氧基中的一种。
[0011]
其中,本申请所述卤素优选氟、氯、溴。
[0012]
优选的,所述r为甲基、2
‑
氟苯基、3
‑
氟苯基、4
‑
氟苯基、 2
‑
甲基
苯基、3
‑
甲基苯基、4
‑
甲基苯基、2
‑
甲氧基苯基、3
‑
甲氧基苯基、2
‑
溴苯基、苯基、4
‑
乙基苯基、4
‑
丙基苯基、4
‑
异丙基苯基、4
‑
丁基苯基、4
‑
异丁基苯基、 4
‑
叔丁基苯基。
[0013]
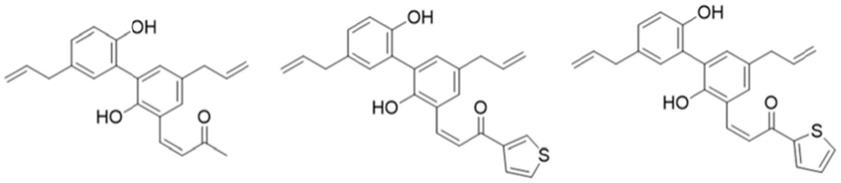
即,所述厚朴酚衍生物为以下化合物的任意一种:
[0014]
[0015][0016]
上述化合物依次为:
[0017]4‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基
‑3‑
烯
‑2‑
酮
[0018]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(噻吩
‑2‑
基)丙
‑2‑
烯
‑1‑
酮
[0019]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(噻吩
‑3‑
基)丙
‑2‑
烯
‑1‑
酮
[0020]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮
[0021]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮
[0022]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮
[0023]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮
[0024]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮
[0025]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮
[0026]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮
[0027]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮
[0028]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮
[0029]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
甲氧基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0030]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
甲氧基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0031]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
溴苯基)丙
‑2‑
烯
‑1‑
酮
[0032]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
苯基丙
‑2‑
烯
‑1‑
酮
[0033]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
乙基苯基)丙
‑2‑
烯
‑1‑
酮
[0034]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
丙基苯基)丙
‑2‑
烯
‑1‑
酮
[0035]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
异丙基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0036]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
丁基苯基)丙
‑2‑
烯
‑1‑
酮
[0037]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
异丁基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0038]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
叔丁基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0039]
本申请还提供了上述的厚朴酚衍生物的制备方法,所述方法为先合成5,5'
‑ꢀ
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛这一中间体,再以5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛这一中间体合成厚朴酚衍生物。
[0040]
合成路线为:
[0041][0042]
其中,上述步骤具体为通过以氯化镁为催化剂,以多聚甲醛和厚朴酚生成 5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛,再通过丙酮、乙酰基噻吩或者苯乙酮类化合物进行羟醛缩合反应生成相应的厚朴酚衍生物。
[0043]
进一步的,合成步骤为:以厚朴酚为原料与多聚甲醛、氯化镁反应得到5,5'
‑ꢀ
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛,得到如式ii所示的化合物;5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛与丙酮,2
‑
乙酰基噻吩或3
‑
乙酰基噻吩,或苯乙酮类化合物iv反应形成如式iii所示的厚朴酚衍生物。
[0044][0045]
具体优选的包括以下步骤:
[0046]
(1)以1当量厚朴酚为原料,加入30
‑
100ml无水四氢呋喃中,加入4
‑
10 当量多聚甲醛,2
‑
10当量氯化镁,1
‑
5当量三乙胺,50
‑
80摄氏度反应4
‑
12h提纯得到5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛;
[0047]
(2)1当量5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛加入到乙醇溶液中,加入10
‑
30当量氢氧化钠,再分别加入1
‑
3当量的丙酮、2
‑
乙酰基噻吩、3
‑
乙酰基噻吩、或苯乙酮类化合物iv中的其中一种,反应12
‑
48h,加入稀盐酸调ph 至3
‑
10,乙酸乙酯萃取之后分离纯化得到化合物。
[0048]
本申请还提供上述厚朴酚衍生物在制备预防或者治疗肝癌的药物中的应用。
[0049]
本申请所述的厚朴酚衍生物在临床上的给药方式可以采用口服、注射等方式。
[0050]
本申请的厚朴酚衍生物临床所用剂量为0.01mg~1000mg/天,也可根据病情的轻重或剂型的不同偏离此范围。
[0051]
有益效果:本申请提供的厚朴酚衍生物具有较好的肝癌细胞抑制作用和比较高抑制肝癌细胞迁徙的性能,从而能够制备具有抗肝癌作用的药物的新化合物实体;本申请提
供的制备方法解决了天然植物中含量少,分离难的问题,以廉价的厚朴酚为原料,通过羰基化生成单体的5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
甲醛,再通过羟醛缩合,生成厚朴酚衍生物,合成方法简单,条件容易,具有较好的可操作性和重复性。这些合成的厚朴酚衍生物在治疗肝癌等表现着不同程度的活性,是潜在的治疗肝癌的新化学实体,对于相关疾病新药的开发具有重要的意义。
附图说明
[0052]
图1为实施例20中化合物分别以1.25和2.5μm存在以及空白组与0h组条件下,测试的划痕实验结果。
具体实施方式
[0053]
下面结合附图及实施例对本申请的技术方案作进一步详细说明。
[0054]
实施例1
[0055]4‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基)
‑
[1,1'
‑
联苯]
‑3‑
基
‑3‑
烯
‑2‑
酮
[0056]
a、5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛
[0057][0058]
室温条件下向200ml无水四氢呋喃中加入厚朴酚(2.66g,10mmol),加入多聚甲醛(1.16g,40mmol),氯化镁(2.86g,30mmol),三乙胺(1.01ml,10mmol)60 摄氏度搅拌10h,tlc检测反应完毕,加入水终止反应,减压蒸除大部分四氢呋喃,加入二氯甲烷,萃取3次,每次50ml,合并有机层,用无水硫酸钠干燥,浓缩二氯甲烷,得粘稠状黄色膏状物1.2g,产率40.8%。esi
‑
ms m/z:295.1[m+h]
+
, 相对分子质量294.1。1hnmr(300mhz,cdcl3):δ12.00(s,1h),9.97(s,1h),7.50 (dd,j=3.0,3.0hz,2h),7.19(dd,j=3.0,3.0hz,2h),7.09(d,j=3.0hz,1h), 7.04(d,j=3.0hz,1h),5.97
‑
6.03(m,2h),5.19
‑
5.09(m,4h),3.45(dd,j=3.0hz, 4h)。
[0059]
b、丙酮
[0060][0061]
将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加丙酮(63.8μl,1.1mmol),室温搅拌反应24h, tlc检测反应结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.125g产率为37.4%。经鉴定为4
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑ꢀ
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基
‑3‑
烯
‑2‑
酮,esi
‑
ms m/z:335.2[m+h]
+
,相对分子质量 334.2,1h nmr(300mhz,cdcl3):δ8.12(d,j=12.0hz,1h),7.50(d,j=6.0hz, 1h),7.50(d,j=12.0hz,1h),7.30(d,j=6.0hz,1h),7.15
(d,j=3.0hz,1h),7.02 (d,j=3.0hz,1h)6.95(d,j=3.0hz,1h),5.97
‑
6.05(m,2h),5.19
‑
5.05(m,4h), 3.45(dd,j=6.0,6.0hz,4h),2.39(s,3h)。
[0062]
实施例2
[0063]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(噻吩
‑2‑
基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0064]
参照实施例1,原料替换为2
‑
乙酰基噻吩,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 2
‑
乙酰基噻吩(107.82mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粉末状固体。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.315g,产率为78.3%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
基)
‑1‑
(噻吩
‑2‑
基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:403.1[m+h]
+
,相对分子质量402.1,1h nmr(300mhz,cdcl3):δ8.52(d,j=18.0hz,1h),7.98(dd,j=3.0,3hz,1h),7.75(dd,j=3.0,3.0hz,1h),7.57(d,j=18.0hz,1h),7.52(d,j= 3.0hz,1h),7.26
‑
7.10(m,5h),5.97
‑
6.05(m,2h),5.19
‑
5.05(m,4h),3.45(dd,j= 6.0,6hz,4h)。
[0065]
实施例3
[0066]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(噻吩
‑3‑
基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0067]
参照实施例1,原料替换为3
‑
乙酰基噻吩,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 3
‑
乙酰基噻吩(107.82mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.285g,产率为70.9%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(噻吩
‑3‑
基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:403.1[m+h]
+
,相对分子质量402.1,1h nmr(300mhz,cdcl3):δ8.52(d,j=18.0hz,1h),8.29(dd,j=3.0, 3.0hz,1h),7.73(dd,j=3.0,3.0hz,1h),7.57(d,j=18.0hz,1h),7.52(d,j=3.0 hz,1h),7.42
‑
7.10(m,5h),5.97
‑
6.05(m,2h),5.19
‑
5.05(m,4h),3.45(dd,j=6.0, 6.0hz,4h)。
[0068]
实施例4
[0069]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
氟苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0070]
参照实施例1,原料替换为2
‑
氟苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 2
‑
氟苯乙酮(152mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.155g,产率为37.4%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(2
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:415.1[m+h]
+
,
相对分子质量414.1,1h nmr(300mhz,cdcl3):δ8.52(d,j=18.0hz,1h),8.29(dd,j=3.0hz,1h), 7.73(dd,j=6.0hz,1h),7.57(d,j=18.0hz,1h),7.52(d,j=3.0hz,1h), 7.42
‑
7.10(m,5h),5.97
‑
6.05(m,2h),5.19
‑
5.05(m,4h),3.45(dd,j=6.0,6.0hz, 4h)。
[0071]
实施例5
[0072]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮
[0073]
参照实施例1,原料替换为3
‑
氟苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加3
‑
氟苯乙酮(152mg,1.1mmol),室温搅拌反应24h,tlc检测反应结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯= 5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.124g,产率为30.0%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(3
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:415.1[m+h]
+
,相对分子质量414.1,1h nmr(300mhz,cdcl3):δ8.45(d,1h,j=18.0hz),7.91(d,j=3.0hz,1h),7.80 (d,j=18.0hz,1h),7.70(d,j=6.0hz,1h),7.59
‑
7.49(m,2h),7.35(m,1h),7.26(d, j=3.0hz,1h),7.20
‑
7.12(m,3h),6.03(m,2h),5.15(m,4h),3.43(dd,j=6.0,6.0 hz,4h)
[0074]
实施例6
[0075]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮
[0076]
参照实施例1,原料替换为4
‑
氟苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 4
‑
氟苯乙酮(152mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.172g,产率为35.5%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
氟苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:415.1[m+h]
+
,相对分子质量414.1,1h nmr(300mhz,cdcl3):δ8.52(d,j=18.0hz,1h),8.29(dd,j=3.0, 3.0hz,1h),7.73(dd,j=3.0,3.0hz,1h),7.57(d,j=18.0hz,1h),7.52(d,j=3.0 hz,1h),7.42
‑
7.10(m,5h),5.97
‑
6.05(m,2h),5.19
‑
5.05(m,4h),3.45(dd,j=6.0, 6.0hz,4h)。
[0077]
实施例7
[0078]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮
[0079]
参照实施例1,原料替换为2
‑
氯苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 2
‑
氯苯乙酮(169mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.182g,产率为42.3%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,
2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(2
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:431.1[m+h]
+
,相对分子质量430.1,1h nmr(300mhz,cdcl3):δ:7.96(d,j=18.0hz,1h,),8.11(d,j=6.0hz,2h), 7.67(d,j=18.0hz,1h),7.48(s,1h),7.28
‑
7.06(m,6h),5.98(m,2h),5.10(m,4h), 3.38(dd,j=6.0,6.0hz,4h)。
[0080]
实施例8
[0081]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
氯苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0082]
参照实施例1,原料替换为3
‑
氯苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 3
‑
氯苯乙酮(169mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.128g,产率为29.8%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:431.1[m+h]
+
,相对分子质量430.1,1h nmr(300mhz,cdcl3):δ:8.33(d,j=18.0hz,1h),8.03(dd,j=6.0, 6.0hz,2h),7.46(d,j=18.0hz,1h),7.41(m,3h),7.36(m,3h),7.30(d,j=6.0 hz,2h),5.98(m,2h),5.10(m,4h),3.38(dd,j=6.0,6.0hz,4h)。
[0083]
实施例9
[0084]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
氯苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0085]
参照实施例1,原料替换为4
‑
氯苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 4
‑
氯苯乙酮(169mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.128g,产率为29.8%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(4
‑
氯苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:431.1[m+h]
+
,相对分子质量430.1,1h nmr(300mhz,cdcl3):δ:8.32(d,j=18.0hz,1h),8.03(dd,j=3.0,3.0hz, 2h),7.46(d,j=18.0hz,1h),7.41(m,3h),7.36(m,3h),7.30(d,j=6.0hz,2h), 5.98(m,2h),5.10(m,4h),3.38(dd,j=6.0,6.0hz,4h)。
[0086]
实施例10
[0087]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
甲氧基苯基)丙
‑2‑ꢀ
烯
‑1‑
酮
[0088]
参照实施例1,原料替换为2
‑
甲氧基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加2
‑
甲氧基苯乙酮(165mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚: 乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.172g,产率为40.4%。经鉴定为3
‑
(5,5'
‑
二烯丙
基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
甲氧基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:427.2[m+h]
+
,相对分子质量426.2,1h nmr(300mhz,cdcl3):δ:8.24(d,j=18.0hz,1h),7.70 (dd,j=3.0,3.0hz,1h),7.57(d,j=18.0hz,1h),7.54(dd,j=3.0,3.0hz,1h), 7.50(dd,j=3.0,3.0hz,1h),7.22(d,3.0hz,1h),7.16
‑
7.02(m,5h),6.01(m,2h), 5.12(m,4h),3.94(s,3h),3.42(dd,j=6.0,6.0hz,4h)。
[0089]
实施例11
[0090]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
甲氧基苯基)丙
‑2‑ꢀ
烯
‑1‑
酮
[0091]
参照实施例1,原料替换为3
‑
甲氧基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加3
‑
甲氧基苯乙酮(165mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚: 乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.172g,产率为40.4%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
甲氧基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:427.2[m+h]
+
,相对分子质量426.2,1h nmr(300mhz,cdcl3):δ:8.34(d,j=18.0hz,1h),7.69 (d,j=18.0hz,1h),7.68(d,j=3.0hz,1h),7.60(t,j=6.0hz,1h),7.51(d,j=3.0 hz,1h),7.44(t,j=6.0hz,1h),7.21(d,j=3.0hz,1h),7.19
‑
7.07(m,4h),6.01(m, 2h),5.12(m,4h),3.91(s,3h),3.42(dd,6.0,6.0hz,4h)。
[0092]
实施例12
[0093]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
溴苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0094]
参照实施例1,原料替换为2
‑
溴苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 2
‑
溴苯乙酮(218mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.196g,产率为41.4%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(2
‑
溴苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:475.1[m+h]
+
,相对分子质量474.1,1hnmr(300mhz,cdcl3):δ:7.91(d,j=18.0hz,1h),7.69(dd,j=3.0,3.0hz, 1h),7.47(dd,j=3.0,3.0hz,1h),7.42(td,j=3.0,3.0,3.0hz,1h),7.34(td,j=3.0, 3.0,3.9hz,2h),7.29(d,j=3.0hz,1h),7.14(dd,j=3.0,3.0hz 1h),7.07(d,j= 3.0hz,1h),7.02(d,j=15.0hz,1h),6.01(m,2h),5.12(m,4h),3.42(dd,j=6.0, 6.0hz,4h)。
[0095]
实施例13
[0096]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(2
‑
甲基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0097]
参照实施例1,原料替换为2
‑
甲基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 2
‑
甲基苯乙
酮(147mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.357g,产率为85.6%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(2
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:411.2[m+h]
+
,相对分子质量410.2,1h nmr(300mhz,cdcl3):δ:8.12(d,j=18.0hz,1h),7.61(dd,j=3.0,3.0hz, 1h),7.47
‑
7.39(m,3h),7.34
‑
7.30(m,2h),7.25(d,j=3.0hz,1h),7.17
‑
7.07(m, 3h),6.01(m,2h),5.12(m,4h),3.40(dd,j=6.0,6.0hz,4h),2.52(s,3h)。
[0098]
实施例14
[0099]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0100]
参照实施例1,原料替换为3
‑
甲基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 3
‑
甲基苯乙酮(147mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.323g,产率为78.8%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(3
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:411.2[m+h]
+
,相对分子质量410.2,1hnmr(300mhz,cdcl3):δ8.46(d,j=18.0hz,1h),7.92(m,2h),7.72(d,j=18.0hz,1h),7.53(d,j=3.0hz,1h),7.47
‑
7.42(m,2h),7.24(d,j=6.0hz,1h), 7.17(m,2h),7.12(s,1h),6.01(m,2h),5.12(m,4h),3.42(dd,j=6.0,6.0hz,4h), 2.49(s,3h)。
[0101]
实施例15
[0102]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
甲基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0103]
参照实施例1,原料替换为4
‑
甲基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 4
‑
甲基苯乙酮(147mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.323g,产率为78.8%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(4
‑
甲基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:411.2[m+h]+,相对分子质量410.2,1h nmr(300mhz,cdcl3):δ8.46(d,j=18.0hz,1h),7.92(m,2h),7.72(d,j= 18.0hz,1h),7.53(d,j=3.0hz,1h),7.47
‑
7.42(m,2h),7.24(d,j=6.0hz,1h), 7.17(m,2h),7.12(s,1h),6.01(m,2h),5.12(m,4h),3.42(dd,j=6.0,6.0hz,4h), 2.49(s,3h)。
[0104]
实施例16
[0105]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
乙基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0106]
参照实施例1,原料替换为4
‑
乙基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 4
‑
乙基苯乙酮(163mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.353g,产率为83.3%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(4
‑
乙基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:425.2[m+h]
+
,相对分子质量424.2,1h nmr(300mhz,cdcl3):δ1h nmr(300mhz,cdcl3)δ:8.47(d,j= 18.0hz,1h),8.07(d,j=6.0hz,2h),7.72(d,j=18.0hz,1h),7.53(s,1h),7.39(d, j=6.0hz,2h),7.21
‑
7.09(m,4h),6.01(m,2h),5.12(m,2h),3.42(dd,j=6.0,6.0 hz,4h),2.77(q,j=15.0hz,2h),1.30(t,j=9.0hz,3h)。
[0107]
实施例17
[0108]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
丙基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0109]
参照实施例1,原料替换为4
‑
丙基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 4
‑
丙基苯乙酮(178mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.353g,产率为83.3%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(4
‑
丙基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:439.2[m+h]
+
,相对分子质量 438.2,1h nmr(300mhz,cdcl3):δ:1hnmr(300mhz,cdcl3)δ:8.47(d,j= 18.0hz,1h),8.07(d,j=6.0hz,2h),7.72(d,j=18.0hz,1h),7.53(s,1h),7.39(d, j=6.0hz,1h),7.21
‑
7.09(m,4h),6.01(m,2h),5.12(m,4h),3.42(dd,j=6.00, 6.00hz,4h),2.77(t,j=9.0hz,2h),1.30(m,j=9.0hz,2h),0.93(t,j=12.0hz, 3h)。
[0110]
实施例18
[0111]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
异丙基苯基)丙
‑2‑ꢀ
烯
‑1‑
酮
[0112]
参照实施例1,原料替换为4
‑
异丙基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加4
‑
异丙基苯乙酮(178mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚: 乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.366g,产率为83.6%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
基)
‑1‑
(4
‑
异丙基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:439.2[m+h]+,相对分子质量438.2,1hnmr(300mhz,cdcl3):δ1h nmr(300mhz,cdcl3)δ:8.40 (d,j=18.0hz,1h),8.06(d,j=6.0hz,2h),7.72(d,j=18.0hz,1h),7.52(s,1h), 7.40(d,j=6.0hz,2h),7.21
‑
7.09(m,4h),6.01(m,2h),5.12(m,4h),3.42(dd,j= 6.0,6.0hz,4h),2.77(m,1h),1.30(d,9.0hz,6h)。
[0113]
实施例19
[0114]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
丁基苯基)丙
‑2‑
烯
‑1‑ꢀ
酮
[0115]
参照实施例1,原料替换为4
‑
丁基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加 4
‑
丁基苯乙酮(178mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到黄色粉末状固体0.366g,产率为83.6%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
基)
‑1‑
(4
‑
丁基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:453.2[m+h]+,相对分子质量 452.2,1hnmr(300mhz,cdcl3):δ1hnmr 8.46(d,j=18.0hz,1h),8.06(d,j= 6.0hz,2h),7.72(d,j=18.0hz,1h),7.55(s,1h),7.37(d,j=6.0hz,2h), 7.21
‑
7.09(m,4h),6.01(m,2h),5.12(m,4h),3.42(dd,j=6.0,6.0hz,4h),2.77(q, j=12.0hz,2h),1.68(m,2h),1.42(m,2h),0.98(d,j=12.0hz,3h)。
[0116]
实施例20
[0117]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
异丁基苯基)丙
‑2‑ꢀ
烯
‑1‑
酮
[0118]
参照实施例1,原料替换为4
‑
异丁基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加4
‑
异丁基苯乙酮(178mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚: 乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粉末状固体0.366g,产率为83.6%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
异丁基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:453.2[m+h]+,相对分子质量452.2,1hnmr(300mhz,cdcl3):δ:1hnmr(300mhz,cdcl3):δ 8.46(d,18.0hz,1h),8.06(d,j=6.0hz,2h),7.73(d,j=18.0hz,1h),7.52(s, 1h),7.32(d,j=6.0hz,2h),7.21(d,j=3.0hz,2h)7.17
‑
7.09(m,2h),6.01(m,2h), 5.12(m,4h),3.42(dd,j=3.0,3.0hz,4h),2.77(q,j=12.0hz,2h),1.95(m,1h), 0.98(d,j=3.0hz,6h)。
[0119]
实施例21
[0120]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
(4
‑
叔丁基苯基)丙
‑2‑ꢀ
烯
‑1‑
酮
[0121]
参照实施例1,原料替换为4
‑
叔丁基苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
ꢀ‑
[1,1'
‑
联苯]
‑3‑
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加4
‑
叔丁基苯乙酮(178mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚: 乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粉末状固体0.366g,产率为83.6%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑ꢀ
联苯]
‑3‑
基)
‑1‑
(4
‑
叔丁基苯基)丙
‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:453.2[m+h]
+
,相对分子质量452.2,1hnmr(300mhz,cdcl3):δ1hnmr(300mhz,cdcl3)δ:8.48 (d,j=18.0hz,1h),8.06(d,j=6.0hz,2h),7.72(d,j=18.0hz,1h),7.57(d,j= 9.0hz,
2h),7.52(d,j=3.0hz,1h),7.25(d,3.0hz,1h),7.21
‑
7.09(m,3h),6.00 (m,2h),5.09(m,4h),3.42(dd,j=6.0,6.0hz,4h),1.34(s,9h)。
[0122]
实施例22
[0123]3‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
苯基丙
‑2‑
烯
‑1‑
酮
[0124]
参照实施例1,原料替换为苯乙酮,将5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑ꢀ
甲醛(294mg,1mmol)溶于乙醇中,加入10%koh溶液4ml,搅拌中滴加苯乙酮 (132mg,1.1mmol),室温搅拌反应24h,tlc检测反应,结束后,滴加稀盐酸至ph≈7,加入二氯甲烷,萃取3次,每次30ml,合并有机层,用无水硫酸钠干燥减压蒸除有机溶剂,得黄色粘稠状产物。利用柱色谱(石油醚:乙酸乙酯=5:1)层析,滤液浓缩后得到的固体于红外干燥器中干燥,得到暗黄色粘稠膏状固体0.204g,产率为51.5%。经鉴定为3
‑
(5,5'
‑
二烯丙基
‑
2,2'
‑
二羟基
‑
[1,1'
‑
联苯]
‑3‑
基)
‑1‑
苯基丙
ꢀ‑2‑
烯
‑1‑
酮,esi
‑
ms m/z:397.2[m+h]
+
,相对分子质量396.2,1hnmr(300mhz, cdcl3):δ:1hnmr(300mhz,cdcl3):δ8.48(d,18.0hz,1h),8.09(d,j=6.0hz, 2h),7.72(d,j=18.0hz,1h),7.63(m,1h),7.58
‑
7,50(m,3h),7.22(d,j=3.0hz, 1h)7.18
‑
7.09(m,3h),6.00(m,2h),5.09(m,4h),3.42(dd,6.0,6.0hz,4h)。
[0125]
实施例23
[0126]
人肝癌细胞株(hep
‑
g2,smmc
‑
7721)由中国科学院上海生物化学与细胞生物学研究所提供,人肝癌细胞株(hep
‑
g2,smmc
‑
7721)由凯基生物技术发展有限公司提供。人肝癌细胞株(hep
‑
g2,smmc
‑
7721)和人肝癌细胞株(hep
‑
g2, smmc
‑
7721)在含体积分数为10%胎牛血清的dmem培养液中分别培养,于 37℃、5%co2保持饱和湿度条件下培养,3
‑
4天传代一次。传代时用质量分数 0.25
‑
edta%胰酶消化1
‑
2min,弃去消化液,加入新的培养液吹打均匀,按所需细胞量移入新培养瓶中,添加完全培养液至适量。当hep
‑
g2,smmc
‑
7721, hepa1
‑
6分别长满后,消化、计数,种板,24h后,细胞换用不含胎牛血清的dmem 的培养基进行培养,并用不同浓度的上述实施例制备所得化合物(终浓度为 25μmol)孵育24h,然后加入5%的mtt,孵育4个小时,于492nm处测量吸光度,计算ic
50
值,结果如下表所示。
[0127]
[0128][0129]
根据统计结果可见,相较于厚朴酚和阳性对照索拉非尼,本申请合成的厚朴酚衍生物针对各肝癌细胞系的ic
50
值均有效提升。
[0130]
实施例24
[0131]
人肝癌细胞株(smmc
‑
7721)在含体积分数为10%胎牛血清的dmem培养液中培养,于37℃、5%co2保持饱和湿度条件下培养,3
‑
4天传代一次。传代时用质量分数0.25
‑
edta%胰酶消化1
‑
2min,弃去消化液,加入新的培养液吹打均匀,按所需细胞量移入新培养瓶中,添加完全培养液至适量。当smmc
‑
7721 分别长满后,消化、计数,种六孔板,24h后,细胞换用不含胎牛血清的dmem 的培养基进行培养,并用不同浓度实施例20制备所得化合物(终浓度为2.5μmol),并用枪头对空白组和给药组进行划痕,孵育24h,对0h组进行划痕,用pbs洗净,于倒置显微镜下观察拍照,结果如图1所示。根据图示可以明显看出,空白组间隙较0h组要窄许多,给药组均介于给药组与空白组中间,证明实施例20 制备所得化合物可以抑制细胞迁移。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1