一种光驱动循环式聚合酶链式反应微流控装置及其应用
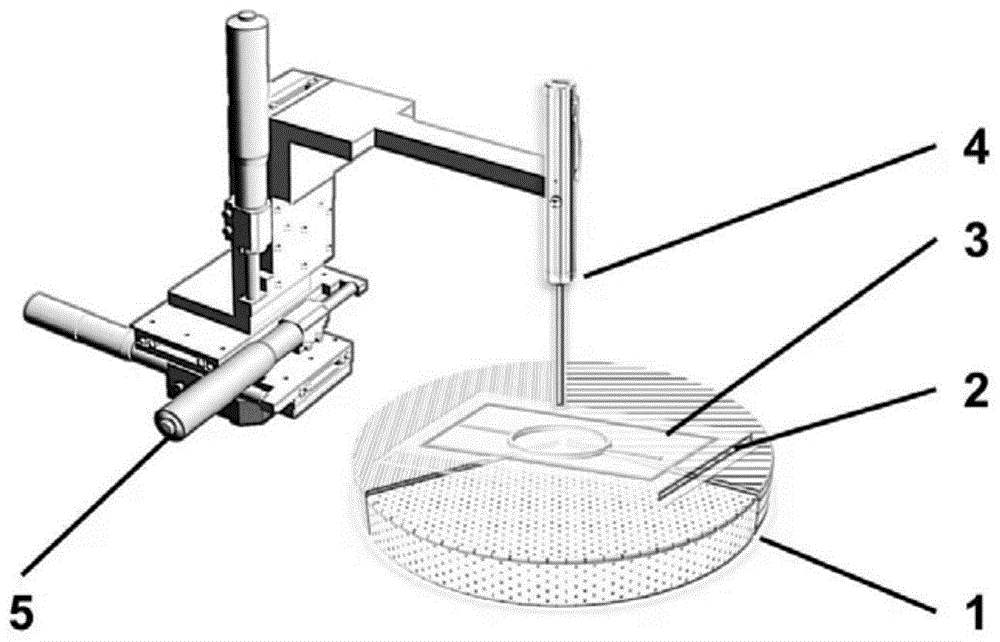
本发明涉及微流控技术领域,尤其是涉及一种光驱动循环式聚合酶链式反应微流控装置及其应用。
背景技术:
聚合酶链式反应(pcr)能够通过少量的dna或rna片段在不同温度区域的循环反应,在短时间内实现成倍复制扩增。利用微流控技术可以把常规的pcr集成到几平方厘米的芯片上,其体积小、携带方便、表面积和体积比值大、容易操作并且结果快速,可用于现场即时诊断,有效缩短检验周转期,为应急处置、急救实施提供了重要手段。目前微流控pcr主要有静态腔室型pcr、连续流动型pcr和闭环型pcr等,共同的特点都是可以缩小反应体系,实现反应液升降温的变化。静态腔室型反应液静止在反应腔室中,外部的热控装置反复升降温为整个腔室提供变化温度。连续流动型pcr是通过外接注射器泵或气动阀等来操控液体流经不同温区及在每个温区的停留时间,热惯性取决于液体自身的热质量,与芯片的关系较小,因而热循环效率较高。但受限于单向泵出的驱动方式,连续流动型的反应时间和反应次数受通道设计影响很大,因此针对所需而进行定制化设计的程度很高。通过闭合通道实现液体的循环控制是解决上述问题的有效手段,如何实现闭合通道内液体的驱动是其关键问题。目前循环式pcr芯片的驱动方式主要有热对流驱动和磁驱动两种,其中热对流pcr是基于rayleigh-be′nard原理,即密闭装置内存在温度不同的两区域,温度的差异使得不同位置处液体的密度不同,从而产生浮力差异进而产生热对流运动;磁驱动是通过在通道中安装磁性纳米粒子塞子,在外部磁场下推动液体流动。前者无法精确控制液体流速,容易造成体系温度扩散,影响反应效率,而后者纳米粒子容易堵塞进样口,并且会造成生物样品的接触污染。因此,开发非接触式、可精确操控流速的循环驱动方法对于微流控pcr装置十分必要。
技术实现要素:
本发明的目的在于提供一种光驱动循环式聚合酶链式反应微流控装置及其应用,以通过光控实现流速的精确控制,提升反应效率。
本发明的目的可以通过以下技术方案来实现:
本发明提供一种光驱动循环式聚合酶链式反应微流控装置,包括:微流控pcr芯片、光源控制单元、温度控制单元,所述微流控pcr芯片由光响应薄膜和带有闭合形状凹槽的基板粘结构成,所述基板上的凹槽与光响应薄膜形成闭合通道,所述闭合通道为样品进行pcr反应的场所;所述光源控制单元用于控制光斑照射样品溶液并跟随液体运动,驱动液体在闭合通道中循环流动;所述温度控制单元用于将微流控pcr芯片内闭合通道的不同区域分别加热至设定温度。
在本发明的一个实施方式中,所述光响应薄膜为能在光照下发生弯曲变形的材料,并且能够在pcr反应所需的温度(95℃以上)时保持光致形变能力。
在本发明的一个实施方式中,所述光响应薄膜的材料的种类包括但不限于液晶高分子、光响应凝胶膜、光响应聚酰亚胺、聚氨酯等工程塑料或橡胶。
在本发明的一个实施方式中,所述光响应薄膜的厚度为10-50μm,照射后所述光响应薄膜发生弯曲形变,响应时间≤5秒,响应温度范围为0-120℃。
在本发明的一个实施方式中,所述基板具有一定的耐热性能,维卡软化温度大于100℃。能够通过数控雕刻机、光刻、蚀刻、准分子激光加工、热压、注塑、3d打印等方式中的一种或几种进行加工。
在本发明的一个实施方式中,所述基板的材质可以是聚甲基丙烯酸甲酯(pmma)、聚碳酸酯(pc)、聚四氟乙烯(ptfe)、聚酰亚胺(pi)、环烯烃聚合物(coc)、玻璃、聚二甲基硅氧烷(pdms)等。
在本发明的一个实施方式中,所述基板的厚度为2-8mm,长宽范围为20-100mm;
所述基板上所加工闭合形状凹槽横截面选自半圆形、矩形或者梯形,半圆形的半径为10-5000μm,所述矩形的宽深范围均为10-5000μm;
在本发明的一个实施方式中,所述基板上的凹槽与光响应薄膜形成闭合通道的截面形状为环形时,则其半径为5-50mm;若闭合通道的截面形状为其它形状,则其最小外接圆的半径为5-50mm。
在本发明的一个实施方式中,所述闭合通道内壁经过亲水修饰处理形成修饰层,有助于样品水溶液在光控下的运动;所述修饰层为含无机硅酸盐纳米粒子的凝胶亲水涂层,或亲水性蛋白(如牛白蛋白)。
在本发明的一个实施方式中,所述基板上还设置有进样通道和出样通道,所述进样通道和出样通道均与闭合通道连通,所述进样通道和出样通道的宽度与闭合通道一致,所述进样通道和出样通道的深度范围为1-50μm,且在同一芯片中所述进样通道和出样通道的深度小于等于闭合通道的深度。
在本发明的一个实施方式中,样品注入后,利用密封胶封闭进样通道和出样通道。
在本发明的一个实施方式中,所述光源控制单元包括液体控制光源及光源平移装置,所述光源平移装置用于带动液体控制光源实现三自由度的移动,进而能够实现光源x、y、z三方向的移动,其中,x、y分别指同一平面上相垂直的两个坐标方向,z是指垂直于x、y所在平面,并分别垂直x、y的一个坐标方向。
在本发明的一个实施方式中,所述液体控制光源为紫外光、可见光或近红外光中的任意一种,所述液体控制光源是单点光源、线光源或阵列式集成光源中的任意一种,若光源为单点光源或线光源,需要加装光源平移装置。
在本发明的一个实施方式中,所述光源平移装置可以为机械传动式结构,采用已有技术即可实现,具有10μm以内的重复定位精度,10mm/min-100mm/min的光斑移动速度范围,不小于80mm×30mm的可控移动范围。
在本发明的一个实施方式中,所述液体控制光源置于微流控pcr芯片上方5-15cm处。
在本发明的一个实施方式中,所述温度控制单元包括加热片、控温器以及配套的电源,所述加热片设有两个及以上,各加热片相互独立能够将微流控pcr芯片内闭合通道的不同区域分别加热至相应的温度;所述加热片、控温器及电源通过电线相连,使不同加热片的温度能够独立调节。
各个加热片的温度通过控温器精确控制,并相互独立,不同加热片的温度可以相同,也可以不同,以满足不同种类dna扩增的需求。
在本发明的一个实施方式中,优选地,各加热片设置成扇形,且各加热片相互独立而又两两相邻,可以组成圆形。
本发明光驱动循环式聚合酶链式反应微流控装置使用时的连接方式为:
光响应薄膜与基板上表面通过热粘接的方式紧密贴合构成微流控pcr芯片,使基板上的凹槽与光响应薄膜形成闭合通道。样品注入后,利用密封胶封闭进样通道和出样通道,将微流控pcr芯片通过热粘胶粘贴于温度控制单元的加热片上。加热片、控温器及电源通过电线相连,使三个区域的温度可以独立调节。将光源控制单元的光源灯头置于微流控pcr芯片上方5-15cm处,将光源控制单元的光源固定于光源平移装置上,能够在微流控pcr芯片上方移动。控制光斑照射样品溶液并跟随液体运动,驱动液体在闭合通道中循环流动。
使用本发明光驱动循环式聚合酶链式反应微流控装置进行检测的检测步骤为:
1.在微流控pcr芯片通道内通过进样通道预导入pcr反应物混合液(包括模板dna、引物、taq聚合酶、荧光探针、dntp和缓冲液),用密封胶封闭进样通道和出样通道。
2.将微流控pcr芯片通过粘胶紧贴在加热片上,确保闭合通道不同区域在不同的加热片上,三个独立的扇形加热区块分别覆盖闭合通道的一部分。开启加热器,通过红外热成像仪测定三块区域的温度达到稳定。
3.开启光源,调节光斑初始位置与反应液一端对齐。设定光源平移装置的循环程序,操控光源跟随液体移动,确保光斑一直照射液体的末端。循环圈数1-100圈可调。
4.循环完成后,关闭光源和加热装置,待微流控pcr芯片冷却至室温后,取下置于荧光显微镜下,直接观察反应后液体的荧光情况,并根据荧光强度确定反应扩增程度。
与现有技术相比,本发明具有以下优点及有益效果:
本发明利用光作为微流控体系中液滴的驱动源,相较于传统注射泵驱动的微流控体系,光源体积小,可以实现非接触操控,因此可以有效减小整个pcr反应装置的体积,真正实现便携化的核酸扩增检测。同时,光可以实现远程精确操控。增加了流体的控制精度,并且非接触操控也有效避免了样品被污染的风险。
本发明技术中可以利用闭合通道实现反应的多次循环,相较于传统的单向驱动反应时间和反应次数不受通道设计影响,可以根据dna种类和浓度的不同设定扩增时间和次数,提高反应的准确性和可靠性。
传统注射泵驱动的微流控体系中的流体为连续相,在实际操作过程中,液体需要充满整个管道才能完成后端操作。这在一定程度会导致样品浪费,在珍贵样品以及痕量样品的检测中会受到一定限制。而在基于光流控操作中,流体为非连续相,一般为液柱,并且光能够精确控制液柱的位置,并操作液柱完成一系列后端操作,真正意义上实现了样品检测的低损耗。
光控液体运输是基于光致不对称形变诱导形成拉普拉斯压差的机理,液体驱动过程中产生的流体涡可以有效提高反应物之间的混合效率,缩减反应时间。
附图说明
图1为本发明实施例中涉及的光驱动循环式聚合酶链式反应微流控装置的结构示意图;
图2为实施例1中使用三温区式光控微流体pcr芯片的实验示意图;
图3为实施例2中使用两温区式光控微流体pcr芯片的实验示意图;
图4为实施例3中使用振荡式光控微流体pcr芯片的实验示意图。
具体实施方式
参考图1,本发明提供一种光驱动循环式聚合酶链式反应微流控装置,包括:微流控pcr芯片、光源控制单元、温度控制单元,所述微流控pcr芯片由光响应薄膜和带有闭合形状凹槽的基板粘结构成,所述基板上的凹槽与光响应薄膜形成闭合通道,所述闭合通道为样品进行pcr反应的场所;所述光源控制单元用于控制光斑照射样品溶液并跟随液体运动,驱动液体在闭合通道中循环流动;所述温度控制单元用于将微流控pcr芯片内闭合通道的不同区域分别加热至设定温度。
所述光响应薄膜为能在光照下发生弯曲变形的材料,并且能够在pcr反应所需的温度时保持光致形变能力。所述光响应薄膜的材料的种类包括但不限于液晶高分子、光响应凝胶膜、光响应聚酰亚胺、聚氨酯等工程塑料或橡胶。所述光响应薄膜的厚度为10-50μm,照射后所述光响应薄膜发生弯曲形变,光响应的反应时间≤5秒,响应温度范围0-120℃。
所述基板为硬质材质,具有一定的耐热性能,维卡软化温度大于100℃。能够通过数控雕刻机、光刻、热压、注塑、3d打印等方式中的一种或几种进行加工。所述基板的材质可以是聚甲基丙烯酸甲酯(pmma)、聚碳酸酯(pc)、聚四氟乙烯(ptfe)、聚酰亚胺(pi)、环烯烃聚合物(coc)等。所述基板的厚度为2-8mm,长宽范围为20-100mm;
所述基板上所加工闭合形状凹槽横截面选自半圆形或矩形,半圆形的半径为10-5000μm,所述矩形的宽深范围均为10-5000μm;所述基板上的凹槽与光响应薄膜形成闭合通道的截面形状为环形时,则其半径为5-50mm;若闭合通道的截面形状为其它形状,则其最小外接圆的半径为5-50mm。所述基板上还设置有进样通道和出样通道,所述进样通道和出样通道均与闭合通道连通,所述进样通道和出样通道的宽度与闭合通道一致,所述进样通道和出样通道的深度范围为1-50μm,且在同一芯片中所述进样通道和出样通道的深度小于等于闭合通道的深度。样品注入后,利用密封胶封闭进样通道和出样通道。
在本发明的一个实施方式中,所述闭合通道内壁经过亲水修饰处理形成修饰层,有助于样品水溶液在光控下的运动;所述修饰层为含无机硅酸盐纳米粒子的凝胶亲水涂层,或亲水性蛋白(如牛白蛋白)。
所述光源控制单元包括液体控制光源及光源平移装置,所述光源平移装置用于带动液体控制光源实现三自由度的移动,进而能够实现光源x、y、z三方向的移动,其中,x、y分别指同一平面上相垂直的两个坐标方向,z是指垂直于x、y所在平面,并分别垂直x、y的一个坐标方向。所述液体控制光源为紫外光、可见光或近红外光中的任意一种,所述液体控制光源是单点光源、线光源或阵列式集成光源中的任意一种,若光源为单点光源或线光源,需要加装光源平移装置。所述光源平移装置可以为机械传动式结构,采用已有技术即可实现,具有10μm以内的重复定位精度,10mm/min-100mm/min的光斑移动速度范围,不小于80mm×30mm的可控移动范围。所述液体控制光源置于微流控pcr芯片上方5-15cm处。
所述温度控制单元包括加热片、控温器以及配套的电源,所述加热片设有两个及以上,各加热片相互独立能够将微流控pcr芯片内闭合通道的不同区域分别加热至相应的温度;所述加热片、控温器及电源通过电线相连,使不同加热片的温度能够独立调节。各个加热片的温度通过控温器精确控制,并相互独立,不同加热片的温度可以相同,也可以不同,以满足不同种类dna扩增的需求。优选地,各加热片设置成扇形,且各加热片相互独立而又两两相邻,可以组成圆形。
本发明光驱动循环式聚合酶链式反应微流控装置使用时的连接方式为:
光响应薄膜与基板上表面通过热粘接的方式紧密贴合构成微流控pcr芯片,使基板上的凹槽与光响应薄膜形成闭合通道。样品注入后,利用密封胶封闭进样通道和出样通道,将微流控pcr芯片通过热粘胶粘贴于温度控制单元的加热片上。加热片、控温器及电源通过电线相连,使三个区域的温度可以独立调节。将光源控制单元的光源灯头置于微流控pcr芯片上方5-15cm处,将光源控制单元的光源固定于光源平移装置上,能够在微流控pcr芯片上方移动。控制光斑照射样品溶液并跟随液体运动,驱动液体在闭合通道中循环流动。
使用本发明光驱动循环式聚合酶链式反应微流控装置进行检测的检测步骤为:
1.在微流控pcr芯片通道内通过进样通道预导入pcr反应物混合液(包括模板dna、引物、taq聚合酶、荧光探针、dntp和缓冲液),用密封胶封闭进样通道和出样通道。
2.将微流控pcr芯片通过粘胶紧贴在加热片上,确保闭合通道不同区域在不同的加热片上,三个独立的扇形加热区块分别覆盖闭合通道的一部分。开启加热器,通过红外热成像仪测定三块区域的温度达到稳定。
3.开启光源,调节光斑初始位置与反应液一端对齐。设定光源平移装置的循环程序,操控光源跟随液体移动,确保光斑一直照射液体的末端。循环圈数1-100圈可调。
4.循环完成后,关闭光源和加热装置,待微流控pcr芯片冷却至室温后,取下置于荧光显微镜下,直接观察反应后液体的荧光情况,并根据荧光强度确定反应扩增程度。
下面结合附图和具体实施例对本发明进行详细说明。
实施例1
参考图2,三温区反应实现沙门氏菌dna的扩增
1、预反应混合液的配制:购买标准沙门氏菌核酸检测试剂盒,其中包括复溶液(提供缓冲溶液、mg2+等)、冻干样品(无活性的沙门氏菌dna)、冻干检测试剂(提供taq酶、引物、游离碱基等)。取50μl纯化水至“冻干样品”中,溶解后混匀,即为样品。再分别取22.5μl的“复溶液”于两管“冻干检测试剂”中,在高速离心机上溶解混匀,向其中一管加入2.5μl的之前配好的样品,另一管加入2.5μl的纯化水作为空白对照。混合好后得到pcr反应液,留作备用。
2、样品组的反应:用移液枪向芯片闭合通道内注入0.4μl样品,之后将密封胶涂覆于进样口和出样口,使体系密封。将芯片置于加热片上,用粘胶粘紧,并开启控温器,调节三个扇形加热区域的温度依次为60℃,72℃和94℃。待温度稳定后,采用光强为80mw/cm2的470nm蓝光驱动闭合通道内液体的运动,并控制液体在不同温区反应的时间。0s到10s时反应液处于高温区,此时dna的双链解螺旋成单链,10s到35s时引物与单链dna结合,35s到55s时游离的碱基按照互补配对原则重新形成双链dna,循环一圈则扩增一次,循环一圈的时间约为1min,分别循环5圈、10圈和20圈,时间分别为5min、13min和25min。
3、将反应完成的样品置于荧光显微镜下,调节荧光通道为fam通道,观察芯片内液体的荧光情况。
4、空白对照组的反应:为了对样品组的反应情况进行对照,将0.4μl空白样品注入另一片芯片中,保证两块芯片的通道尺寸、光响应薄膜膜厚等参数一致。以相同的方法操控空白样品循环5圈、10圈和20圈,时间分别为5min、13min和25min。
5、将反应完成的样品组和空白对照组通过毛细管吸出并收集于离心管中,通过琼脂糖凝胶电泳详细分析样品扩增情况。反应圈数越多,相应的凝胶电泳条带在紫外灯下的荧光越亮。以商用pcr仪反应30圈后的荧光强度为100%,分别得到20圈、10圈、5圈以及空白对照组的荧光强度为98.9%、34.3%、2.5%和1.2%。
实施例2:
参考图3,两温区反应实现沙门氏菌dna的扩增
1、预反应混合液的配制:购买标准沙门氏菌核酸检测试剂盒,其中包括复溶液(提供缓冲溶液、mg2+等)、冻干样品(无活性的沙门氏菌dna)、冻干检测试剂(提供taq酶、引物、游离碱基等)。取50μl纯化水至“冻干样品”中,溶解后混匀,即为样品。再分别取22.5μl的“复溶液”于两管“冻干检测试剂”中,在高速离心机上溶解混匀,向其中一管加入2.5μl的之前配好的样品,另一管加入2.5μl的纯化水作为空白对照。混合好后得到pcr反应液,留作备用。
2、样品组的反应:用移液枪向芯片闭合通道内注入0.4μl样品,之后将密封胶涂覆于进样口和出样口,使体系密封。将芯片置于加热片上,用粘胶粘紧,并开启控温器,调节其中两个加热区域的温度为60℃,另一个为94℃。待温度稳定后,采用光强为80mw/cm2的470nm蓝光驱动闭合通道内液体的运动,并控制液体在不同温区反应的时间。0s到10s时反应液处于高温区,此时dna的双链解螺旋成单链,10s到55s时引物与单链dna结合,同时游离的碱基按照互补配对原则重新形成双链dna,循环一圈则扩增一次,循环一圈的时间约为1min,分别循环5圈、10圈和20圈,时间分别为5min、13min和25min。
3、将反应完成的样品置于荧光显微镜下,调节荧光通道为fam通道,观察芯片内液体的荧光情况。
4、空白对照组的反应:为了对样品组的反应情况进行对照,将0.4μl空白对照样品注入另一片芯片中,保证两块芯片的通道尺寸、光响应薄膜膜厚等参数一致。以相同的方法操控空白样品循环5圈、10圈和20圈,时间分别为5min、13min和25min。
5、将反应完成的样品组和空白对照组通过毛细管吸出并收集于离心管中,通过琼脂糖凝胶电泳详细分析样品扩增情况。与三温区反应类似,两温区反应的圈数越多,相应的凝胶电泳条带在紫外灯下的荧光也越亮。
实施例3
参考图4,震荡式反应实现沙门氏菌dna的扩增
1、预反应混合液的配制:购买标准沙门氏菌核酸检测试剂盒,其中包括复溶液(提供缓冲溶液、mg2+等)、冻干样品(无活性的沙门氏菌dna)、冻干检测试剂(提供taq酶、引物、游离碱基等)。取50μl纯化水至“冻干样品”中,溶解后混匀,即为样品组。再分别取22.5μl的“复溶液”于两管“冻干检测试剂”中,在高速离心机上溶解混匀,向其中一管加入2.5μl的之前配好的样品,另一管加入2.5μl的纯化水作为空白对照。混合好后得到pcr反应液,留作备用。
2、样品组的反应:用移液枪向芯片闭合通道内注入0.4μl样品,之后将密封胶涂覆于进样口和出样口,使体系密封。将芯片置于加热片上,用粘胶粘紧,并开启控温器,调节其中两个加热区域的温度为60℃,另一个为94℃。待温度稳定后,采用光强为80mw/cm2的470nm蓝光驱动闭合通道内液体在两个温区间振荡运动,并控制液体在不同温区反应的时间。0s到20s时反应液处于高温区,此时dna的双链解螺旋成单链,20s到45s时引物与单链dna结合,同时游离的碱基按照互补配对原则重新形成双链dna,循环一圈则扩增一次,循环一次的时间约为45s,相较于环形循环时间显著缩短。
3、将反应完成的样品置于荧光显微镜下,调节荧光通道为fam通道,观察芯片内液体的荧光情况。
4、空白对照组的反应:为了对样品组的反应情况进行对照,将0.4μl空白样品注入另一片芯片中,保证两块芯片的通道尺寸、光响应薄膜膜厚等参数一致。以相同的方法操控空白样品循环振荡。
5、将反应完成的样品组和空白对照组通过毛细管吸出并收集于离心管中,通过琼脂糖凝胶电泳详细分析样品扩增情况。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!