一种检测羊源性成分的引物对和探针及其试剂盒和应用
1.本发明涉及一种检测羊源性成分的引物对和探针及其试剂盒和应用,属于生物技术和食品安全快速检测领域,特别涉及一种基于重组酶介导等温核酸扩增技术
‑
侧流免疫技术检测羊源性成分的引物对和探针及其试剂盒和应用。
背景技术:
2.肉类和肉制品被认为是人体蛋白质的重要来源,并已进化为一种基本的饮食成分,因其令人欣赏的味道和风味在世界各地被广泛消费。由于经济利润的诱惑(经济动机的掺假,ema),不道德的生产者可能会尝试用其他低廉的肉类代替羊肉。全球都发生了肉类掺假事件。2013年发生在英国和欧洲的马肉丑闻(即所谓的“马门”丑闻)是最著名的食品欺诈和污染事件之一,它证明了目前复杂的国际食品供应链中固有的脆弱性。肉类掺假直接威胁消费者的健康,削弱加工企业的信誉,破坏贸易秩序和公平竞争;此外,它还可能触犯某些国家或民族的饮食禁忌。因此,为了保护消费者的权益,避免不公平的市场竞争,提供一种可靠、高效、快速、准确的方法,能够准确地从肉制品中鉴别出动物种类,防止肉品变味的情况,势在必行。
3.目前,几种分析方法已被验证和开发用于筛选和监测肉类掺假,如光谱分析、电泳、酶联免疫吸附试验(elisa)、色谱分析等。应用最广泛的方法是聚合酶链反应(pcr),包括常规pcr、实时pcr、引物多重pcr、pcr
‑
rflp、高分辨率熔融(hrm)分析、pcr
‑
测序等。然而,现有的技术需要相当多的操作技能,昂贵的设备和漫长的过程,这些条件或资源局限都限制了食品肉类的检测应用。
4.近年新发展起来的核酸等温扩增技术,主要有核酸依赖性扩增检测技术(nuclear acid sequence
‑
based amplification,nasba)、环介导等温扩增技术(loop
‑
mediated isothermal amplification,lamp)、依赖解旋酶dna恒温扩增技术(helicase
‑
dependent isothermal dna amplification,hda)、滚环核酸扩增技术(rolling circle amplification,rca)、重组酶聚合酶扩增技术(recombinase polymerase amplification,rpa)、重组酶介导等温核酸扩增技术(recombinase aided amplification,raa)等。其基本原理均是模仿体内核酸复制机制,由各种蛋白酶参与反应,帮助dna聚合酶复制dna,以实现dna的等温扩增。与pcr相比,等温扩增技术使得核酸在恒温条件下得以扩增,摆脱了昂贵的热循环实验仪器,并且可在短时间内实现目的片段的指数扩增,使在多种非实验室条件下进行核酸扩增检测成为现实。
5.重组酶辅助扩增联合侧流免疫技术(recombinase assisted amplification
‑
lateral flow device,raa
‑
lfd),即将重组酶辅助扩增技术(raa)结合侧向流动免疫技术(lfd)的一种联用技术。我们拟基于raa
‑
lfd技术,构建一种适合于检测现场(超市、肉市场等)对肉品掺假快速检测的方法。
技术实现要素:
6.为了克服现有技术的不足,本发明目的是提供一种检测羊源性成分的扩增引物对和探针。
7.本发明另一目的是根据扩增引物对和探针提供一种基于重组酶介导等温核酸扩增技术
‑
侧流免疫技术检测羊源性成分的试剂盒。
8.本发明另一目的是提供基于重组酶介导等温核酸扩增技术
‑
侧流免疫技术检测羊源性成分的试剂盒的应用。
9.该试剂盒及其检测方法简便快速、适合于现场检测羊源性成分,对操作人员的技术要求、设备要求较低,适合现场快速检测,在食品安全的快速检测中有广阔的应用前景。
10.为了达到上述目的,本发明采用以下技术方案:
11.本发明提供一种检测羊源性成分的扩增引物对和探针,序列分别如下:
12.上游引物yang
‑
f:gcctctccagtattaaacttgc,如seq id no:1所示;
13.下游引物yang
‑
r:fitc
–
cgtttgcatgtttaagacagac,如seq id no:2所示;
14.探针yang
‑
pro:
15.biotin
–
cttcccactccacaagcccacataacaacc
‑
(h)
‑
atacaagaaaagcac
‑
pho,如seq id no:3所示;
16.其中,fitc为荧光基团;biotin为生物素;h为四氢呋喃位点;pho为磷酸化修饰。
17.该探针序列中插入一个dspacer四氢呋喃(thf)来模拟一个基本位点进行修饰位点,thf修饰核苷酸在dna聚合酶的作用下,可以高效地实现dna链的延伸。
18.本发明提供根据如上所述检测羊源性成分的扩增引物对和探针设计的试剂盒,所述试剂盒包括raa反应体系和lfd试纸条,所述lfd试纸条的检测线上带有生物素抗体和荧光基团抗体,质控线上带有亲和素
‑
胶体金特异性抗体。
19.进一步地,所述荧光基团抗体为fam抗体的纳米金粒。
20.将带有生物素标记、6
‑
羧基荧光激素fam标记的引物和探针与靶核酸进行扩增反应,产物为同时带有生物素和fam标记的扩增子。lfd试纸条前端是靠近浸液区的检测线,靠近手持端吸液区即后端是质控线。lfd试纸条前端检测线带有fam抗体的纳米金粒,检测线上还带有生物素抗体,将扩增产物滴到试纸条上,扩增子上的fam基团与fam抗体反应,检测线处的生物素抗体与扩增子上的生物素结合后,检测线上显示条带,未被捕获的产物与质控线处的亲和素
‑
胶体金特异性抗体结合显示条带。
21.fam标记也可根据需要选择合适的其他标记,如地高辛标记进行应用。
22.检测线与质控线条带颜色,根据胶体金粒径和还原剂选择的改变,肉眼所看到颜色会有改变,但不影响检测结果,可根据需要选择合适的胶体金粒径和还原剂。
23.进一步地,所述raa反应体系包括在raa反应通用干粉中加入以下体积比组成:
[0024][0025]
更进一步地,所述raa反应体系中,所述raa反应通用干粉的加入量为1μg/10~30μl;所述raa反应通用干粉中包括有:重组酶,bst dna聚合酶,ssb蛋白,修复酶,dntps。
[0026]
所述raa反应通用干粉为raa基础通用反应试剂冻干粉。例如江苏奇天基因生物科技有限公司产品,每管2μg冻干粉,反应规格为50μl,即每50μl反应体系加入raa基础通用反应试剂冻干粉2μg。本领域技术人员可以根据需要选择合适的raa基础通用反应试剂产品进行应用。
[0027]
更进一步地,所述tris
‑
hcl缓冲液浓度为300mm,ph=8.0。
[0028]
更进一步地,所述上游引物yang
‑
f的浓度为10μm;下游引物yang
‑
r的浓度为10μm;探针yang
‑
pro的浓度为10μm。
[0029]
更进一步地,所述mgaco的浓度为280mm,加入量为体积百分比4%。
[0030]
更进一步地,所述试剂盒反应条件为37~42℃条件下反应15~25min。
[0031]
更进一步地,所述试剂盒还包括有阳性对照;所述阳性对照为根据羊的d
‑
loop基因的序列,合成标靶区域的质粒。
[0032]
更进一步地,所述阳性对照的制备包括以下步骤:
[0033]
根据ncbi中羊的d
‑
loop基因的序列,以羊源性成分检测用引物对上游引物yang
‑
f、下游引物yang
‑
r进行目的序列克隆测序后,使用质粒dna小量提取试剂盒提取阳性克隆质粒dna,以紫外分光光度计测出质粒dna的od
260
值,按照公式od
260
:1od=50μg/ml dsdna,及羊源性成分的特异性扩增片段对应的重组质粒的分子量计算质粒dna的拷贝数,获得的不同拷贝数的质粒dna溶液于
‑
20℃冻存备用;
[0034]
所述质粒dna拷贝数的计算公式:
[0035]
质粒拷贝数=质粒浓度
×
6.02
×
10
23
/(660
×
质粒总长度);
[0036]
所述拷贝数包括但不限于:1
×
100拷贝/μl、1
×
101拷贝/μl、1
×
102拷贝/μl、1
×
103拷贝/μl、1
×
104拷贝/μl和1
×
105拷贝/μl、1
×
106拷贝/μl、1
×
108拷贝/μl。
[0037]
本发明提供如上所述检测羊源性成分试剂盒的应用,用于检测羊源性成分,所述检测包括以下步骤:
[0038]
a、样本留取:用无菌剪刀留取待检测样品至无菌离心管,待用;
[0039]
b、dna提取:采用5%chelex
‑
100提取待测肉样品的dna,获得样品dna提取液;
[0040]
c、raa反应体系:每个样品按以下体积百分比配制:59%tris
‑
hcl缓冲液、4.2%上游引物yang
‑
f、1.2%探针yang
‑
pro、4.2%下游引物yang
‑
r、4%样品dna提取液或阳性对照或阴性质控样本、21.8~25.4%ddh2o,依次加入到已分装raa反应通用干粉的反应管中,最
后加入2~5.6%mgaco进行反应;将反应管放置在37~42℃条件下反应15~25min,得到扩增产物;
[0041]
d、吸取扩增产物至新的反应管中,稀释50~300倍;
[0042]
e、lfd试纸条检测:将lfd试纸条的浸液区端插入稀释后的反应管中,待判读区域全部浸润,将试纸平放1
‑
3min,等待条带出现;
[0043]
f、根据所述lfd试纸条显色情况直接读取检测结果:仅在质控线出现一条线,表明样品中无羊源性成分,或其拷贝数低于试剂盒最低检测限;出现两条线,一条位于检测线,另一条位于质控线,表示样品中存在羊源性成分;质控线无条带出现,表明核酸试纸条失效。
[0044]
进一步地,步骤c中,所述mgaco的加入量为体积百分比4%。
[0045]
进一步地,步骤c中,所述mgaco于最后加入反应管盖内壁,加后扣上管盖帽才进行下一个样品raa反应体系的加样操作。主要是因为mgaco加入后即启动反应,以防止气胶溶的扩散。
[0046]
进一步地,步骤c中,实验组、对照组之间的加样顺序为先完成对照组阴性质控样本ddh20的raa反应体系的配制,再进行实验组样品dna提取液、阳性对照组的raa反应体系的配制。
[0047]
进一步地,lfd试纸条10min内观察结果,10min后判读无效。
[0048]
与现有技术相比,本发明具有以下有益效果:
[0049]
本专利基于重组酶介导等温核酸扩增技术侧流免疫(raa
‑
lfd)技术,是raa技术和lfd技术的联合应用,提供了一种新的羊源性成分掺假现场检测方法,可实现肉眼结果的可视化检测。相较于其他检测方法,此方法检测灵敏度高,可稳定检测初始模板低至1
×
101拷贝/μl的raa扩增产物,操作简便快速,整个检测过程也仅需20
‑
30分钟即可完成,无需专门设备,结果准确可以满足现场样本的检测,特别适合农贸市场、超市、批发市场等现场检测。
附图说明
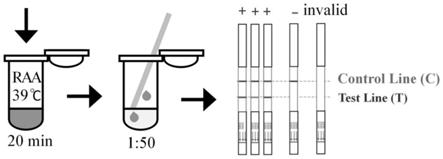
[0050]
图1为本发明重组酶介导等温核酸扩增技术侧流免疫技术的检验程序;
[0051]
图2为本发明重组酶介导等温核酸扩增技术侧流免疫技术的原理;
[0052]
图中:图a为双向引物重组酶聚合酶扩增;图b为探针与靶核酸进行扩增反应;图c为侧流免疫技术检测;
[0053]
图3为实施例中羊源性成分检测用探针和引物位置的示意图;
[0054]
图4为实施例中一次性核酸检测试纸条结构示意图;
[0055]
图5为实施例中一次性核酸检测试纸条结果判读示意图;
[0056]
图6为效果试验例1中羊源性成分核酸试纸条检测体系灵敏度及特异性试验结果;
[0057]
图7为效果试验例1中raa
‑
lfd检测方法和引物特异性评价结果;
[0058]
图8为效果试验例2中羊源性成分核酸试纸条检测体系扩增精密性和重复性试验结果;
[0059]
图9为效果试验例4中使用横向流动试纸(左)和电泳(右)评估raa
‑
lfd检测中不同mgaco浓度结果;
[0060]
图10为效果试验例4中使用横向流动试纸(左)和电泳(右)评估raa
‑
lfd检测中不
同孵育时间结果;
[0061]
图11为效果试验例4中使用横向流动试纸(左)和电泳(右)评估raa
‑
lfd检测中不同扩增温度结果。
具体实施方式
[0062]
重组酶介导等温核酸扩增技术侧流免疫技术检测程序如图1所示,具体工作原理如下:
[0063]
重组酶介导等温核酸扩增技术侧流免疫技术(recombinase aided amplification
‑
lateral flow device,raa
‑
lfd),是指将重组酶介导等温核酸扩增技术(raa)结合侧向流动免疫试纸条(lfd)的一种联用技术,其原理如图2所示:用带生物素标记、6
‑
羧基荧光激素fam标记的引物和探针与靶核酸进行扩增反应,最终形成同时带有fam基团和生物素标记的扩增子。lfd试纸条前端是靠近浸液区的检测线,靠近手持端吸液区即后端是质控线。lfd试纸条前端检测线带有fam抗体的纳米金粒,检测线上还带有生物素抗体,将扩增产物滴到试纸条上,扩增子上的fam基团与检测线上的fam抗体反应,检测线处的生物素抗体与扩增子上的生物素结合,检测线上显示红色条带,未被捕获的产物与质控线处的亲和素
‑
胶体金特异性抗体结合显示蓝色条带。检测线与质控线条带颜色,根据胶体金粒径和还原剂的不同,肉眼所看到颜色会有不同。
[0064]
现结合附图与具体实施例对本发明作进一步说明。
[0065]
实施例
[0066]
1、样本留取
[0067]
用无菌剪刀留取待检测样品至无菌离心管,待用。
[0068]
2、dna提取
[0069]
采用5%chelex
‑
100提取待测肉样品的dna。
[0070]
3、raa
‑
lfd
[0071]
3.1、羊源性成分的特异性序列扩增引物和探针设计
[0072]
下载羊(nc_001941.1)线粒体基因组全序列,以羊的d
‑
loop基因的序列作为靶基因,分析羊序列特点并与常见掺假肉类物种序列做比对,包括鸭(nc_009684.1)、牛(nc_006853.1)、猪(nc_000845.1)、鸡(nc_040902.1),应用primer premier 5.0软件设计种属特异性扩增引物。探针序列位于扩增引物中间区段,经四氢呋喃修饰。引物设计遵循以下原则:
[0073]
(1)物种间引物pcr退火温度一致,扩增产物介于150~350bp;
[0074]
(2)引物具有物种特异性,不会在非本物种模板下发生非特异性扩增;
[0075]
(3)引物可以在pcr与raa中通用;
[0076]
(4)探针长度约为45~60bp;使用美国国家生物技术信息中心(ncbi)的blast功能对引物扩增区段序列进行比对,完成引物扩增特异性的初步鉴定。
[0077]
探针序列中插入一个dspacer四氢呋喃(thf)来模拟一个基本位点。
[0078]
通过鉴定的引物交由杭州擎科梓熙生物技术有限公司合成,纯度级别为hplc。引物具体序列、探针及扩增下游引物标记情况、扩增片段大小详细见表1和图3。
[0079]
表1羊源性成分现场检测试剂盒raa扩增引物序列
[0080][0081][0082]
其中,thf:tetrahydrofuran四氢呋喃;fitc:fluorescein isothiocyanate异硫氰酸荧光素;biotin:生物素标记;pho:phosphorylation磷酸化修饰。
[0083]
3.2、raa反应体系及反应时间
[0084]
按照表2进行raa反应体系的配制(单个样品/反应)。体系设计是经过实验优化的。往raa反应通用干粉管中依次加入50μl raa反应体系各组分:tris
‑
hcl缓冲液、上游引物yang
‑
f、探针yang
‑
pro、下游引物yang
‑
r、样品dna提取液或阳性对照、ddh2o、mgaco,进行核酸的恒温体外扩增。raa反应通用干粉中包括有:重组酶,bst dna聚合酶,ssb蛋白,修复酶,dntps;购买自江苏奇天基因生物科技有限公司,每管2μgraa反应通用冻干粉,反应规格为50μl。tris
‑
hcl缓冲液浓度为300mm,ph=8.0。mgaco最后加入反应管盖内壁,加后扣上管盖帽才进行下一个样品raa反应体系的加样操作。实验组和对照组的加样顺序为阴性质控样本ddh2o、待检样本(梯度稀释的羊源性成分重组质粒或羊源性成分待检样裂解液),每个样本添加完毕后均需立即扣好管盖,避免气溶胶污染。阴性质控样本先加可避免气溶胶污染以造成质控样本假阳性。最后将反应管放置在39℃条件下反应25min。
[0085]
表2 raa反应体系
[0086]
组分用量(μl)tris
‑
hcl缓冲液29.5上游引物yang
‑
f(10μm)2.1探针yang
‑
pro(10μm)0.6下游引物yang
‑
r(10μm)2.1质粒或样品裂解液2mgaco(280mm)2以ddh2o补足体积至50
[0087]
3.3、lfd操作
[0088]
raa反应结束后,打开eppendorf管,吸取扩增产物至一新的eppendorf管中,做好标记,并稀释50倍,马上进行试纸条检测。lfd试纸条结构见图4,lfd试纸条前端检测线上带有fam抗体的纳米金粒,检测线上还带有生物素抗体,质控线上带有亲和素
‑
胶体金特异性抗体。
[0089]
lfd操作步骤如下:将lfd试纸条的浸液区端(标示蓝色箭头向上)插入eppendorf管,液面不得超过浸液区的max指示线,待判读区域全部浸润(约需30
‑
60sec),将试纸平放
1
‑
3min,等待红色条带出现。根据试纸条显色情况直接读取检测结果。本方法一般1min左右即能出现条带,10min内观察结果,10min后判读无效。
[0090]
实验判断标准见图5,每个测试样品至少出现一条质控线,有或无检测线。阴性对照仅出现一条蓝线(在质控线c)。阳性对照出现两条线,一条位于检测线(t),呈红色,另一条位于质控线(c),呈蓝色。仅在质控线出现一条蓝线,表明样品中无羊源性成分,或其拷贝数低于试剂盒最低检测限。出现两条线,一条位于检测线(t),另一条位于质控线(c),表示样品中存在羊源性成分。质控线无蓝色条带出现,表明核酸试纸条失效。
[0091]
效果试验例1敏感性及特异性试验
[0092]
标准质粒构建:
[0093]
根据ncbi中羊的d
‑
loop基因的序列,合成标靶区域的质粒。羊源性成分检测用引物进行目的序列克隆测序后,使用质粒dna小量提取试剂盒提取阳性克隆质粒dna,之后以紫外分光光度计测出质粒dna的od
260
值,按照公式od
260
:1od=50μg/ml dsdna,及羊源性成分的特异性扩增片段对应的重组质粒的分子量计算质粒dna的拷贝数,获得的不同拷贝数的质粒dna溶液于
‑
20℃冻存备用。
[0094]
按照下面的公式获得质粒的拷贝数:
[0095]
质粒拷贝数=质粒浓度
×
6.02
×
10
23
/(660
×
质粒总长度)
[0096]
计算拷贝数并稀释至1
×
108拷贝/μl,
–
20℃保存备用。
[0097]
以1
×
106拷贝/μl作为比对盘原液,进行10
‑1×
比对盘原液样本,10
‑2×
比对盘原液样本,10
‑3×
比对盘原液样本,10
‑4×
比对盘原液样本,10
‑5×
比对盘原液和10
‑6×
比对盘原液样本梯度稀释对比。将已定值的重组质粒稀释至1
×
105拷贝/μl,再10倍系列稀释,获得1
×
100拷贝/μl、1
×
101拷贝/μl、1
×
102拷贝/μl、1
×
103拷贝/μl、1
×
104拷贝/μl和1
×
105拷贝/μl稀释液为后续扩增模板,
‑
20℃保存备用。
[0098]
利用试剂盒进行raa扩增和试纸条检测,获得产品的检测下限为1
×
102拷贝/μl。在初始模板为1
×
103~1
×
106拷贝/μl的情况下,试纸条显色速度很快,从试纸条插入pcr反应管,至条带显色不超过3分钟。当初始模板拷贝数为1
×
101~1
×
102拷贝/μl的情况下,阳性样品的t线显色时间与高拷贝数一致,仅条带略浅,由此可见,本检测体系的灵敏度均可稳定检测初始模板低至1
×
101拷贝/μl的raa扩增产物,整个检测过程也仅需3分钟即可完成。同时以牛肉、鸡肉、鸭肉质粒和超纯水作为阴性对照的情况下,试纸条的检测均显示为阴性。结果如图6所示,阴性1~3号试纸条的扩增初始模板分别为牛肉dna、鸡肉dna和鸭肉dna,阳性4~10号试纸条的扩增初始模板分别为羊源性成分核酸拷贝数为100~106拷贝/μl。
[0099]
图7为raa
‑
lfd检测方法(左)和引物(右)的特异性评价结果,可以看出本发明提供的raa
‑
lfd检测方法能够成功完成羊源性成分的特异性检测。
[0100]
效果试验例2精密性和重复性试验
[0101]
以超纯水作为阴性对照,以1
×
100拷贝/μl、1
×
101拷贝/μl、1
×
102拷贝/μl的重组质粒为模板,进行3次平行试验(a、b和c)。结果如图8所示,本检测体系均可稳定检测初始模板低至1
×
101拷贝/μl的raa扩增产物,且保证阴性对照无假阳性,检测结果稳定可靠。
[0102]
效果试验例3对比验证实例
[0103]
利用本发明raa
‑
lfd联合技术与多重pcr进行对比的实验验证,结果如下表3所示。
[0104]
表3 raa
‑
lfd联合技术与多重pcr的检测结果
[0105][0106]
由表3检测实例可以看出,本发明提供的raa
‑
lfd检测方法能够特异性检测羊源性成分,且具有可实现肉眼结果的可视化检测、高灵敏度、操作简便快速的优势,整个检测过程也仅需20
‑
30分钟即可完成。
[0107]
效果试验例4 raa反应体系优化评价
[0108]
使用横向流动试纸和电泳评估raa
‑
lfd检测中不同mgaco浓度,通过调整镁盐浓度以优化达到最佳raa
‑
lfd条件。首先,对5种浓度的mgaco(1μl,1.5μl,2.0μl,2.5μl,2.8μl的280mm mgaco储备液)进行实验,探索raa反应中mg离子的最佳浓度,以鉴定羊源性成分。我们评估mgaco浓度范围的反应温度是39℃和反应时间20min。结果如图9所示,5种浓度的mgaco均能实现羊源性成分的鉴定,实验线的dna条带和亮度随着mgaco浓度的变化而变化,这表明mgaco浓度对raa扩增效率至关重要。dna带的强度和亮度测试线显示最优280mm mgaco添加体积为2μl。
[0109]
使用横向流动试纸和电泳评价raa
‑
lfd检测的不同孵育时间(15min~25min),在39℃和最佳mgaco浓度下考察培养时间在raa反应体系中对羊源性成分检测特异性的影响。结果如图10所示,从图10中我们发现,扩增时间为15min~25min时,均能看到清晰条带,当扩增时间增加到20min时,可以看到明显的测试信号,因此我们选择20min作为最佳孵育时间。
[0110]
使用横向流动试纸和电泳评价raa
‑
lfd检测的不同扩增温度(37℃~42℃),使用最佳的mgaco浓度和20分钟的孵育时间来评估孵育温度,以评估培养温度在raa反应体系中对羊源性成分检测特异性的影响。结果如图11所示,在37、39和42℃进行raa
‑
lfd检测时,没有观察到测试线的差异,都具有明显的检测线,说明在这个温度范围内进行raa反应都是合适的。
[0111]
本发明并不局限于上述实施方式,如果对本发明的各种改动或变型不脱离本发明
的精神和范围,倘若这些改动和变型属于本发明的权利要求和等同技术范围之内,则本发明也意图包含这些改动和变动。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1