EMA处理结合微控芯片数字PCR检测肉制品中单增李斯特菌的方法
ema处理结合微控芯片数字pcr检测肉制品中单增李斯特菌的方法
技术领域
1.本发明涉及微生物检测技术领域,具体涉及ema处理结合微控芯片数字pcr检测肉制品中单增李斯特菌的方法。
背景技术:
2.单核细胞增生李斯特氏菌(listeria monocytogenes,lm)简称单增李斯特菌,是常见食源性致病菌,也是一种人畜共患病的病原菌。该菌可引起人畜的李氏杆菌病,感染后主要表现为败血症、脑膜炎和单核细胞增多。其广泛存在于自然界中,在4℃的环境中仍可生长繁殖,单增李斯特菌污染的食品严重威胁人类的健康。单核增生李斯特菌在全球范围内是最常见的食源性致病菌之一,是肉制品检验中的必检病原菌。我国近几年肉制品进出口贸易量大,检测任务繁重。目前食品中单增李斯特菌的检验方法有传统的分离培养法、环介导恒温扩增(lamp)、免疫磁珠法等,这些检测方法都需要采集样品进行增菌实验、分离培养,耗时较长。
3.国内外对单增李氏菌的检测方法大体上可分为两类,一类为常规检测方法,另一类为快速检测方法。目前国家标准gb 4789.30-2016《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》中认可的3种方法都属于常规检测方法。标准第一法适用于食品中该菌的定性检验;第二法适用于该菌含量较高的食品中单增生李斯特菌的计数;第三法适用于该菌含量较低食品的检测。三种方法所需时间为别为4-5d、1-2d和3-4d,结果较为准确,但程序繁琐,耗时均较长。gb/t 22429-2008《食品中沙门氏菌、肠出血性大肠埃希氏菌o157及单核细胞增生李斯特氏菌的快速筛选检验酶联免疫法》、sn/t 2552.12-2010《乳及乳制品卫生微生物学检验方法》第12部分:单核细胞增生李斯特氏菌检测与计数法、sn/t 2754.4-2011《出口食品中致病菌环介导恒温扩增(lamp)检测方法》第4部分:单核细胞增生李斯特菌、sn/t 0184.3-2008《进出口食品中单核细胞增生李斯特氏菌检测方法免疫磁珠法》、sn/t 4525.9-2016《出口食品中致病菌的分子分型mlst方法》第9部分:单核细胞增生李斯特氏菌等标准规定的方法虽各有优点,但均需要进行增菌实验,耗时较长,而且增菌实验中培养基成分易对荧光pcr造成干扰,造成假阳性,造成不必要的召回或退回而引起浪费。2010年美国密苏里大学发明了一种利用ema结合qpcr更灵敏更为迅速的沙门氏菌检测方法,仅仅5到12小时就可以完成测试,因为ema只选择性通过死菌细胞膜进而阻止dna进行pcr扩增,从而可以结合qpcr技术快速检测出活的沙门氏菌数量,给人们带来众多启示。叠氮溴化乙锭(edthidium monoazide bromide,ema)是一种具光亲和标记特性的荧光核酸染料。ema经光分解后,可渗透到细胞壁(细胞膜)不完整的细胞内(即非活菌),共价结合到溶液和损伤的细胞核酸上,从而阻断聚合酶链式反应的进行。数字pcr即digital pcr(dpcr),是一种核酸分子绝对定量技术。而近几年来发展的数字pcr方法可以不经增菌,直接提取样品dna进行检测,避免了培养基的干扰,同时可精确得出dna原始的copy数,快速而准确。第三代pcr技术相较于qpcr,数字pcr能够直接数出dna分子的个数,是对起始样品的
绝对定量,可精确地对靶dna或rna分子中的细微变化进行定量分析,检测和监测病原体的灵敏度更高。传统的单增李斯特菌检测的方法,需要对样品进行全部的前后增菌处理,耗时长,利用dpcr法则无需进行严格的前后增菌实验,可相应减少耗时。对此,可将ema处理与dpcr技术相结合,来检测单增李斯特菌。
4.目前数字pcr商品化平台可以分为三种类型,包括微流控芯片数字pcr系统(cdpcr)、基于液滴的数字pcr系统(ddpcr)和基于微反应室/孔板的数字pcr系统即微控芯片数字pcr(quantstudio 3d数字pcr)。2006年,quantalife利用油包水微滴生成技术开发了微滴式数字pcr技术;2013年,life technologies推出了quantstudio 3d数字pcr系统。芯片是反应体系在芯片小孔中进行;微滴是反应体系在油包水中进行。两者实际原理一样,只是反应体系所处的物理介质不同。其中微控芯片数字pcr:分割方式稳定性好,均一性好,成本相对较高一些;微滴式数字pcr:分割反应速度快,成本低,但其稳定性差、微滴易融合,数据分析要求相对较高。与此同时,微控芯片数字pcr操作流程为封闭式,其密封性更好,更能有效避免病毒扩散和交叉污染,微滴式数字pcr具有开放性操作。程逸宇等的《微滴数字pcr定量检测乳制品中单核细胞增生李斯特氏菌》公开了运用qx200微滴式数字pcr系统检测单核细胞增生李斯特氏菌的方法,与微控芯片数字pcr系统(quantstudio 3d数字pcr相比,两者所用试剂、材料及反应总体系均不同。基于微控芯片的数字pcr系统运用的是美国thermo fisher的quantstudio 3d仪,目前尚未见基于微控芯片的数字pcr系统用于细菌检测的相关报道。所以需要一种方法能够将ema处理与微控芯片数字pcr系统结合来检测肉制品中单增李斯特菌,开发利用ema处理与dpcr技术相结合的检测方法,以更为快速、准确地检测肉制品中单增李斯特菌活菌量,有利于提高进出口食品微生物检验的效率和权威。
技术实现要素:
5.针对上述现有技术,本发明的目的是提供ema处理结合微控芯片数字pcr检测肉制品中单增李斯特菌的方法。本发明是一种快速、简便、特异性强、灵敏度高、稳定性良好的仅检测单增李斯特菌活菌的有效方法。
6.为实现上述目的,本发明采用如下技术方案:
7.本发明的第一方面,提供一种检测单增李斯特菌的引物探针组合,包括上游引物、下游引物和探针,所述上游引物序列如seq id no.1所示(5
’‑
ccatcaatcaaaataatgcagacat-3’);所述下游引物序列如seq id no.2所示(5
’‑
aatgaatcacgttttacagggagaa-3’);所述探针序列如seq id no.3所示(5
’‑
fam-tcgagcctaacctatccaggtgctctcg-bhq1-3’)。
8.本发明的第二方面,提供上述引物探针组合在检测单增李斯特菌中的应用。
9.本发明的第三方面,提供利用上述引物探针组合进行ema处理结合微控芯片数字pcr检测肉制品中单增李斯特菌的方法,包括以下步骤:
10.(1)增菌培养得到增菌培养液;
11.(2)使用ema处理步骤(1)得到的增菌培养液,提取模板dna;
12.(3)步骤(2)所得模板dna进行微控芯片数字pcr反应,进行扩增反应;
13.(4)收集读取阴性、阳性微滴的数量后传至数据处理软件得到最终定量检测结果。
14.优选的,步骤(1)中,增菌培养的方法:
15.对于食品样品:称取或吸取1g(1ml)样品,加入到10ml李斯特菌选择性培养液lb1中,30
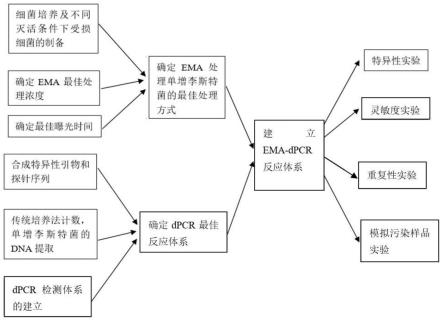
±
1℃增菌8
±
1h后,吸取1ml,12000rmp离心5min,弃上清,沉淀菌体中加入1.5ml李斯特菌选择性培养液lb1。
16.对于菌培养物:挑取1-2个菌落至1.5ml李斯特菌选择性培养液lb1中,30℃
±
1℃,摇菌5
±
1h,至浑浊。
17.对于菌液:直接取1.5ml菌液,或吸取50μl菌液加入1.5ml的李斯特菌选择性培养液lb1中,30℃
±
1℃,摇菌2-5h,至浑浊。
18.更为优选的,所述李斯特菌选择性培养液lb1为取225ml的李斯特菌特异性培养液lb,加入5mg萘啶酮酸,3mg吖啶黄素,混匀,得到李斯特菌选择性培养液lb1;所述李斯特菌特异性培养液lb为:酪蛋白酪蛋白胨5.0g/l,多价蛋白胨5.0g/l,酵母5.0g/l,nacl 20.0g/l,磷酸二氢钠12.0g/l,磷酸二氢钾1.4g/l,七叶皂苷1.0g/l。
19.优选的,步骤(2)中,ema的处理浓度为20μg/ml,光作用时间为20min。
20.优选的,步骤(3)中,所述微控芯片数字pcr的反应体系为:quantstudio 3d digital pcr master mix v2预混液7.3μl,seq id no.1所示的上游引物和seq id no.2所示的下游引物终浓度均为0.6pmol/μl,seq id no.3所示的探针终浓度为0.25pmol/μl,模板1.4μl,用水补足至15μl。
21.优选的,步骤(3)中,反应扩增条件为:96℃,10min(预变性);60℃,2min;98℃,30sec(延伸),42个循环;60℃,2min,10℃,维持。
22.优选的,步骤(4)中,最低菌液检出限度为20cfu/ml,灵敏度为1copy/μl。
23.本发明的有益效果:
24.(1)本发明的ema-dpcr检测方法将是一种快速、简便、特异性强、灵敏度高、稳定性良好的仅检测单增李斯特菌活菌的有效方法。该法标准程序的建立,将提高肉制品中单增李斯特菌检验的效率和精确度,尤其有利于进出口肉制品的快速通关。
25.(2)本发明的方法中copy数与单增李斯特菌的模板菌液浓度呈线性关系,r2等于0.9995,最低菌液检出限度为20cfu/ml,灵敏度为1copy/μl。本发明建立了切实可行的肉制品中单增李斯特菌ema-dpcr快速检测方法及标准程序,消除“假阳性”的结果,其灵敏度更高,特异性强,稳定性良好,预期可在12小时内完成对肉制品中单增李斯特菌的准确检验,可提高进出口肉制品单增李斯特菌检测的效率和准确性。
26.(3)本发明的引物+探针特异性强,可特异性检测出单增李斯特菌,其相同种属的格氏李斯特菌、威尔氏李斯特菌、西尔氏李斯特菌、伊氏李斯特菌、英诺克李斯特菌及其他重要食源性细菌如金黄色葡萄球菌株、大肠杆菌、沙门氏菌均检测不出。同时该引物+探针的检测灵敏度高,为1.0copy/μl,是至今为止已知的单增李斯特菌检测中灵敏度最高的。
附图说明
27.图1为本发明检测方法的技术路线;
28.图2为确定dpcr最佳反应体系的反应结果图,a:1.5ng/μl模板浓度的dpcr反应结果图;b:1.5ng/μl模板浓度的dpcr反应阴阳微滴峰值图;c:阴性对照的dpcr反应结果图;d:阴性对照的dpcr反应阴阳微滴峰值图;
29.图3为特异性试验dpcr结果,a-j:分别以单增李斯特菌、英诺克李斯特菌、格氏李
斯特菌、伊氏李斯特菌、西尔李斯特菌、威尔李斯特菌、大肠杆菌、金黄色葡萄球菌、猪伤寒沙门氏菌和阴性对照为模板的dpcr反应结果图;k-t:分别以单增李斯特菌、英诺克李斯特菌、格氏李斯特菌、伊氏李斯特菌、西尔李斯特菌、威尔李斯特菌、大肠杆菌、金黄色葡萄球菌、猪伤寒沙门氏菌和阴性对照为模板的dpcr反应阴阳微滴峰值图。
30.图4为重复性试验结果;
31.图5为灵敏度试验结果,图5-a中,c0-c7分别为模板菌液浓度为2cfu/ml,2
×
101cfu/ml,2
×
102cfu/ml,2
×
103cfu/ml,2
×
104cfu/ml,2
×
105cfu/ml,2
×
106cfu/ml,2
×
107cfu/ml的dpcr反应结果图;图5-b为分别以c7-c0菌液浓度为模板的dpcr结果copy数柱状图;图5-c中为在菌液浓度2
×
10
3-106cfu/ml范围内,dpcr结果copy数与待测菌液浓度的线性关系图。
具体实施方式
32.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
33.正如背景技术部分介绍的,第三代pcr技术相较于qpcr,数字pcr能够直接数出dna分子的个数,是对起始样品的绝对定量,可精确地对靶dna或rna分子中的细微变化进行定量分析,检测和监测病原体的灵敏度更高。传统的单增李斯特菌检测的方法,需要对样品进行前后的增菌处理,耗时长,利用dpcr法则无需进行严格的前后增菌实验,可相应减少耗时。基于微控芯片的数字pcr系统运用的是美国thermo fisher的quantstudio 3d仪,目前尚未见基于微控芯片的数字pcr系统用于细菌检测的相关报道。基于此,本发明的目的是提供ema处理结合微控芯片数字pcr检测肉制品中单增李斯特菌的方法。
34.首先,现有检测技术中单增李斯特菌培养耗时长,需要前后增菌,本发明选用李斯特菌选择性培养基与培养液。菌液培养的方法为:单核细胞增生性李斯特菌(菌液),取50μl已有菌液,加入到5ml的lb1中,30℃,摇菌4-8h,至可见明显浑浊;本发明中,李斯特菌的培养需要4-8小时,大大缩短了单增李斯特菌的培养时间。另取50μl已有菌液,加入李斯特氏菌显色培养基的板中,37℃,培养24h以上,至可见明显蓝色的菌落(周围带透明环)。李斯特菌特异性培养液lb成分(g/l):酪蛋白酪蛋白胨5.0,多价蛋白胨5.0,酵母5.0,nacl 20.0,磷酸二氢钠12.0,磷酸二氢钾1.4,七叶皂苷1.0。传统培养方法中前后增菌实验分别用到lb1,lb2培养液。李斯特菌选择性培养液lb1的制备方法为:取225ml的lb,加入5mg萘啶酮酸,3mg吖啶黄素,混匀得到李斯特菌选择性培养液lb1;李斯特菌选择性培养液lb2的制备方法为:取200ml的lb,加入4mg萘啶酮酸,5mg吖啶黄素,混匀,得到李斯特菌选择性培养液lb2。而本技术只需不完全的前增菌实验,仅用到lb1,无需用到lb2。
35.其次,确定ema处理的最佳条件。细菌的核酸提取,采用商品化的试剂盒提取,比以往粗体的方法得到的细菌核酸的结果更加准确,从而使得最终确定的ema处理的方法条件更加准确,确定ema处理单增李斯特菌的处理方式的方法为:取经过热处理的菌液(100℃沸水浴15min)与正常菌液,分别装于1.5ml的离心管中(每管1ml,共60管)。向已有菌液中分别加入ema,使ema终浓度为0μg/ml、5μg/ml、10μg/ml、15μg/ml、20μg/ml、25μg/ml,混合体系振荡5sec后,暗处孵育10min,进行光作用(将菌液置于卤钨灯下方18cm处,分别曝光0、5、10、
15、20min),作矩阵处理后,使ema最大限度进入到受损细胞内。将处理后的菌液,严格按照onestep-lysistm bacteria dna kit试剂盒步骤提取模板dna,进行qpcr反应,重复3次。
36.选取可完全抑制热处理后得到的死菌菌液的pcr扩增,即死菌的ct值为阴性,同时适合正常活菌菌液的pcr扩增,即活菌的ct值为阳性,同时两者ct值差值最大的ema处理浓度与光作用时间,作为ema最佳处理浓度。由表1可知,ema最佳处理浓度为20μg/ml,最佳光作用时间为20min。
37.表1确定ema处理的最佳条件
[0038][0039]
再次,确定dpcr最佳反应体系。本发明是首次将微控芯片数字pcr技术用于细菌的检测,首次确定单增李斯特菌微控芯片数字pcr反应体系。选择单增李斯特菌hly基因的lm溶血素(listeriolysin o,llo)保守区,设计探针和特异性引物。在探针3'端用淬灭荧光染料bhq1标记,5'端用报告荧光染料6-carboxyfluorescein(fam)标记,其特异性强,灵敏度高。
[0040]
如图2所示,探索确定dpcr最佳反应体系,体系组成为:quantstudio 3d digital pcr master mix v2预混7.3μl,上下游引物终浓度均为0.6μmol/l,探针终浓度为0.25μmol/l,模板(阳性对照:核酸浓度分别为30,3,1.5,1,0.5,0.05,0.03ng/μl;阴性对照:灭菌的ddh2o)1.4μl,用水补足至15μl。反应扩增条件为:96℃,10min(预变性);60℃,2min;98℃,30sec(延伸),39个循环;60℃,2min,10℃,维持。
[0041]
经过dpcr的反应探索,为确保结果的精准性,最终体系为:quantstudio 3d digital pcr master mix v2预混7.3μl,上下游引物终浓度均为0.6μmol/l,探针终浓度为0.25μmol/l,模板(阳性对照:核酸浓度为1.5ng/μl;阴性对照:灭菌的ddh2o)1.4μl,用水补足至15μl。反应扩增条件为:96℃,10min(预变性);60℃,2min;98℃,30sec(延伸),42个循环;60℃,2min,10℃,维持。
[0042]
最后,数字pcr可实现灵敏且精确的绝对靶位点定量,利用阳性和阴性pcr反应的数目计算样本中的绝对目标分子数,无需参照标准曲线。最低菌液检出限度为20cfu/ml,灵敏度为1copy/μl。
[0043]
为了使得本领域技术人员能够更加清楚地了解本技术的技术方案,以下将结合具体的实施例详细说明本技术的技术方案。
[0044]
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道
购买得到。
[0045]
实施例1
[0046]
拟一待检肉样,检测是否有单增李斯特活菌。
[0047]
(1)于待检测肉样,采用五点取样法,取5g左右的肉样,充分剪碎,加入50ml的李斯特菌特异性培养液lb1中,30℃,220rmp,摇菌4-8小时。
[0048]
(2)取上述菌液1ml,用ema最佳处理条件处理:最佳处理浓度为20μg/ml,最佳光作用时间为20min,用商品化试剂盒,提取细菌dna。
[0049]
(3)用所得模板dna进行dpcr反应,quantstudio 3d digital pcr master mix v2预混7.3μl,上下游引物终浓度均为0.6μmol/l,探针终浓度为0.25μmol/l,模板(阳性对照:核酸浓度为1.5ng/μl;阴性对照:灭菌的ddh2o)1.4μl,用水补足至15μl。反应扩增条件为:96℃,10min(预变性);60℃,2min;98℃,30sec(延伸),42个循环;60℃,2min,10℃,维持。分析数据。
[0050]
(4)若dpcr结果copy数>1,则判断为阳性,待检肉样中有单增李斯特菌活菌存在;若copy数<1,则判断为阴性,待检肉样中无单增李斯特菌活菌存在。
[0051]
实施例2
[0052]
(1)特异性试验
[0053]
为验证方法的特异性,对一定浓度的以下菌株的活菌悬液进行ema-dpcr反应扩增:一株单增李斯特菌标准株(10403s)、一株英诺克李斯特菌(分离株)、一株格氏李斯特菌、一株威尔氏李斯特菌、一株西尔氏李斯特菌、一株伊氏李斯特菌、一株金黄色葡萄球菌株、一株大肠杆菌、一株猪伤寒沙门氏菌。
[0054]
同时对上述菌株,进行增菌试验,并用ema最佳处理条件同时对其处理,后用商品化细菌dna提取试剂盒,提取其核酸,得到模板dna。用已确定的最佳dpcr反应体系,进行数字pcr反应,分析数据,获得其特异性试验结果:ema-dpcr检测单增李斯特菌具有较高的特异性。如图3所示,dpcr结果数据:单增李斯特菌为2038.8copies/μl,其余均小于1copyies/μl,即为阴性。其中,a-j:分别以单增李斯特菌、英诺克李斯特菌、格氏李斯特菌、伊氏李斯特菌、西尔李斯特菌、威尔李斯特菌、大肠杆菌、金黄色葡萄球菌、猪伤寒沙门氏菌和阴性对照为模板的dpcr反应结果图;k-t:分别以单增李斯特菌、英诺克李斯特菌、格氏李斯特菌、伊氏李斯特菌、西尔李斯特菌、威尔李斯特菌、大肠杆菌、金黄色葡萄球菌、猪伤寒沙门氏菌和阴性对照为模板的dpcr反应阴阳微滴峰值图。
[0055]
(2)重复性试验
[0056]
以2
×
106cfu/ml的单增李斯特菌的活菌样作为模板提取样本,进行ema-dpcr方法检测。分别进行批内和批间重复性试验,利用拷贝数计算变异系数进行重复性评估。
[0057]
将浓度为2
×
106cfu/ml的单增李斯特菌的活菌菌液作为模板提取样本,用ema-dpcr方法检测,进行批内(样品标号1,2,3)与批间(样品标号4,5,6)重复性试验,试验得到的阳性微滴的拷贝数结果如图4所示。从批内重复结果可知,其变异系数为1.03%、1.17%;批间重复结果可知,其变异系数为0.58%,这表明ema-dpcr方法检测具有良好的重现性。
[0058]
(3)灵敏度试验
[0059]
为验证方法的灵敏度,将浓度为2
×
107cfu/ml的单增李斯特菌菌液10倍梯度倍比稀释,分别标记为c7-c0。各取1ml菌液提取模板dna,进行ema-dpcr方法检测。d pcr结果显
示:阴性对照中,阳性微滴只有1个,可忽略不计,阴性对照成立,说明系统中没有污染或非特异性扩增。在c0样品中,阳性微滴为4(》5可判为阳性)判断为阴性,达到最低检测限度。此外,在c7-c1样品中,反应生成的微滴数均大于12000个,所有反应微滴的形成均正常,结果可靠。随着c7-c1浓度的降低,dpcr结果的阳性微滴数和拷贝数逐渐减少,如图5(a)和图5(b)所示。ema-dpcr的灵敏度可达1.0copy/μl,最低检出限度为101cfu/ml。同时,在菌液浓度为2
×
10
3-106cfu/ml范围内,dpcr结果拷贝数与待测菌液浓度呈良好的线性关系(r2=0.9995),如图5(c)所示。
[0060]
试验例:模拟污染样品试验
[0061]
取肉制品7份,分别称取1g,剪碎、研磨,加入到10ml的李斯特菌选择性培养液(lb1)中。取其中3份样品,分别加入1ml浓度为5
×
107,5
×
106,5
×
105cfu/ml的单增李斯特菌活菌菌液;另取3份样品,分别加入1ml浓度为5
×
107,5
×
106,5
×
105cfu/ml的单增李斯特菌死菌菌液;取1份样品,单独仅加入1ml浓度为107cfu/ml的英诺克李斯特菌(作为阴性可控对照)。按《食品安全国家标准食品微生物学检验单增细胞增生李斯特氏菌检验》(gb 4789.30-2016)方法对上述加标样品进行单增李斯特菌分离鉴定。同步,将7份处理的样品,30℃
±
1℃增菌8h左右后用ema-dpcr方法检测,以验证两种检测方法结果是否一致。实验结果与传统国标方法相同,具体结果数据见表2。
[0062]
表2模拟污染样品试验结果
[0063][0064]
注:模拟样品1没有dpcr结果,这是因为菌液浓度过大,由于微控芯片数字pcr系统本身的特点,模板浓度过高会造成实验数据的不成立,其与微控芯片数字pcr系统的高灵敏度相对应。该模拟实验模拟的为高浓度下的菌体量,实际检测中不会含有如此高的菌液浓度。间接反映了,本技术无需进行长时间的增菌实验,灵敏度高。
[0065]
试验结果表明:ema-dpcr方法结果中其copy数与单增李斯特菌的模板菌液浓度呈线性关系,r2等于0.9995,最低菌液检出限度为20cfu/ml,灵敏度为1copy/μl。综上,本实验建立了切实可行的肉制品中单增李斯特菌ema-dpcr快速检测方法及标准程序,消除“假阳性”的结果,其灵敏度更高,特异性强,稳定性良好,预期可在12小时内完成对肉制品中单增李斯特菌的准确检验,可提高进出口肉制品单增李斯特菌检测的效率和准确性。
[0066]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1