一种制备人工熊胆粉的工程酿酒酵母及方法
本发明属于生物技术和医药领域,具体涉及采用工程酿酒酵母制备人工熊胆粉的方法。
背景技术:
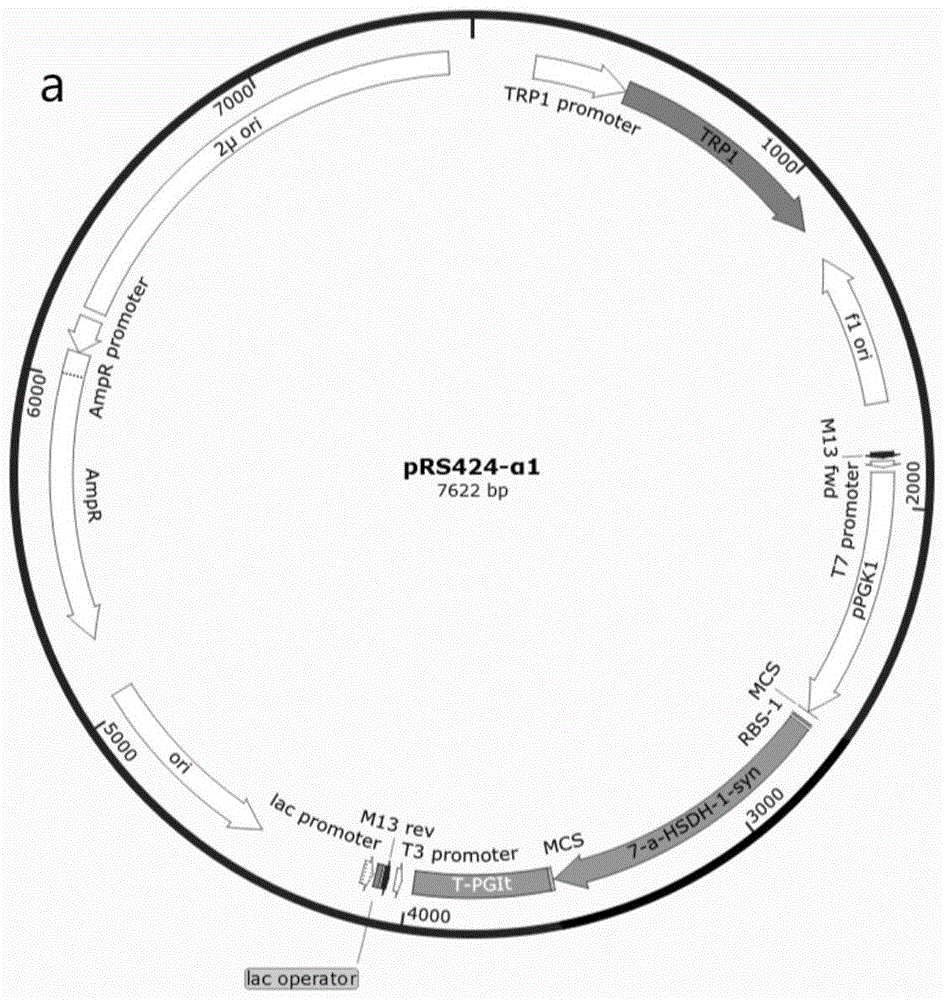
:熊胆粉为熊科动物黑熊(ursusthibetanus)、棕熊(ursusarctos)等经胆囊手术引流胆汁而得的干燥品,临床作为熊胆药物使用,具有清热解毒、平肝明目、杀虫止血等功效,临床多用于治疗肝胆和眼科疾病。胆汁酸类是熊胆粉中含量最高且研究最多的活性成分,其主要有效成分为牛磺熊去氧胆酸(tudca)。当前,活体引流熊胆汁是获取熊胆粉的主要方式,并形成产业规模。活体引流技术分无管和有管两种。通常需要选择健康的熊,麻醉后,开腹先进行手术埋管或造瘘。有管引流可能会导致插管处频繁出现炎症,从而影响胆汁的产量和质量,严重的还会使胆汁引流中断。无管引流是在手术时选择胆囊合适部位置管进行人工造瘘,待导管排出后,创口基本愈合,即可形成胆囊底瘢痕组织和瘘道。这些方式都会严重危害熊科动物的健康与保护,故争议极大。天然熊胆粉的特征活性成分为牛磺熊去氧胆酸(tudca),也含有牛磺鹅去氧胆酸(tcdca),且tudca:tcdca在1.0:1.0~1.5:1.0之间。家禽胆汁与熊胆汁在化学成分组成上的差异为:家禽胆汁中牛磺鹅去氧胆酸(tcdca)为主要成分,且不含有tudca。化学结构上,tudca是tcdca在c-7位羟基的差向异构体。研究表明,tudca可由tcdca经由氧化还原化学反应生成。tcdca依次经过7α-羟基类固醇脱氢酶(7α-hsdh)和7β-羟基类固醇脱氢酶(7β-hsdh)的催化转变成tudca。其反应方程式如下图所示:将生物技术应用于熊去氧胆酸化合物的定向生物合成,由此将低值的家禽胆汁制品转化为高附加值产物,既可以作为熊胆粉的替代资源,可以很大程度上解决药用熊胆粉来源问题,也可以作为新的药用资源,具有强大竞争力和潜力。酿酒酵母被称为绿色安全微生物,广泛应用于食品医药行业。利用工程改造酿酒酵母对家禽胆汁中tcdca进行定向转化,在人工熊胆粉方面具有较为突出的优势。通过基因工程技术调控关键酶表达量与活性,可以实现tcdca到tudca定向转化,从而实现资源的综合利用,更加有效地解决医药市场需求。技术实现要素:本发明旨在提供一种用于生产人工熊胆粉的工程酿酒酵母。本发明提供了一种用于生产人工熊胆粉的方法。本发明通过遗传改造的酿酒酵母中表达的外源酶将家禽胆汁制品中的牛磺鹅去氧胆酸(tcdca)成分转化为一定比例的牛磺熊去氧胆酸(tudca)。本发明要解决的技术问题在于采用绿色安全的工程酿酒酵母,以家禽胆汁制品为底物,通过工程酿酒酵母制备的粗酶,在体外将底物中的牛磺鹅去氧胆酸(tcdca)部分地原位转化为牛磺熊去氧胆酸(tudca)的方法,提供一种绿色、健康、环保的以安全型酿酒酵母为载体,通过表达外源酶催化制备人工熊胆粉的方法。为了解决上述问题,本发明采用的技术方案如下:一种工程酿酒酵母,含有7α-hsdh基因的重组载体和7β-hsdh基因的重组载体。7α-hsdh基因和7β-hsdh基因分别表达7α-羟基类固醇脱氢酶和7β-羟基类固醇脱氢酶。7α-hsdh分别来源于撒丁岛梭菌(clostridiumsardiniensestraindsm599,genbank登录号:jn191345.1)和大肠杆菌(escherichiacolistraintw14359,genbank登录号:cu928163.2);7β-hsdh基因分别来源于撒丁岛梭菌(clostridiumsardiniensestraindsm599,genbank登录号:jn191345.1)和活泼瘤胃球菌(ruminococcusgnavusstrainn53,genbank登录号:kf052988.1);分别采用http://www.jcat.de/在线软件以大肠杆菌为宿主菌,根据密码子偏好性,对上述两个7α-hsdh和7β-hsdh全基因序列进行密码子优化,并进行全基因合成,分别记为α1、α2、β1、β2,其核苷酸序列分别如seqidno.1-no.4所示。所述的7α-hsdh基因的核苷酸序列如seqidno.1或seqidno.2所示;所述的7β-hsdh基因的核苷酸序列如seqidno.3或seqidno.4所示;更优选的,所述7α-hsdh基因的核苷酸序列如seqidno.2所示,7β-hsdh基因的核苷酸序列如seqidno.4所示。所述的载体为prs424和prs426质粒;更进一步,7α-hsdh基因连接到prs424质粒上,7β-hsdh基因连接到prs426质粒上;所述的酿酒酵母宿主菌为cen.pk2-1c或w303a,更优选的,所述的酿酒酵母宿主菌为cen.pk2-1c。所述工程酿酒酵母的构建方法如下:(1)载体构建:将7α-hsdh和7β-hsdh基因分别连接到载体上得到重组载体;(2)工程酿酒酵母构建:将连接了7α-hsdh和7β-hsdh基因的重组载体分别转导到酿酒酵母菌感受态细胞中,得到工程酿酒酵母。优选的,步骤(1)中,所述的7α-hsdh基因的核苷酸序列如seqidno.1或seqidno.2所示;所述的7β-hsdh基因的核苷酸序列如seqidno.3或seqidno.4所示;更优选的,所述7α-hsdh基因的核苷酸序列如seqidno.2所示,7β-hsdh基因的核苷酸序列如seqidno.4所示。所述的载体为prs424和prs426质粒;更进一步,7α-hsdh基因连接到prs424质粒上,7β-hsdh基因连接到prs426质粒上;步骤(2)所述的酿酒酵母菌为cen.pk2-1c或w303a,更优选的,所述的酿酒酵母菌为cen.pk2-1c。携带重组载体的工程酿酒酵母发酵后收集菌体,破碎取粗酶液。可以用酸洗玻璃珠法或者均质机破碎法制备粗酶液。具体的,取工程酿酒酵母菌体,洗涤后用细胞破碎缓冲液重悬,采用酸洗玻璃珠涡旋混合-冰浴,重复3-15次,充分裂解细胞;或采用匀质机破碎细胞,所得混合物即为粗酶液。细胞破碎缓冲液组成如下:ph4.5~7.5、含0~15wt%甘油的5~200mm磷酸钠盐缓冲液。优选的,细胞破碎缓冲液中甘油含量为0~5wt%。粗酶液可以进一步干燥制成粗酶粉;可采用冷冻干燥或者真空冷冻干燥制备粗酶粉。上述工程酿酒酵母、粗酶粉或者粗酶液可以在体外将底物中的牛磺鹅去氧胆酸(tcdca)部分地原位转化为牛磺熊去氧胆酸(tudca),因此可以用于制备人工熊胆粉。一种制备人工熊胆粉的方法,步骤包括:(1)将家禽胆汁制品溶液、nadp+溶液、粗酶液或复溶于水溶液中的粗酶粉混合均匀,将混匀后液体置于20~37℃孵育反应20分钟-24小时;优选的,在25~35℃下孵育反应;所述的家禽胆汁制品溶液为ph4.5~7.5的5~200mm磷酸钠盐缓冲液和家禽胆汁制品混合物;反应体系中,家禽胆汁制品的含量为3-30g/l,优选为4-25g/l;以nadpna计,反应体系中nadp+的含量为0.06-0.15g/l,优选为0.1g/l;含有7α-hsdh基因的重组载体和7β-hsdh基因的重组载体的工程酿酒酵母经过破碎得到所述的粗酶液或者粗酶粉菌;反应体系中粗酶液或者粗酶粉溶液的体积比为5%-50%,优选为12%-35%;粗酶液与酵母工程菌培养液体积比为1-3:100;(2)停止反应,过滤或离心,取无沉淀清液;停止反应的方法为沸水浴5~10分钟,冷却;(3)过大孔树脂用水和乙醇溶液洗脱,浓缩干燥得到人工熊胆粉;具体为:用h2o洗脱至无色,再用85%-95%(体积浓度)乙醇冲至洗脱液无色并收集该部分洗脱液。减压旋蒸,浓缩液过有机滤膜,滤液水浴挥至浸膏状,真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。步骤(1)所述的粗酶液通过以下方法制备:含有携带7α-hsdh基因的重组载体和携带7β-hsdh基因的重组载体的工程酿酒酵母菌发酵后,收集菌体,破碎取粗酶液。粗酶液可以进一步干燥制成粗酶粉;可采用冷冻干燥或者真空冷冻干燥制备粗酶粉。进一步,所述的7α-hsdh基因的核苷酸序列如seqidno.1或seqidno.2所示;7β-hsdh基因的核苷酸序列如seqidno.3或seqidno.4所示。优选的,所述7α-hsdh基因的核苷酸序列如seqidno.2所示,7β-hsdh基因的核苷酸序列如seqidno.4所示。所述的酿酒酵母菌为cen.pk2-1c。所述的载体为prs424和prs426质粒;更进一步,7α-hsdh基因连接到prs424质粒上,7β-hsdh基因连接到prs426质粒上。所述工程酿酒酵母的发酵方法为:(1)工程酿酒酵母种子菌制备:工程酿酒酵母在sd-trp--ura-固体平板上活化工程酿酒酵母细胞,25℃~37℃培养2~6天;挑取携带重组质粒的酿酒酵母单菌落,接种到含有sd-trp--ura-液体培养基中,25℃~37℃,120~300rpm摇床中培养12~48小时;(2)菌液按照1-10%接种量接种到含有sd-trp--ura-培养基的三角瓶中,25℃~37℃,120~300rpm摇床培养16~72小时。优选的,接种量为3%-5%,更优选为5%。所述的sd-trp--ura-固体培养基的组成如下:minimalsdbase15~40g/l,dosupplement-trp/-ura0.5~5g/l,琼脂粉4~20g/l。所述的sd-trp--ura-液体培养基的组成如下:minimalsdbase15~40g/l,dosupplement-trp/-ura0.5~5g/l。所述的minimalsdbase成分组成如下:硫酸铵、微量元素、葡萄糖按比例混合而成。所述的dosupplement-trp/-ura成分组成如下:缺失色氨酸和尿嘧啶的do添加剂。与现有技术相比,本发明具有如下有益效果:1)选用的绿色安全的酿酒酵母菌cen.pk2-1c和w303a作为工程酿酒酵母宿主菌,易于培养,转化产物安全、健康;粗酶液制备过程操作简便、易于控制,粗酶液酶活性稳定,粗酶粉且复溶于水溶液后酶活性稳定;2)选用密码子优化的7α-hsdh和7β-hsdh基因作为修饰宿主菌的工程基因,其表达水平高,酶的催化稳定、可控;3)采用本方法,底物中牛磺鹅去氧胆酸(tcdca)转化速度快,可在较短时间内得到一定比例的tudca,tudca与tcdca比例在1~1.5之间;4)混合液反应过程操作简便、易于控制,对人工熊胆粉的理论研究及药用价值的广泛利用具有重要贡献。酿酒酵母被称为绿色安全微生物,广泛应用于食品医药行业。本发明利用工程改造酿酒酵母对家禽胆汁中tcdca进行定向转化,在人工熊胆粉方面具有较为突出的优势。通过基因工程技术调控关键酶表达量与活性,可以实现tcdca到tudca定向转化,从而实现资源的综合利用,更加有效地解决医药市场需求。附图说明图1为prs424-α1单基因表达载体图谱。图2为prs424-α2单基因表达载体图谱。图3为prs426-β1单基因表达载体图谱。图4为prs426-β2单基因表达载体图谱。图5为工程酿酒酵母反应液样品hplc图谱。具体实施方式为了更好的理解本发明的实质,下面将结合附图和实施例来对本发明做进一步的详细说明。应当理解,此处所描述的具体实施方式仅仅用于解释本发明,并不用于限定本发明。sd-trp--ura-固体培养基的组成如下:minimasdbase15~40g/l(硫酸铵、微量元素、葡萄糖按比例混合而成,购自北京酷来博科技有限公司),dosupplement-trp/-ura(缺失色氨酸和尿嘧啶的do添加剂)0.5-5g/l,琼脂4~20g/l。sd-trp--ura-液体培养基的组成如下:minimalsdbase15~40g/l,dosupplement-trp/-ura0.5~5g/l。破碎缓冲液组成如下:ph4.5~7.5、含5%甘油的5~200mm磷酸钠盐缓冲液。实施例1工程酿酒酵母构建与菌体收集(1)载体构建:将两个7α-hsdh和两个7β-hsdh基因(其核苷酸序列分别如seqidno.1-no.4)采用双酶切、t4连接酶连接法分别连接到prs424和prs426质粒载体上,分别命名为prs424-α1、prs424-α2、prs426-β1、prs426-β2。其结构分别如图1-图4所示。(2)工程酿酒酵母构建:将prs424-α1、prs424-α2、prs426-β1、prs426-β2分别转化到酿酒酵母菌cen.pk2-1c和w303a感受态细胞中,得到工程酿酒酵母cen.pk2-1c-prs424-α1-prs426-β1、cen.pk2-1c-prs424-α1-prs426-β2、cen.pk2-1c-prs424-α2-prs426-β1、cen.pk2-1c-prs424-α2-prs426-β2、w303a-prs424-α1-prs426-β1、w303a-prs424-α1-prs426-β2、w303a-prs424-α2-prs426-β1、w303a-prs424-α2-prs426-β2,分别记为cen-α1β1、cen-α1β2、cen-α2β1、cen-α2β2、w3-α1β1、w3-α1β2、w3-α2β1、w3-α2β2。(3)工程酿酒酵母培养:用接种环蘸取保种的上述携带重组质粒工程酿酒酵母的甘油菌,在sd-trp--ura-固体平板上划线,活化工程酿酒酵母细胞,30℃培养箱中倒置培养2~3天,至长出白色单菌落。挑取单菌落,接种到含有sd-trp--ura-液体培养基中,30℃,220rpm摇床中培养24小时。按照5%接种量接种到含有sd-trp--ura-液体培养基中,30℃,220rpm摇床继续培养24小时。(4)收集菌体:收集10毫升细胞培养液,2200rpm,4℃离心5分钟,弃上清。用500μl无菌水重悬,转移到离心管中,4℃高速离心(13000rpm)30秒,弃去上清,菌体细胞-80℃冻存备用。实施例2工程酿酒酵母cen-α2β2的培养(1)用接种环蘸取保种cen-α2β2甘油菌,将-80℃冰箱保存的工程酿酒酵母用划线法涂布到含有sd-trp--ura-的固体平板上划线,活化工程酿酒酵母细胞,于30℃培养箱中倒置培养2~3天,至长出白色单菌落。(2)挑取酿酒酵母单菌落,接种到含有毫升的sd-trp--ura-液体培养基的15毫升无菌管中,于30℃、220rpm摇床中培养24小时,所得为一级种子液。(3)将上述第(2)步中得到种子液按照5%接种量,接种到含有15毫升sd-trp--ura-液体培养基的50毫升无菌管中,于30℃、220rpm摇床培养24小时。所得既可以作为二级种子液用于后续放大培养,也可以作为工程酵母培养液用于菌体收集。(4)将上述第(3)步中得到菌液按照5%接种量,接种到1~3个含有2升sd-trp--ura-液体培养基的5升三角瓶中,于30℃、220rpm摇床培养24小时。所得即为工程酿酒酵母放大培养液,用于菌体收集。实施例3酸洗玻璃珠法制备粗酶液和粗酶粉(1)按实施例2第(3)步的10毫升工程酿酒酵母培养液,2200rpm,4℃离心5分钟,弃上清。(2)用500μl无菌水重悬菌体,转移到离心管中,4℃、13000rpm高速离心60秒,弃上清,菌体细胞-80℃冻存备用。(3)用500μl细胞破碎缓冲液(50mm磷酸钠盐缓冲液,ph6.5,5%甘油)重悬菌体,2200rpm,4℃离心5分钟,弃上清。(4)用150μl细胞破碎缓冲液重悬菌体,加入相同体积的酸洗玻璃珠(424~600μm),涡旋混合-冰浴(涡旋混合30秒,冰浴30秒,重复10次,总时间10分钟),以充分裂解细胞。(5)12000rpm离心5~10分钟,将上清液转移到新的离心管中,所得即为粗酶液;或于冷冻干燥机中干燥,即得粗酶粉。所得粗酶液和粗酶粉置于-20℃~-80℃冰箱保存备用。其他工程酿酒酵母菌用同样的方法制备粗酶液和粗酶粉。实施例4匀质机破碎法制备粗酶液和粗酶粉(1)按实施例2第(4)步操作得到的6升工程酿酒酵母培养液,于3500rpm、4℃离心10分钟,弃上清。(2)用200毫升无菌水重悬菌体,转移到离心管中,12000rpm离心60秒,弃上清,菌体细胞-80℃冻存备用。(3)用200毫升细胞破碎缓冲液重悬菌体,2600rpm、4℃离心10分钟,弃上清。(4)用120毫升细胞破碎缓冲液重悬菌体,利用匀质机,600~1000bar破碎细胞。(5)12000rpm离心5~10分钟,将上清液转移到新的离心管中,所得即为粗酶液,或于冷冻干燥机中干燥,即得粗酶粉。所得粗酶液和粗酶粉置于-20℃~-80℃冰箱保存备用。实施例5工程酿酒酵母人工熊胆粉制备(方法一)(1)催化反应:微量离心管中加入6g/l的精制鸡胆粉溶液、nadp+溶液、实施例5工程酿酒酵母cen-α2β2的粗酶液各800μl、50μl、150μl,混匀后置于30℃培养箱内,反应3小时。所得即为反应液。(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过d101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用h2o冲至洗脱液无色,再用95%乙醇冲至洗脱液无色并收集该部分洗脱液。50℃减压旋蒸,浓缩液过0.45μm有机滤膜,滤液水浴挥至浸膏状,50℃真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为1.1:1.0。hplc检测结果如图5所示。产物的hplc检测分析方法如下:取反应液样品或人工熊胆粉复溶于甲醇样品,于12000rpm离心1.5分钟,取上清液按1:5的比例加入用水饱和的正丁醇对其进行萃取,混匀分层后,取出上层清液并用氮气吹干或挥干,加入与上清液等体积的hplc级甲醇重新溶解,用0.22μm滤膜过滤。反向色谱柱agilentporoshell120ec-c18column(2.7μm,4.6mm×150mm),使用cad检测器对转化产物进行分析,流速为0.6ml/min,进样量为1μl,柱温40℃,采集频率10hz,雾化温度45℃,流动相为乙腈(a相)和0.3%甲酸的5mmol/l醋酸铵水溶液(b相),进行梯度洗脱。梯度条件如下:时间(min)流速(ml/min)乙腈0.3%甲酸的5mmol/l醋酸铵水溶液00.62080150.62773250.63565350.63763450.69010实施例6工程酿酒酵母人工熊胆粉制备(方法二)(1)催化反应:微量离心管中加入15g/l的精制鸡胆粉溶液、nadp+溶液、实施例5工程酿酒酵母cen-α2β2的粗酶液各800μl、50μl、400μl,混匀后置于30℃培养箱内,反应6小时。所得即为反应液。(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过d101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用h2o冲至洗脱液无色,再用95%乙醇冲至洗脱液无色并收集该部分洗脱液。50℃减压旋蒸,浓缩液过0.45μm有机滤膜,滤液水浴挥至浸膏状,50℃真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为1.5:1.0。实施例7工程酿酒酵母人工熊胆粉制备(方法三)(1)催化反应:微量离心管中加入20g/l的精制鸡胆粉溶液、nadp+溶液、实施例5工程酿酒酵母cen-α2β2的粗酶液各800μl、50μl、150μl,混匀后置于20℃培养箱内,反应9小时。所得即为反应液。(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过d101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用h2o冲至洗脱液无色,再用95%乙醇冲至洗脱液无色并收集该部分洗脱液。50℃减压旋蒸,浓缩液过0.45μm有机滤膜,滤液水浴挥至浸膏状,50℃真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为1.2:1.0。实施例8工程酿酒酵母人工熊胆粉制备(方法四)(1)催化反应:微量离心管中加入15g/l的粗制鸡胆粉溶液、nadp+溶液、实施例5工程酿酒酵母cen-α2β2的粗酶液各800μl、50μl、150μl,混匀后置于25℃培养箱内,反应3小时。所得即为反应液。(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,于8000rpm离心20分钟取上层清液,过d101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用h2o冲至洗脱液无色,再用95%乙醇冲至洗脱液无色并收集该部分洗脱液。50℃减压旋蒸,浓缩液过0.45μm有机滤膜,滤液水浴挥至浸膏状,50℃真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为1.3:1.0。实施例9工程酿酒酵母人工熊胆粉制备(方法五)(1)催化反应:微量离心管中加入15g/l的粗制鸡胆粉溶液、nadp+溶液、实施例5工程酿酒酵母cen-α2β2的粗酶液各800μl、50μl、150μl,混匀后置于30℃培养箱内,反应6小时。所得即为反应液。(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,于8000rpm离心20分钟取上层清液,过d101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用h2o冲至洗脱液无色,再用95%乙醇冲至洗脱液无色并收集该部分洗脱液。50℃减压旋蒸,浓缩液过0.45μm有机滤膜,滤液水浴挥至浸膏状,50℃真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为1.3:1.0。实施例10工程酿酒酵母人工熊胆粉制备(方法六)(1)催化反应:微量离心管中加入15g/l的粗制鸡胆粉溶液、nadp+溶液、实施例5工程酿酒酵母cen-α2β2的粗酶液各800μl、50μl、150μl,混匀后置于25℃培养箱内,反应9小时。所得即为反应液。(2)人工熊胆粉制备:收集反应液,沸水浴5~10分钟,冷却,用3mm滤纸真空抽滤,取滤过清液,过d101大孔树脂,一次上样量与树脂等体积,流速控制在成滴下落不连成线。先用h2o冲至洗脱液无色,再用95%乙醇冲至洗脱液无色并收集该部分洗脱液。50℃减压旋蒸,浓缩液过0.45μm有机滤膜,滤液水浴挥至浸膏状,50℃真空干燥箱干燥至恒重,取出捣碎即得人工熊胆粉。所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为1.3:1.0。对照例工程酿酒酵母w303a-α1β2破碎后取粗酶液,用实施例5同样的反应条件催化制备人工熊胆粉。经过hplc检测,所得人工熊胆粉复溶于甲醇后进行液相检测,其中tudca和tcdca的比值为0.2386。sequencelisting<110>上海中医药大学<120>一种制备人工熊胆粉的工程酿酒酵母及方法<160>4<170>patentinversion3.3<210>1<211>888<212>dna<213>clostridiumsardiniensestrain<400>1catatggtgaacataatgaaaagattagaaggaaaagtcgcaatagtaacatcatctact60agaggaataggacgtgcatctgcagaagcattagcaaaagaaggtgctttagtatatcta120gcagcacgttcagaggaattagctaatgaagttatagcagatataaaaaagcaaggtgga180gtagctaagtttgtttactttaatgctagagaagaagaaacttacacttcaatggtagaa240aaagttgctgaagctgaaggcaggatagatatattagttaataactacggtggaacaaat300gttaatttagataagaacttaactgctggagatacagatgaattctttagaatattaaaa360gataacgttcaaagtgtatacttaccagcaaaagctgctataccacacatggaaaaagta420ggcggtggaagcatagttaatatctcaactataggatcagttgttccagatatatcaaga480atagcttactgtgtatcaaaatccgctataaactctttaactcaaaacatagcattacaa540tatgcaagaaagaatatcagatgtaatgcagtattacctggtttaataggaactagagca600gcactcgaaaatatgactgatgaatttagagactcattcttaggacatgttcctttaaat660agagtaggaagaccagaagatatagcaaatgcagttttatactatgcctctgatgattca720ggttatgtaacaggaatgattcatgaagttgcaggaggttttgcattaggaactcctcaa780tattcagaatactgtccaagaggaggaggaggatctggaggaggaggatctggaggagga840ggatctcctcctcctgcactgcctccgaaacgtcgtcgttaactcgag888<210>2<211>858<212>dna<213>escherichiacoli<400>2catatggtgtttaattctgacaacctgagactcgacggaaaatgcgccatcatcacaggt60gcgggtgcaggtattggtaaagaaatcgccattacattcgcgacagctggcgcatctgtg120gtggtcagtgatattaacgccgacgcagctaaccatgttgtagacgaaattcaacaactg180ggtggtcaggcatttgcctgccgttgtgatattacttccgaacaggaactctctgcactg240gcagactttgctatcagtaagctgggtaaagttgatattctggttaacaacgccggtggc300ggtggacctaaaccgtttgatatgccaatggcggattttcgccgtgcttatgaactgaat360gtgttttcttttttccatctgtcacaacttgttgcgccagaaatggaaaaaaatggcggt420ggcgttattctgaccatcacttctatggcggcagaaaataaaaatataaacatgacttcc480tatgcatcatctaaagctgcggccagtcatctggtcagaaatatggcgtttgacctgggt540gaaaaaaatattcgggtaaatggcattgcgccgggggcaatattaaccgatgccctgaaa600tccgttattacaccagaaattgaacaaaaaatgttacagcacacgccgatcagacgtctg660ggccaaccgcaagatattgctaacgcagcgctgttcctttgctcgcctgctgcgagctgg720gtaagcggacaaattctcaccgtctccggtggtggggtacaggagctcaatggaggagga780ggatctggaggaggaggatctggaggaggaggatctcctcctcctgcactgcctccgaaa840cgtcgtcgttaactcgag858<210>3<211>861<212>dna<213>clostridiumsardiniense<400>3catatgaattttagagaaaaatatggacaatggggaattgttttaggggcaacagaagga60attggtaaagctagtgcttttgaattagctaaaagagggatggatgttattttagttgga120agaagaaaagaagcattagaagagttagctaaggcaatacatgaagaaacaggaaaagaa180atcagagtattaccacaagatttatctgaatatgatgctgcagaaagattaatagaagca240actaaagatttagatatgggagtcattgagtatgttgcatgtctacatgcaatgggacaa300tataataaagttgactacgctaaatatgaacaaatgtatagagttaatataagaacattc360tcaaaattattacatcactatataggtgaattcaaagaaagagatagaggtgcattcata420acaataggatctttatcaggatggacatcattaccattctgtgcagaatatgcagcagaa480aaagcttatatgatgacagtaacagaaggagttgcttacgaatgtgcaaatactaatgtt540gacgtaatgcttttatcagcgggttcaacaatcacacctacttggttaaaaaataaacca600tcagatcctaaggcggttgcagcagcaatgtatccagaagatgttataaaagatggattt660gaacaattaggaaagaaatttacttatttagctggagagttaaatagagaaaaaatgaag720gaaaataatgcaatggatagaaatgatttaattgcaaaactaggaaaaatgtttgatcac780atggcaggaggaggaggatctggaggaggaggatctggaggaggaggatctggtgttaaa840gaaagcctggtttaactcgag861<210>4<211>867<212>dna<213>ruminococcusgnavusstrainn53<400>4catatgacattgagagaaaaatatggagaatggggaattattttaggcgctactgaaggt60gtcggaaaagcattttgtgaaaggcttgccaaagaaggtatgaatgtcgtaatggtcgga120cgccgtgaagaaaaattaaaagagctcggtgaggaactaaaaaacacttatgagattgat180tataaagtcgtaaaagcagacttttcgctgccagatgctactgacaaaatttttgctgca240acagaaaatctggatatgggatttatggcctatgtagcctgcttacactcttttggcaaa300atccaggatacaccttgggaaaagcatgaggcaatgatcaacgtaaacgttgttacattt360atgaaatgcttctatcactatatgaaaatctttgctgcacaggatcgcggtgctgtcatc420aacgtatcttctatgactggaatttccagttcaccatggaatggccaatatggtgcagga480aaggcattcattttaaaaatgacagaggctgttgcctgtgaaacggaaaagaccaatgtt540gatgtggaagtcatcactttgggaactactctgacaccaagtcttttaagcaacctgcct600ggcggaccacagggggaagctgttatgaagactgctcaaacaccggaagaagttgtggac660gaagcttttgaaaaattaggaaaagaactgtctgtcatttccggagagcgtaataaagcc720agcgtccatgactggaaagcgaatcatacagaagatgactatatccgctatatgggatct780ttctatcaagaaggaggaggaggatctggaggaggaggatctggaggaggaggatctggt840gttaaagaaagcctggtttaactcgag867当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1