一种同时检测多种菊花常见病毒/类病毒的检测方法
1.本发明涉及生物技术领域,具体为一种同时检测多种菊花常见病毒/类病毒的检测方法。
背景技术:
2.菊花为菊科菊属多年生草本植物,是我国传统名花,是世界四大切花之一,具有重要的经济价值。菊花主要通过扦插繁殖,其过程利于病毒的积累和传播,从而致使菊花品种退化,品质和产量严重下降。已报道侵染菊花的病毒有20多种,主要包括菊花b病毒(chrysanthemum virus b,cvb)、番茄不孕病毒(tomato aspermy virus,tav)、烟草花叶病毒(tobacco mosaic virus,tmv)、番茄斑萎病毒(tomato spotted wiltvirus,tswv)、菊花茎坏死病毒(chrysanthemum stem necrosis virus, csvn)5种病毒和菊花褪绿斑驳类病毒(chrysanthemum chlorotic mottleviroid,cchmvd)、菊花矮化类病毒(chrysanthemum stunt viroid,csvd) 2种类病毒。cvb为香石竹潜隐病毒属rna病毒,是危害菊花的主要病毒之一,患病菊花表现为轻型花叶症或不表现症状,感病菊花形成明显的花叶症状或坏死斑,严重感病的产生褐色枯斑。cvb既可通过汁液和扦插条伤口传播,也可通过桃蚜和马铃薯传播,观赏菊花上普遍发生,自然侵染率达到26.55%。 tav也是rna病毒,其引起的菊花不孕病毒病呈现出花叶、病叶扭曲、病株萎缩和花色不正常等症状,自然侵染率达19.27%。cchmvd是一种类病毒,主要引起菊花褪绿、枯黄、斑点等症状。
3.菊花在栽培中往往会同时受到几种病毒/类病毒的复合侵染,由病毒病引起的菊花种质退化、质量下降,已成为菊花生产上的一个突出问题,目前尚无有效的药剂能防治菊花病毒病,早发现并及时拔除病株和使用脱毒种苗是防止菊花病毒病的最佳办法。植物病毒的检测方法主要包括指示植物检测法、电子显微镜技术、血清学方法和分子生物学方法等,这些方法在特异性、灵敏度和准确性方面均存在不足,容易造成假阳性或假阴性现象。rt
‑
pcr是将 rna病毒的反转录与pcr扩增结合的检测技术。过往的菊花病毒的pcr检测研究多集中于一种或两种菊花病毒的rt
‑
pcr定性检测,难以对菊花病毒载量准确定量,检测灵敏度和效率相对较低。而菊花在生长过程中往往同时受到多种病毒的复合感染。因此,有必要建立一种可同时对多种菊花病毒快速、定量的检测方法。为此,需要设计相应的技术方案解决存在的技术问题。
技术实现要素:
4.(一)解决的技术问题
5.针对现有技术不足,本发明提供了一种同时检测多种菊花常见病毒/类病毒的检测方法,解决了:现有的菊花病毒的pcr检测研究多集中于一种或两种菊花病毒的rt
‑
pcr定性检测,难以对菊花病毒载量准确定量,检测灵敏度和效率相对较低的问题。
6.(二)技术方案
7.为实现以上目的,本发明通过以下技术方案予以实现:一种同时检测多种菊花常
见病毒/类病毒的检测方法,具体包括以下方法,具体包括有,s1,引物与探针的设计;
8.s2,定量标准品的制备;
9.s3,引物探针的筛选;
10.s4,3重实时荧光定量pcr扩增体系的优化;
11.s5,3重实时荧光定量pcr扩增程序优化;
12.s6,性能评价;
13.s7,样本测试试验。
14.作为本发明的进一步优选方式,步骤s1中,首先从ncbi数据库中下载 cvb、tav、cchmvd 3种菊花病毒/类病毒全基因组序列,用mega6.06生物学软件进行比对,分别在cvb和tav的编码外壳蛋白基因、cchmvd类病毒的保守区域设计引物探针,引物探针设计软件为primer express 2.0和primerpremier 5.0,每种病毒/类病毒设计2条正链引物,2条负链引物,1条探针,即4种引物探针组合。
15.作为本发明的进一步优选方式,步骤s2中,rna标准品的制备:体外合成含有pgem
‑
t载体的cvb、tav、cchmvd 3种病毒/类病毒目的基因片段的质粒,采用ecor i酶切下含有t7启动子的目的片段测序鉴定后sac i酶切线性化,酶切产物纯化回收后,用t7 high efficiency transcription kit体外反转录成cdna,根据测定的浓度换算成拷贝数,采用carry rna稀释液10 倍梯度稀释成定量标准品(浓度分别为:1.0
×
1010拷贝/ml、1.0
×
109拷贝/ml、1.0
×
108拷贝/ml、1.0
×
107拷贝/ml、1.0
×
106拷贝/ml、1.0
×ꢀ
105拷贝/ml、1.0
×
104拷贝/ml、1.0
×
103拷贝/ml),
‑
80℃储存备用。
16.作为本发明的进一步优选方式,步骤s3中,具体方法包括25μl反应体系:12.5μl 2
×
hot
‑
start hitaq rt
‑
pcr mix,上下游引物各0.5μl(10 μmol/l)、探针0.25μl(10μmol/l)、mg2+2.0μl(25mmol/l)、dntps 0.5μl(10mmol/l),模板5μl,补水至25μl,以1.0
×
1010拷贝/ml~ 1.0
×
103拷贝/ml的病毒标准品为模板,对上述设计3种病毒/类病毒的2组引物探针组合进行筛选,rt
‑
pcr扩增程序:50℃25min,1循环;95℃5min, 1循环;95℃10s,60℃40s(荧光收集),40循环。
17.作为本发明的进一步优选方式,步骤s4中,包括探针浓度优化,固定3 种病毒/类病毒引物浓度为200nmol/l,设置3个不同探针浓度水平(80 nmol/l、100nmol/l、120nmol/l),用10倍梯度稀释的标准品(1.0
×
107 拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它反应试剂组分,测试不同探针浓度对扩增结果的影响。
18.作为本发明的进一步优选方式,步骤s4中,包括引物浓度优化,根据确定的探针浓度,按照引物探针1∶1、2∶1和3∶1的比例,用10倍梯度稀释的标准品(1.0
×
107拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它反应试剂组分,测试不同引物浓度对扩增结果的影响。
19.作为本发明的进一步优选方式,步骤s4中,包括mg2+浓度优化,根据优化的引物和探针浓度,设置4个不同的mg2+浓度水平(2.0mmol/l、2.5 mmol/l、3.0mmol/l、3.5mmol/l),用10倍梯度稀释的标准品(1.0
×
107 拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它试剂组分,测试不同mg2+浓度对扩增结果的影响。
20.作为本发明的进一步优选方式,步骤s5中,包括最适反转录时间试验,设置了3个不同反转录时间,分别为20min、25min和30min,用低浓度参考品1.0
×
103拷贝/ml平行检测
20次,测试不同反转录时间对检测限参考品检出率的影响。
21.作为本发明的进一步优选方式,步骤s5中,包括最适退火温度试验,设置了3个不同退火温度,分别为58℃、60℃和62℃,用低浓度参考品1.0
×ꢀ
103拷贝/ml平行检测20次,测试不同退火温度对检测限参考品检出率的影响。
22.作为本发明的进一步优选方式,步骤s5中,包括最适扩增循环数试验,设置了3个不同扩增循环数,分别为35、40和42扩增循环,用低浓度参考品1.0
×
103拷贝/ml平行检测3次,测试不同扩增循环数对检测限参考品检出率的影响。
23.作为本发明的进一步优选方式,步骤s6中,包括敏感性试验,分别取cvb、 tav、cchmvd 3种病毒的低浓度参考品(1.0
×
104拷贝/ml、1.0
×
103拷贝 /ml和5.0
×
102拷贝/ml)进行20次平行检测,结合阴性对照,以95%的检出率(19次检出)作为相应病毒的检测敏感性。
24.作为本发明的进一步优选方式,步骤s6中,包括定量线性范围试验,分别取cvb、tav、cchmvd 3种病毒/类病毒的定量标准品(1.0
×
1010拷贝/ml~ 1.0
×
103拷贝/ml)进行3次重复检测,结合阴性对照,测试扩增体系对3 种病毒的定量线性范围。
25.作为本发明的进一步优选方式,步骤s6中,重复性试验,分别取cvb、 tav、cchmvd 3种病毒/类病毒的高浓度标准品(1.0
×
107拷贝/ml)和低浓度标准(1.0
×
104拷贝/ml)进行10次平行检测,结合阴性对照质控。统计不同浓度水平下ct值变异系数。
26.(三)有益效果
27.本发明提供了一种同时检测多种菊花常见病毒/类病毒的检测方法。具备以下有益效果:
28.本发明基于多重实时荧光定量rt
‑
pcr技术原理,根据cvb、tav和cchmvd 3种菊花病毒/类病毒基因组的保守区序列分别设计2对特异性的引物探针,经筛选后分别得到1组最优引物探针组合进行多重实时荧光定量rt
‑
pcr体系的构建。通过对扩增体系中3种病毒探针浓度、引物浓度、mg
2+
浓度和dntps 浓度进行优化,确定反应体系中cvb、tav和cchmvd 3种病毒的最终探针浓度分别为100nmol/l、120nmol/l和80nmol/l,最终引物浓度分别为200 nmol/l、240nmol/l和160nmol/l,最优mg2+浓度为3.0mmol/l,dntps浓度为200μmol/l,确定了多重实时荧光定量反应体系。引物的设计、引物浓度、退火温度和反应循环数是影响多重rt
‑
pcr的关键因素。
29.本发明通过对扩增程序中反转录时间、退火温度和循环数进行摸索,病毒rna经反转录25min后在退火温度60℃下进行40个循环反应,3种菊花病毒/类病毒最低检测限均可达到1.0
×
103拷贝/ml,灵敏度高,提供了一种定量检测方法。
30.采用本发明所构建的3种菊花病毒/类病毒多重实时荧光rt
‑
pcr检测体系具有检测灵敏度高、可定量线性范围宽的优点,其线性范围为1.0
×
103拷贝/ml~1.0
×
1010拷贝/ml;重复性研究结果显示,其对高浓度(1.0
×
107拷贝/ml)和低浓度(1.0
×
104拷贝/ml)标准品分别重复检测10次,检测结果的ct值变异系数均小于5%,表明检测多重检测体系重现性好。
附图说明
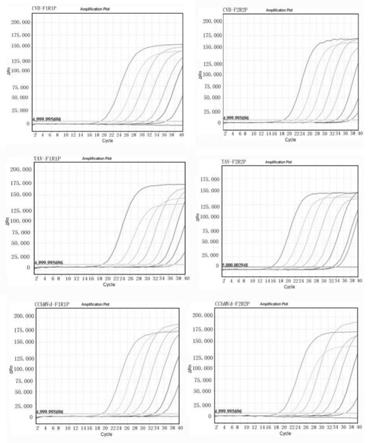
31.图1为本发明的不同病毒/类病毒引物筛选示意图;
32.图2为本发明的不同探针浓度对扩增结果的影响示意图;
33.图3为本发明的不同引物浓度对扩增结果的影响示意图;
34.图4为本发明的不同mg2+浓度对扩增结果的影响示意图;
35.图5为本发明的不同dntps浓度对扩增结果的影响示意图;
36.图6为本发明的不同循环数对扩增的影响示意图;
37.图7为本发明的重pcr反应体系的定量线性范围示意图;
38.图8为本发明的特异性检测示意图;
39.图9为本发明的菊花病毒检测示意图。
具体实施方式
40.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
41.请参阅图1
‑
9,本发明实施例提供一种技术方案:一种同时检测多种菊花常见病毒/类病毒的检测方法,其中,
42.1材料
43.1.1主要试剂
44.hot
‑
start hitaq rt
‑
pcr mix购自菲鹏生物股份有限公司,磁珠法dna 胶回收试剂盒、dntps购自生工生物工程(上海)股份有限公司(以下简称生工生物),carry rna、质粒小量提取试剂盒、植物总rna提取试剂盒均购自天根生化科技(北京)有限公司,t4连接酶、dh5α、pgem
‑
t载体、psti限制性内切酶购自promega公司,t7 high efficiency transcription kit购自transgen biotech公司。
45.1.2主要仪器
46.abi7500(life science)、tom
‑
k1
‑
10tf超纯水仪(上海托莫斯科学仪器有限公司)、dw
‑
hl340a1超低温冰箱、yxq
‑
ls
‑
70a立式压力蒸汽灭菌器(上海博讯公司)、veriti
tm 96
‑
well thermal cycler(life science公司)、 mupid
‑
exu电泳仪(advance公司)、tom
‑
bio20凝胶成像仪(tomos公司)、 sj
‑
cj
‑
ifd超净工作台(苏州苏洁净化设备有限公司)。
47.2方法
48.2.1引物与探针的设计
49.首先从ncbi数据库中下载cvb、tav、cchmvd 3种菊花病毒/类病毒全基因组序列,用mega6.06生物学软件进行比对,分别在cvb和tav的编码外壳蛋白基因、cchmvd类病毒的保守区域设计引物探针,引物探针设计软件为 primer express 2.0和primer premier 5.0,每种病毒/类病毒设计2条正链引物,2条负链引物,1条探针,即4种引物探针组合。引物、探针均在生工生物合成,引物和探针序列及标记见表1。
50.表1引物及探针详细信息
51.52.[0053][0054]
2.2定量标准品的制备
[0055]
rna标准品的制备:体外合成含有pgem
‑
t载体的cvb、tav、cchmvd 3种病毒/类病毒目的基因片段的质粒,采用ecor i酶切下含有t7启动子的目的片段测序鉴定后sac i酶切线性化,酶切产物纯化回收后,用t7 highefficiency transcription kit体外反转录成cdna,根据测定的浓度换算成拷贝数,采用carry rna稀释液10倍梯度稀释成定量标准品(浓度分别为: 1.0
×
10
10
拷贝/ml、1.0
×
109拷贝/ml、1.0
×
108拷贝/ml、1.0
×
107拷贝/ml、 1.0
×
106拷贝/ml、1.0
×
105拷贝/ml、1.0
×
104拷贝/ml、1.0
×
103拷贝/ml),
ꢀ‑
80℃储存备用。
[0056]
2.3引物探针的筛选
[0057]
25μl反应体系:12.5μl 2
×
hot
‑
start hitaq rt
‑
pcr mix,上下游引物各0.5μl(10μmol/l)、探针0.25μl(10μmol/l)、mg
2+
2.0μl(25mmol/l)、 dntps 0.5μl(10mmol/l),模板5μl,补水至25μl。以1.0
×
10
10
拷贝 /ml~1.0
×
103拷贝/ml的病毒标准品为模板,对上述设计3种病毒/类病毒的 2组引物探针组合进行筛选。
[0058]
rt
‑
pcr扩增程序:50℃25min,1循环;95℃5min,1循环;95℃10 s,60℃40s(荧光收集),40循环。
[0059]
2.4.1探针浓度优化
[0060]
固定3种病毒/类病毒引物浓度为200nmol/l,设置3个不同探针浓度水平(80nmol/l、100nmol/l、120nmol/l),用10倍梯度稀释的标准品(1.0
ꢀ×
107拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它反应试剂组分,测试不同探针浓度对扩增结果的影响。
[0061]
2.4.2引物浓度优化
[0062]
根据确定的探针浓度,按照引物探针1∶1、2∶1和3∶1的比例,用10 倍梯度稀释的标准品(1.0
×
107拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它反应试剂组分,测试不同引物浓度对扩增结果的影响。
[0063]
2.4.3mg
2+
浓度优化
[0064]
根据优化的引物和探针浓度,设置4个不同的mg
2+
浓度水平(2.0mmol/l、 2.5mmol/l、3.0mmol/l、3.5mmol/l),用10倍梯度稀释的标准品(1.0
ꢀ×
107拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它试剂组分,测试不同mg
2+
浓度对扩增结果的影响。
[0065]
2.4.4dntps浓度优化
[0066]
根据优化的引物浓度、探针和mg
2+
浓度,设置3个不同的dntps浓度水平(150μmol/l、200μmol/l、250μmol/l),用10倍梯度稀释的标准品(1.0
ꢀ×
107拷贝/ml~1.0
×
103拷贝/ml)及阴性对照作为待测标本,结合其它试剂组分,测试不同dntps浓度对扩增结果的影响。
[0067]
2.53重实时荧光定量pcr扩增程序优化
[0068]
2.5.1最适反转录时间试验
[0069]
设置了3个不同反转录时间,分别为20min、25min和30min,用低浓度参考品1.0
×
103拷贝/ml平行检测20次,测试不同反转录时间对检测限参考品检出率的影响。
[0070]
2.5.2最适退火温度试验
[0071]
设置了3个不同退火温度,分别为58℃、60℃和62℃,用低浓度参考品 1.0
×
103拷贝/ml平行检测20次,测试不同退火温度对检测限参考品检出率的影响。
[0072]
2.5.3最适扩增循环数试验
[0073]
设置了3个不同扩增循环数,分别为35、40和42扩增循环,用低浓度参考品1.0
×
103拷贝/ml平行检测3次,测试不同扩增循环数对检测限参考品检出率的影响。
[0074]
2.6性能评价
[0075]
2.6.1敏感性试验
[0076]
分别取cvb、tav、cchmvd 3种病毒的低浓度参考品(1.0
×
104拷贝/ml、 1.0
×
103拷贝/ml和5.0
×
102拷贝/ml)进行20次平行检测,结合阴性对照,以95%的检出率(19次检出)作为相应病毒的检测敏感性。
[0077]
2.6.2定量线性范围试验
[0078]
分别取cvb、tav、cchmvd 3种病毒/类病毒的定量标准品(1.0
×
10
10
拷贝/ml~1.0
×
103拷贝/ml)进行3次重复检测,结合阴性对照,测试扩增体系对3种病毒的定量线性范围。
[0079]
2.6.3重复性试验
[0080]
分别取cvb、tav、cchmvd 3种病毒/类病毒的高浓度标准品(1.0
×
107拷贝/ml)和低浓度标准(1.0
×
104拷贝/ml)进行10次平行检测,结合阴性对照质控。统计不同浓度水平下ct值变异系数。
[0081]
2.6.4特异性实验
[0082]
采用本研究构建的cvb、tav、cchmvd 3种菊花病毒/类病毒实时荧光定量rt
‑
pcr检测体系对南京农业大学“中国菊花种质资源保存中心”实验室留存的cvb、tav、cchmvd、tmv和黄瓜花叶病毒(cucumber mosaic virus, cmv)核酸进行检测。
[0083]
2.7样本测试试验
[0084]
从南京农业大学“中国菊花种质资源保存中心”菊花基地随机采集20株样品,采用植物总rna提取试剂盒进行rna提取,用本研究建立的3种菊花病毒/类病毒检测体系和扩增条件进行实时荧光rt
‑
pcr扩增检测。选择一株cvb阳性病毒株进行ta克隆测序分析,采用磁珠法回收pcr产物,连接pmd18
‑
t 载体,至dh5α感受态测序,测序数据进行ncbi blast分析。
[0085]
25μl反应体系:12.5μl 2
×
hot
‑
start hitaq rt
‑
pcr mix,cvb上下游引物f1r1组合各0.5μl(10μmol/l)、探针0.25μl(10μmol/l)、mg
2+ 2.0μl(25mmol/l)、dntps 0.5μl(10mmol/l),模板5μl,补水至25 μl。扩增程序:50℃25min,1循环;95℃5min,1循环;95℃10s, 60℃30s,72℃40s,35循环。
[0086]
实施例一
[0087]
引物筛选
[0088]
cvb、tav、cchmvd 3种菊花病毒/类病毒的引物探针组合均有扩增(图1), cvb的f2r2p组合扩增灵敏度可以达到1.0
×
103拷贝/ml,f1r1p组合扩增灵敏度为1.0
×
104拷贝/ml,且f2r2p组合在低浓度模板下仍有明显“s”型扩增曲线,最终选择f2r2p作为cvb最终引
物探针组合。同理,tav选择f2r2p 组合,cchmvd选择f1r1p组合。
[0089]
实施例二
[0090]
扩增体系优化
[0091]
探针浓度
[0092]
不同探针浓度对cvb、tav、cchmvd 3种病毒/类病毒的扩增曲线的线型和荧光高度影响较大,扩增荧光高度均随探针浓度的升高而增加,过高的探针浓度导致cchmvd无平台期(图2)。在cvb、tav和cchmvd探针浓度分别为100nmol/l、120nmol/l和80nmol/l时,3种病毒/类病毒对浓度为1.0
ꢀ×
107拷贝/ml~1.0
×
103拷贝/ml的标准品扩增曲线均呈“s”型曲线,平台期荧光高度基本一致;
[0093]
引物浓度
[0094]
不同引物浓度对3种病毒/类病毒的扩增曲线的线型和检测灵敏度有一定的影响,当引物探针浓度比例2∶1和3∶1时,3种病毒/类病毒对对浓度为 1.0
×
107拷贝/ml~1.0
×
103拷贝/ml的标准品均具有较好的检测敏感性和扩增线型(图3),引物探针比例在2∶1时的扩增曲线与引物探针比例为3∶1 重合,最终选择引物探针比例2∶1,即反应体系中cvb、tav和cchmvd的引物浓度分别为200nmol/l、240nmol/l和160nmol/l。
[0095]
mg
2+
浓度
[0096]
在4种mg
2+
浓度水平下cvb、tav和cchmvd 3种病毒/类病毒均具有较好的扩增线型和检测敏感性,当mg
2+
浓度为3.0mmol/l,3种病毒/类病毒扩增平台期荧光高度最高,扩增线型最好(图4),确定体系中mg
2+
终浓度为3.0 mmol/l。
[0097]
dntps浓度
[0098]
dntps浓度偏低影响cvb、tav和cchmvd 3种病毒/类病毒的检测敏感性,在dntps浓度为150μmol/l时,3种病毒/类病毒的扩增敏感性低;在dntps 浓度为200μmol/l和250μmol/l时,3重pcr扩增体系的敏感性均达到1.0
ꢀ×
103copies/ml(图5);dntps浓度为250μmol/l与200μmol/l时扩增敏感性和扩增线型一致,选择200μmol/l的dntps浓度为体系终浓度。
[0099]
实施例三
[0100]
反转录时间
[0101]
反转录时间对cvb、tav和cchmvd 3种病毒/类病毒低浓度参考品(浓度 1.0
×
104拷贝/ml)的检出率有影响(表2)。当反转录时间为20min时,cvb、 tav和cchmvd低参考品的检出率分别为100%(20/20)、90%(18/20)和80%(16/20);当反转录时间为25min和30min时,3种病毒的低参考品的检出率均为100%(20/20),选择25min作为最适反转录时间。
[0102]
表2不同反转录时间对扩增的影响
[0103][0104]
退火温度
[0105]
不同退火温度对cvb、tav和cchmvd 3种病毒/类病毒低浓度参考品(浓度为1.0
×
104拷贝/ml)的检出率有影响(表3)。退火温度为58℃时,cvb、 tav和cchmvd的检出率分别为95%(19/20)、90%(18/20)和95%(19/20);退火温度为60℃时,3种病毒/类病毒低浓度参考品的检出率均为100%(20/20);在退火温度为62℃时,3种病毒/类病毒的低浓度参考品的检出率均较低,分别为cvb 85%(17/20)、tav 90%(19/20)和cchmvd 80%(16/20)。确定最适退火温度为60℃,在此温度下,3重pcr检测体系对1.0
×
104拷贝 /ml的低浓度参考品的检出率均为100%
[0106]
表3不同退火温度对扩增的影响
[0107][0108][0109]
循环数
[0110]
当扩增循环数为35时,cvb、tav和cchmvd 3种病毒/类病毒对低浓度参考品(浓度为1.0
×
103拷贝/ml)扩增荧光低,无明显“s”型扩增曲线;当循环数为40和(或)42时,3种病
毒/类病毒的最低检测限参考品均有“s”型扩增曲线,并且在循环数为40时扩增荧光高度达到平台期(图6),确定最适循环数为40。
[0111]
实施例四
[0112]
敏感性
[0113]
在上述优化的3重扩增体系和扩增条件下,cvb、tav和cchmvd 3种病毒 /类病毒对1.0
×
104拷贝/ml的低浓度参考品的检出率均为100%;对1.0
×
103拷贝/ml的低浓度参考品检出率分别为cvb 100%(20/20)、tav 100%(20/20)和cchmvd 95%(19/20);cvb、tav和cchmvd对5.0
×
102拷贝/ml的低浓度检测限参考品的检出率分别为90%、80%和85%(表4),确定3重病毒/类病毒检测体系的敏感性为1.0
×
103拷贝/ml。
[0114]
表4敏感性检测
[0115][0116][0117]
线性范围
[0118]
由图7可知,扩增体系对cvb、tav和cchmvd 3种病毒/类病毒检测的线性范围为1.0
×
103拷贝/ml~1.0
×
10
10
拷贝/ml。在此多重扩增体系下,cvb、 tav和cchmvd扩增决定系数r2分别为0.998、0.993和0.997,扩增效率e 分别为93.69%、94.81%和98.27%。因此,3重pcr扩增体系的扩增效率高,定量线性范围宽。
[0119]
重复性
[0120]
对1.0
×
107拷贝/ml和1.0
×
104拷贝/ml的两种不同浓度的rna参考品进行10次平行检测,定量结果lg值偏差(cv%)分别为3.53%和4.81%(表5),表明本研究建立的检测体系具有定量结果准确、定量误差小的优点。
[0121]
表5不同浓度的两种参考品定量
[0122][0123]
特异性
[0124]
对南京农业大学“中国菊花种质资源保存中心”留存的cvb、tav、csvd、 tmv和cmv进行核酸检测。菊花b病毒和番茄不孕病毒检测结果成阳性;菊花矮化类病毒、烟草花叶病毒和黄瓜花叶病毒检测结果为阴性(图8),说明本多重体系特异性好,其它菊花病毒核酸不会对体系检测产生非特异性干扰。
[0125]
样本测试
[0126]
从南京农业大学“中国菊花种质资源保存中心”基地随机选择20株菊花叶片进行本研究试剂检测,检出6例cvb和4例tav(图9),其病毒载量为 2.5
×
104拷贝/ml~5.5
×
107拷贝/ml。对编号05检测结果为cvb阳性株的pcr 产物进行ta克隆并经测序分析,其与mh678704.1 cvb的同源性为100%。
[0127]
以上显示和描述了本发明的基本原理和主要特征和本发明的优点,对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
[0128]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1