基于HBVS区的高敏HBVRNA定量检测的引物探针组合物、试剂盒及其应用
本发明属于生物医药
技术领域:
,涉及基于hbvs区的高敏hbvrna定量检测的引物探针组合物、试剂盒及其应用。
背景技术:
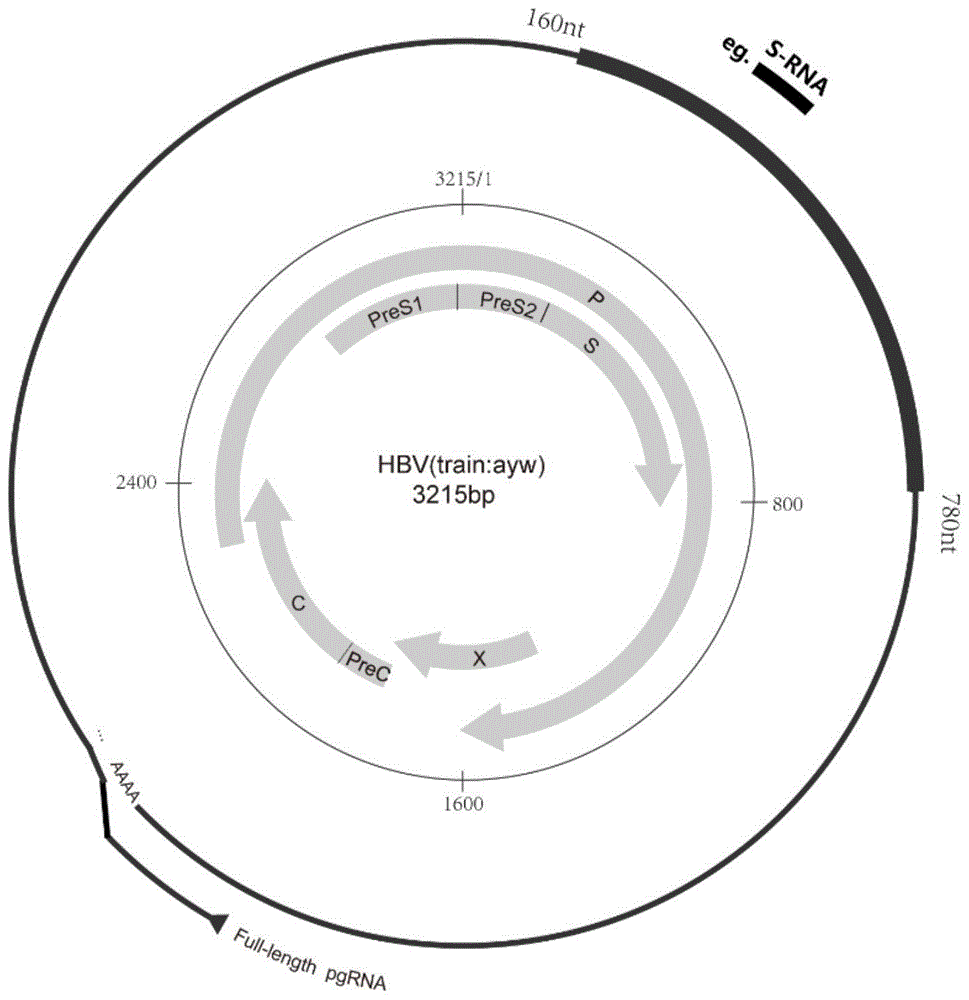
:乙型肝炎病毒(hbv)dna水平是肝细胞癌(hcc)发生发展的独立危险因素,hbvdna水平越高,患者发生hcc的风险就越高。因此,针对hbvdna水平高引起的肝脏损伤慢性乙型肝炎(chb)患者,国内外《慢性乙型肝炎防治指南》均建议他们接受核苷(酸)类药物(nas)或者聚乙二醇干扰素(peg-ifn)治疗,以控制病毒复制,延缓疾病进展,降低hcc的发生风险。由于目前难以实现慢性hbv感染的治愈(hbsag转阴、肝内cccdna清除),因此,科学家们将hbvdna转阴(病毒学应答)、hbeag血清学转换(hbeag血清学应答)作为抗病毒治疗的应答指标,以评估抗病毒治疗药物的疗效。已有研究表明,在抗病毒治疗过程中,实现病毒学应答和hbeag血清学应答的患者较非应答患者/应答不佳患者,hcc发生风险显著下降,提示hbvdna和hbeag是监测慢乙肝患者抗病毒治疗疗效和慢性肝病进展的重要临床指标。近年,随着核苷类抗病毒药物在慢乙肝患者中的普遍应用,很多患者获得了很好的病毒抑制效果,大多数患者达到血清hbvdna检测不到、hbeag血清学转换的治疗效果,而hbsag水平变化不大。这种情况下,需要新的能够反应病情变化的指标。其中hbvrna作为cccdna的直接下游产物,比hbvdna更能代表肝内cccdna的状态。已有研究表明血清hbvrna与肝内cccdna转录活性相关,是慢乙肝患者抗病毒治疗应答的早期预测指标,并且可以预测nas停药后疾病复发的情况。实际上,血清hbvrna的存在形式较hbvdna复杂。科学家们发现,血清hbvrna主要为hbv前基因组rna(pgrna)(wangj,shent,huangx,etal.serumhepatitisbvirusrnaisencapsidatedpregenomernathatmaybeassociatedwithpersistenceofviralinfectionandrebound.jhepatol.2016;65(4):700-710.),pgrna长短不一,既存在完整的全长pgrna,又存在3’端截断型pgrna以及不同剪接形式的pgrna(lius,zhoub,valdesjd,sunj,guoh.serumhepatitisbvirusrna:anewpotentialbiomarkerforchronichepatitisbvirusinfection.hepatology.2019;69(4):1816-1827.)。而以往的关于hbvrna的临床研究中,不同研究团队采用的hbvrna检测方法各不相同,因此,检测到的hbvrna种类可能是不同的,这可能会导致不同的研究结果,如由某一检测方法测定的hbvrna水平可以预测慢乙肝患者抗病毒治疗应答的hbvrna,但是不一定可以预测停药后疾病复发。hbvrna阳性,代表患者肝内cccdna仍在活跃转录,患者停药后复发风险极高并可能增加疾病进展风险。因此,建立血清hbvrna检测方法,尤为需要关注检测灵敏度以及对于低病毒载量样本的阳性率,以避免出现假阴性,增加患者慢性肝病进展风险。技术实现要素:针对现有技术的不足和实际需求,本发明提供了基于hbvs区的高敏hbvrna定量检测的引物探针组合物、试剂盒及其应用,所述引物探针组合物的靶基因位于hbv基因组的s区,实现了灵敏、特异的hbvrna定量检测,提高了低病毒载量样本的检测阳性率,在预测停药复发、肝癌发生以及hbsag转阴等方面具有重要的应用前景。为达此目的,本发明采用以下技术方案:第一方面,本发明提供了一种检测乙肝病毒rna的引物探针组合物,所述引物探针组合物的靶基因位于乙肝病毒基因组的s区,优选为乙肝病毒基因组的s区160~780nt区间。本发明中,乙肝病毒基因组的s区位于基因组的中间区域,稳定性好、不易降解或缺失,采用基于s区设计的引物探针进行hbvrna检测,不仅可以检测到s区基因、而且可以检测到5’末端(prec/core区)和3’末端(x区)等在低病毒载量的慢乙肝患者肝细胞内易降解缺失的基因,因此,特异性靶向s区的引物探针组合物实现了低病毒载量的慢乙肝患者肝细胞中hbvrna的高灵敏检测。优选地,所述靶基因包括常见hbv亚型基因组s区,例如可以是hbv亚型a、b、c、d、e、f、g或h基因型的基因组s区中的任意一种。优选地,所述靶基因包括seqidno:1所示的核酸序列或与seqidno:1具有92%以上同一性的核酸序列;seqidno:1:gavcacaaccatcaggactcctaggacccctgctcgtgttacaggcggggtttttcttgttgacaaaaatcctcacaataccacagagtctagactcgtggtggacttctctcaattttctagggggaacacccgtgtgtcttggccaaaattcgcagtcccaaatctccagtcactcaccaacctgttgtcctccaatttgtcctggttatcgctggatgtgtctgcggcgttttatcatcttcctctgcatcctgctgctatgcctcatcttcttgttggttcttctggactatcaaggtatgttgcccgtttgtcctctaattccaggatcatcaacaaccagcaccggaccatgcaaaacctgcacaactcctgctcaaggaacctctatgtttccctcatgttgctgtacaaaacctacggacggaaactgcacctgtattcccatcccatcatcttgggctttcgcaaaatacctatgggagtgggcctcagtccgtttctcttggctcagtttactagtgccatttgttcagtggttcgtagggctttcccccactgtctggctttcagttatatggatgatgtggttttgggggccaagtctgtacaacatctt。优选地,所述引物包括seqidno:2~9所示的核酸序列,其中,seqidno:2~5为上游引物,seqidno:6~9为下游引物;seqidno:2:catcaggaytcctaggacc;seqidno:3:cctgctcgtgttacaggc;seqidno:4:ggtttttcttgttgacaa;seqidno:5:tgtcctccaatttgtcct;seqidno:6:atgataaaacgccgcagac;seqidno:7:tgaggcatagcagcaggatg;seqidno:8:gtacagcaacawgagggaa;seqidno:9:cccaagatgatgggatgggaata。优选地,所述探针包括seqidno:10~13所示的核酸序列,靶向捕获不同基因型的hbv基因组s区;seqidno:10:ccacagagtctagactcgtggtggact;seqidno:11:ccacgtgtcctggccaaaat;seqidno:12:aaggtatgttgcccgtttgtcctcta;seqidno:13:tcaactaccagcacvggaccatgca。优选地,所述探针包括taqman探针和/或杂交探针。优选地,所述探针标记有荧光基团和/或淬灭基团,优选为所述探针的5’端标记有荧光基团、3’端标记有淬灭基团。优选地,所述荧光基团包括fam、cys、cy5、vic、tet、joe、hex或rox中的任意一种。优选地,所述淬灭基团包括tamra、bhq1、bhq2、bhq3、nfq、dabcyl或eclipse中的任意一种。第二方面,本发明提供了一种检测乙肝病毒rna的试剂盒,所述试剂盒包括第一方面所述的引物探针组合物。本发明中,采用第一方面所述的引物探针组合物构建检测乙肝病毒rna的qpcr体系,实现了灵敏准确检测乙肝病毒rna的效果,相较于现有的乙肝病毒rna检测方法,显著提高了低拷贝数乙肝病毒rna的检测阳性率,所述体系能够精准监测慢乙肝患者抗病毒治疗效果,预测治疗应答效果,预测停药复发、肝癌发生和hbsag转阴,具有重要的应用价值。优选地,所述试剂盒还包括酶混合液、dntp混合液或pcr缓冲液中的任意一种或至少两种的组合。优选地,所述酶混合液包括dna聚合酶和/或逆转录酶。优选地,所述dntp混合液包括datp、dctp、dgtp和dutp。优选地,所述pcr缓冲液中含有mg2+。优选地,所述试剂盒还包括阴性质控品和阳性质控品。优选地,所述阳性质控品包括含有乙肝病毒基因组s区的质粒。第三方面,本发明提供了一种检测乙肝病毒rna的体系,所述体系包括第一方面所述的引物探针组合物。优选地,所述引物探针组合物中的引物在所述体系中的终浓度为0.1~1pmol/μl,例如可以是0.1pmol/μl、0.2pmol/μl、0.3pmol/μl、0.4pmol/μl、0.5pmol/μl、0.6pmol/μl、0.7pmol/μl、0.8pmol/μl、0.9pmol/μl或1pmol/μl,优选为0.5pmol/μl。优选地,所述引物探针组合物中的探针在所述体系中的终浓度为0.1~1pmol/μl,例如可以是0.1pmol/μl、0.2pmol/μl、0.3pmol/μl、0.4pmol/μl、0.5pmol/μl、0.6pmol/μl、0.7pmol/μl、0.8pmol/μl、0.9pmol/μl或1pmol/μl,优选为0.5pmol/μl。优选地,所述体系还包括rna样本、逆转录酶、dna聚合酶、dntps和mg2+。优选地,所述rna模板在所述体系中的终浓度为10ng/μl~100μg/μl,例如可以是10ng/μl、100ng/μl、1μg/μl、10μg/μl或100μg/μl。优选地,所述逆转录酶在所述体系中的终浓度为0.5~10u/μl,例如可以是0.5u/μl、1u/μl、5u/μl或10u/μl。优选地,所述dna聚合酶在所述体系中的终浓度为0.005~0.05u/μl,例如可以是0.005u/μl、0.01u/μl或0.05u/μl。优选地,所述dntps在所述体系中的终浓度为20~200μmol/l,例如可以是20μmol/l、50μmol/l、100μmol/l或200μmol/l。优选地,所述mg2+在所述体系中的终浓度为0.5~3.0mmol/l,例如可以是0.5mmol/l、1mmol/l、2mmol/l或3mmol/l。第四方面,本发明提供了一种以非疾病诊断和/或治疗为目的的检测乙肝病毒rna的方法,所述方法包括:采用第一方面所述的引物探针组合物、第二方面所述的试剂盒或第三方面所述的体系对rna样本进行荧光定量pcr,检测乙肝病毒rna的水平。优选地,所述荧光定量pcr的条件为:92~98℃预变性10~30s;92~98℃变性10~20s,55~65℃退火40~60s,70~75℃延伸10~30s,共进行35~45个循环。优选地,在进行预变性之前,还包括45~55℃反转录5~8min的步骤。第五方面,本发明提供了一种检测乙肝病毒rna的装置,所述装置包括:逆转录单元:用于将乙肝病毒rna样本逆转录为dna样本;荧光定量pcr单元:用于采用第一方面所述的引物探针组合物、第二方面所述的试剂盒或第三方面所述的体系对rna样本进行荧光定量pcr,检测乙肝病毒rna的水平。第六方面,本发明提供了第一方面所述的引物探针组合物、第二方面所述的试剂盒、第三方面所述的体系或第五方面所述的装置在制备肝病诊断试剂、慢性乙肝抗病毒治疗的疗效评价和/或安全停药、治疗终点监测的hbv诊断试剂中的应用。优选地,所述肝病包括急慢性乙型肝炎、乙型肝炎相关肝衰竭、肝硬化或肝癌中的任意一种或至少两种的组合。与现有技术相比,本发明具有如下有益效果:(1)本发明以乙肝病毒基因组的s区基因为靶点,设计特异性引物探针,实现了灵敏准确检测低拷贝乙肝病毒的效果;(2)本发明的基于hbvs区的hbvrna检测方法对于检测低病毒载量患者的血清hbvrna阳性率,相较于现有技术得到显著提高;(3)本发明构建的基于hbvs区的hbvrna检测体系和检测方法可以检测出低拷贝数的病毒核酸,为预测乙肝停药复发、肝癌发生、表面抗原消失等中期疗效判定和疾病发展终点事件提供了可靠的方法,在预测慢乙肝患者停药复发、肝癌发生和hbsag转阴等方面具有潜在的应用价值。附图说明图1为靶向乙肝病毒基因组s区的引物探针位置示意图;图2为不同浓度的阳性质控品的rt-qpcr扩增曲线,其中,扩增曲线从左到右代表的阳性质控品浓度依次为5.0×107拷贝/μl、5.0×106拷贝/μl、5.0×105拷贝/μl、5.0×104拷贝/μl、5.0×103拷贝/μl、5.0×102拷贝/μl、5.0×101拷贝/μl;图3为rt-qpcr标准曲线;图4a为基于hbvs区的高敏hbvrna(s-rna)、prec-rna、x-rna和race的阳性率比较结果,图4b为race法和商业试剂盒sansure的阳性率比较结果;图5为基于hbvs区的高敏hbvrna(s-rna)和race预测慢乙肝患者停药复发的结果;图6a为基于hbvs区的高敏hbvrna定量检测结果分析血清hbvrna水平与慢乙肝患者肝癌发生之间的关系,图6b为基于hbvprec区的hbvrna定量检测结果分析血清hbvrna水平与慢乙肝患者肝癌发生之间的关系;图7为基于hbvs区的高敏hbvrna定量检测结果预测患者停药后hbsag转阴结果;图8为基于hbvs区的高敏hbvrna(s-rna)和hbvdna24周的水平预测慢乙肝患者hbeag血清学应答的结果;图9a为rna应答患者在核苷(酸)类似物治疗过程中的hbvdna和hbvrna的动态变化,图9b为rna应答不佳患者在核苷(酸)类似物治疗过程中的hbvdna和hbvrna的动态变化。具体实施方式为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。实施例1引物探针组合物的设计本实施例以不同亚型hbv基因组s区seqidno:1为靶基因,设计特异性引物探针seqidno:2~13,其中,seqidno:2~5为上游引物,seqidno:6~9为下游引物,seqidno:10~13为探针,示意图如图1所示。实施例2hbvrna的提取本实施例首先利用virusspinkit(qiagen,德国)从乙肝患者血清样本中提取核酸,再采用dna消化酶dnasei(thermofisherscientific)消化dna,从而获取hbvrna,步骤如下:(1)吸取888μlal缓冲液至24.6μlcarrierrna中,吹打均匀;(2)将25μl蛋白酶加入到1.5mlep管中,并加入200μl常温待提取血清(血清分装前吹打混匀),随后加入200μlal(carrierrna浓度为28μg/ml),涡旋震荡15s,56℃加热15min;(3)将样本瞬时离心后,加入250μl无水乙醇,涡旋震荡15s,室温放置5min;(4)将含有样本的过滤柱置于新的收集管中,加入500μlbufferaw1,8000rpm离心1min;(5)将过滤柱置于新的收集管中,加入500μlbufferaw2,8000rpm离心1min;(6)将过滤柱置于新的收集管中,加入500μl无水乙醇,8000rpm离心1min;(7)将过滤柱置于新的收集管中,14000rpm高速离心3min;(8)将过滤柱置于新的收集管中,打开盖子,56℃加热3min,同时预热ave缓冲液;(9)将过滤柱置于新的1.5mlep管中,加入50μlave缓冲液,室温放置5min;(10)14000rpm高速离心1min,随后将30μl提取核酸进行dnasei消化,40μldnasei消化体系见表1;(11)37℃加热40min,随后加入2μledta(50mm),65℃加热10min,得到hbvrna。表1试剂体积(μl)10×消化缓冲液(10×digestionbuffer)4无酶水(nuclease-freewater)4dnasei(2u/μl)2样本30实施例3靶向hbv基因组s区的hbvrna定量检测本实施例采用seqidno:2~9所示的引物对、seqidno:10~13所示的探针进行hbvrna阳性质控品的hbvrna定量检测,rt-qpcr试剂为fastvirus1-stepmastermix(appliedbiosystems)(主要成分包括逆转录酶、dna聚合酶、dntps、mg2+),体系如表2所示,荧光定量pcr条件如表3所示。表2表3阳性质控品的制备方法为:人工合成上述引物探针组合物的靶基因(seqidno:1),克隆至pgemeasy质粒(promega)上,转染至大肠杆菌jm109(takara)内进行大量扩增;使用qiagen质粒midi试剂盒(qiagen)纯化含有靶基因的高质量dna质粒,用ndei(takara)线性化,再使用t7ribomaxtmexpressrna试剂盒(promega)进行rna转录;采用dnasei消化转录后rna中残余的dna模板,并由qiampminelute病毒纯化试剂盒(qiagen)纯化转录后的rna标准品,最后使用nanodropnd-2000进行定量(thermoscientific),作为hbvrna阳性质控品。阳性质控品在不同浓度下(5.0×101~5.0×107拷贝/μl)的rt-qpcr扩增曲线如图2所示,以阳性质控品的浓度取log值为横坐标、ct值为纵坐标,建立标准曲线如图3所示,说明采用seqidno:2~13所示的引物探针组合物成功构建靶向hbv基因组s区的hbvrna检测体系。实施例4阳性率检测本实施例采用基于乙肝病毒基因组prec/core区、s区(引物为seqidno:2、seqidno:6,探针为seqidno:10)、x区和3’端polya尾(race法)的rna检测方法检测188例低病毒载量的慢乙肝患者血清hbvrna水平,如图4a所示,发现基于s区的检测方法得到的rna阳性率最高,而race法得到的阳性率最低(66%vs10%,p<0.05)。本实施例进一步比较了race法与商业试剂盒(sansure)对另外100例慢乙肝患者血清hbvrna的定量结果,如图4b所示,race法检测的hbvrna阳性率较商业试剂盒检测的rna阳性率更高,进而突出了本发明方法对于低病毒载量样本的检测优势(阳性率:s区方法>race法>商业试剂盒)。实施例5预测慢乙肝患者停药复发的实现过程在一项真实世界的慢乙肝患者停药队列中(n=50),采用实施例3(引物为seqidno:3、seqidno:7,探针为seqidno:11)和基于race的hbvrna检测方法平行检测患者停药时的血清hbvrna水平,应用roc曲线检验两种方法得到的hbvrna水平预测停药后肝炎复发的效能。结果如图5所示,实施例3的基于hbvs区的高敏hbvrna定量检测方法检测的hbvrna水平可以较好地预测停药后4年的肝炎复发,而race法不能很好地预测停药后肝炎复发。实施例6预测肝癌的实现过程在接受抗病毒治疗的慢乙肝患者中,仍然有部分患者发展为肝癌。本实施例利用实施例3的基于hbvs区的高敏hbvrna定量检测方法(引物为seqidno:4、seqidno:8,探针为seqidno:12)检测345名接受抗病毒治疗的慢乙肝患者的血清hbvrna水平,并通过kaplan-meier曲线分析血清hbvrna水平与慢乙肝患者肝癌发生之间的关系。结果如图6a所示,hbvrna阴性的患者其肝癌发生风险显著低于hbvrna阳性患者。本实施例同时利用基于hbvprec区的hbvrna检测方法检测这些患者的hbvrna水平,结果如图6b所示,绝大部分患者未检测到hbvrna,其与肝癌发生的相关性无统计学差异。实施例7预测hbsag清除的实现过程目前,尚未有药物可以治愈慢性hbv感染或清除hbsag,只有少部分患者经过长时间的抗病毒治疗后,可以实现hbsag转阴(功能性治愈),因此,识别大概率可以实现功能性治愈的慢乙肝患者,有利于优化抗病毒治疗策略,提高临床资源分配效率。本实施例利用实施例3的基于hbvs区的高敏hbvrna定量检测方法(引物为seqidno:5、seqidno:9,探针为seqidno:13)检测170名慢乙肝患者停药时的hbvrna水平,结果如图7所示,发现hbvrna阴性的患者,停药后实现hbsag转阴的机会较hbvrna阳性的患者显著增加,可见hbvrna是慢乙肝患者hbsag转阴的一个早期预测指标。实施例8预测慢乙肝患者抗病毒治疗应答的实现过程在抗病毒治疗过程中,慢乙肝患者发生hbeag血清学转换意味着患者有较好的抗乙肝免疫应答能力,肝内cccdna转录活性较低。血清hbvrna是肝内cccdna的无创替代指标,对于hbeag阳性的慢乙肝患者,血清hbvrna可以有效预测慢乙肝患者接受抗病毒治疗后hbeag血清学转换。以核苷酸类似物为例,在一项慢乙肝患者治疗队列中(n=69),采用实施例3的基于hbvs区的高敏hbvrna定量检测方法检测基线和24周的血清hbvrna水平,应用roc曲线检验hbvrna水平预测nas治疗2年后的hbeag血清学转换的效能。结果如图8所示,基于hbvs区的高敏hbvrna定量检测方法检测的24周hbvrna水平可以较好地预测nas抗病毒治疗的hbeag转阴,其预测效能较hbvdna更好。实施例9血清hbvrna作为监测慢乙肝患者抗病毒治疗疗效的新指标基于实施例6的结果可知,高水平的血清hbvrna可增加慢乙肝患者发生肝癌的风险。因此,有效降低血清hbvrna水平可作为经典的抗病毒治疗(包括ifn和nas)以及新型抗病毒治疗方案(如核衣壳抑制剂、sirna、乙肝病毒入胞抑制剂、免疫调节药物等)的疗效监测指标之一。同时作为乙肝病毒的核酸物质,hbvrna是肝内cccdna的直接下游产物,较hbvdna更能代表cccdna的转录状态。在评价乙肝新药的抗病毒疗效时,除了以传统的hbvdna转阴和hbeag血清学转换作为衡量指标,血清hbvrna转阴更是反映了肝内cccdna的低活性状态,直接反映了乙肝病毒被抑制的程度。以经典的nas抗病毒治疗为例,在nas治疗过程中,当血清hbvdna迅速被抑制,血清hbvrna仍可持续在较高水平(基于实施例3的高敏hbvrna定量检测方法检测结果),随着抗病毒治疗时长的增加,如图9a和图9b所示,有些患者的hbvrna水平可逐渐下降(图9a),而有些患者的hbvrna水平可维持在较高水平(图9b),说明这两类患者对nas抗病毒治疗的应答是有差别的,同时也提示着hbvrna持续不转阴的患者可能需要改善抗病毒治疗策略,以期获得更好的疗效。同理,血清hbvrna亦可作为乙肝新药研发的疗效监测指标之一。综上所述,本发明以常见hbv亚型基因组s区为靶基因,设计特异性引物探针,基于所述引物探针构建的荧光定量pcrhbvrna检测方法实现了低病毒载量患者的血清hbvrna的灵敏特异检测,在预测慢乙肝患者停药复发、肝癌发生和hbsag转阴的效果等方面展现出临床应用潜力。申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属
技术领域:
的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1