一种高纯度CRISPR-Cas9蛋白的酶切方法与流程
本发明属于生物基因技术领域,具体的,涉及一种高纯度crispr-cas9蛋白的酶切方法。
背景技术:
crispr/cas9系统目前已经迅速成为科研和医学领域最具潜力的基因编辑工具,该基因编辑系统最大优势在于只需要设计一个靶向目标序列的sgrna(single-guiderna)就能引导cas9核酸酶结合到特定的基因序列,并指导cas9核酸酶切割相应的结合位点,进而完成对靶基因的编辑。但传统的crispr/cas9技术所获得的蛋白纯度和浓度低,酶切方案没有特异性,致使酶切效率不稳定,影响胶回收率以及后续实验。
本实验通过优化cas9基因,设计不同的载体和纯化方案,获得高表达量、高纯度和浓度的蛋白,并通过改变酶切体系大小,以及酶切反应时间,胶回收率及测序检测的方法验证最佳酶切条件,最后通过荧光定量pcr和westernblotting实验检测目的基因的表达量,确认是否成功敲除目的基因。
技术实现要素:
本发明的目的在于提供一种高纯度crispr-cas9蛋白的酶切方法。
本发明需要解决的技术问题为:
传统的crispr/cas9技术所获得的蛋白纯度和浓度低,酶切方案没有特异性,致使酶切效率不稳定,影响胶回收率以及后续实验。
本发明的目的可以通过以下技术方案实现:
一种高纯度crispr-cas9蛋白的酶切方法,包括以下步骤:
第一步、载体构建:合成rgp基因,并克隆至自行改造pgreat-m载体,完成载体构建,进行条件优化,筛选最优单克隆;
第二步、载体蛋白表达和纯化:使用组合形纯化标签his+mbp+tev+cas9进行载体蛋白表达和多步纯化条件优化;
第三步、高浓度和纯度纯化方案设计:即使用自行优化的培养基培养,mbp柱进行纯化,his-tev酶进行酶切,再通过ni柱反筛,分子筛和离子柱多步纯化,获得高纯度和浓度的cas9蛋白,并进行hplc检测;
第四步、基因敲除酶切体系条件构建和效率优化:包括ssa活性检测、体外切割活性验证、内源活性检测。
进一步地,所述载体构建的具体步骤如下:首先合成rgp基因,并克隆至自行改造pgreat-m载体,得到重组质粒,然后将重组质粒分别加入至100μl的感受态细胞中,轻轻混合均匀,置于冰上30min,再于42℃水浴条件下,热激90s后立即转移至冰上放置5min,得第一混合物,向第一混合物中加入500μl的预热lb培养基,所述预热lb培养基为37℃水浴下放置2-3min后的lb培养基,然后于37℃下振荡培养1h,取出200μl培养的菌体,用涂布棒将其均匀涂在含有相应抗性的lb琼脂平板中,于温度为37℃下,倒置培养过夜,得到最优单克隆,选取单克隆于5管lb培养基中,在温度37℃下,培养至菌体od600为0.6-0.8,然后加入浓度为1mol/l的iptg至其最终浓度为0.5mm,培养4h后,在转速12000r/min条件下,离心,然后收集菌种制样,进行sds-page与westernblot分析;将接种保种菌培养至菌体od600为0.6-0.8,取4管培养物并向其中加入浓度为1mol/l的iptg至终浓度分别为0.2mm、0.2mm、1mm与1mm,将iptg终浓度0.2mm、1mm的一组样品于37℃下,转速220r/min条件下,培养4h,另一组于15℃,转速220r/min条件下,培养16h,诱导融合蛋白表达,然后各条件制样,进行sds-page分析;取iptg终浓度0.2mm、1mm、于37℃下、转速220r/min条件下、培养4h和于15℃、转速220r/min条件下、培养16h的菌液进行离心收集菌体,利用tris-naclbuffer进行细胞破碎,然后将上清沉淀分别制样,进行sds-page分析。
进一步地,所述载体蛋白表达和纯化的具体步骤如下:取菌液50μ接种于100ml含卡那霉素的lb液态培养基中,于温度37℃,转速180r/min条件下过夜培养,次日将菌液全部移至1l含卡那霉素的lb液态培养基培养至菌液od600=0.5-0.6时向其中计入诱导剂iptg至终浓度为1mmol/l,诱导3h后收集菌体,弃上清,按每毫升菌体5-10ml咪唑平衡缓冲液的比例悬浮菌体,进行超声波破碎,所述咪唑平衡缓冲液的浓度为10mmol/l,ph值为8.0,所述超声波破碎每次10s、间隔10s、破碎60min,破碎后于4℃,转速12000r/min条件下,离心30min,然后取上清,再用0.45μm孔径的滤膜过滤上清,利用his-tag技术进行纯化,首先根据待纯化蛋白的量将介质加入层析柱中,静置5min待液体流尽,然后再取5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液于层析柱中,静置5min待液体流尽,然后将样品少量多次加入层析柱中,静置3min左右再流出,收集流出液,少量多次加入5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液洗涤蛋白,再依次用10mmol/l、20mmol/l、50mmol/l的ph8.0咪唑平衡缓冲液洗脱5个柱体积,静置30min,收集流出液并进行sds-page电泳检测纯化效果。
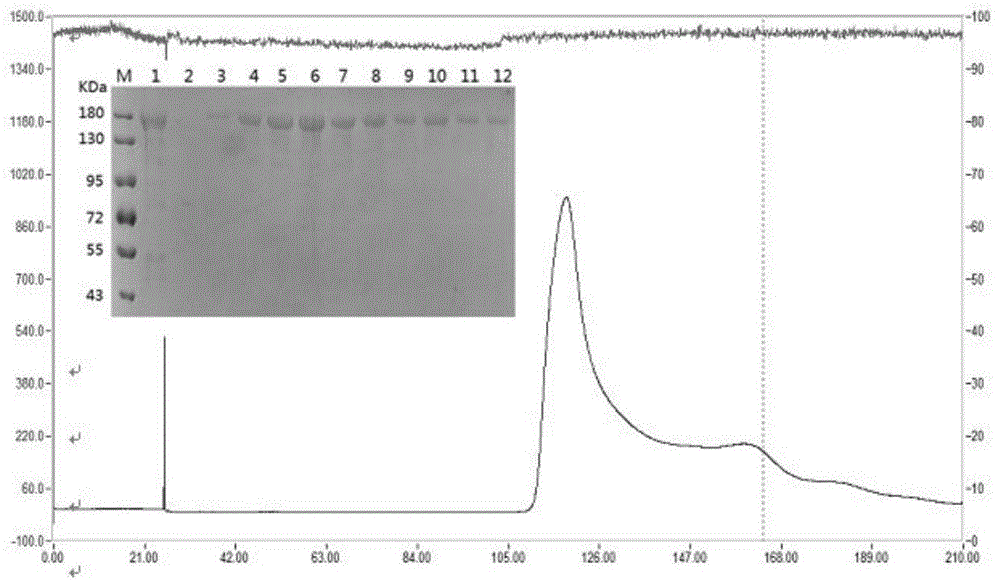
进一步地,所述hplc纯度检测的具体步骤如下:使用hplc结束检测目的蛋白纯度,用蛋白质标样配制三组不同浓度的蛋白质溶液,接着绘制蛋白质浓度与峰高和峰面积相关的标准曲线,再在相同条件下测位置样品的峰高和峰面积,即可得未知样品的浓度,保证待测样品中所有组份均出峰的情况下,用目标蛋白的峰面积和峰高除以所有峰峰面积和峰高的总和即可的目标蛋白的纯度。
本发明的有益效果:
本实验通过优化cas9基因,设计不同的载体和纯化方案,获得高表达量、高纯度和浓度的蛋白,并通过改变酶切体系大小,以及酶切反应时间,胶回收率及测序检测的方法验证最佳酶切条件,最后通过荧光定量pcr和westernblotting实验检测目的基因的表达量,确认是否成功敲除目的基因,区别于传统的cas9蛋白,本研究通过特定构建载体的设计,后期纯化工艺优化,保证了高水平和高活性蛋白酶的获得,并通过酶切体系的设计优化,使得cas蛋白活性得到高效发挥。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明的载体蛋白表达和多步纯化条件优化的示意图;
图2为本发明cas蛋白hplc检测的数据图;
图3为本发明cas蛋白hplc检测结构的示意图;
图4为本发明ssa活性检测的检测示意图;
图5为本发明体外切割活性验证的示意图;
图6为本发明内源活性检测的示意图。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1
请参阅图1-6所示,一种高纯度crispr-cas9蛋白的酶切方法,包括以下步骤:
第一步、载体构建:合成rgp基因,并克隆至自行改造pgreat-m载体,完成载体构建,进行条件优化,筛选最优单克隆;
第二步、载体蛋白表达和纯化:使用组合形纯化标签his+mbp+tev+cas9进行载体蛋白表达和多步纯化条件优化;
第三步、高浓度和纯度纯化方案设计:即使用自行优化的培养基培养,mbp柱进行纯化,his-tev酶进行酶切,再通过ni柱反筛,分子筛和离子柱多步纯化,获得高纯度和浓度的cas9蛋白,并进行hplc检测;
第四步、基因敲除酶切体系条件构建和效率优化:包括ssa活性检测、体外切割活性验证、内源活性检测。
进一步地,所述载体构建的具体步骤如下:首先合成rgp基因,并克隆至自行改造pgreat-m载体,得到重组质粒,然后将重组质粒分别加入至100μl的感受态细胞中,轻轻混合均匀,置于冰上30min,再于42℃水浴条件下,热激90s后立即转移至冰上放置5min,得第一混合物,向第一混合物中加入500μl的预热lb培养基,所述预热lb培养基为37℃水浴下放置2-3min后的lb培养基,然后于37℃下振荡培养1h,取出200μl培养的菌体,用涂布棒将其均匀涂在含有相应抗性的lb琼脂平板中,于温度为37℃下,倒置培养过夜,得到最优单克隆,选取单克隆于5管lb培养基中,在温度37℃下,培养至菌体od600为0.6-0.8,然后加入浓度为1mol/l的iptg至其最终浓度为0.5mm,培养4h后,在转速12000r/min条件下,离心,然后收集菌种制样,进行sds-page与westernblot分析;将接种保种菌培养至菌体od600为0.6-0.8,取4管培养物并向其中加入浓度为1mol/l的iptg至终浓度分别为0.2mm、0.2mm、1mm与1mm,将iptg终浓度0.2mm、1mm的一组样品于37℃下,转速220r/min条件下,培养4h,另一组于15℃,转速220r/min条件下,培养16h,诱导融合蛋白表达,然后各条件制样,进行sds-page分析;取iptg终浓度0.2mm、1mm、于37℃下、转速220r/min条件下、培养4h和于15℃、转速220r/min条件下、培养16h的菌液进行离心收集菌体,利用tris-naclbuffer进行细胞破碎,然后将上清沉淀分别制样,进行sds-page分析。
所述载体蛋白表达和纯化的具体步骤如下:取菌液50μ接种于100ml含卡那霉素的lb液态培养基中,于温度37℃,转速180r/min条件下过夜培养,次日将菌液全部移至1l含卡那霉素的lb液态培养基培养至菌液od600=0.5-0.6时向其中计入诱导剂iptg至终浓度为1mmol/l,诱导3h后收集菌体,弃上清,按每毫升菌体5-10ml咪唑平衡缓冲液的比例悬浮菌体,进行超声波破碎,所述咪唑平衡缓冲液的浓度为10mmol/l,ph值为8.0,所述超声波破碎每次10s、间隔10s、破碎60min,破碎后于4℃,转速12000r/min条件下,离心30min,然后取上清,再用0.45μm孔径的滤膜过滤上清,利用his-tag技术进行纯化,首先根据待纯化蛋白的量将介质加入层析柱中,静置5min待液体流尽,然后再取5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液于层析柱中,静置5min待液体流尽,然后将样品少量多次加入层析柱中,静置3min左右再流出,收集流出液,少量多次加入5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液洗涤蛋白,再依次用10mmol/l、20mmol/l、50mmol/l的ph8.0咪唑平衡缓冲液洗脱5个柱体积,静置30min,收集流出液并进行sds-page电泳检测纯化效果。
所述hplc纯度检测的具体步骤如下:使用hplc结束检测目的蛋白纯度,用蛋白质标样配制三组不同浓度的蛋白质溶液,接着绘制蛋白质浓度与峰高和峰面积相关的标准曲线,再在相同条件下测位置样品的峰高和峰面积,即可得未知样品的浓度,保证待测样品中所有组份均出峰的情况下,用目标蛋白的峰面积和峰高除以所有峰峰面积和峰高的总和即可的目标蛋白的纯度。
实施例2
一种高纯度crispr-cas9蛋白的酶切方法,包括以下步骤:
第一步、载体构建:合成rgp基因,并克隆至自行改造pgreat-m载体,完成载体构建,进行条件优化,筛选最优单克隆;
第二步、载体蛋白表达和纯化:使用组合形纯化标签his+mbp+tev+cas9进行载体蛋白表达和多步纯化条件优化;
第三步、高浓度和纯度纯化方案设计:即使用自行优化的培养基培养,mbp柱进行纯化,his-tev酶进行酶切,再通过ni柱反筛,分子筛和离子柱多步纯化,获得高纯度和浓度的cas9蛋白,并进行hplc检测;
第四步、基因敲除酶切体系条件构建和效率优化:包括ssa活性检测、体外切割活性验证、内源活性检测。
所述载体构建的具体步骤如下:首先合成rgp基因,并克隆至自行改造pgreat-m载体,得到重组质粒,然后将重组质粒分别加入至100μl的感受态细胞中,轻轻混合均匀,置于冰上30min,再于42℃水浴条件下,热激90s后立即转移至冰上放置5min,得第一混合物,向第一混合物中加入500μl的预热lb培养基,所述预热lb培养基为37℃水浴下放置2min后的lb培养基,然后于37℃下振荡培养1h,取出200μl培养的菌体,用涂布棒将其均匀涂在含有相应抗性的lb琼脂平板中,于温度为37℃下,倒置培养过夜,得到最优单克隆,选取单克隆于5管lb培养基中,在温度37℃下,培养至菌体od600为0.7,然后加入浓度为1mol/l的iptg至其最终浓度为0.5mm,培养4h后,在转速12000r/min条件下,离心,然后收集菌种制样,进行sds-page与westernblot分析;将接种保种菌培养至菌体od600为0.7,取4管培养物并向其中加入浓度为1mol/l的iptg至终浓度分别为0.2mm、0.2mm、1mm与1mm,将iptg终浓度0.2mm、1mm的一组样品于37℃下,转速220r/min条件下,培养4h,另一组于15℃,转速220r/min条件下,培养16h,诱导融合蛋白表达,然后各条件制样,进行sds-page分析;取iptg终浓度0.2mm、1mm、于37℃下、转速220r/min条件下、培养4h和于15℃、转速220r/min条件下、培养16h的菌液进行离心收集菌体,利用tris-naclbuffer进行细胞破碎,然后将上清沉淀分别制样,进行sds-page分析。
所述载体蛋白表达和纯化的具体步骤如下:取菌液50μ接种于100ml含卡那霉素的lb液态培养基中,于温度37℃,转速180r/min条件下过夜培养,次日将菌液全部移至1l含卡那霉素的lb液态培养基培养至菌液od600=0.5时向其中计入诱导剂iptg至终浓度为1mmol/l,诱导3h后收集菌体,弃上清,按每毫升菌体5-10ml咪唑平衡缓冲液的比例悬浮菌体,进行超声波破碎,所述咪唑平衡缓冲液的浓度为10mmol/l,ph值为8.0,所述超声波破碎每次10s、间隔10s、破碎60min,破碎后于4℃,转速12000r/min条件下,离心30min,然后取上清,再用0.45μm孔径的滤膜过滤上清,利用his-tag技术进行纯化,首先根据待纯化蛋白的量将介质加入层析柱中,静置5min待液体流尽,然后再取5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液于层析柱中,静置5min待液体流尽,然后将样品少量多次加入层析柱中,静置3min左右再流出,收集流出液,少量多次加入5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液洗涤蛋白,再依次用10mmol/l、20mmol/l、50mmol/l的ph8.0咪唑平衡缓冲液洗脱5个柱体积,静置30min,收集流出液并进行sds-page电泳检测纯化效果。
所述hplc纯度检测的具体步骤如下:使用hplc结束检测目的蛋白纯度,用蛋白质标样配制三组不同浓度的蛋白质溶液,接着绘制蛋白质浓度与峰高和峰面积相关的标准曲线,再在相同条件下测位置样品的峰高和峰面积,即可得未知样品的浓度,保证待测样品中所有组份均出峰的情况下,用目标蛋白的峰面积和峰高除以所有峰峰面积和峰高的总和即可的目标蛋白的纯度。
实施例3
一种高纯度crispr-cas9蛋白的酶切方法,包括以下步骤:
第一步、载体构建:合成rgp基因,并克隆至自行改造pgreat-m载体,完成载体构建,进行条件优化,筛选最优单克隆;
第二步、载体蛋白表达和纯化:使用组合形纯化标签his+mbp+tev+cas9进行载体蛋白表达和多步纯化条件优化;
第三步、高浓度和纯度纯化方案设计:即使用自行优化的培养基培养,mbp柱进行纯化,his-tev酶进行酶切,再通过ni柱反筛,分子筛和离子柱多步纯化,获得高纯度和浓度的cas9蛋白,并进行hplc检测;
第四步、基因敲除酶切体系条件构建和效率优化:包括ssa活性检测、体外切割活性验证、内源活性检测。
所述载体构建的具体步骤如下:首先合成rgp基因,并克隆至自行改造pgreat-m载体,得到重组质粒,然后将重组质粒分别加入至100μl的感受态细胞中,轻轻混合均匀,置于冰上30min,再于42℃水浴条件下,热激90s后立即转移至冰上放置5min,得第一混合物,向第一混合物中加入500μl的预热lb培养基,所述预热lb培养基为37℃水浴下放置2min后的lb培养基,然后于37℃下振荡培养1h,取出200μl培养的菌体,用涂布棒将其均匀涂在含有相应抗性的lb琼脂平板中,于温度为37℃下,倒置培养过夜,得到最优单克隆,选取单克隆于5管lb培养基中,在温度37℃下,培养至菌体od600为0.7,然后加入浓度为1mol/l的iptg至其最终浓度为0.5mm,培养4h后,在转速12000r/min条件下,离心,然后收集菌种制样,进行sds-page与westernblot分析;将接种保种菌培养至菌体od600为0.7,取4管培养物并向其中加入浓度为1mol/l的iptg至终浓度分别为0.2mm、0.2mm、1mm与1mm,将iptg终浓度0.2mm、1mm的一组样品于37℃下,转速220r/min条件下,培养4h,另一组于15℃,转速220r/min条件下,培养16h,诱导融合蛋白表达,然后各条件制样,进行sds-page分析;取iptg终浓度0.2mm、1mm、于37℃下、转速220r/min条件下、培养4h和于15℃、转速220r/min条件下、培养16h的菌液进行离心收集菌体,利用tris-naclbuffer进行细胞破碎,然后将上清沉淀分别制样,进行sds-page分析。
所述载体蛋白表达和纯化的具体步骤如下:取菌液50μ接种于100ml含卡那霉素的lb液态培养基中,于温度37℃,转速180r/min条件下过夜培养,次日将菌液全部移至1l含卡那霉素的lb液态培养基培养至菌液od600=0.5-0.6时向其中计入诱导剂iptg至终浓度为1mmol/l,诱导3h后收集菌体,弃上清,按每毫升菌体5-10ml咪唑平衡缓冲液的比例悬浮菌体,进行超声波破碎,所述咪唑平衡缓冲液的浓度为10mmol/l,ph值为8.0,所述超声波破碎每次10s、间隔10s、破碎60min,破碎后于4℃,转速12000r/min条件下,离心30min,然后取上清,再用0.45μm孔径的滤膜过滤上清,利用his-tag技术进行纯化,首先根据待纯化蛋白的量将介质加入层析柱中,静置5min待液体流尽,然后再取5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液于层析柱中,静置5min待液体流尽,然后将样品少量多次加入层析柱中,静置3min左右再流出,收集流出液,少量多次加入5-10倍柱体积的10mmol/l、ph8.0的咪唑平衡缓冲液洗涤蛋白,再依次用10mmol/l、20mmol/l、50mmol/l的ph8.0咪唑平衡缓冲液洗脱5个柱体积,静置30min,收集流出液并进行sds-page电泳检测纯化效果。
所述hplc纯度检测的具体步骤如下:使用hplc结束检测目的蛋白纯度,用蛋白质标样配制三组不同浓度的蛋白质溶液,接着绘制蛋白质浓度与峰高和峰面积相关的标准曲线,再在相同条件下测位置样品的峰高和峰面积,即可得未知样品的浓度,保证待测样品中所有组份均出峰的情况下,用目标蛋白的峰面积和峰高除以所有峰峰面积和峰高的总和即可的目标蛋白的纯度。
以上内容仅仅是对本发明的构思所作的举例和说明,所属本技术领域的技术人员对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,只要不偏离发明的构思或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!