一种用于检测微小残留病灶的组合物及试剂盒的制作方法
1.本发明涉及医学分子诊断领域,具体涉及一种检测微小残留白血病灶的 引物、探针及其试剂盒等。
背景技术:
2.白血病是一种常见的恶性血液病,且其发病率近年呈上升趋势,严重危害 人类健康,我国每年死于白血病的患者在3万人以上,近年来,由于化放疗的 进展及造血干细胞移植在临床上的日益广泛应用,急慢性白血病的治疗效果 明显改善,大多数病人可达缓解,长期生存病例越来越多,现已知白血病长期缓 解甚至治愈的关键是如何控制缓解后的复发问题,由于多数白血病缓解后一 段时间进入急性期是由原来的白血病细胞克隆增殖的结果,因此检测微小残 留病(niimalerdsiualdsiease,mrd)对白血病的疗效评价预后判断和复发监测等 都有十分重要的意义。
3.mrd是指白血病患者经过治疗达到完全缓解(包括骨髓移植治疗)后体 内残存少量的白血病细胞的状态。临床上只要将白血病细胞总数控制在105 个以下,即骨髓中原始或幼稚肿瘤细胞在5%以下,患者的病情即可完全控制而 达到临床完全缓解状态(称为cr),但恶性克隆增殖的潜力可存在于此5%以 下的白血病细胞中,微小残留白血病和临床白血病之间没有固定的界限,这主 要取决于检测方法的敏感性。因此,mrd的存在是导致白血病缓解后复发急 性加重以及影响患者长期存活的主要因素。提高残留白血病细胞检测技术的 水平的重要意义在于:(1)指导白血病化疗,根据体内白血病细胞的负荷决定是 继续治疗还是停止治疗;(2)在新的水平上选择最适宜的治疗方法;(3)更早地发 现药物的耐药;)更早地预测白血病复发;(5)评价自身骨髓移植的净化效果;(6) 为体内残留白血病细胞分布和增生动力学的研究提供可能性,所以,为了更深 入客观的评价白血病的治疗效果,判断预后,调整缓解后治疗方案,改善疗效,预 防复发,急慢性白血病mrd的研究成为近年来突出而重要的问题。
4.慢性粒细胞白血病(chronic myeloid leukemia,cml)是起源于造血干细胞 的恶性克隆性血液系统疾病。其标志性特征为形成了t(9;22)(q34;q11)易 位,即ph染色体,继而产生了bcr
‑
abl融合基因。由于bcr基因断裂 位点的不同,通常会产生三种不同类型的bcr/abl融合基因转录本: m
‑
bcr(e1a2),m
‑
bcr(e13a2/e14a2)和μ
‑
bcr(e19a2),分别编码 190
‑
kda,210
‑
kda和230
‑
kda的融合蛋白。p210主要存在于慢性粒细胞 白血病(chronic myeloid leukaemia,cml)患者以及30%的ph+all患者 中,p190主要存在于ph+all患者中,p230则常见于慢性中性粒细胞白 血病(neutrophilic chronicmyeloid leukaemia,cnl)。以往的研究报道显示, p190和p210在ph+b
‑
all中可以单独表达,也可以共同存在。有研究发 现,p190和p210在活化和信号转导方面存在差异,这表明bcr/abl不同 转录本的生物学特征和临床意义可能不同。然而,关于bcr/abl不同转录 本特别是p190和p210共表达患者的分布,临床特征以及预后意义仍然是 未知的。目前,临床上广泛采用实时荧光定量pcr(real
‑
time fluorescentquantitativepcr,rt
‑
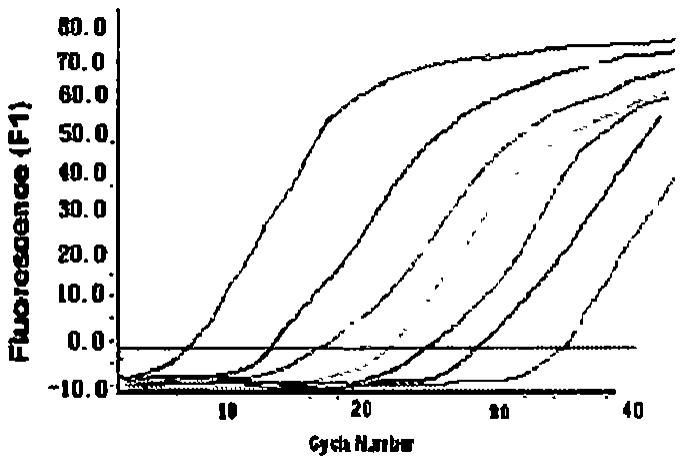
qpcr)来对bcr/abl(p210)进行分子学监
测。有试验 证实,通过tki治疗的患者,最初3个月的rt
‑
qpcr结果与其的预后直 接相关。但是由于不同实验室仪器,试剂,内参基因等影响因素的不同,导 致各个实验室bcr/abl(p210)转录本的结果不具可比性。为解决这个问题, 国际上首先采用bcr/abl(p210)转录本相当于初诊时的下降水平来评估患 者的分子生物学反应(molecular response,mr)。2005年,美国国立卫生 研究院(national institutes of health,nih)提出使用国际标准(the internationalscale,is)的建议,通过一定系数将各实验室的bcr
‑
abl/abl检测值转换为 国际标准值(bcr
‑
abl/ablis),该系数即为各实验室转换系数(cf)。若转 换后的值相对患者初发水平下降3个log值,即1000倍,说明cml患 者已获得主要分子生物学缓解(major molecular remission,mmr)。2012年, 欧洲又提出深层次的分子生物学反应:mr4.0,mr4.5和mr5.0。
5.已有isav(the imatinib suspension and validation study)报道,经伊马 替尼(imatinib,im)规律治疗24个月以上,至少18个月维持完全细胞学 缓解(complete molecularresponse,cmr)的108例cml患者,停用im之 后,有48.1%的患者复发,并且73.1%的患者在停药之后的9个月内出现 了分子生物学的复发。表明,由于目前检测方法敏感度的限制,即使rt
‑
qpcr 检测不到白血病细胞的微小残留(minimal residualdisease,mrd),白血病 细胞仍然可能存在。这就对检测方法的敏感度提出了更高的要求。
技术实现要素:
6.本发明的目的在于针对现有技术中用于检测微小残留灶的rt
‑
pcr方法 灵敏度不高,检测准确性低,寻求设计一种检测bcr/abl(p210)的引物以及 探针,从而建立一种新的超灵敏、检测重复性好的微小残留病检测试剂盒。
7.为解决上述技术问题,本发明采用如下技术方案。
8.本发明提供一种组合物,所述组合物包括用于扩增bcr
‑
abl融合基因 的引物,所述引物的序列如seq id no:1和seq id no:2所示。
9.优选的,所述组合物还包括探针,所述探针的序列如seq id no:3。
10.优选的,所述组合物还包括用于扩增内参基因的引物和探针。
11.优选的,所述扩增内参基因的引物的序列如seq id no:4和seq idno:5所示。
12.优选的,所述扩增内参基因的探针的序列如seq id no:6所示。
13.优选的,所述探针上标记荧光基团。
14.优选的,所述荧光基团选自fam、bhq
‑
mgb、tamra、tet、hex、 rox。
15.本发明提供一种荧光定量pcr反应体系,所述反应体系包括:引物序列 如seq id no:1、seq id no:2、seq id no:4、seq id no:5所示,探针序 列如seq id no:3、seq id no:6所示,所述探针标记有荧光基团。
16.其中,所述seq id no:1的核苷酸序列为tgaaactcc agaccgtcca。
17.其中,所述seq id no:2的核苷酸序列为ttagagtgttatctccactg。
18.其中,所述seq id no:3的核苷酸序列为cttggagttccaacgagcggcttca。
19.其中,所述seq id no:1的核苷酸序列为cagtagcat ctgactttga。
20.其中,所述seq id no:1的核苷酸序列为gcttagagtgttatctcca。
21.其中,所述seq id no:1的核苷酸序列为attttcactgggtccagcgagaag。
22.本发明请求保护所述的组合物以及所述的反应体系在制备检测微小残留 病灶试剂中的用途。
23.本发明请求保护一种检测微小残留病灶的试剂盒,所述试剂盒包括所述 的组合物,阴性质控以及阳性质控。
24.本发明通过设计针对bcr
‑
abl融合基因特异性的引物及探针序列,通过 对k562阳性细胞的扩增,其检测灵敏度可以达到10
‑6,具有极高的灵敏度, 相对于目前已有的检测试剂盒,其检测灵敏度较低,或检测的靶标仅是对应 的阳性质粒,可信度不够,本发明的试剂盒具有更高的操作性。且对确诊为 cml的患者不同治疗时期的融合基因bcr
‑
abl的拷贝数进行检测,在不同的 治疗时期cr1、cr2、cr3,检测的融合基因的拷贝数和治疗的趋势相一致, 且和进口的试剂盒的检测一致。其检测过程简单方便、精密度、准确度和特 异性高,得以保证检测结果的正确性。
附图说明
25.图1.bcr
‑
abl基因荧光定量检测灵敏度。
26.图2.管家基因abl荧光定量检测灵敏度。
27.图3.cml的患者不同治疗时期bcr
‑
abl基因的检测
具体实施方式
28.以下结合附图对本发明的具体实施方式进行详细说明。应当理解的是, 此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
29.实施例1 k562细胞的培养
30.准备:消毒物品(离心管、培养瓶、吸管、枪头等);1640/小牛血清培养基 (9∶1);
31.从液氮罐中取出k562细胞冻存管放置于42℃水浴锅中快速融化细胞, 转移至预先加有3ml含10%胎牛血清(fbs)的1640培养液的15ml离 心管中,1000rpm,5min离心细胞后弃上清,用1ml含10%fbs的1640培 养液悬浮细胞,转入加有5ml 10%fbs的1640培养液的25t培养瓶内, 置于37℃,5%co2培养箱内培养,每2
‑
3天传代一次。
32.冻存:收集处于对数生长期的细胞,收集细胞前24小时换液一次,1000 rpm,5min离心细胞后弃上清,约每106个细胞加入1ml冻存液(胎牛血 清∶dmso=95∶5),混匀后每支1.5ml的冻存管中分装1ml,标明日期、 名称。降温程序为4℃ 1h 40min,
‑
80℃过夜,移入液氮长期保存。
33.实施例2 单个核细胞的提取(密度梯度离心法)
34.(1)取等量的正常人外周血与pbs混匀分层。
35.(2)取一支离心管,加入外周血样本等量的分离液。
36.(3)用吸管小心吸取血液样本加于分离液之液面上,2500rpm,15min离 心。
37.(4)离心后,此时离心管中由上至下分为四层。其中第一层为血浆层; 第二层为环状乳白色淋巴细胞层;第三层为透明分离液层;第四层为红细胞 层。
38.(5)用吸管小心吸取第二层环状乳白色淋巴细胞层到另一离心管中,向 该离心管中加入10ml 1
×
pbs,混匀细胞。2000rpm,8min离心后,弃上清。
39.(6)用吸管以2ml 1
×
pbs重悬以上细胞,1800rpm,6min离心后, 弃上清。
40.(7)重复第6步2
‑
3次,弃上清后以1ml 1
×
pbs重悬细胞,于4℃ 保存备用。
41.实施例3 细胞计数及细胞的梯度稀释
42.(1)用酒精清洁细胞计数板及盖玻片,专用清洁布拭干,将盖玻片置于 计数板适当位置。
43.(2)吸取10ul细胞悬液加入计数板与盖玻片的缝隙中,于10倍电子 显微镜下观察。
44.(3)分别计数四个大格,若细胞位于线上,只计上线与左线(计上不计 下,计左不计右)。
45.(4)按照下列公式计算细胞总数:细胞数/ml=4个大格总数
×
稀释倍数
ꢀ×
104/4。
46.(5)取等浓度等体积的k562细胞和人外周血单个核细胞(pbmc)悬 液,混匀得k562∶pbmc=1∶1细胞悬液。
47.(6)取100ul 1∶1细胞悬液后加入900ul的pbmc悬液,混匀得 k562∶pbmc=1∶10细胞悬液。
48.(7)取100ul 1∶10细胞悬液后再加入900ul的pbmc悬液,混匀 k562∶pbmc=1∶102细胞悬液。
49.(8)随后依次梯度稀释为1∶103、1∶104、1∶105、1∶106细胞悬液。
50.(9)将上述梯度稀释的细胞悬液保存于4℃。
51.实施例4 总rna的提取(梯度稀释细胞悬液及患者外周血)及反转录
52.(1)取已梯度稀释好的细胞悬液,1000rpm,5min离心,弃去培养基, 1
×
pbs 5ml洗涤,1000rpm,离心5min后弃上清,重复上一步骤,留细胞 沉淀。取已收集的cml患者外周血300ul加入900ul破红液,混匀后,静 置10min,12000rpm,1min离心,弃上清,留细胞沉淀。
53.(2)在上述细胞沉淀中,分别加入100ul depc水,吹打混匀后加入 350ul mrc液,混匀,再加入350ul 70%乙醇混匀。
54.(3)将上述样品加入准备好的结合柱
‑
收集柱中,14000rpm,离心1min, 弃废液加入300ul rna wash buffer,14000rpm,离心1min。
55.(4)弃废液,加入700ul rnawash buffer,14000rpm,离心1min。
56.(5)弃废液,加入500ul rnawash buffer,14000rpm,离心1min。
57.(6)弃废液,加入500ul rnawash buffer,14000rpm,离心1min,弃 废液后空管离心2min。
58.(7)将收集柱放入新的ep管中,加入25ul depc水,静置2min后 12000rpm,离心2min。
‑
80℃保存备用。
59.(8)取总rna样本200ng,对其进行逆转录以形成cdna。首先加 入随机引物0.5μl,逆转录形成的cdna样本,depc水补至11.1μl,70 ℃热浴5min,结束后立即对产物进行冰浴;在上述反应管中加入逆转录酶 1μl,已配制好的rt
‑
buffer 8μl;反应条件为:25℃ 10min,42℃ 60min, 70℃ 10min,反应结束后产物于
‑
20℃保存备用。。
60.实施例5 建立荧光定量pcr反应体系及灵敏度测定
61.荧光定量pcr实验:取cdna 6μl行pcr反应,体系如下:premix extaq(takara)12.5μl,depc水4.5μl,bcr/abl(p210)上下游引物0.5μl (10μm),taqman探针(probe)1μl
(10μm),引物探针为seq id no:1
‑
3 所示。,共25μl体积。同样体系行abl内参的检测反应,引物探针为seqid no:4
‑
6所示。反应条件为预变性95℃ 10s后重复进行变性95℃ 15s,退 火62℃ 30s,共45个循环。
62.rt
‑
qpcr检测k562细胞与pbmc依次梯度稀释的细胞悬液,显示:rt
‑
qpcr的最低检测浓度为10
‑6。结果见图1,为bcr
‑
abl(p210)融合基 因扩增曲线(曲线从左到右依次为1、10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、10
‑6梯度 稀释细胞悬液);图2为管家基因abl扩增曲线(曲线从左到右依次为1、 10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、10
‑6梯度稀释细胞悬液)。
63.表明本发明的引物探针的最低检测浓度可以达到10
‑6,具有较高的检测 灵敏度。
64.实施例6 荧光定量pcr方法检测微小残留病灶的准确性
65.提取确诊为cml的患者不同治疗时期(cr1期为治疗30天,cr2期为 治疗30天,cr3期为治疗30天)的外周血,按照上述实施例2
‑
5的方法分 别提取制备相应的cdna扩增模板,检测该患者经过治疗后体内微小残留病 灶的情况,扩增结果如图3所示。从图3可以看出,经过治疗后,该患者体 内的bcr
‑
abl融合基因的拷贝数明显下降,表明微小残留病灶明显减少, 患者症状缓解,该结果进一步通过进口试剂盒进行验证,所获得的结果与本 发明的方法一致。
66.本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于 上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技 术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的 等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围 和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1