抗尿酸氧化酶单克隆抗体的制作方法
1.本发明涉及生物医药技术领域,具体涉及一种抗尿酸氧化酶单克隆抗体及其 用途。
背景技术:
2.尿酸是鸟类、爬行类和包括人在内的灵长类动物体内嘌呤代谢的终产物,因 为在这些动物体内缺乏以分子氧为受体催化尿酸进一步分解为尿囊素、二氧化碳 和双氧水的尿酸氧化酶。尿酸作为人体嘌呤代谢的终产物经肾脏排泄,当尿酸生 成超过肾脏代谢能力或者当肾脏处于病理状态时就会造成血浆尿酸显著升高,形 成高尿酸血症。由于尿素及其盐类在血液中的低溶解度和易沉积性就使得高尿酸 血症会引发或加剧多种疾病,例如:持续高尿酸血症时尿酸结晶沉积在外周关节、 滑膜引起的急性炎症和疼痛是痛风的主要病因;尿酸不仅可以刺激血管平滑肌细 胞增殖,还将导致内皮细胞功能障碍;血浆高尿酸也是动脉粥样硬化等心血管疾 病的重要危险因素;尿酸沉积在肾脏组织,是引发急性肾衰、肾小管损伤、iga 肾炎的主要原因,因此高尿酸血症会对自身健康带来诸多风险。
3.降尿酸的经典方案是用别嘌呤醇等黄嘌呤氧化酶抑制剂类药物降低尿酸生 成,或用丙磺舒、苯溴马龙等药物促进尿酸排泄。黄嘌呤的水溶性低于尿酸,其 积累有潜在的危险,黄嘌呤氧化酶抑制剂在初始尿酸浓度太高时疗效很差,还能 引发超敏综合征,表现为发热、毒性上皮细胞坏死溶解、肝炎和嗜酸细胞增高, 死亡率达20%,另外这类药和丙磺舒、苯溴马龙等促尿酸排泄类药都有明显肝 肾毒性。因此,经典的降尿酸治疗策略不够安全而且疗效也不够理想。尿囊素的 优良水溶性和肾脏对尿囊素的高效排泄能力使尿酸氧化酶成为治疗高尿酸血症 及其继发症的理想药物:临床研究表明尿酸氧化酶可快速高效降低血清尿酸,且 几乎没有毒副作用;在治疗肿瘤裂解综合征时,尿酸氧化酶比别嘌呤醇更安全有 效;用于治疗痛风,能快速分解关节处沉积的尿酸从而消除引发的炎症和皮肤损 伤。
4.尿酸氧化酶(也称为尿酸酶)作为一种新型的降尿酸药物,其中一种重组黄 曲霉尿酸氧化酶(商品名:拉布立酶)被欧美批准用于临床预防治疗肿瘤溶解综 合征,因此尿酸氧化酶具有良好的成药性。中国发明专利zl02819387.3公开了 产朊假丝酵母尿酸氧化酶及其制备方法。然而,蛋白质药物具有潜在的免疫原性, 可能诱导人体产生抗药物抗体(anti-drug antibodies,adas)。adas可能降低 药物疗效,或者引起过敏反应,甚至威胁生命。监测蛋白质药物的潜在免疫反应 (immune response,ir)已成为药物开发和上市后的监管要求。常用检测包括: 对结合药物抗体的检测、抗药物中和抗体检测等。制备抗体用于临床样品中 adas检测成为必要。因此,有必要提供一种新型的抗尿酸氧化酶单克隆抗体用 于在抗尿酸氧化酶抗体检测中作为阳性质控品。
技术实现要素:
5.为了解决上述技术问题,本发明提供了一种新型的抗尿酸氧化酶单克隆抗体, 其
由保藏编号为cgmcc no.21493的杂交瘤细胞株产生,可用于在抗尿酸氧化 酶抗体检测中作为阳性质控品。
6.本发明采用了如下技术方案:
7.本发明的第一个方面提供了一种杂交瘤细胞株,其保藏编号为cgmccno.21493。
8.本发明的第二个方面提供了一种抗尿酸氧化酶单克隆抗体,其由保藏编号为 cgmcc no.21493的杂交瘤细胞株产生。
9.本发明的第三个方面提供了一种抗尿酸氧化酶单克隆抗体,包括:
10.(a)重链互补决定区vhcdr1、vhcdr2、vhcdr3,所述的vhcdr1 的氨基酸序列如seq id no:9所示,所述的vhcdr2的氨基酸序列如seq id no:10所示,所述的vhcdr3的氨基酸序列如seq id no:11所示,和
11.(b)轻链互补决定区vlcdr1、vlcdr2、vlcdr3,所述的vlcdr1的 氨基酸序列如seq id no:12所示,所述的vlcdr2的氨基酸序列如seq id no: 13所示,所述的vlcdr3的氨基酸序列如seq id no:14所示。
12.根据本发明的优选实施例,所述的抗尿酸氧化酶单克隆抗体的重链可变区的 氨基酸序列如seq id no:7所示,轻链可变区的氨基酸序列如seq id no:8 所示。
13.根据本发明的优选实施例,所述的抗尿酸氧化酶单克隆抗体的重链的氨基酸 序列如seq id no:5所示,轻链的氨基酸序列如seq id no:6所示。
14.本发明的第四个方面提供了一种核酸分子,所述的核酸分子编码如上所述的 抗尿酸氧化酶单克隆抗体。
15.根据本发明的优选实施例,所述的核酸分子编码重链可变区的核苷酸序列如 seq id no:3所示,编码轻链可变区的核苷酸序列如seq id no:4所示。
16.根据本发明的优选实施例,所述的核酸分子编码重链的核苷酸序列如seqid no:1所示,编码轻链的核苷酸序列如seq id no:2所示。
17.本发明的第五个方面提供了所述的抗尿酸氧化酶单克隆抗体用于在抗尿酸 氧化酶抗体检测中作为阳性质控品的用途。
18.有益效果:本发明提供了一种能够特异性结合尿酸氧化酶的单克隆抗体,其 由保藏编号为cgmcc no.21493的杂交瘤细胞株产生,可用于在抗尿酸氧化酶 抗体检测中作为阳性质控品。
附图说明
19.图1为重组尿酸氧化酶western blot检测结果。
具体实施方式
20.本发明中,术语“抗体(ab)”和“免疫球蛋白g(igg)”是有相同结构特 征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同 的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋 白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫 键。每条重链的一端有可变区(vh),其后是恒定区。每条轻链的一端有可变区 (vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可 变区与重链的可变区相对。
21.本发明中,术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗 体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。 单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常 是具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决 定簇。除了它们的特异性外,单克隆抗体的好处还在于它们是通过杂交瘤细胞的 培养来合成的,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特 性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生 产抗体。
22.本发明中,术语“可变”表示抗体中可变区的某些部分在序列上有所不同, 它形成各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分 布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr) 或超变区中的三个片段中。可变区中较保守的部分称为框架区(fr)。天然重链 和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接 环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr 通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位 (参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。恒定区不 直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体依 赖的细胞介导的细胞毒性作用(adcc,antibody-dependent cell-mediatedcytotoxicity)等。
23.以下实施例、实验例是对本发明进行进一步的说明,不应理解为对本发明的 限制。实施例不包括对传统方法的详细描述,如elisa检测抗体效价的方法、 protein a亲和层析纯化抗体的方法等。
24.本发明优选的小鼠杂交瘤细胞29d7f2a8已于2021年01月22日保藏于中国微 生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏地址为北京市朝阳 区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.21493。
25.实施例1:抗原尿酸氧化酶的制备
26.根据中国发明专利zl02819387.3说明书实施例1-3记载的方法制备尿酸氧化 酶工程菌株。
27.复苏尿酸氧化酶工程菌,斜面37℃培养17~24小时。然后将菌种接种到摇瓶 中,37℃,200~300rpm振摇培养。当菌液的od600为2.0~5.0时,接种至发酵罐 培养。450~700rpm,ph7.0发酵罐培养,保持溶氧≥50%,od600为7.5~9.5加 入iptg诱导表达2小时。离心收集菌体,使用裂解液重悬菌体,然后使用匀浆器 处理悬液,离心处理后悬液并收集上清液。通过疏水层析和离子交换获得纯化的 尿酸氧化酶。
28.实施例2:杂交瘤细胞系的建立
29.2.1、动物免疫
30.将实施例1中纯化的尿酸氧化酶用弗氏完全佐剂乳化,对4-6周龄balb/c小 鼠进行背部皮下及足垫多点注射,剂量为7.2mg/kg。以后每14天加强免疫一次, 剂量为3.6mg/kg,抗原使用弗氏不完全佐剂乳化。免疫两次后取尾血以elisa法 梯度稀释测定血清效价,根据结果确定是否加强免疫。效价最高的小鼠以尾静脉 注射加强免疫,抗原用生理盐水混匀,剂量为7.2mg/kg。
31.2.2、细胞融合
32.无菌制备免疫的小鼠脾细胞和对数生长期的sp2/0细胞,用rpmi 1640培养液 (购
自gibco)洗两次,细胞计数后,以1个sp2/0细胞和3个脾细胞的比例混合细 胞,离心1000rpm,5min后移弃上清,轻轻打松细胞团块,在37℃、90秒内加入 1ml的peg(polyethylene glycol solution,购自sigma),经过30秒摇动,在90秒内 逐滴加入1ml预热的含1%ps(pen strep,购自gibco)的rpmi 1640培养液终止 融合反应,最后加入40ml预热的含1%ps的rpmi 1640培养液稀释peg,800rpm 离心5min,重悬细胞于选择性hat培养液(购自gibco)中,调节细胞密度为2.0
ꢀ×
105脾细胞/ml,每孔0.2ml接种于96孔板中。
33.2.3、阳性杂交瘤细胞的筛选
34.融合7-10天内挑选细胞克隆,使用实施例1中纯化的尿酸氧化酶进行elisa 检测。标记细胞株号。对阳性孔细胞进行有限稀释,每次有限稀释后5-6天测定 elisa值,挑取od280阳性值较高的单克隆孔进行有限稀释,直至elisa测定96 孔板全板结果为阳性。挑取阳性值高的单克隆细胞株扩大培养并保种冻存。
35.实施例3:抗体的制备及纯化
36.3.1、杂交瘤细胞摇瓶培养
37.选取表达量高的杂交瘤细胞培养至对数生长期时,用杂交瘤细胞无血清培养 基(hybridoma-sfm(1
×
)含2.5%超低igg血清,购自gibco)重悬细胞,转移 至1000ml摇瓶,培养体积为300ml/瓶。连续培养10天,收集细胞培养上清。
38.3.2、抗体纯化
39.采用protein a亲和层析法纯化培养上清中的特异性单克隆抗体。纯化后的单 克隆抗体采用elisa法进行鉴定,浓度测定后-20℃冻存。
40.实施例4:单克隆抗体特性鉴定
41.选择重组的尿酸氧化酶蛋白,用免疫印迹的方法检测本发明的单克隆抗体的 识别特异性。具体方法如下:分别上样不同质量的重组尿酸氧化酶,进行 10%sds-page电泳,然后用电转仪将凝胶中的蛋白转移到pvdf膜上,将膜置 于含5%脱脂奶粉的tbst封闭液中室温孵育2h,tbst缓冲液洗膜后,加入封 闭液稀释的抗尿酸氧化酶抗体4℃过夜孵育,tbst缓冲液洗膜后,加入1:5000 稀释的hrp-羊抗小鼠二抗(购自中杉金桥)室温孵育1h,再次tbst缓冲液洗 膜,加入ecl超敏显色液显色,曝光机采集图像。免疫印迹实验结果如图1所 示,杂交瘤单克隆细胞株29d7f2a8所分泌的单克隆抗体可特异识别重组的尿酸 氧化酶蛋白,具有很高的特异性。
42.实施例5:单克隆抗体测序
43.从上述实施例中得到的杂交瘤单克隆细胞株29d7f2a8中提取编码抗体的核 酸,测序即得到本发明的抗尿酸氧化酶抗体的序列。从杂交瘤优选的单克隆细胞 株中提取编码抗体的核酸并测序得到抗体序列的过程为本领域技术人员熟知并 常用的方法。
44.具体地,本发明通过扩增培养上述实施例中优选的杂交瘤单克隆细胞 29d7f2a8,收取1
×
106个细胞,用trizol法提取rna,用smart race技术将rna 反转录合成cdna,使用fastpfu dna polymerase试剂盒进行pcr扩增 获得重链和轻链全长,使用连接酶将目标片段连接至载体,并将连接产物转化进 大肠杆菌感受态细胞,然后挑取单克隆进行测序,最后使用imgt/v-quest数据 库进行测序结果比对和进一步分析(以上实验及分析委托苏州金唯智生物科技有 限公司完成)。
45.本发明优选的杂交瘤单克隆细胞株29d7f2a8中获得的单克隆抗体的重链全 长的
核苷酸序列如seq id no:1所示,轻链全长的核苷酸序列如seq id no:2 所示。经分析,本发明优选的杂交瘤单克隆细胞株29d7f2a8中获得的单克隆抗 体的重链可变区的核苷酸序列如seq id no:3所示,轻链可变区的核苷酸序列 如seq id no:4所示。
46.由上述重链和轻链全长的核苷酸序列翻译即得到本发明优选的杂交瘤单克 隆细胞株提取的抗尿酸氧化酶单克隆抗体的重链全长的氨基酸序列如seq idno:5所示,轻链全长的氨基酸序列如seq id no:6所示。经分析,本发明优 选的杂交瘤单克隆细胞株提取的抗尿酸氧化酶单克隆抗体的重链可变区的氨基 酸序列如seq id no:7所示,轻链可变区的氨基酸序列如seq id no:8所示。
47.本发明优选的抗尿酸氧化酶单克隆抗体的重链全长的氨基酸序列(seq id no:5)
48.qvqlqqpgaelvkpgtsvklscktsgytftnywihwvkqgpgqglewigeidpsdsytiysqkfkgkatltvdkfsstaymhlssltsedsavyycargdyalswgqgtlvtvsaakttapsvyplapvcgdttgssvtlgclvkgyfpepvtlt wnsgslssgvhtfpavlqsdlytlsssvtvtsstwpsqsitcnvahpasstkvd kkieprgptikpcppckcpapnllggpsvfifppkikdvlmislspivtcvvvdvs eddpdvqiswfvnnvevhtaqtqthredynstlrvvsalpiqhqdwmsgke fkckvnnkdlpapiertiskpkgsvrapqvyvlpppeeemtkkqvtltcmvtd fmpediyvewtnngktelnykntepvldsdgsyfmysklrvekknwverns yscsvvheglhnhhttksfsrtpgk(其中下划线部分为重链可变区的氨基酸 序列,seq id no:7)
49.本发明优选的抗尿酸氧化酶单克隆抗体的轻链全长的氨基酸序列(seq id no:6)
50.divmtqshrfmstsvgdrvsltckasqdvstavawyqqkpgqspklliysasyrytgvpdrftgsgsgtdftftvssvqaedlavyycqqhygapytfgggtkleikradaaptvsifppsseqltsggasvvcflnnfypkdinvkwkidgserq ngvlnswtdqdskdstysmsstltltkdeyerhnsytceathktstspivksf nrnec(其中下划线部分为轻链可变区的氨基酸序列,seq id no:8)
51.根据imgt法则对本发明优选的抗尿酸氧化单克隆抗体的重链可变区和轻链 可变区的氨基酸序列进行分析并确定了3个抗原互补决定区 (complementarity-determining region,cdr)和4个框架区(frame region,fr)。 其中,重链互补决定区的氨基酸序列为vhcdr1:gytftnyw(seq id no:9)、 vhcdr2:idpsdsyt(seq id no:10)和vhcdr3:argdyals(seq id no: 11),轻链互补决定区的氨基酸序列为vlcdr1:qdvsta(seq id no:12)、 vlcdr2:sas(seq id no:13)和vlcdr3:qqhygapyt(seq id no: 14)。
52.实施例6:单克隆抗体作为抗临床样本ada检测中的阳性质控品
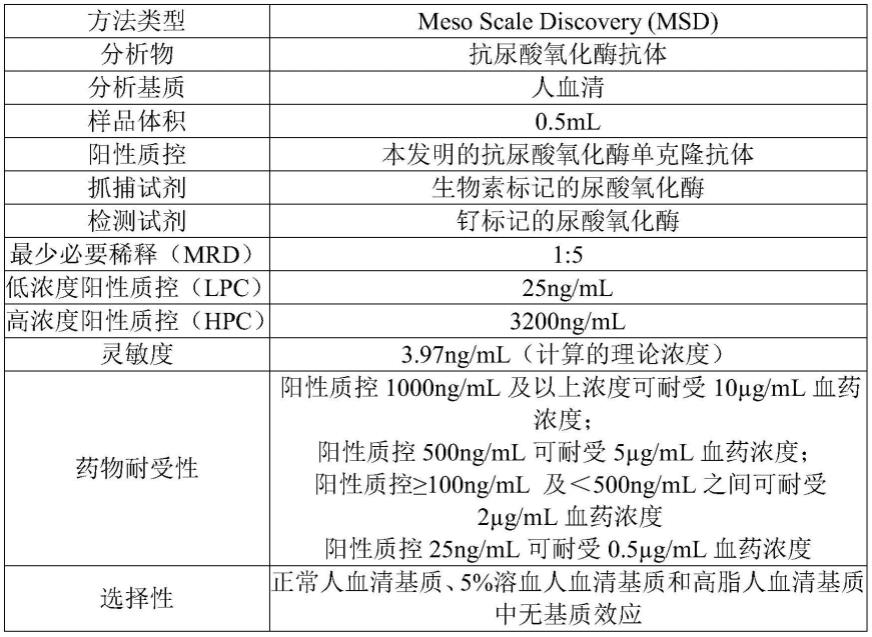
53.本发明制备的抗尿酸氧化酶单克隆抗体可用于尿酸氧化酶临床试验中ada 检测的阳性质控品。
54.具体实施方式如下:该试验先将预先包被有链霉亲和素的96孔msd板进 行封闭,之后加入有生物素标记的尿酸氧化酶孵育,洗板后加入稀释过的质控及 样品,经过一段时间的孵育后再次洗涤,加入钌标记的尿酸氧化酶孵育,最后经 过一次洗涤后加入read buffer(购自msd)。将板置于msd读板仪中,触发电 催化化学发光反应产生发光信号。化学发光信号强弱与样品中ada含量正相关。
55.分析步骤:
56.1.封闭孵育:在msd板每孔中加入150μl封闭缓冲液(购自superblock), 然后将板密封并在室温条件下孵育1-3小时。
57.2.洗板:用洗涤液(0.5%tween20-pbs)每孔350μl将msd板清洗3次,在 吸水纸上
拍干溶液。
58.3.生物素标记工作液孵育:在msd板每孔中加入50μl浓度为2μg/ml的生 物素标记的尿酸氧化酶工作液(biotin标记试剂盒,购自thermo),然后将 板密封并在室温条件下孵育60分钟(
±
10分钟)。
59.4.样品预处理:取一块稀释板,将所有阳性质控品(本发明的抗尿酸氧化酶单 克隆抗体)、阴性质控品(空白血清)和未知样品用分析缓冲液(1%bsa-pbst) 进行1:5稀释:25μl阳性质控品/阴性质控品/未知样品+100μl分析缓冲液。
60.5.洗板:用洗涤液每孔350μl将msd板清洗3次,在吸水纸上拍干溶液。
61.6.样品孵育:将50μl预处理过的阳性质控品、阴性质控品和未知样品从稀释 板转移到msd板中,复孔分析(使用多通道移液器)。然后将板密封并在 室温条件下以500rpm震荡速度孵育120分钟(
±
10分钟)。
62.7.洗板:用洗涤液每孔350μl将msd板清洗3次,在吸水纸上拍干溶液。
63.8.筛选孵育:在msd板每孔中加入50μl浓度为4μg/ml的钌标记的尿酸氧化 酶(钌标记试剂盒,购自msd),然后将板密封并在室温条件下以500rpm 震荡速度孵育60分钟(
±
10分钟)。
64.9.洗板:用洗涤液每孔350μl将msd板清洗3次,在吸水纸上拍干溶液。
65.10.读板:在msd板每孔中加入150μl的readbuffert(2
×
,购自msd)。十分 钟内完成读板。
66.方法学总结如表1所示。
67.表1、方法学总结
[0068][0069]
样品结果如表2所示。
[0070]
表2、样品结果
[0071][0072]
由表2的结果可知,本发明的抗尿酸氧化酶单克隆抗体能够特异性结合尿酸 氧化酶,可用于在抗尿酸氧化酶抗体检测中作为阳性质控品。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1