一种利用流式细胞分选仪获取指定粒径外泌体的分离纯化方法
本发明属于纳米生物颗粒获取领域,具体涉及一种利用流式细胞分选仪获取指定粒径外泌体的分离纯化方法。
背景技术:
细胞释放出不同大小的细胞外囊泡(evs),因其运载的信号分子及膜内含物在细胞间通讯发挥了重要作用,越来越受到研究者的重视。据文献报道(exosomesandectosomesinintercellularcommunication;2019cell-reassessmentofexosomecomposition),大小不同的外囊泡的作用也不同,其中50-150nm由内小体(exosomes)衍生的小胞外囊泡(sevs)可以精确地将rna、dna和蛋白质分配到正确的细胞外,并确定它们的分泌机制,对于识别生物标志物和设计未来的药物干预措施至关重要。
另外,粒径、浓度等物理参数,是评估外泌体分离的主要指标之一,随着外泌体在临床应用的不断研究,对外泌体分离方法及检测手段提出了更高的要求。
目前常用的分离方法有超速离心法、尺寸排阻法及聚合物沉淀法等,但不同分离纯化方法得到的外泌体粒径参数不一致。已有文献表明,超速离心法提取的外泌体颗粒主要在40-500nm之间,粒径大小均有分布;尺寸排阻法提取的外泌体颗粒主要在40-120nm之间,以小粒径颗粒居多;聚合物沉淀法提取的外泌体主要分布在40-100nm之间,只有极少数分布在100nm以上,大粒径的颗粒较少。以上方法均无法获取50-200nm之间(含50-150nm)的小胞外囊泡,一定程度上影响下游实验的开展,因此纯化分离特定粒径区间的外囊泡是亟待解决的问题。
流式细胞仪能够对细胞及细胞大小的生物颗粒进行定量表征,入射激光束逐个照射液流系统中的细胞或颗粒,由高灵敏度检测器接收散射光及其他荧光信号后,完成多参数分析,例如颗粒的形状及大小。对于相同折射率的颗粒及其悬浮介质,其散射光通常与颗粒大小有关,现有的灵敏型流式细胞仪散射光范围通常在300-500nm之间。然而,外泌体因粒径小,通常位于其背景噪声之内,常规方法无法对其进行分析及分选。
技术实现要素:
针对上述情况,为克服现有技术的缺陷,本发明提供一种利用流式细胞分选仪获取指定粒径外泌体的分离纯化方法。
为了实现上述目的,本发明提供以下技术方案:
一种利用流式细胞分选仪获取指定粒径外泌体的分离纯化方法,包括以下步骤:
(1)设置仪器参数和选择配件:使用mofloastrioseq流式细胞分选仪进行外泌体分选,使用50μm空气喷射喷嘴(jet-in-air),鞘液的压力为75-80.5psi,样品流的压力与鞘液的压力差值为0.3-0.6psi;阈值设置为0.01;
在流式分选中,不同大小的空气喷射喷嘴需要不同鞘液压力来维持液流的稳定,本发明中用50μm的喷嘴,只有大于或等于80psi的鞘液压力才能维持液流稳定。
样品流和鞘液的压力差决定分选的上样速度,在本发明设置条件下(样品流的压力与鞘液的压力差值为0.3-0.6psi),液流较稳定,且上样速度使分选效率达到较高水平。如果设置其他数值,会对以上两方面有影响。
(2)利用聚苯乙烯珠,标定粒径为50nm、100nm、200nm和500nm的外泌体颗粒的位置;
(3)利用流式细胞仪分离纯化50-200nm粒径的外泌体颗粒。
如果是分离纯化其他粒径的外泌体,设置的仪器参数与以上所述的参数一样,比如空气喷射喷嘴,鞘液的压力,样品流的压力等参数一样,只是圈门范围有所变化,圈出所要的颗粒范围即可。
进一步地,在步骤(1)之前,利用超速离心法制备大小不同粒径的外泌体混合液。
进一步地,步骤(1)中,设置仪器参数,前向角(fsc)和侧向角(ssc)使用对数(log)参数。
进一步地,步骤(3)中,使用聚苯乙烯珠的稀释液,其中稀释倍数为1:1000。
进一步地,步骤(1)中,鞘液压力设置为80psi。
进一步地,在步骤(1)之前,还包括获得外泌体混合液的步骤。
进一步地,所述获得外泌体混合液的步骤为:采用超速离心法从细胞上清液中获得外泌体混合液。
进一步地,所述获得外泌体混合液的步骤为:
p4代panc-1细胞的融合度为75%时,用浓度为0.01m,ph为7.2-7.4的磷酸缓冲溶液润洗panc-1细胞,加入含体积分数10%无外泌体的胎牛血清的dmem培养基,37℃培养48h后收集细胞上清液,采用超速离心法从细胞上清液中获得外泌体混合液:
4℃,300×g离心10min,取上清液;然后再2000×g离心10min,取上清液;再10000×g离心30min,取上清液;再100000×g离心70min,取沉淀,加入pbs缓冲液洗涤沉淀,100000×g离心70min,取沉淀,用pbs缓冲液重悬得到外泌体混合液。
本发明的有益效果是:
(1)本发明利用流式细胞分选仪快速分离检测外泌体,能够制备指定粒径外泌体。本发明方法采用流式细胞分选仪分离纯化指定粒径的外泌体,比如分离纯化50-200nm粒径的外泌体;分离纯化后的外泌体粒径通过粒径仪验证,可以解决获取粒径均一的、指定粒径的外泌体研究的瓶颈问题。
(2)本发明的方法能够得到50-200nm的外泌体,粒径范围更小,不含其他粒径范围,纯度高。
(3)本发明采用的流式细胞仪用荧光微球可检测到的粒径最小值达70nm,利用电子噪音作为分界线,可获得大于50nm的颗粒。
(4)本发明的分离纯化方法不仅能够获得粒径为50-200nm的外泌体,还可以运用此方法得到其他粒径范围的外泌体;如果是分离纯化其他粒径范围的外泌体,设置的仪器参数与以上所述的参数一样(比如空气喷射喷嘴,鞘液的压力,样品流的压力等参数一样),只是圈门范围有所变化,圈出所要的颗粒范围即可。
附图说明
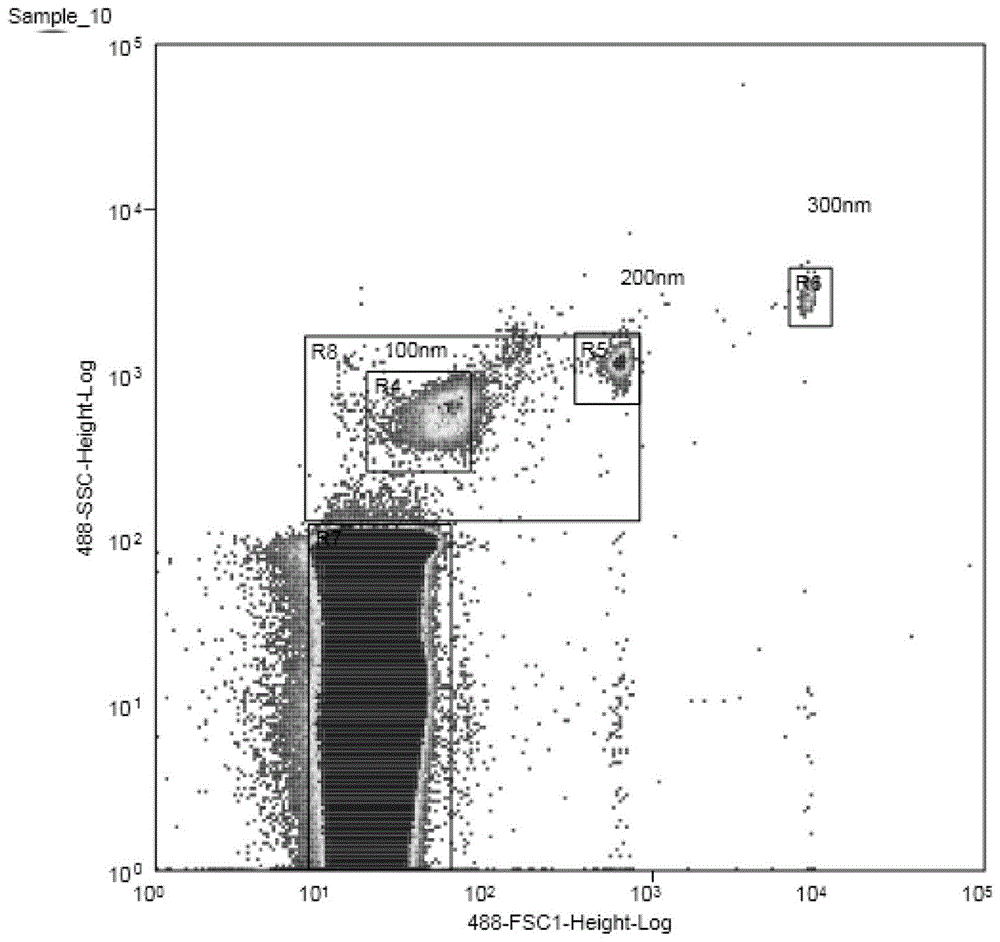
图1聚苯乙烯珠的分选基线图,电子噪音为50nm,聚丙乙烯珠分别显示100nm、200nm和300nm。
图2超速离心法获取的粒径大小不同外泌体混合悬液的分选图。
图3超速离心法分离(分选前)得到的外泌体粒径分布图。
图4分选后外泌体粒径大小的验证图。
具体实施方式
为了使本申请的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本申请进行描述和说明。应当理解,此处所描述的具体实施例仅仅用以解释本申请,并不用于限定本申请。基于本申请提供的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本申请保护的范围。
在本申请中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本申请的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域普通技术人员显式地和隐式地理解的是,本申请所描述的实施例在不冲突的情况下,可以与其它实施例相结合。
除非另作定义,本申请所涉及的技术术语或者科学术语应当为本申请所属技术领域内具有一般技能的人士所理解的通常意义。本申请所涉及的“一”、“一个”、“一种”、“该”等类似词语并不表示数量限制,可表示单数或复数。本申请所涉及的术语“包括”、“包含”、“具有”以及它们任何变形,意图在于覆盖不排他的包含;本申请所涉及的“连接”、“相连”、“耦接”等类似的词语并非限定于物理的或者机械的连接,而是可以包括电气的连接,不管是直接的还是间接的。本申请所涉及的“多个”是指大于或者等于两个。“和/或”描述关联对象的关联关系,表示可以存在三种关系,例如,“a和/或b”可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。本申请所涉及的术语“第一”、“第二”、“第三”等仅仅是区别类似的对象,不代表针对对象的特定排序。
以下实施例中采用的试剂、仪器等均能够通过商业途径获得。所述pbs指的是:浓度为0.01m,ph为7.2-7.4的磷酸缓冲溶液。
实施例1、人胰腺癌细胞panc-1的培养
人胰腺癌细胞panc-1源自于胰腺癌导管细胞,购自中国科学院细胞库(目录号:tchu98),细胞贴壁培养在含有体积分数90%的胎牛血清的dmem培养基(品牌:corningcellgro,目录号:10-013-cv)中,37℃,体积分数为5%二氧化碳。
实施例2、人胰腺癌细胞panc-1来源的外泌体的分离及粒度分布检测
p4代panc-1细胞的融合度为75%左右时,用pbs润洗panc-1细胞2次,加入含体积分数10%无外泌体的胎牛血清(品牌:suer,目录号:suer050qy)的dmem培养基(具体地,向75cm2的细胞培养瓶中加入30mldmem培养基,dmem培养基,品牌:corningcellgro,目录号:10-013-cv),37℃培养48h后收集细胞上清液80ml,采用超速离心法从细胞上清中获得外泌体混合液:
4℃,300×g离心10min,取上清液;然后再2000×g离心10min,取上清液;再10000×g离心30min,取上清液;再100000×g离心70min,取沉淀,加入10mlpbs洗涤沉淀,100000×g离心70min,取沉淀,用200mlpbs重悬得到外泌体重悬液。
将外泌体重悬液放入粒度仪中进行粒度分布检测(品牌:malvern,型号:zetasizernanozs90),发现粒度范围在0-400nm之间(如图3所示)。
实施例3、人胰腺癌细胞panc-1来源的外泌体的流式分选及粒度分布检测
本实施例中,将实施例2中制备的外泌体重悬液进行流式分选(采用流式细胞分选仪,品牌:beckmancoulter,型号:mofloastrioseq)。在一些实施方式中,可以采用其他方法制备得到外泌体混合液,然后利用流式分选仪进行分离纯化。在另外一些实施方式中,收集细胞上清液,利用流式细胞分选仪获取指定粒径外泌体的分离纯化方法。
本实施例中,利用流式细胞分选仪获取指定粒径外泌体的分离纯化方法,包括以下步骤:
(1)流式细胞分选仪调试及分选方案设置:使用50μm空气喷射喷嘴,鞘液压力80psi,样品流的压力为80.3psi,手动调节液滴延迟,在整个实验过程中保持稳定。
本实施例中,通过调节液滴振荡的频率和振幅,使液流稳定,获取一定的液滴延迟(液滴延迟值为25±5),并持久维持,进行分选。
选择50μm空气喷射喷嘴是为了使分选液滴尽可能小,从而使分选后的外泌体达到一定浓度要求,有利于下游实验。
阈值设置为0.01,前向角(fsc)和侧向角(ssc)使用对数(log)参数。在利用流式细胞分选仪分离纯化外泌体的实验中,阈值的设置相当于设定可检测到的外泌体颗粒大小,阈值越大,可检测到的外泌体颗粒越大,颗粒小的外泌体会被阈值切掉,无法检测,本实施例中将阈值设置为0.01,可以使大于电子噪音的颗粒全部被检测到。
(2)利用聚苯乙烯珠光子相关光谱(pcs)对照混合试剂盒(货号:6602336,beckmancoulter)画出不同颗粒(50nm、100nm、200nm、300nm)大小的基线图(如图1所示)。采用超纯水稀释聚苯乙烯珠,将其稀释1000倍。
图1中的r表示的是流式图中的门,也就是圈定的范围,r5表示的是200nm荧光微球所在的位置,r4是100nm荧光微球所在的位置,r6是300nm荧光微球所在的位置,r7是电子噪音,r8是50-200nm荧光微球所在的位置。
(3)根据基线图从外泌体混合液中分选出指定粒径大小(50-200nm)的外泌体溶液(如图2中的r8所示)。图2中的r表示的是流式图中的门,也就是圈定的范围,r5表示的是200nm荧光微球所在的位置,r4是100nm荧光微球所在的位置,r6是300nm荧光微球所在的位置,r7是电子噪音,r8是50-200nm荧光微球所在的位置。
(4)利用粒径仪验证分选获得的外泌体粒径范围。
将流式分选后得到的外泌体放入粒度仪中进行粒度分布检测(激光粒度仪,品牌:malvern,型号:zetasizernanozs90),发现外泌体粒度范围在50-200nm之间(如图4所示)。
本领域的技术人员应该明白,以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本申请的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干变形和改进,这些都属于本申请的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!