抗H10亚型禽流感病毒血凝素蛋白单克隆抗体ZJU10-01及其应用
本发明属于生物技术领域,涉及抗h10亚型禽流感病毒血凝素蛋白单克隆抗体的制备及应用,是利用细胞工程、抗体工程技术,获得分泌抗血凝素蛋白的单克隆抗体的杂交瘤细胞系,通过同品系的小鼠诱导腹水,制备抗血凝素蛋白的单克隆抗体zju10-01,鉴定为igg1、κ型,再通过亲和纯化、免疫方法等技术实现对该抗体的应用。
背景技术:
h10亚型禽流感病毒1949年在德国的鸡中首次分离出来。长期以来,h10亚型禽流感病毒在动物中持续传播。虽然人类感染禽流感病毒的情况并不多见,但是通过与受感染的禽类直接接触或通过受污染的环境也会发生零星感染。
禽流感病毒通常在家禽和野生鸟类中传播。其中,h5和h7亚型通常是高致病性禽流感病毒,而其他亚型是低致病性禽流感病毒。h10亚型禽流感病毒因其在人类中的具有潜在流行威胁而备受关注。近年来,h10亚型禽流感病毒越来越多地从禽类中分离出来,例如h10n1、h10n2、h10n3、h10n4、h10n5、h10n6、h10n7、h10n8和h10n9。h10亚型禽流感病毒可以在哺乳动物之间传播并引起人类的零星感染。目前,h10亚型禽流感至今仍在鸟类中持续传播,对人类健康是一个巨大的潜在威胁。
经典的流感病毒的检测方法是是通过病毒分离。近年来,分子检测方法也得到了极大发展,实时定量聚合酶链反应已被广泛用于流感病毒感染的实验室诊断。然而,这些方法对技术和实验室要求很高并且耗时。由于单克隆抗体技术的发展,基于单克隆抗体的检测方法也被广泛使用于病毒检测,如抗原捕获酶联免疫吸附试验和胶体金免疫层析试纸条。上述方法具有快速、灵敏、廉价的优势,这能促进更早更广泛的发现h10亚型禽流感病毒,控制疫情扩散。
综上所述,开发h10亚型禽流感病毒单克隆抗体,建立快速灵敏检测方法的对于病毒的防控具有重要的意义。基于以上背景,本项目选定h10亚型禽流感病毒血凝素蛋白为靶抗原,采用融合杂交瘤技术建立稳定分泌抗血凝素蛋白单克隆抗体的杂交瘤细胞系,并大量制备、纯化和鉴定这些单克隆抗体。该单克隆抗体的成功获得,为建立新型的h10亚型禽流感病毒诊断方法——基于免疫学技术的诊断奠定物质基础。同时对疾病发病机理、预后及疗效判定等方面的研究起到重要作用。
本发明用到杂交瘤细胞技术。该技术将免疫小鼠的b淋巴细胞与骨髓瘤细胞sp2/0融合,以建立分泌均质抗体的杂交瘤细胞系,也称为单克隆抗体技术。该技术涉及到动物免疫、细胞培养、细胞融合、细胞克隆培养和免疫测定等一系列方法。
技术实现要素:
本发明的目的是提供一种抗h10亚型禽流感病毒血凝素蛋白单克隆抗体,能识别h10亚型禽流感病毒。该单克隆抗体亚型为igg1、κ型,命名为zju10-01,能特异性识别禽流感病毒的血凝素蛋白。
抗体的重链氨基酸序列如seqidno.2(dna序列如seqidno.1),轻链氨基酸序列如seqidno.4(dna序列如seqidno.3)。
seqidno.1
heavychain:dnasequence(351bp)
signalsequence-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4
caggttcagctgcagcagtctggagctgaactcatgaggcctggggcctcagtgaagatatcctgcaaggttaatggctacaaattcagtgatttctggatagaatgggtaaggcagaggcctggacatggccttgagtggattggcgagattttgcctggaactggtactacccactaccatgaaaaacttaaggccagggccacattcactgaagatacatcatccaatacagcctacatacaactcagcagcctgacatctgaggactctgccgtctatttttgtgctctttactacgagggtgctatggactactggggtcaaggaacctcagtcaccgtctcctca
seqidno.2
heavychain:aminoacidsequence(117aa)
signalpeptide-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4
qvqlqqsgaelmrpgasvkisckvngykfsdfwiewvrqrpghglewigeilpgtgtthyheklkaratftedtssntayiqlssltsedsavyfcalyyegamdywgqgtsvtvss
seqidno.3
lightchain:dnasequence(336bp)
signalsequence-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4
gatgttgtgatgacccaaactccactctccctgcctgtcagtcttggagatcaagcctccatgtcttgcagatctagtcagagccttgtatacagggatggaaacacctatttacattggtacctgcagaagccaggccagtctccaaagctcctgatctacaaagtttccaaccgattttctggggtcccagacaggttcagtggcagtggatcagggacagatttcacactcaagatcagcagagtggaggctgaggatctgggaatttatttctgctctcagaatacacatattccgtggacgttcggtggaggcaccaagctggaaatcaaa
seqidno.4
lightchain:aminoacidsequence(112aa)
signalpeptide-fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4
dvvmtqtplslpvslgdqasmscrssqslvyrdgntylhwylqkpgqspklliykvsnrfsgvpdrfsgsgsgtdftlkisrveaedlgiyfcsqnthipwtfgggtkleik
本发明提供产生单克隆抗体的杂交瘤细胞,它是由免疫的balb/c小鼠脾细胞和小鼠骨髓瘤细胞sp2/0经融合、筛选、克隆、传代后获得的小鼠杂交瘤细胞系zju10-01,能稳定分泌抗h10亚型禽流感病毒血凝素蛋白的单克隆抗体zju10-01。
抗h10亚型禽流感病毒血凝素蛋白单克隆抗体的制备方法,通过以下步骤和技术方案实现:
(1)动物的免疫:选择6-8周龄balb/c小鼠,以纯化的h10n3亚型禽流感病毒(a/duck/human/s11205/2012)血凝素蛋白对小鼠进行免疫。
(2)小鼠骨髓瘤细胞的培养:培养小鼠骨髓瘤细胞sp2/0并使之保持良好的生长状态用于细胞融合。
(3)细胞融合:采用聚乙二醇介导的细胞融合法。将步骤(1)中挑选出的小鼠处死,获取脾脏淋巴细胞。收集步骤(2)中的sp2/0细胞,将上述两种细胞混合离心,然后以聚乙二醇介导细胞融合,融合后的细胞适当稀释,接种至96孔培养板,适当条件培养。
(4)杂交瘤细胞的筛选:将上述培养物在次黄嘌呤-磷酸核糖转移酶选择性培养基中培养。在细胞集落长到大小合适时,吸取细胞培养上清液做抗体鉴定,筛选阳性克隆。
(5)杂交瘤细胞的克隆化:以有限稀释法克隆阳性的杂交瘤细胞,将稀释到一定密度的细胞接种至96孔细胞培养板,使每孔只有一个细胞生长。形成细胞集落的孔取上清做酶联免疫吸附检测,筛选和鉴定阳性克隆。选择抗体效价最高的且呈单个克隆细胞生长的培养孔,再次进行有限稀释,连续进行4次以上的有限稀释,并连续传代20代以上,获得稳定高效表达抗h10亚型禽流感病毒单克隆抗体的杂交瘤细胞株,将克隆化后的杂交瘤细胞做抗体鉴定及理化性状分析。
(6)单克隆抗体腹水制备:选择8-10周balb/c健康小鼠,每只腹部接种含5×106个阳性杂交瘤细胞pbs缓冲液,接种细胞7-10天后小鼠腹部明显膨大,密切观察小鼠的健康状况腹部征象,待腹水尽可能多,并且小鼠濒临死亡之前,收集腹水离心,测定抗体效价,并纯化腹水中的单克隆抗体;
(7)单克隆抗体的纯化:使用蛋白g琼脂凝胶亲和纯化法纯化小鼠腹水中单克隆抗体
(8)本发明得到一个产生抗h10亚型禽流感病毒血凝素蛋白单克隆抗体杂交瘤系,即zju10-01,zju10-01杂交瘤细胞系经4次克隆化,持续培养六月余,分泌抗体稳定。该细胞株经液氮冻存,复苏后生长良好,抗体分泌未见衰退。酶联免疫吸附间接法实验测得zju10-01培养上清效价为1:64,腹水效价为1:2048。经单克隆抗体免疫球蛋白亚型分析显示该杂交瘤细胞产生的抗体类型为igg1。
本发明的另一个目的是提供该单克隆抗体zju10-01在含有h10亚型禽流感病毒的体液、尿囊液或其他环境样本中的检测(非诊断目的),通过制备胶体金免疫层析试纸条和酶联免疫吸附法实现。
另外本发明提供了另一种胶体金免疫层析试纸条,包含抗h10亚型禽流感病毒血凝素蛋白的单克隆抗体zju10-01,用于检测h10亚型禽流感病毒。
本发明的优点在于提供了一种抗h10亚型禽流感病毒血凝素蛋白的单克隆抗体。制备方法简单易行,更为重要的是该方法制备的单克隆抗体可以有多种用途,如对临床和实验室的h10亚型禽流感样本进行定性诊断。
附图说明
图1为单克隆抗体zju10-01的免疫球蛋白亚型分析。
图2为胶体金试纸条检测h10亚型禽流感病毒的特异性。
图3为胶体金试纸条检测h10亚型禽流感病毒的灵敏度。
图4为酶联免疫吸附法检测h10亚型禽流感病毒的特异性。
图5为酶联免疫吸附法检测h10亚型禽流感病毒的灵敏度。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1.抗h10亚型禽流感病毒血凝素蛋白的单克隆抗体的制备方法
(1)小鼠的免疫:首次免疫,将h10亚型禽流感病毒血凝素蛋白与佐剂1:1体积混合均匀,总体积0.5毫升。每只balb/c小鼠0.1毫升(含h10亚型禽流感病毒血凝素蛋白抗原100微克),大腿内侧肌肉注射。第21天按同样方式加强免疫一次。第35天采微量尾血进行酶联免疫吸附实验测定,抗体滴度最高达到1:32000,选择抗体滴度最高的小鼠尾静脉注射加强免疫一次,于3天后进行细胞融合。
(2)小鼠骨髓瘤细胞sp2/0的培养传代:用10%牛血清的dmem培养基对来自balb/c小鼠的sp2/0骨髓瘤细胞株进行培养传代,在含5%二氧化碳的37℃孵箱中培养。融合前一天通常不传代以保证融合时细胞进入对数生长期。
(3)细胞融合:以balb/c小鼠腹腔巨噬细胞作为饲养细胞,在融合前一天,接种balb/c小鼠腹腔巨噬细胞于96孔培养板,含20%牛血清的次黄嘌呤-鸟嘌呤-磷酸核糖转移酶培养基培养一天。取最后一次加强免疫3天的小鼠取脾,采用压力注水法分离脾脏淋巴细胞,离心洗涤细胞后用dmem培养液重悬。收集sp2/0细胞,离心,洗涤后用dmem培养液重悬,进行计数。将3×108个免疫小鼠脾淋巴细胞与3×107个小鼠骨髓瘤细胞sp2/0混合。两种细胞混合,离心弃上清,用手掌轻轻搓动离心管,使细胞块松动,用融合管缓慢加入37℃预温的聚乙二醇,其间轻轻振摇离心管,将细胞吸入融合管,静置90秒后将细胞吹入离心管,然后按先慢后快的原则,于第1分钟内加完1毫升dmem培养基,于第2分钟内加完2毫升dmem培养基,于第3分钟内加完7毫升dmem培养基,以后1分钟内逐渐加入37℃预温的dmem培养基40毫升。800转每分钟低速离心10分钟。然后加入含有20%牛血清的次黄嘌呤-鸟嘌呤-磷酸核糖转移酶培养基,用玻璃滴管分别接种到加有饲养细胞的96孔培养板,一般每次融合的细胞铺2-4块板,在含5%二氧化碳的37℃孵箱中培养。
(4)杂交瘤细胞的筛选:96孔培养板5天后半量换液(含次黄嘌呤-鸟嘌呤-磷酸核糖转移酶)一次,10天后改用含次黄嘌呤-磷酸核糖转移酶培养液。融合后的杂交瘤细胞在含次黄嘌呤-磷酸核糖转移酶的选择性培养液中大约持续培养两周。在细胞集落长到适当大小时(在10倍物镜下观察,细胞克隆大小以占满一个视野为宜),吸取细胞培养上清液进行酶联免疫吸附实验,筛选阳性克隆。采用酶联免疫吸附实验间接法筛选阳性杂交瘤克隆。主要步骤:①0.01摩尔每升ph9.6碳酸盐缓冲液稀释h10亚型血凝素蛋白,然后分别于96孔酶标板加入0.1毫升每孔,蛋白量为20纳克每孔,4℃过夜;②0.01摩尔每升ph7.4磷酸盐缓冲液(含吐温20)洗板5次;③用含有5%牛血清白蛋白0.01摩尔每升ph7.4的磷酸盐缓冲液封闭2小时;④洗板3次;⑤加入杂交瘤培养上清,0.1毫升每孔,同时设阳性对照(h10亚型蛋白免疫小鼠血清)、阴性对照(sp2/0培养上清液)和空白对照,室温反应2小时;⑥洗板3次;⑦加1:10000稀释的辣根过氧化物酶标记的羊抗小鼠igg,0.1毫升每孔,室温反应1小时;⑧洗板3次;⑨加入显色液室温避光反应5分钟;⑩2摩尔每升硫酸终止反应;450纳米测定其光密度值,以测定值除以阴性≥2.1为阳性。
(5)杂交瘤细胞的克隆化:杂交瘤细胞的克隆化培养按照有限稀释法进行,选择抗体检测阳性的杂交瘤孔细胞作适当增殖后,准确计数细胞。用完全dmem培养基稀释成10个每毫升的细胞悬液接种到已有饲养细胞的96孔培养板中,每孔0.1毫升,10天后观察细胞生长情况,并检测上清液中抗体水平,选择抗体效价最高的且呈单个克隆细胞生长的培养孔,再次进行有限稀释,连续进行4次以上的有限稀释,并连续传代20代以上,获得稳定高效表达抗h10亚型禽流感病毒单克隆抗体的杂交瘤细胞株。
(6)单克隆抗体腹水制备:选择8-10周balb/c健康小鼠,每只腹部接种含5×106个阳性杂交瘤细胞pbs缓冲液,接种细胞7-10天后小鼠腹部明显膨大,密切观察小鼠的健康状况腹部征象,待腹水尽可能多时收集小鼠腹水。
(7)单克隆抗体的纯化:采用亲和纯化法(蛋白g琼脂凝胶)纯化腹水中单克隆抗体。①处理腹水:于4℃10000转每分钟将腹水离心15分钟,去除沉淀物,收集上清,将其与3-4倍体积的结合缓冲液混合,再于4℃10000转每分钟离心15分钟去除沉淀物。于4℃10000转每分钟离心15分钟去除沉淀物。②将预装有蛋白g琼脂凝胶的亲和纯化柱用5倍柱床体积的结合缓冲液充分清洗。③将稀释的腹水上柱,控制流速8-10滴每分钟。④将已过柱的腹水重复上柱一次。⑤用5倍柱床体积的结合缓冲液充分洗涤纯化柱。⑥用洗脱缓冲液洗脱结合的单克隆抗体,控制流速8-10滴每分钟,收集洗脱液于预加有0.1毫升的磷酸钾缓冲液(ph7.9)的收集管中,每管收集0.5毫升含抗体的洗脱液。⑦于280纳米检测每管洗脱液的吸光度,并收集蛋白含量大于0.1毫克每毫升的洗脱液。⑧向超滤离心管内加入抗体洗脱液,于4℃10000转每分钟离心10-20分钟至抗体洗脱液终体积约为1毫升。加入并于0.1摩尔每升ph7.4的磷酸盐缓冲液10毫升,于8℃10000转每分钟离心10-20分钟,最后一次离心浓缩抗体至终体积约1毫升,吸取抗体浓缩液于收集管中。⑨将脱盐后的抗体溶液稀释后,于280纳米测蛋白含量。⑩将纯化的抗体分装于小管中,置于低温冰箱备用。
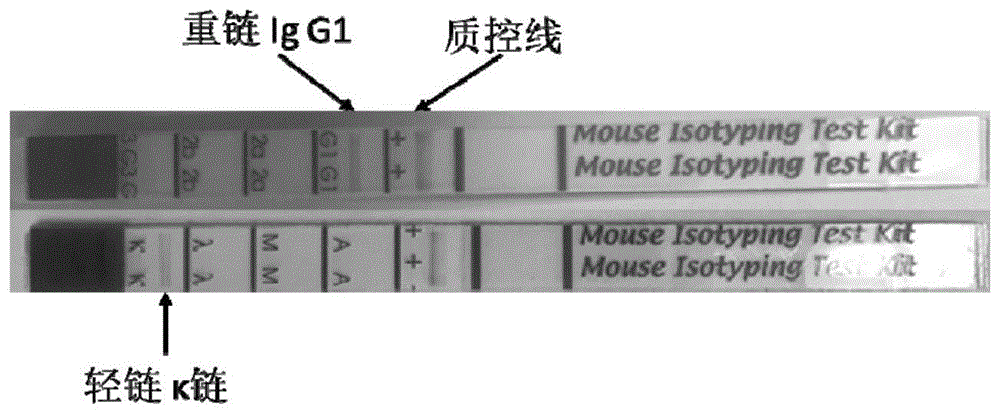
(8)单克隆抗体的亚型鉴定:采用bio-rad公司的小鼠单克隆抗体免疫球蛋白分型试剂盒分析。将纯化的单抗作适当稀释后进行检测,操作严格按试剂盒说明书进行。试验结果为zju10-01杂交瘤细胞分泌的单克隆抗体为igg1、κ型。
结果见附图1。
实施例2.用该单克隆抗体进行h10亚型禽流感病毒的定性检测
本发明制备的抗h10亚型禽流感病毒血凝素蛋白单克隆抗体可以用来定性检测h10亚型禽流感病毒,鉴定方法可以通过下述方法实现:
h10免疫层析胶体金检测试纸条:
(1)胶体金溶液制备:取100毫升玻璃瓶1个,加入超纯水49.5毫升,而后加入1%氯金酸0.5毫升,配制成50毫升0.01%氯金酸溶液,加热煮沸后在持续搅拌的条件下一次性加入1%柠檬酸三钠溶液1.8毫升,继续搅拌加热,继续加热同时观察溶液颜色的变化(灰蓝色变成紫色,再由紫色变成红色),等溶液颜色不再发生变化后,停止加热,自然冷却至室温,用超纯水定容至50毫升,4℃避光保存备用;
(2)胶体金标记物条件优化:①胶体金最佳ph值的确定:取9个离心管,每个离心管中加入胶体金溶液1毫升,依次加入0、5、10、15、20、25、30、40以及50微升的0.1摩尔每升的碳酸钾溶液,混匀,室温静置1小时;依次从每个离心管中取100微升液体置入新离心管,再分别加入3微升的1毫克每毫升的zju10-01抗体,混匀,静置15分钟;每孔中加入20微升10%的氯化钠溶液,混匀,静置2小时,观察胶体金颜色,保持红色的最低ph即为胶体金溶液的最佳ph。取最佳ph值胶体金溶液600微升,分别加至离心管,每管100微升;依次加2、4、6、8、10以及12微升的0.1毫克每毫升zju10-01抗体,混匀,静置15分钟;再加入20微升10%的氯化钠溶液,混匀,室温下静置2小时,观察胶体金颜色,保持红色的最小蛋白量为该抗体最低稳定蛋白量,将此基础上增加20%,即为金标抗体最适蛋白量;
(4)胶体金标记物的制备:取步骤(1)中的胶体金溶液20毫升,根据步骤(3)中选定的最优条件,电磁搅拌器250转每分钟搅拌,逐滴加入2毫升的1毫克每毫升zju10-01抗体,反应10分钟;逐滴加入2毫升10%牛血清白蛋白,继续搅拌反应10分钟;金标抗体溶液在4℃,12000转每分钟离心30分钟后弃上清,收集沉淀,将沉淀用金标抗体稀释液定容至2毫升,制备成zju10-01抗体胶体金标记物;
(5)胶体金膜的制备:将载体玻璃纤维素膜浸泡在胶体金标记物溶液中,室温自然晾干备用;
(6)硝酸纤维素膜的制备:将羊抗鼠igg抗体、抗h10亚型禽流感病毒的另一株单抗1f3稀释成1毫克每毫升,分别划在硝酸纤维素膜的质控线和检测线上,制备成包被膜,室温自然晾干;
(7)样品垫前处理:玻璃纤维素膜浸泡在样品垫处理液中,室温自然晾干;
(8)检测卡的组装:先将包被好检测单抗和质控二抗的硝酸纤维素膜安装在专用的支撑板上,再依次装上金标垫、样品垫、吸水垫,金标垫和吸水垫留一段在硝酸纤维素膜上,样品垫留一段在金标垫上,保证每一部分相互连接,使样品能够顺利流动。切条制备成检测试纸条。
(9)确定胶体金试纸条检测h10亚型禽流感病毒的特异性:用胶体金试纸条对不同病毒尿囊液样本进行检测,包括h1、h2、h3、h4、h5、h6、h7、h9、h10、h11亚型禽流感病毒以及乙型流感病毒、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、传染性法氏囊病病毒(ibdv)、禽副粘病毒(apmv-4)。检测结果表明,胶体金试纸条对h10亚型禽流感病毒具有较好的特异性。
结果见附图2。
(10)确定胶体金试纸条检测h10亚型禽流感病毒的灵敏度:将h10亚型禽流感病毒稀释至26、25、24、23、22、21、20、2-1血凝素单位,将100微升的待检样品滴加到试纸条样品垫区,观察质控线和检测线是否出现红色条带。结果判定:质控线出现红色条带说明试纸条有效,否则无效。检测线出现红色条带说明样品中含有h10亚型禽流感病毒,否则不含有h10亚型禽流感病毒。检测结果表明,胶体金试纸条检测h10亚型禽流感病毒的灵敏度为1个血凝素单位。
结果见附图3。
(11)胶体金试纸条与其他检测方法的对比实验:采用禽流感病毒h10亚型的核酸检测试剂盒(上海之江生物有限公司)的检测方法进行对比分析,对临床样本进行检测分析,胶体金试纸条的特异性达到了98.2%,胶体金试纸条检测方法具有快速、特异、便捷等优点,具有了良好的临床应用前景。
h10酶联免疫吸附法:
(1)抗体的预处理:将纯化得到的zju10-01抗体用0.01摩尔每升磷酸盐缓冲液稀释成4微克每毫升,将h10亚型禽流感病毒的另一株抗体1f3用0.01摩尔每升磷酸盐缓冲液稀释成2毫克每毫升,备用;
(2)辣根过氧化物酶标记检测抗体:采用辣根过氧化酶标记试剂盒标记抗体1f3,在2毫克每毫升的100抗体1f3溶液中加入10微升反应启动液,轻轻混匀;再加入100微克辣根过氧化物酶,轻轻混匀,37℃下静置2小时,期间可轻轻晃动两次;加入10微升反应终止液,轻轻混匀,室温下静置1小时;4℃避光保存,备用;
(3)酶标板包被:在10毫升0.01摩尔每升ph9.6的碳酸盐缓冲液中加入10微升4微克每毫升的zju10-01抗体,混匀;取一块96孔酶标板,加入100微升抗体-包被液每孔,4℃过夜;
(4)洗涤:包被结束后弃掉抗体-包被液,用磷酸盐吐温缓冲液进行洗涤,在每孔中加入400微升磷酸盐吐温缓冲液,弃掉洗液,再加入400微升磷酸盐吐温缓冲液,重复洗涤5次,拍干酶标板;
(5)封闭:在包被好的酶标板中加入200微升5%牛血清白蛋白磷酸盐溶液,室温下静置2小时;
(6)洗涤:将封闭结束的酶标板进行洗涤,步骤参照步骤(4)洗涤5次;
(7)样本孵育:在步骤(6)的酶标板孔中加入100微升样本,37℃下孵育1小时;
(8)洗涤:将孵育结束的酶标板进行洗涤,步骤参照步骤(4)洗涤5次;
(9)二抗孵育:用磷酸盐吐温缓冲液将步骤(2)中的辣根过氧化酶标记抗体1f3稀释500倍至4微克每毫升;在步骤(8)的酶标板孔中加入100微升辣根过氧化酶标记抗体1f3溶液,37℃下孵育30分钟;
(10)洗涤:将孵育结束的酶标板进行洗涤,步骤参照步骤(4)洗涤5次;
(11)显色:在步骤(10)的酶标板孔中加入100微升四甲基联苯胺显色液,室温下避光反应5分钟;
(12)终止:在酶标板中加入100微升每孔的2摩尔每升硫酸终止反应;
(13)读板:于450纳米测定其光密度值,以测定值除以阴性≥2.1为阳性;
(14)确定h10联免疫吸附法法检测h10亚型禽流感病毒的特异性:用酶联免疫吸附法对已知的病毒尿囊液样本进行检测,包括h1、h2、h3、h4、h5、h6、h7、h9、h10、h11亚型禽流感病毒以及乙型流感病毒、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、传染性法氏囊病病毒(ibdv)、禽副粘病毒(apmv-4)。检测结果表明,联免疫吸附法对h10亚型禽流感病毒具有较好的特异性。
结果见附图4。
(15)确定h10酶联免疫吸附法检测h10亚型禽流感病毒的灵敏度:将h10亚型禽流感病毒依次稀释至26、25、24、23、22、21、20、2-1血凝素单位,将100微升的样品按步骤(1)-步骤(13)进行检测。结果判定:空白孔和阴性孔未显色提示该酶联免疫吸附法有效,否则无效;以测定值除以阴性≥2.1判定为阳性。检测结果表明,该酶联免疫吸附检测h10亚型禽流感病毒的灵敏度为0.5个血凝素单位。
结果见附图5。
(16)酶联免疫吸附法与其他检测方法的对比实验:采用禽流感病毒h10亚型的核酸检测试剂盒(上海之江生物有限公司)的检测方法进行对比分析,对临床样本进行检测分析,联免疫吸附法检测方法的特异性达到了99.4%,联免疫吸附法检测方法具有快速、特异、便捷等优点,具有了良好的临床应用前景。
应理解,本发明是结合最佳实施例进行描述的,然而在阅读了本发明的上述内容后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>浙江大学医学院附属第一医院
<120>抗h10亚型禽流感病毒血凝素蛋白单克隆抗体zju10-01及其应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>351
<212>dna
<213>人工序列(artificialsequence)
<400>1
caggttcagctgcagcagtctggagctgaactcatgaggcctggggcctcagtgaagata60
tcctgcaaggttaatggctacaaattcagtgatttctggatagaatgggtaaggcagagg120
cctggacatggccttgagtggattggcgagattttgcctggaactggtactacccactac180
catgaaaaacttaaggccagggccacattcactgaagatacatcatccaatacagcctac240
atacaactcagcagcctgacatctgaggactctgccgtctatttttgtgctctttactac300
gagggtgctatggactactggggtcaaggaacctcagtcaccgtctcctca351
<210>2
<211>117
<212>prt
<213>人工序列(artificialsequence)
<400>2
glnvalglnleuglnglnserglyalagluleumetargproglyala
151015
servallysilesercyslysvalasnglytyrlyspheseraspphe
202530
trpileglutrpvalargglnargproglyhisglyleuglutrpile
354045
glygluileleuproglythrglythrthrhistyrhisglulysleu
505560
lysalaargalathrphethrgluaspthrserserasnthralatyr
65707580
ileglnleuserserleuthrsergluaspseralavaltyrphecys
859095
alaleutyrtyrgluglyalametasptyrtrpglyglnglythrser
100105110
valthrvalserser
115
<210>3
<211>336
<212>dna
<213>人工序列(artificialsequence)
<400>3
gatgttgtgatgacccaaactccactctccctgcctgtcagtcttggagatcaagcctcc60
atgtcttgcagatctagtcagagccttgtatacagggatggaaacacctatttacattgg120
tacctgcagaagccaggccagtctccaaagctcctgatctacaaagtttccaaccgattt180
tctggggtcccagacaggttcagtggcagtggatcagggacagatttcacactcaagatc240
agcagagtggaggctgaggatctgggaatttatttctgctctcagaatacacatattccg300
tggacgttcggtggaggcaccaagctggaaatcaaa336
<210>4
<211>112
<212>prt
<213>人工序列(artificialsequence)
<400>4
aspvalvalmetthrglnthrproleuserleuprovalserleugly
151015
aspglnalasermetsercysargserserglnserleuvaltyrarg
202530
aspglyasnthrtyrleuhistrptyrleuglnlysproglyglnser
354045
prolysleuleuiletyrlysvalserasnargpheserglyvalpro
505560
aspargpheserglyserglyserglythraspphethrleulysile
65707580
serargvalglualagluaspleuglyiletyrphecysserglnasn
859095
thrhisileprotrpthrpheglyglyglythrlysleugluilelys
100105110
- 还没有人留言评论。精彩留言会获得点赞!