CART细胞的制备方法、CART细胞及其应用与流程
car t细胞的制备方法、car t细胞及其应用
技术领域
1.本发明涉及生物技术领域,尤其是涉及一种car t细胞的制备方法、car t细胞及其应用。
背景技术:
2.研究表明在cd7在大于95%的淋巴母细胞t细胞白血病和淋巴瘤以及外周血t细胞淋巴瘤中有表达。因此,cd7分子作为血液系统恶性疾病的肿瘤细胞表面的异常标志物,被用来做恶性t淋巴细胞白血病的免疫治疗抗体的靶点。而cd7在正常nk细胞和t细胞中也有部分表达。
3.大多研究者考虑t细胞内源性的cd7会使cd7-car t细胞互相残杀,cd7-car t细胞很难在体外制备成功,所以目前大多研究者通过基因编辑方法敲除t细胞内源性的cd7或者通过cd7的阻断剂阻断t细胞内源性cd7的表达制备cd7-car t细胞,而t细胞中无内源性cd7的cd7-car t细胞则会扩增出满足临床需求的细胞。
技术实现要素:
4.本发明提供了一种car t细胞的制备方法,所述方法包括:将car基因导入外周血来源的t细胞,获得重组细胞;培养所述重组细胞3-12天,获得所述car t细胞;所述car基因编码特异性靶向cd7的car。
5.所述外周血来源的t细胞含有内源性的cd7基因,所述外周血来源的t细胞表达内源性cd7。
6.该方法可包括:(1)激活所述外周血来源的t细胞,并培养2天,例如可采用dynabeads cd3/cd28活化磁珠进行激活;(2)将car基因导入完成步骤(1)处理的t细胞,获得重组细胞;(3)培养所述重组细胞3-12天,获得所述car t细胞。
7.上文中,培养所述重组细胞3-12天例如可为培养所述重组细胞7-12天或者10-12天。
8.可选地,根据上述的制备方法,所述car含有抗cd7的单链抗体。所述car可由抗cd7的单链抗体、4-1bb、cd3ζ和tegfr连接而成。例如,所述car是氨基酸序列是序列表中seq id no.2的蛋白质。
9.可选地,所述car基因的编码链的编码序列是seq id no.1中的第15位-2585位。
10.上文中,所述外周血来源的t细胞可来自健康供者或者肿瘤患者。
11.按照上述的制备方法制备的car t细胞也在本发明的保护范围之内。
12.可选地,所述car t细胞的内源性cd7表达水平低于外周血来源的t细胞的90%。所述car t细胞的内源性cd7表达水平可低于外周血来源的t细胞的90%、93%、95%或99%。
13.本发明还提供了一种敲除内源性cd7基因的car t细胞的制备方法,所述方法包括:
14.(1)将car基因导入外周血来源的t细胞,获得重组细胞;
15.(2)采用crispr/cas9系统敲除所述重组细胞的cd7基因,得到cd7基因被敲除的重组细胞,所述cd7基因被敲除的重组细胞为所述敲除内源性cd7基因的car t细胞;
16.所述car基因为上述的car基因。
17.所述crispr/cas9系统可包括特异性靶向于cd7基因的grna。所述特异性靶向于cd7基因的grna的靶标核苷酸序列可为5
’‑
ggagcaggtgatgttgacgg-3’。例如,所述特异性靶向于cd7基因的grna的序列如seq id no.4所示。所述crispr/cas9系统具体可包括实施例制备的cas9 rnp-cd7复合物。
18.可选地,上述敲除内源性cd7基因的car t细胞的制备方法中,所述步骤(2)包括将cas9蛋白和所述grna采用电穿孔法转染至所述重组细胞。可选地,所述电穿孔法转染的电压为250v,脉冲时间为800μs,电脉冲转染次数2次,间隔1000s。
19.可选地,上述敲除内源性cd7基因的car t细胞的制备方法中,步骤(1)之前还可包括:激活所述外周血来源的t细胞,并培养2天。例如可采用dynabeads cd3/cd28活化磁珠进行激活。
20.按照上述敲除内源性cd7基因的car t细胞的制备方法制备的敲除内源性cd7基因的car t细胞也属于本发明的保护范围之内。
21.本发明还提供了一种抗肿瘤药物,所述抗肿瘤药物包括上述的car t细胞和/或上述的敲除内源性cd7基因的car t细胞。
22.上述的car t细胞制备方法或上述的car t细胞或上述的敲除内源性cd7基因的car t细胞制备方法或上述的敲除内源性cd7基因的car t细胞的应用也属于本发明的保护范围之内。该应用具体可为在制备抗肿瘤药物中的应用。
23.所述肿瘤可为以cd7为靶点的恶性肿瘤,也可为t细胞恶性肿瘤,例如,所述肿瘤选自急性t淋巴细胞白血病、t细胞淋巴瘤、急性髓细胞白血病中的一种或多种。
24.本专利可用健康供者或者患者外周血来源的t细胞制备的car t细胞,不需要用额外的方法敲除内源性cd7,即可在体外扩增制备出满足患者需求的细胞量,节省了生产成本。
25.本专利制备的car t细胞具有转染率高>90%,中央记忆性t细胞和效应记忆型t细胞比例高的特点,并且其在体外和体内具有有效抗肿瘤能力。
附图说明
26.图1为cd7-car基因结构示意图。
27.图2为senl_t7 wt细胞的制备流程。
28.图3为senl_t7 ko细胞的制备流程。
29.图4为senl_t7 ko细胞的制备的两种方法的比较
30.图5为t细胞、senl_t7 wt细胞和senl_t7 ko
t-e
细胞的cd7表达检测。
31.图6为senl_t7 wt细胞和senl_t7 ko
t-e
细胞的扩增情况。
32.图7为senl_t7 wt细胞和senl_t7 ko
t-e
细胞的car表达检测。
33.图8为senl_t7 wt细胞和senl_t7 ko
t-e
细胞的比较情况。
34.图9为senl_t7 wt细胞和senl_t7 ko
t-e
细胞体外抗肿瘤能力检测。
35.图10为senl_t7 wt细胞和senl_t7 ko
t-e
细胞的细胞因子检测。
36.图11为冻存复苏后的senl_t7 wt细胞和senl_t7 ko
t-e
细胞的活率及体外活性。
37.图12为动物实验给样流程图。
38.图13给药后荷瘤小鼠体内荧光强度变化。
39.图14为回输后car t细胞在患者体内的扩增和患者体内cd7的表达水平。
具体实施方式
40.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
41.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
42.采用graphpad prism8统计软件对数据进行处理,实验结果以平均值
±
标准偏差表示,采用atwo-tailed,unpaired t test检验。
43.1.外周血单个核细胞(pbmc)的制备:
44.本外周血可以是健康供者也可以是患者本身的外周血。如果是患者本身外周血需要根据患者的外周血mrd和骨髓血mrd综合评估分选方案,筛查出正常的t细胞的标记抗体,从而进行分选。一般采用cd3磁珠或者cd4和cd8磁珠两种方式进行分选。
45.将外周血与无菌生理盐水1∶1混匀稀释后,缓慢加入到单个核细胞分离液(东方华辉)中(稀释血∶分离液=2∶1),密度梯度离心,800g,离心20min,升7降4。离心结束后将白膜层轻轻吸出转移至新的50ml离心管中,加入无菌生理盐水重悬后800g,4℃离心10min,离心结束后将上清液弃掉,用涡旋振荡器震散细胞沉淀层,加入无菌生理盐水定容至50ml,上下颠倒离心管、混匀后移入离心机,800g,4℃离心10min,得到的沉淀即为单个核细胞。
46.2.t细胞的分离
47.离心结束后向单个核细胞沉淀中加入细胞分选液(dpbs+0.5%hsa)(1
×
107个细胞加80μl细胞分选液),依据分选磁珠(masc)数量∶cd3+t细胞总数=1∶1,加入分选磁珠(健康供者外周血分选磁珠为cd3分选磁珠,患者自体外周血根据流式检测结果而定,可以是cd3分选磁珠、cd4和cd8分选磁珠等),吹吸混匀后放入4℃冰箱避光孵育15分钟,孵育完成后按照每1
×
107pbmc加入1~2ml细胞分选液,混匀后800g,4℃离心5min。按照1
×
108pbmc加入500ul缓冲液,吹吸混匀细胞沉淀层。然后将细胞悬液加入已经准备好的磁力柱中,让其自由滴下,等到液体滴完后再加入3ml细胞分选液清洗磁力柱,重复2遍。留在磁力柱中的细胞即为阳性细胞。将磁力柱从磁力架中移出,加入5ml细胞分选液用磁力柱中的活塞用力挤压磁力柱中缓冲液,将磁力柱中的阳性细胞冲洗至离心管中,即为分选阳性细胞。
48.3.t细胞的活化培养
49.将装有分选阳性细胞的离心管混匀后800g,4℃离心5min。离心结束后将上清液弃掉,用含有200ui/ml il-2的581培养基(corning)重悬混匀,然后按照t细胞与活化磁珠cd3/cd28(thermo fisher)1∶1的比例加入活化磁珠,放入37℃、5%co2细胞培养箱进行培养。
50.如无特殊说明,下述细胞培养的培养基均为含有200ui/ml il-2的581培养基。
51.下述实施例中的cas9 rnp-cd7复合物按如下方法制备。
52.cas9蛋白和cd7-sgrna复合物(cas9 rnp-cd7)的制备:将9μg cas9蛋白(takara)和4.5μg cd7-sgrna(核苷酸序列seq id no.4所示)加入到30μl eo buffer中,室温孵育10min,形成cas9 rnp-cd7。seq id no.4中,a、g、c和u为核糖核苷酸,t为脱氧核糖核苷酸,第1-3位核苷酸的核糖中的2
′‑
oh均替换为甲氧基,磷酸均被替换为硫代磷酸;倒数第1-3位核苷酸的核糖中的2
′‑
oh均替换为甲氧基,磷酸均被替换为硫代磷酸;第1-20位核苷酸为cd7基因的grna的靶标核苷酸序列。
53.下述实施例中的人急性t淋巴白血病细胞系(t-all细胞系)ccrf-cem-luc是由购买的ccrf-cem细胞系(通派生物)通过转染luc-puro慢病毒,经过筛选得到的带有荧光素酶标记的ccrf-cem细胞(ccrf-cem-luc)。luc-puro慢病毒采用实施例1中慢病毒包装方法制备,其中,将慢病毒表达载体senl-7替换为luciferase puro(序列如seq id no.5所示)。
54.下述实施例中流式检测所用抗体如下表所示。
55.表1流式检测所用抗体信息表
56.抗体名称厂家货号pe anti-human cd7bioleneend343106pacific blue
tm
anti-humanbiolengend301033apc/cyanine7 anti-humanbiolengend300318fitc anti-human cd4biolengend300538pe/cyanine7 anti-human tcrbiolengend306720fitc anti-human pd1biolengend329904pe anti-human tim3biolengend345006apc anti-human lag3biolengend369212fitc anti-human 45rabiolengend304106brilliant violet 510
tm
biolengend3048447aad viability stainingbiolengend420404erb-biotinmerck kgaa223861apc streptavidinbiolengend405207pe streptavidinbioswan200503
57.实施例1制备senl_t7 wt细胞和senl_t7 ko
t-e
细胞
58.一、构建慢病毒载体
59.将cd7的scfv片段克隆至具有4-1bb和cd3ζ的第二代car结构骨架中,以t2a连接胞外tegfr结构域,得到名称为cd7-car的car。cd7-car由抗cd7的单链抗体、4-1bb、cd3ζ和tegfr连接而成。cd7-car基因具体结构为ef1a-leader-anti cd7 scfv-igg4 hinge-cd28tm-4-1bb-cd3ζ-t2a-tegfr(如图1)。其中,ef1a为延长因子1α的启动子,leader是信号肽的编码序列,anti cd7 scfv是抗cd7单链可变片段(scfv)的编码序列,igg4 hinge为铰链区,cd28tm是跨膜区,4-1bb和cd3ζ胞内信号区为胞内共刺激域,通过t2a肽连接表达tegfr胞外区域,以便病毒转导后检测car的表达。
60.cd7-car基因编码链的编码序列是seq id no.1的第15-2585位,seq id no.1中第1-8位为pac i的识别位点,第15-78位为信号肽的编码序列,第79-857位为抗cd7单链可变
片段(scfv)的编码序列,第858-881位hinge序列,第882-974位为cd28tm基因序列,第975-1103位为4-1bb基因序列,第1104-1439位为cd3ζ基因序列,第1440-1511位为t2a基因序列,第1512-2585位tegfr基因序列。蛋白质cd7-car氨基酸序列是序列表中seq id no.2。seq id no.2中,第1-22位氨基酸残基是leader的氨基酸序列,第23-281位氨基酸残基是抗cd7的单链抗体(anti-cd7 scfv)的氨基酸序列,第282-294位氨基酸残基是igg4 hinge的氨基酸序列,295-320位氨基酸残基是cd28tm的氨基酸序列,第321-363位氨基酸残基是4-1bb的氨基酸序列,第364-475位氨基酸残基是cd3ζ的氨基酸序列,第481-498位氨基酸残基是t2a的氨基酸序列,第499-856位氨基酸残基是tegfr的氨基酸序列。
61.cd7-car基因表达载体(慢病毒表达载体),为全序列合成,将其命名为senl-t7,序列是seq id no.3。senl-t7含有seq id no.1所示的cd7-car基因的编码区,能在细胞中表达氨基酸序列是序列表中seq id no.2的蛋白质cd7-car。
62.构建成功的慢病毒表达载体经pac i和spei酶切鉴定及序列测定正确后,用于慢病毒包装。
63.二、慢病毒包装
64.慢病毒包装操作步骤如下:
65.将已长到80%-90%的293ft细胞培养瓶(t175)从37℃5%co2的细胞培养箱中取出,加入2ml trypletm express消化后收集洗涤细胞,每145mm细胞培养皿中加入9
×
106个细胞,加20ml dmem培养基(thermo fisher),轻轻摇匀,放入37℃,5%co2培养箱中培养。
66.24小时后,按每个145mm平皿75ul无血清dmem培养基、15μg慢病毒表达载体senl-7、7.5μg编码rev蛋白的包装质粒pspax2、3.75μg编码vsv-g蛋白的包膜质粒pmd2.g的量将以上溶液混合均匀。向混合液中加入转染试剂62.5μl/145mm平皿,再次混合均匀,室温静置10min。将用于包装病毒的293ft细胞从37℃5%co2的细胞培养箱中取出,将上述混合液平均加到每平皿中,轻轻摇匀,放入37℃5%co2培养箱中。4h后,弃旧培养基,加入5ml已预热的pbs清洗细胞,再加入20ml新鲜的已预热的含10%胎牛血清的dmem培养基,放入37℃5%co2培养箱中培养。
67.继续培养48h-72h后收取培养上清作为病毒原液。将原液收集到用0.45μm滤器过滤到50ml离心管中,4℃18500g高速离心2h。将上清液弃净,加入无血清培养基重悬病毒颗粒。加入的培养基体积∶病毒原液体积=1∶500。此即为病毒浓缩液(慢病毒senl-t7)。将病毒浓缩液按100μl/管分装,另外留取10μl进行病毒滴度测定。将分装好的浓缩液置于-80℃保存。
68.三、senl_t7 wt细胞的制备和senl_t7 ko
t-e
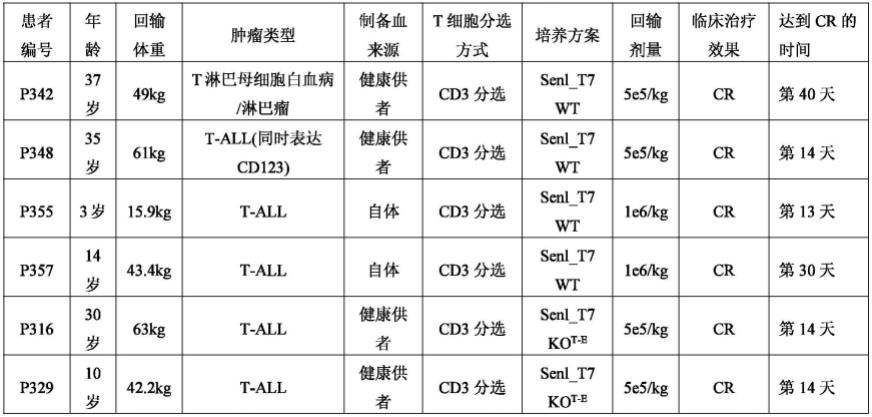
细胞的制备
69.1 senl_t7 wt细胞的制备
70.按照上述t细胞分离活化的方法制备t细胞。将分选出来的t细胞,加入dynabeads cd3/cd28活化磁珠进行激活,放入37℃、5%co2细胞培养箱进行培养(记为day0),培养48小时后,用上述制备的病毒浓缩液加入到t细胞中,离心2小时(2000rp,35℃)进行慢病毒转染,转染完成后用含有200ui/ml il-2的581培养基放入37℃、5%co2细胞培养箱进行培养,day5取样,通过流式细胞术进行car+比例检测。day12到day14收获细胞,通过洗涤去除培养基,并使用含1%hsa的0.9%生理盐水进行冲悬细胞获得senl_t7 wt细胞。
71.具体制备流程见图2。
72.2 senl_t7 ko
t-e
细胞的制备
73.下述实施例是对senl_t7 ko细胞制备方法中电转和病毒转染时间的优化。
74.2.1先进行电转cd7grna敲除cd7再转导病毒(e-t)
75.按照上述t细胞分离活化的方法制备t细胞。将分选出来的t细胞,加入dynabeads cd3/cd28活化磁珠进行激活,放入37℃、5%co2细胞培养箱进行培养,培养48小时后,收集细胞,去除磁珠,用eo buffer重悬1e7个细胞,将cas9 rnp-cd7复合物加入到细胞中,混匀,室温孵育10min,对细胞进行电转,电转条件为250v电压,脉冲800μs,间隔1000s,对细胞进行2次电转,放入37℃、5%co2细胞培养箱继续培养24小时后,用上述制备的病毒浓缩液加入到t细胞中,离心2小时(2000rp,35℃)进行慢病毒转染,继续培养至12-14天,获得senl_t7 ko
e-t
细胞(具体制备流程见图3)。
76.2.2先进行病毒转导再电转cd7grna敲除cd7(t-e)
77.按照上述t细胞分离活化的方法制备t细胞。将分选出来的t细胞,加入dynabeads cd3/cd28活化磁珠进行激活,放入37℃、5%co2细胞培养箱进行培养,培养48小时后,用上述制备的病毒浓缩液加入到t细胞中,离心2小时(2000rp,35℃)进行慢病毒转染,继续培养24小时后,收集细胞,去除磁珠,用eo buffer重悬1e7个细胞,将cas9 rnp-cd7复合物加入到细胞中,混匀,室温孵育10min,对细胞进行电转,电转条件为250v电压,脉冲800μs,间隔1000s,对细胞进行2次电转,继续培养至12-14天,获得senl_t7 ko
t-e
细胞(具体制备流程见图3)。
78.2.3对比e-t和t-e两种方法制备senl_t7 ko细胞
79.采用流式细胞术检测上述制备的senl_t7 ko
e-t
细胞和senl_t7 ko
t-e
细胞扩增倍数、car+比例、cd4+和cd8+的比值、t细胞记忆表型。
80.从扩增倍数、car+比例、cd4+和cd8+的比值、t细胞记忆表型进行对比,结果显示(图4),两种方式制备的senl_t7ko细胞,senl_t7 ko
e-t
细胞的扩增倍数比senl_t7 ko
t-e
细胞高,但无显著差异。senl_t7 ko
e-t
细胞的扩增倍数介于25.2~75.7倍之间(平均值
±
标准差45.3
±
11.6);senl_t7 ko
t-e
的扩增倍数介于12.3~48.3倍之间(平均值
±
标准差22.98
±
6.6)。比较两者car+的比例,senl_t7 ko
t-e
细胞的car+比例较高,且具有显著差异(p<0.05),其中senl_t7 ko
t-e
细胞的car+比例在36.62%~98.88%之间(平均值
±
标准差75.08%
±
12.3%);senl_t7 ko
e-t
细胞的car+比例在23.25%~49.5%之间(平均值
±
标准差34.0%
±
5.5%);senl_t7 ko
t-e
细胞的cd4+和cd8+比例的比值较senl_t7 ko
e-t
细胞的高,但无统计学差异,其中senl_t7 ko
t-e
细胞的cd4+和cd8+比例的比值在0.03~2.5之间(平均值
±
标准差1.22
±
0.48);senl_t7 ko
e-t
细胞的cd4+和cd8+比例的比值在0.017~0.46之间(平均值
±
标准差0.23
±
0.09)。比较t细胞记忆表型的差异,senl_t7 ko
t-e
细胞的car+cd4+t细胞的中央记忆型细胞(t
cm
)比例(平均值
±
标准差45%
±
3.9%)比senl_t7 ko
e-t
细胞的高(平均值
±
标准差26%
±
4.5%);senl_t7 ko
e-t
细胞的car+cd4+t细胞的效应细胞(te)(平均值
±
标准差17%
±
2.3%)比senl_t7 ko
t-e
细胞的高(平均值
±
标准差6.6%
±
2.4%)。
81.以上结果表明,用t-e方式制备的senl_t7 ko细胞car+阳性率更高,car+cd4+t细胞的中央记忆型细胞(t
cm
)比例高,cd4+和cd8+比例更合适,虽然扩增倍数比e-t稍低,但是制备出的细胞数足够临床使用。所以后续选用t-e方式制备的senl_t7 ko细胞,标记为
senl_t7 ko
t-e
。
82.3 cd7表达的变化
83.采用流式检测t细胞、senl_t7 wt细胞和senl_t7 ko
t-e
细胞的cd7表达。
84.检测结果如图5所示。图5中a为senl_t7 wt细胞和senl_t7 ko
t-e
细胞在培养当天(0天),培养第5天(5天),培养第14天(14天)检测结果。图5中b为上述t细胞分离活化的方法制备t细胞、培养第14天senl_t7 wt细胞和senl_t7 ko
t-e
细胞的流式图。
85.结果显示,t细胞表面高表达cd7分子,转染cd7-car慢病毒后,在第5天流式检测结果显示senl_t7 wt细胞和senl_t7 ko
t-e
细胞表面cd7的表达都显著地降低,senl_t7 wt细胞表面cd7的表达均值为5.8%(n=10),senl_t7ko
t-e
细胞表面cd7的分子表达均值为1.19%(n=9),在培养14天时流式检测结果显示senl_t7 wt细胞和senl_t7 ko
t-e
细胞表面cd7表达分别为0.84%和0.34%。
86.4 senl_t7 wt细胞和senl_t7 ko
t-e
细胞的扩增
87.采用细胞计数法观察senl_t7 wt细胞和senl_t7 ko
t-e
细胞的扩增情况。
88.图6为senl_t7 wt和senl_t7 ko
t-e
细胞在培养当天(0天)、培养第2天(2天)、培养第3天(3天)、培养第7天(7天)、培养第9天(9天)、培养第10天(10天)、培养第12天(12天)、培养第14天(14天)的细胞计数结果曲线图,细胞从0天培养到第14天时,senl_t7 wt细胞数由1
×
107个细胞生长到1.0
×
108个,senl_t7 ko
t-e
细胞从0天培养到第14天时,细胞数由1
×
107个细胞生长到2.45
×
108个。
89.综上结果显示,senl_t7 wt细胞的扩增速度慢,扩增倍数低,而且其细胞表面的cd7表达下调(图5),这表明senl_t7 wt细胞对其自身表达cd7的t细胞进行了杀伤,最终获得cd7阴性的senl_t7 wt细胞,并且获得的细胞数量可供患者输注。而由于senl_t7 ko
t-e
细胞对t细胞进行了基因编辑,敲除了t细胞内源性的cd7,所以细胞生长较为正常。
90.5 car表达检测
91.流式细胞数检测细胞表面car分子的表达。
92.图7为培养到第14天的senl_t7 wt细胞和senl_t7 ko
t-e
细胞上car的表达检测结果。图7中a为senl_t7 wt细胞和senl_t7 ko
t-e
细胞上car的表达率,senl_t7 wt细胞上car的表达率均值高达98.14
±
0.58%,senl_t7 ko
t-e
细胞上car的表达率为81.09
±
7.9%。图7中b为上述t细胞分离活化的方法制备t细胞、senl_t7 wt细胞和senl_t7ko
t-e
细胞上car的表达流式检测结果。
93.6 senl_t7 wt细胞和senl_t7 ko
t-e
细胞免疫表型的研究
94.为了更准确的比较senl_t7 wt细胞和senl_t7 ko
t-e
细胞的差异,我们用同一个健康供者或者患者自体的t细胞分别按两种制备方法(见上述1 senl_t7 wt细胞的制备和2 senl_t7 ko
t-e
细胞的制备)制备senl_t7_wt细胞和senl_t7ko
t-e
细胞。
95.采用流式检测培养到第14天的senl_t7 wt细胞和senl_t7 ko
t-e
细胞的扩增倍数、car表达、cd4和cd8的比值、car+cd4+记忆表型、car+cd8+记忆表型。
96.检测结果如图8所示,其中,用直线相连的数据点为采用同一个健康供者或者患者自体的t细胞分别制备的senl_t7wt细胞和senl_t7 ko
t-e
细胞。图8中a为senl_t7 wt细胞和senl_t7 ko
t-e
细胞的扩增倍数,图8中b为senl_t7wt细胞和senl_t7 ko
t-e
细胞的car表达率,图中c为senl_t7 wt细胞和senl_t7 ko
t-e
细胞的cd4和cd8的比值,图中d为senl_t7 wt
cem-luc注射到6-8周龄、体重为20-24g的b-ndg小鼠(百奥赛图)的尾静脉中,活体成像检测成瘤后,回输细胞治疗。
109.将小鼠随机分为3组:senl_t7 wt组和senl_t7 ko
t-e
组和t细胞对照组,每组6只。用同一个供者的外周血分别制备senl_t7 wt细胞、senl_t7 ko
t-e
细胞、并采用上述活化培养方法获得t细胞。按照实施例1中senl_t7 wt细胞和senl_t7 ko
t-e
细胞的制备方法制备,将培养第14天收获的细胞做为本实施例使用的senl_t7 wt细胞、senl_t7ko
t-e
细胞。每只小鼠通过尾静脉注射1
×
107个细胞/只。每天监测小鼠存活情况和每7天用小动物活体成像仪(ivis lumina,series iii,pe)观察肿瘤的生长特性并采集发光信号。具体实验流程参见图12,其中d0给药即为给小鼠注射细胞当天。
110.结果显示,和t细胞对照组(t cells)相比,senl_t7 wt组、senl_t7 ko
t-e
组的小鼠体内肿瘤负荷明显低于t细胞对照组(图13),图13的左侧图为小动物活体成像仪检测图片,右侧图为荧光强度图。三组小鼠在给药后21天内全部存活。senl_t7 wt组、senl_t7 ko
t-e
组小鼠临床症状明显改善,试验期间未出现与药物相关或无关的不良反应,说明senl_t7 wt细胞、senl_t7 ko
t-e
细胞在小鼠体内具有抗淋巴细胞白血病的作用。
111.实施例5 senl_t7 wt细胞和senl_t7 ko
t-e
细胞在临床中的应用
112.采用senl_t7 wt细胞和senl_t7 ko
t-e
细胞治疗难治性急性t细胞淋巴白血病(t-all)和t淋巴母细胞白血病/淋巴瘤患者。
113.现取6例患者进行car t细胞疗效的分析(患者情况详见表2),其中输注senl_t7 wt细胞的4名患者中有两名是用hla相合的健康供者的t细胞制备(p342和p348),两名是患者自体的t细胞制备而成(p355和p357)。senl_t7wt细胞和senl_t7 ko
t-e
细胞按照实施例1中senl_t7 wt细胞和senl_t7 ko
t-e
细胞的制备方法制备,将培养第14天收获的细胞做为本实施例使用的senl_t7 wt细胞、senl_t7 ko
t-e
细胞。
114.表2实施例5临床应用的相关信息
[0115][0116]
输注senl_t7 wt细胞的4名患者是t-all、t-all(同时表达cd123)和t淋巴母细胞白血病/淋巴瘤,年龄在3岁-37岁之间,体重在15.9kg-61kg之间,回输剂量在5
×
105个/kg-1
×
106个/kg,在car t细胞输注13天-40天评估mrd(minimal residual diseas,微小残留病灶)阴性为达到完全缓解(cr)。mrd阴性表示未检测到微小残留病灶。输注senl_t7 ko
t-e
细胞的2名患者是用hla相合的健康供者的t细胞制备(p316和p329)。输senl_t7 ko
t-e
细胞的2名患者是t-all,年龄为10岁和30岁,体重为42.2kg和63kg,回输剂量5
×
105个/kg,在car t细胞输注13天-14天达到完全缓解(cr)。
[0117]
采用qpcr方法检测静脉血的方式监测回输后的患者不同天内car t细胞在体内的扩增情况,用流式细胞术检测静脉血的方式监测回输后不同天内患者体内cd7的表达。
[0118]
图14是患者在输注car t细胞后car-t在体内的扩增情况以及cd7的表达,左侧图为qpcr方法检测car基因的拷贝数,右侧图为流式细胞术检测cd7表达,car t细胞在体内持续时间较长。cd7的表达在第6-13天后下降。
[0119]
上述实施例中,按照实施例1方法制备的senl_t7 wt细胞即为本发明保护的一种所述car t细胞。
[0120]
上述实施例中,按照实施例1方法制备的senl_t7 ko
t-e
细胞即为本发明保护的一种所述敲除内源性cd7基因的car t细胞
[0121]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1