非酒精性脂肪性肝病易感基因的早筛方法及试剂盒与流程
1.本发明属于生物技术领域,具体地说,本发明涉及一种用于非酒精性脂肪性肝病易感基因的早筛方法及试剂盒。
背景技术:
2.非酒精性脂肪性肝病(nafld)是指除外酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,与胰岛素抵抗和遗传易感性密切相关的获得性代谢应激性肝损伤。非酒精性脂肪性肝病现已成为欧美等发达国家和我国富裕地区慢性肝病的重要病因,普通成人nafld患病率10%~30%,其中10%~20%为nash,后者10年内肝硬化发生率高达25%。近10年来,愈来愈多研究揭示了基因多态性与nafld的相关性,尤其在部分既无中心性肥胖又无胰岛素抵抗的nafld患者中,基因可能起到了关键作用。
3.单核苷酸多态性(single nucleotide polymorphism,snps)是一种遗传标记,是指基因组水平上由于单核苷酸的变异,而引起的dna序列的多态性。在人群中的发生频率大于1%,包括单碱基的转换、颠倒以及单碱基的插入或缺失等形式表现,是一种新的遗传标志,可以为疾病的预测、诊断、治疗以及新型药物的研制提供可靠的有效的科学根据。
4.snp在疾病基因定位中所发挥的作用主要包括:1.在疾病定位区域中寻找致病snp,这种snp的出现可能直接导致了基因转录水平上和翻译水平上的变化,即改变了基因表达量或者基因产物蛋白质的组成结构,从而导致某种疾病发生或使得个体对某种特殊的环境易感;2.snp作为一个遗传标记,与疾病或表型紧密连锁。近年来利用snp预测疾病的发生发展已经成为临床和科研工作者的热点,且在肿瘤和心脑血管等重大疾病预测上的应用价值已初见端倪。
5.许多nafld是没有症状的,且对于该疾病的疑似诊断也通常依靠alt水平升高,以及其他临床和生化检查特点,或者无意间由腹部超声检查发现。由于nafld进展缓慢,大多数随机对照试验并没有发现可以绝对减少进展为肝硬化风险的药物,但是持续的减重可以改善肝功能,肝病理,因此目前生活方式的改善仍然是关键的干预手段。因此确定nafld患者较高发风险的一些预测因素非常重要,这可能有助于在nafld诊断时针对给定患者采用适当的治疗方法。目前临床尚未有十分有效的早期检查方法,因此亟需建立一种高灵敏,经济,简单的分子技术筛查方法,造福非酒精性脂肪性肝病诊治。
技术实现要素:
6.本发明的目的在于提供一种非酒精性脂肪性肝病易感基因的早筛方法及试剂盒。
7.本发明的第一方面,提供了一种非酒精性脂肪性肝病易感基因的早筛试剂盒,所述试剂盒包括pcr扩增引物对组,所述pcr扩增引物对组包括特异性扩增选自下组的snp位点的引物对:rs738409、rs58542926、rs780094、rs641738、rs72613567、rs3480、rs7674434、rs12152703、rs5764455和rs6006473。
8.在另一优选例中,所述试剂盒基于多重pcr飞行时间质谱检测非酒精性脂肪性肝
no.29所示。
29.在另一优选例中,所述单碱基延伸引物组中,针对rs6006473的延伸引物如seq id no.30所示。
30.在另一优选例中,所述试剂盒包括第一容器,所述第一容器内含有所述pcr扩增引物对组。
31.在另一优选例中,所述试剂盒包括第二容器,所述第二容器内含有所述单碱基延伸引物组。
32.在另一优选例中,所述试剂盒包括第三容器,所述第三容器内含有pcr预混液,所述pcr预混液主要包括热启动taq酶、dntps、mgcl2、pcr缓冲液。
33.在另一优选例中,所述试剂盒包括第四容器,所述第四容器内含有虾碱性磷酸酶(sap enzyme)。
34.在另一优选例中,所述试剂盒包括第五容器,所述第五容器内含有sap缓冲液。
35.在另一优选例中,所述试剂盒包括第六容器,所述第六容器内含有延伸酶(iplex enzyme)。
36.在另一优选例中,所述试剂盒包括第七容器,所述第七容器内含ddntps。
37.在另一优选例中,所述试剂盒包括第八容器,所述第八容器内含延伸反应缓冲液。
38.在另一优选例中,所述试剂盒还包括纯水。
39.本发明的第二方面,提供了一种基于多重pcr飞行时间质谱检测非酒精性脂肪性肝病易感基因snp基因突变位点的方法,包括以下步骤:
40.(1)以待测样品外周血基因组dna为模板,进行pcr扩增,得扩增产物;
41.(2)应用虾碱式磷酸酶对步骤(1)的扩增产物进行sap处理;
42.(3)使用延伸引物对步骤(2)纯化后的产物进行单碱基延伸反应,得延伸产物;
43.(4)脱盐树脂纯化延伸产物;
44.(5)质谱平台检测分析,判断是否存在基因变异。
45.在另一优选例中,所述步骤(1)中,pcr扩增过程中,特异性扩增选自下组的snp位点:rs738409、rs58542926、rs780094、rs641738、rs72613567、rs3480、rs7674434、rs12152703、rs5764455、rs6006473。
46.在另一优选例中,所述步骤(1)中,pcr扩增过程中,使用所述扩增引物对组进行pcr扩增。
47.在另一优选例中,所述步骤(3)中,使用所述单碱基延伸引物组进行单碱基延伸反应。
48.本发明的第三方面,提供了pcr扩增引物对组的用途,用于制备检测试剂盒,所述检测试剂盒用于检测非酒精性脂肪性肝病易感基因snp基因突变位点;
49.所述引物对组包括序列如seq id no.1至seq id no.20所示的引物。
50.本发明的第四方面,提供了单碱基延伸引物组的用途,用于制备检测试剂盒,所述检测试剂盒用于检测非酒精性脂肪性肝病易感基因snp基因突变位点;
51.所述单碱基延伸引物组包括序列如seq id no.21至seq id no.30所示的延伸引物。
52.应理解,在本发明范围内,本发明的上述各技术特征和在下文(如实施例)中具体
描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
53.本发明提供了一种非酒精性脂肪性肝病易感基因的早筛方法及试剂盒,本发明通过对比中国人群与欧美人群非酒精性脂肪性肝病基因谱的差异性,筛选出与中国人非酒精性脂肪性肝病易感相关基因的10个snp位点,进而能够利用核酸质谱仪对非酒精性脂肪性肝病相关的遗传学标识进行广泛(高通量检测位点、高通量检测样本)筛查和检验。通过多轮筛选,获得了能够对该10个snp位点进行高效多重扩增,且适合massarray核酸质谱检测的多重pcr扩增引物对,并筛选获得了适合的延伸引物,因而实现了对该10个snp位点的高准确性、高灵敏性检测,检测结果稳定,提高了检测阳性率。
54.本申请的测定方法基于多重pcr技术和mass array核酸质谱技术对非酒精性脂肪性肝病易感基因snp基因突变位点进行检测,能够对10个位点同时检测。
55.多重pcr(multiplex pcr),又称多重引物pcr或复合pcr,它是在同一pcr反应体系里加上二对以上引物,同时扩增出多个核酸片段的pcr反应,其反应原理,反应试剂和操作过程与一般pcr相同。
56.影响多重pcr反应的因素有很多,比如:
57.(1)反应体系不平衡,反应体系的不平衡导致在前期的几轮反应中某些优势引物及其模板迅速扩增,获得大量的扩增产物,而这些扩增产物同时又是dna聚合酶的良好抑制剂。所以,随着扩增产物的大量出现,聚合酶的聚合能力被越来越强烈的抑制,因此,前期处于劣势的引物及其模板,这时就更加难以反应,最终导致扩增产物量非常之小,以至于无法检测。
58.(2)引物特异性,如果引物与体系中其他非目的基因片段结合力更强,那么目的基因结合引物的能力就会受到竟争,从而导致扩增效率下降。
59.(3)最佳退火温度不一致,将多对引物放置入一个体系中扩增,由于进行pcr反应的退火温度相同,所以要求每一对引物的最佳退火温度接近。
60.(4)引物二聚体,包括引物间的二聚体以及引物自身所形成的发卡结构,还有一类是第三方dna介导的聚体,这些二聚体和非特异引物一样都会干扰引物与目标结合位点的竟争,影响扩增效率。
61.虽然上述提及了影响扩增效率的几个因素,但更多的因素尚不清楚。到目前为止,还没有一个可以明确预测扩增效率的有效方法。
62.多重pcr
‑
飞行时间质谱检测技术虽然能够进行超高通量的检测,但是其对pcr扩增产物的质量要求较高。本发明人在研究中发现,现有的能够进行多重荧光pcr法检测的扩增引物和延伸引物,直接应用于多重pcr
‑
飞行时间质谱检测中,存在很多缺陷,比如无法进行单碱基延伸反应导致质谱检测的假阴性,灵敏度较低且重复性差难以满足临床应用。因此,本发明人针对每个检测位点,重新设计了多对扩增引物和延伸引物,在单位点检测能够满足要求的情况下,进行多重组合检测验证,经过大量试验筛选,最终获得了灵敏度高、特异性好,且检测结果稳定的适用于飞行时间质谱检测的多重pcr检测体系和延伸引物。
63.本发明采用多重pcr法对靶序列进行扩增,人工设计多对引物,再对其进行优化选
择并验证,最终确定包含如下扩增引物的检测非酒精性脂肪性肝病易感基因snp基因突变位点的共计10个位点的核酸检测试剂盒。
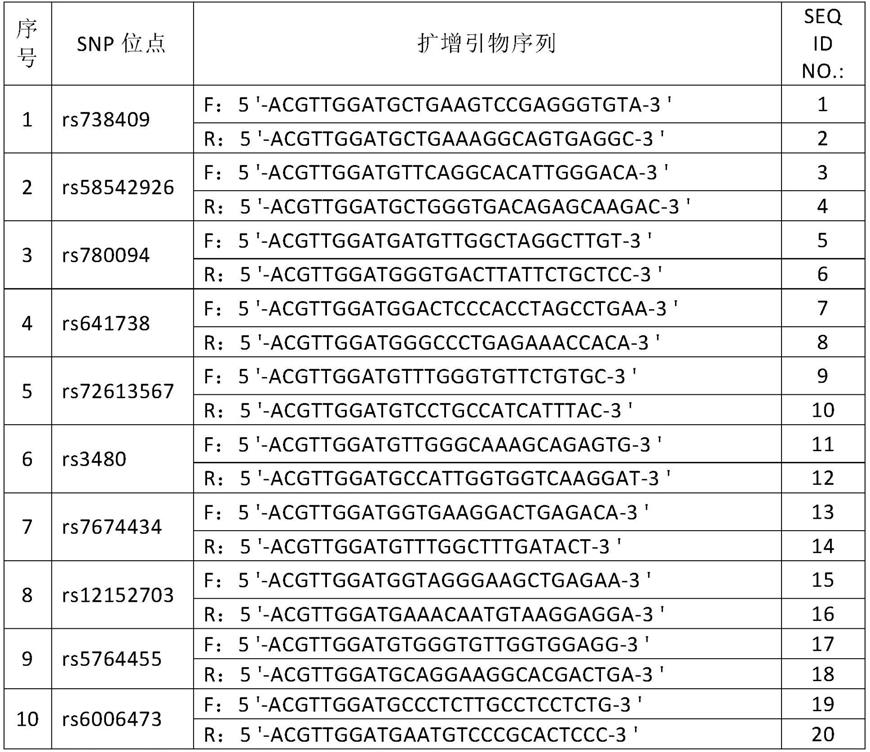
64.表1扩增引物
[0065][0066]
其中,f为上游引物,r为下游引物。
[0067]
延伸引物如表2所示:
[0068]
表2延伸引物
[0069][0070][0071]
表1和表2列出的引物序列,均可采用常规的多核苷酸合成方法合成。
[0072]
除上面提到的扩增引物和延伸引物外,本发明还提供了检测非酒精性脂肪性肝病易感基因snp基因突变位点的试剂盒,所述检测试剂盒中各组分的具体含量如下:
[0073]
表3试剂盒组分
[0074][0075]
本发明还提供了基于多重pcr飞行时间质谱检测非酒精性脂肪性肝病易感基因snp基因突变位点的方法,包括以下步骤:
[0076]
(1)以待测样品外周血基因组dna为模板,进行pcr扩增,得扩增产物;
[0077]
(2)应用虾碱式磷酸酶对步骤(1)的扩增产物进行sap处理;
[0078]
(3)使用延伸引物对步骤(2)纯化后的产物进行单碱基延伸反应,得延伸产物;
[0079]
(4)脱盐树脂纯化延伸产物;
[0080]
(5)质谱平台检测分析,判断是否存在基因变异。
[0081]
进一步地,所述步骤(1)中,pcr扩增过程中,特异性扩增选自下组的snp位点:rs738409、rs58542926、rs780094、rs641738、rs72613567、rs3480、rs7674434、rs12152703、rs5764455、rs6006473。
[0082]
进一步地,所述步骤(1)中,pcr扩增过程中,使用所述扩增引物对组进行pcr扩增。
[0083]
进一步地,所述步骤(3)中,使用延伸引物组进行单碱基延伸反应。
[0084]
进一步地,所述步骤(1)的扩增条件为:95℃、3min;95℃、15s,55℃、15s,72℃、1min,45个循环;72℃保持5min。
[0085]
进一步地,所述步骤(2)的sap处理条件为:57℃40min,65℃5min。
[0086]
进一步地,所述步骤(3)的延伸反应的条件为:95℃、30s;95℃、5s,(51℃、5s,72℃、5s,5个循环),35个循环;72℃保持5min。
[0087]
本发明的主要优点在于:
[0088]
本发明提供的非酒精性脂肪性肝病易感基因的核酸质谱早筛方法考虑了中国人与欧美人群非酒精性脂肪性肝病基因谱的差异性,检测的易感基因更前沿,并纳入了多个与非酒精性脂肪性肝病易感snp位点,这些位点检出成功率高、技术重现性好、性价比高;
[0089]
本发明提供的检测技术,价格优势明显,改变传统单碱基检测价格昂贵、耗时长、操作繁琐等劣势。在非酒精性脂肪性肝病易感基因早筛检测方面的灵敏度更高,通量更大,可实现单个小样本多基因的检测,满足小样本最大化使用。
[0090]
本发明提供的基于massarray核酸质谱技术检测一组非酒精性脂肪性肝病易感基因早筛的核酸质谱方法具有高准确性、高灵敏性的技术优势,检测结果稳定,较sanger测序发具有明显优势,提高了检测阳性率。
[0091]
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0092]
实施例1
[0093]
人类非酒精性脂肪性肝病易感相关基因的snp位点筛选的可行性分析
[0094]
通过搜索ncbi国内外全基因组关联分析(genome
‑
wide association study,gwas)在大规模病理对照组临床研究中得到验证的非酒精性脂肪性肝病发生相关位点,本发明人对其做出筛选和评估,选择了与中国人群患非酒精性脂肪性肝病风险显著相关的10个单核苷酸多态性位点,并且彼此独立,不存在连锁不平衡,因此本发明的位点选择具有代表性、独立性和风险值可积累性,可用于评估个体患非酒精性脂肪性肝病的风险。
[0095]
筛选出的snp位点如下:
[0096]
rs738409、rs58542926、rs780094、rs641738、rs72613567、rs3480、rs7674434、rs12152703、rs5764455、rs6006473。
[0097]
实施例2体系验证
[0098]
体系验证包括准确性、特异性、灵敏性、精密度和人员间对比等。
[0099]
准确性验证方案:各位点检测20例,与sanger测序比较,预期目标95%。
[0100]
特异性验证方案:包含在准确性中,预期目标95%。
[0101]
灵敏验证方案:以人基因组dna阳性样本为模板,标定样本dna含量分别为1ng/μl、5ng/μl、10ng/μl、50ng/μl、100ng/μl进行灵敏度考察。
[0102]
精密度验证方案(含批内、批间、人员比对,不涉及仪器间比对),预期目标95%。
[0103]
批内精密度:每一例样本同一批次重复3次,比较批内精密度。
[0104]
批间精密度:同一操作者分多批次检验同样样本,比较批间精密度。
[0105]
人员间比对:2位操作者检测同样样本,比较人员间结果的差异。
[0106]
具体试验步骤如下:
[0107]
1、dna提取:根据南芯医疗自主研发的血液dna提取试剂盒(为市售的快速高效抽提基因组dna的试剂盒)说明书提供的操作步骤,制备人外周血基因组dna,50μlddh2o洗脱;
[0108]
2、pcr流程
[0109]
(1)样本稀释至20ng/μl;
[0110]
(2)按下表配制pcr反应体系(以下为单个样本量,样本dna共需40ng)
[0111]
表4.pcr反应体系
[0112]
试剂w1(μl)w2(μl)水,ddh2o0.80.810pcr buffer with 20mm0.50.525mm mgcl20.40.4
25mm dntp混合液0.10.125μm扩增引物混合液115u/μl pcr taq酶0.20.220ng/μl dna22总体积5.005.00
[0113]
(3)封膜,vortex混匀30秒,500g离心1分钟;
[0114]
(4)将板放上pcr仪进行以下热循环:
[0115]
95℃3分钟
[0116]
45个循环:
[0117]
(95℃15秒
[0118]
55℃15秒
[0119]
72℃1分钟)
[0120]
72℃5分钟
[0121]
4℃保温
[0122]
2、sap流程
[0123]
(1)取出pcr板,500g离心3分钟;
[0124]
(2)按下表配制sap反应体系(以下为单个样本量);
[0125]
表5.sap反应体系
[0126]
试剂每孔加样(μl)
×
2ddh2o1.533.06sap缓冲液0.170.34sap酶(1.7u/μl)0.30.6总体积2.004.00
[0127]
(3)每孔加2μl sap混液;
[0128]
(4)封膜,vortex混匀30秒,500g离心1分钟;
[0129]
(5)将板放上pcr仪进行以下热循环:
[0130]
57℃40分钟
[0131]
65℃5分钟
[0132]
4℃保温
[0133]
3、ext(单碱基延伸)流程
[0134]
(1)取出pcr板,500g离心3分钟;
[0135]
(2)按下表配制ext反应体系(以下为单个样本量);
[0136]
表6 ext反应体系
[0137]
试剂w1(μl)w2(μl)ddh2o0.620.62iplex缓冲液0.20.2ddntp混合液0.20.2延伸引物混合液0.940.94iplex酶0.040.04
总体积2.002.00
[0138]
(3)加入2μl iplex延伸混液;
[0139]
(4)封膜,vortex混匀30秒,500g离心1分钟;
[0140]
(5)将板放上pcr仪进行以下热循环:
[0141]
95℃30s
[0142]
35个循环:
[0143]
(95℃、5s
[0144]
5个循环:
[0145]
(51℃5s
[0146]
72℃5s))
[0147]
72℃5min
[0148]
4℃保温
[0149]
4、树脂脱盐
[0150]
取出pcr板,500g离心3分钟;把洁净树脂(resin)铺平在dimple plate应孔上,风干最少10分钟;样本板每一个有样本的孔里加入10ul水;封板,vortex 10秒,500g离心1分钟;轻轻将样本板凌空反转,放在已放树脂的dimple plate上,然后将dimple plate连样本板一起反转(过程中两快板不可水平移动),让树脂掉到孔里;取下dimple plate,样本板封板,旋转器上颠倒摇匀3分钟;2000g离心5分钟。
[0151]
5、dispensing点样
[0152]
使用maldi
‑
tof(基质辅助激光解吸电离
‑
飞行时间)质谱仪获得数据各位点聚类图(均聚类清晰)。
[0153]
试验结果:以其中1例样本举例,其准确性验证结果如表7所示。
[0154]
表7准确性验证(一代测序与massarray结果对比)
[0155][0156][0157]
以该例样本rs12152703位点举例,其精密度验证结果见表5。
[0158]
表8 rs12152703位点精密度验证结果
[0159] 重复1重复2重复3批次1gggggg批次2gggggg
批次3gggggg批次4gggggg批次5gggggg
[0160]
整体上,本申请所有位点聚类清晰,基本无灰区,误检可能小。本申请的各位点检测准确性(包含灵敏度及特异性)及精密度验证,见表9。
[0161]
表9准确性、灵敏度、特异性验证结果
[0162]
snp_id准确性灵敏度特异性批内精密度批间精密度人员对比rs738409100%5ng/μl100%100%100%100%rs58542926100%5ng/μl100%100%100%100%rs780094100%5ng/μl100%100%100%100%rs641738100%5ng/μl100%100%100%100%rs72613567100%5ng/μl100%100%100%100%rs3480100%5ng/μl100%100%100%100%rs7674434100%5ng/μl100%100%100%100%rs12152703100%5ng/μl100%100%100%100%rs5764455100%5ng/μl100%100%100%100%rs6006473100%5ng/μl100%100%100%100%
[0163]
上表中,准确性100%表明所有的阳性样本均被正确的检出,且与sanger测序结果一致;特异性100%表明所检测的样本中,没有出现假阳性的结果;批内精密度100%表明各样本同一批次重复检测的结果均能保持一致;批间精密度100%表明同一操作者多批次检验同一样本的检测结果均能保持一致;人员对比100%表明2位操作者检测同样样本的检测结果均能保持一致。
[0164]
综上所述,本发明提供的非酒精性脂肪性肝病易感基因的核酸质谱早筛方法考虑了中国人与欧美人群非酒精性脂肪性肝病基因谱的差异性,检测的易感基因更前沿,并纳入了多个与非酒精性脂肪性肝病易感snp位点,这些位点检出成功率高、技术重现性好、性价比高。
[0165]
对比例1 pcr扩增引物对和延伸引物的筛选
[0166]
针对各位点,本发明人设计了数对至十余对扩增引物和延伸引物,再对其进行验证优化,最终确立了能够用于massarray核酸质谱技术检测的多重pcr扩增引物和延伸引物组合。
[0167]
本对比例以rs738409位点为例,例举部分效果不理想的扩增引物和延伸引物。
[0168]
对照引物对1:
[0169]
f
‑
1:acgttggatgtccgagggtgtatgttagtt(seq id no.:31)
[0170]
r
‑
1:acgttggatgtctgaaaggcagtgaggc(seq id no.:32)
[0171]
对照引物对2:
[0172]
f
‑
2:acgttggatgctgaagtccgagggtgta(seq id no.:1)
[0173]
r
‑
2:acgttggatgcgggtagcctggaaatag(seq id no.:33)
[0174]
对照引物对3:
[0175]
f
‑
3:acgttggatggaagtccgagggtgtatg(seq id no.:34)
[0176]
r
‑
3:acgttggatgaaggaaggagggataagg(seq id no.:35)
[0177]
对照延伸引物1:
[0178]
y
‑
1:ttggtatgttcctgcttcat(seq id no.:36)
[0179]
对照延伸引物2:
[0180]
y
‑
2:ggtatgttcctgcttcat(seq id no.:37)
[0181]
本发明引物对:seq id no.1和2
[0182]
本发明延伸引物:seq id no.21
[0183]
具体方法同上述实施例,在单重筛选实验中,单重pcr扩增后使用不同延伸引物进行单碱基延伸,再对延伸产物进行质谱检测,单重检测结果发现对照引物对1在单重体系中检测能够正常工作,但是无法在多重体系中获得阳性结果。
[0184]
多重体系中,对照引物对2、3和对照延伸引物1的组合,检测灵敏度分别为50ng/μl、10ng/μl;对照引物对2、3和对照延伸引物2的组合,检测灵敏度分别为10ng/μl、10ng/μl;对照引物对2和3分别和seq id no.21所示的延伸引物组合,检测灵敏度能够达到10ng/μl、10ng/μl。而seq id no.1和2所示引物对和seq id no.21所示延伸引物的组合,检测灵敏度能够达到5ng/μl。
[0185]
结果表明,对照引物对1在多重检测系统中,无法有效扩增靶核酸序列,因此不能在多重检测体系中正常工作;对照引物对2和3可以在多重检测体系中正常工作,但是灵敏度较差。而本发明引物对(seq id no.1和2)和本发明延伸引物(seq id no.21)的组合能够在多重检测体系中正常工作,且灵敏度较高,达到5ng/μl。
[0186]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1