一种检测DNA羟化酶TET1的纳米传感器及其检测方法和应用
本发明属于分析测试技术领域,涉及一种检测dna羟化酶tet1的纳米传感器及其检测方法和应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
dna羟化酶tet1是一种fe(ii)和2-氧戊二酸依赖的双加氧酶,它在哺乳动物中负责dna5-甲基胞嘧啶(5mc)羟甲基化。tet1表达失调与多种遗传性疾病和癌症密切相关。因此,准确灵敏地定量tet1活性具有重要意义。
据发明人研究了解,目前tet1检测方法包括染色质免疫沉淀法、酶联免疫吸附法(elisa)、蛋白免疫印迹法、薄层色谱分析法、电化学传感器等。染色质免疫沉淀法是将一定长度范围内的蛋白质-dna片段随机切成一定长度的染色质片段,并通过免疫沉淀法将与靶蛋白结合的dna片段特异性地浓缩,以研究蛋白质与dna相互作用的关系的方法。酶联免疫吸附测定法是将已知的抗原或抗体吸附在固相载体表面,酶标抗原和抗体反应在固相表面进行的方法。蛋白质印迹分析法是基于抗原和抗体特异性结合的分析方法,可用于检测复杂样品中的特定蛋白。薄层色谱分析法(tlc)根据不同的迁移速率在tlc板上分离tet蛋白介导的甲基胞嘧啶氧化物以分析tet蛋白活性。但是,发明人研究发现,这些方法具有需要大量tet1特异性抗体、高样本输入量、耗时的分离操作、灵敏度低等缺点。
技术实现要素:
为了解决现有技术的不足,本发明的目的是提供一种检测dna羟化酶tet1的纳米传感器及其检测方法和应用,本发明提供的纳米传感器不涉及任何特异性抗体,能够简单、快速灵敏定量检测tet1。
为了实现上述目的,本发明的技术方案为:
一方面,一种检测dna羟化酶tet1的纳米传感器,包括发夹探针、t4噬菌体β-葡萄糖基转移酶、内切酶、量子点;
所述发夹探针为能够形成茎环结构的单链dna,所述发夹探针的一端连接荧光剂,另一端能够与量子点配合连接,形成茎环结构的茎区域含有被内切酶识别并剪切的位点,所述位点含有5-甲基胞嘧啶;
量子点与荧光剂能够配合发生荧光共振能量转移。
另一方面,一种上述纳米传感器在检测dna羟化酶tet1活性中的应用。
第三方面,一种dna羟化酶tet1活性的检测方法,提供上述检测dna羟化酶tet1的纳米传感器;步骤如下:
1)将所述纳米传感器孵育成茎环结构;
2)将形成茎环结构的纳米传感器与含有dna羟化酶tet1的待测溶液混合后进行反应;
3)将步骤2)反应后的反应物与尿苷二磷酸葡萄糖、t4噬菌体β-葡萄糖基转移酶进行反应;
4)将步骤3)反应后的反应物与内切酶进行消化反应;
5)将步骤4)获得的消化产物与量子点进行反应,然后进行荧光检测。
第四方面,一种检测dna羟化酶tet1的试剂盒,包括上述纳米传感器、尿苷二磷酸葡萄糖、缓冲溶液。
第五方面,一种上述纳米传感器或试剂盒在筛选dna羟化酶tet1药物中的应用。
本发明的有益效果为:
本发明的纳米传感器含有发夹探针,发夹探针包含的一个5mc可用于tet1检测。在tet1存在条件下,检测探针发生羟甲基化和糖基化反应,生成对限制性内切酶具有抗性的糖基化检测探针。当量子点与糖基化检测探针结合时,量子点与荧光剂之间能够发生高效的fret,从而导致明显荧光信号。该方法不涉及任何特异性抗体、不需要高样本输入量和耗时的分离过程,能够实现tet1的灵敏检测,其检测限为1.68×10-12m。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
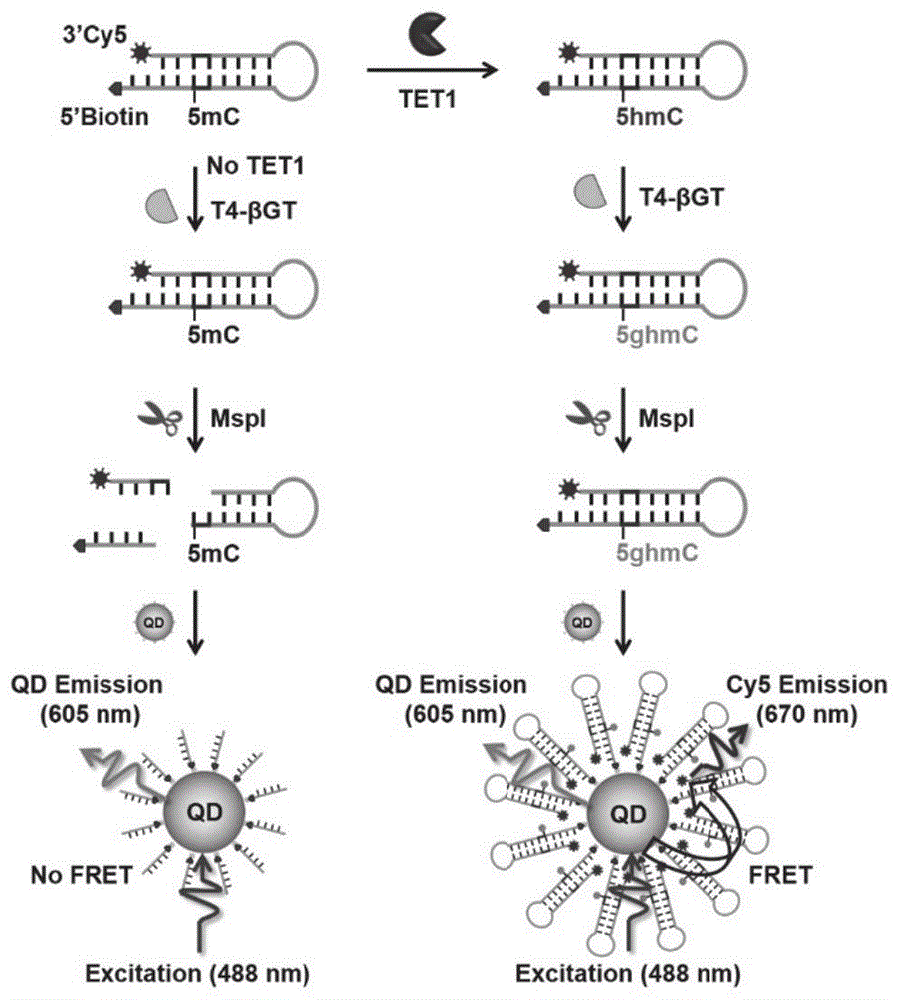
图1为本发明实施例中采用纳米传感器对tet1活性检测的机理图;
图2为本发明实施例中采用纳米传感器对tet1活性检测可行性实验的结果图,(a)聚丙烯酰氨凝胶(page)电泳分析,(b)不存在tet1(对照)和存在tet1的情况下测量的605qd和cy5荧光发射光谱,(c)不存在tet1(对照)和存在tet1的情况下测量605qd的荧光寿命曲线;
图3为本发明实施例中检测tet1的单分子荧光图像,a、b、c为无tet1,d、e、f为存在tet1,标尺为5μm;
图4为本发明实施例中检测tet1的优化实验的结果图,(a)不同用量mspi对应的cy5计数,(b)不同的检测探针与605qd比率对应的fret效率及cy5计数;
图5为本发明实施例中检测tet1的灵敏度和特异性的检测结果图,(a)cy5计数随tet1浓度变化的曲线,插图显示在5.0×10-12到5.0×10-9m范围内cy5计数与tet1浓度的对数呈线性相关,(b)在230nmtet1、23u/mlm.sssi、23u/mldam、230nmsirt1、23u/mlpnk和反应缓冲液(对照)的条件下测定cy5计数。
图6为本发明实施例中不同ni(ii)离子浓度对应的tet1相对活性结果图;
图7为本发明实施例对实际样品检测的结果图,(a)测量sk-n-be(2)和hela细胞提取物得到的cy5计数,(b)cy5计数与sk-n-be(2)细胞数呈线性关系。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
鉴于现有检测tet1的方法存在需要大量tet1特异性抗体、高样本输入量、耗时的分离操作、灵敏度低等缺点,本发明提出了一种检测dna羟化酶tet1的纳米传感器及其检测方法和应用。
本发明的一种典型实施方式,提供了一种检测dna羟化酶tet1的纳米传感器,包括发夹探针、t4噬菌体β-葡萄糖基转移酶、内切酶、量子点;
所述发夹探针为能够形成茎环结构的单链dna,所述发夹探针的一端连接荧光剂,另一端能够与量子点配合连接,形成茎环结构的茎区域含有被内切酶识别并剪切的位点,所述位点含有5-甲基胞嘧啶;
量子点与荧光剂能够配合发生荧光共振能量转移。
在一些实施例中,所述荧光剂为cy5,所述量子点为605qd。
在一些实施例中,发夹探针通过生物素-链霉亲和素与量子点连接。进一步地,发夹探针连接生物素,量子点表面包被链霉亲和素。
在一些实施例中,发夹探针形成茎环结构后,能够连接量子点的一端突出。能够保证发夹探针与量子点连接。
在一些实施例中,所述内切酶为内切酶mspi。
在一些实施例中,发夹探针的序列为:
tttttcactcmcggtcacgttttcgtgaccggagtg,其中,mc为甲基胞嘧啶。
本发明的另一种实施方式,提供了一种上述纳米传感器在检测dna羟化酶tet1活性中的应用。所述应用优选以非疾病的诊断与治疗为目的。
本发明的第三种实施方式,提供了一种dna羟化酶tet1活性的检测方法,提供上述检测dna羟化酶tet1的纳米传感器;步骤如下:
1)将所述纳米传感器孵育成茎环结构;
2)将形成茎环结构的纳米传感器与含有dna羟化酶tet1的待测溶液混合后进行反应;
3)将步骤2)反应后的反应物与尿苷二磷酸葡萄糖、t4噬菌体β-葡萄糖基转移酶进行反应;
4)将步骤3)反应后的反应物与量子点进行反应,然后进行荧光检测。
所述检测方法优选以非疾病的诊断与治疗为目的。
在一些实施例中,步骤1)中孵育的温度为90~100℃,孵育时间为3~7min。
在一些实施例中,步骤2)中反应的温度为35~39℃,反应时间为25~35min。
在一些实施例中,步骤2)中的反应液含有hepes(4-羟乙基哌嗪乙磺酸)、氯化钠、fe(nh4)2(so4)2、抗坏血酸、dtt(二硫苏糖醇)和α-kg(α-酮戊二酸)。hepes、氯化钠、fe(nh4)2(so4)2、抗坏血酸、dtt和α-kg的摩尔比为45~55:45~55:0.070~0.080:1.5~2.5:2.0~3.0:0.5~1.5。
在一些实施例中,步骤3)中反应的温度为35~39℃,反应时间为1.5~2.5h。
在一些实施例中,步骤3)中的反应液含有醋酸钾、tris-ac、醋酸镁、dtt。醋酸钾、tris-ac、醋酸镁、dtt的摩尔比为45~55:15~25:5~15:0.5~1.5。反应液ph为7.0~8.0。
在一些实施例中,步骤4)中反应的温度为35~39℃,反应时间为1.5~2.5h。
在一些实施例中,步骤4)中的反应液含有醋酸钾、tris-ac、醋酸镁、bsa(牛血清白蛋白)。醋酸钾、tris-ac、醋酸镁、bsa的比为5~15:15~25:45~55:50~150,mmol:mmol:mmol:mg。反应液ph为7.0~8.0。
在一些实施例中,步骤5)中反应的温度为室温,反应时间为15~25min。
在一些实施例中,步骤5)中反应液含有tris-hcl、(nh4)2so4、mgcl2。tris-hcl、(nh4)2so4、mgcl2的摩尔比为90~110:5~15:2~4。反应液ph为7.6~8.4。
在一些实施例中,荧光剂为cy5,量子点为605qd,荧光检测的激发波长为487~489nm。
本发明的第四种实施方式,提供了一种检测dna羟化酶tet1的试剂盒,包括上述纳米传感器、尿苷二磷酸葡萄糖、缓冲溶液。
本发明的第五种实施方式,提供了一种上述纳米传感器或试剂盒在筛选dna羟化酶tet1药物中的应用。
具体的,所述dna羟化酶tet1药物为tet1抑制剂。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例
tet1的测定:首先,检测探针与缓冲液a(5mmmgcl2、10mmtris-hcl,ph8.0)在95℃下孵育5min,缓慢冷却至室温。然后,在含有50mmhepes、50mmnacl、75μmfe(nh4)2(so4)2、2mm抗坏血酸、2.5mmdtt和1mmα-kg的反应液中加入144nm检测探针和不同浓度的tet1,37℃反应30min。第三,反应产物与40μm尿苷二磷酸葡萄糖(udp-glucose)和3ut4噬菌体β-葡萄糖基转移酶(t4-βgt)和缓冲液b(50mm醋酸钾、20mmtris-ac、10mm醋酸镁、1mmdtt,ph7.9)组成反应溶液,37℃孵育2h。随后,糖基化产物与30umspi和缓冲液c(10mm醋酸镁、20mmtris-ac、50mm醋酸钾、0.1mg/mlbsa,ph7.9)组成反应溶液,37℃消化2h。最后,将消化后的产物加入0.5nm605qds和60μl缓冲液d(100mmtris-hcl、10mm(nh4)2so4、3mmmgcl2,ph8.0)中,室温孵育20min,得到605qd-dna-cy5纳米结构。
tet1测定的检测探针为5’-biotin-tttttcactcmcggtcacgttttcgtgaccggagtg-cy5-3’,其中,mc为甲基胞嘧啶,序列如seqidno.1所示。
凝胶电泳分析:mspi的消化产物与荧光指示剂(sybrgold)混合加入12%的聚丙烯酰胺凝胶中,凝胶放入三羟甲基氨基甲烷-硼酸(tbe缓冲液:89mmtris-hcl、89mmboricacid、2mmedta,ph8.3)中,在110v恒压室温条件下电泳40min。多通道成像由chemidocmp成像系统完成。sybrgold信号使用epi-blue(460-490nm激发)和518-546nm滤光片进行测量,cy5信号使用epi-red(625-650nm激发)和675-725nm滤光片进行测量。
荧光检测:荧光光谱由荧光分光光度计在488nm的激发波长下进行检测。
单分子检测:将反应产物用缓冲液d(100mmtris-hcl、10mm(nh4)2so4、3mmmgcl2,ph8.0)稀释25倍。取10μl样品加在盖玻片上进行全内反射荧光(tirf)成像。反应产物由488nm激光激发,cy5和605qd发射的光子通过100×油浸透镜采集。使用imagej软件对600×600像素的图像区域内的cy5进行统计。
抑制剂实验:不同浓度的镍(ii)离子与检测探针和230nmtet1在37℃孵育10分钟,随后将铁(ii)离子添加到孵育混合物中,37℃反应30分钟,然后进行上述实验操作过程。
细胞培养和细胞提取:神经母细胞瘤细胞系sk-n-be(2)在45%mem和45%f-12培养基中培养,培养基中加入10%胎牛血清和1%青霉素链霉素。宫颈癌细胞系hela在90%dmem培养基中培养,培养基中加入10%胎牛血清和1%青霉素链霉素。培养皿置于37℃且含有5%二氧化碳的培养箱中培养至细胞成熟。待细胞成熟,使用细胞核提取试剂盒(activemotif)完成细胞提取物的提取,得到的提取物用于随后的检测。
本实施例提供的检测方法检测原理图,如图1所示:首先设计了一种cy5/生物素修饰的发夹检测探针,探针包含的一个5mc可用于tet1检测。在tet1存在下,tet1催化5mc转化为5hmc,生成羟甲基化的检测探针。t4噬菌体β-葡萄糖基转移酶(t4-βgt)可将尿苷二磷酸葡萄糖(udp-glucose)的葡萄糖基转移到5hmc的羟甲基上,形成带有β-葡萄糖基-5-羟甲基胞嘧啶(5ghmc)的葡萄糖基化检测探针。由此得到的糖基化检测探针不能被限制性内切酶mspi切割,因而cy5和生物素分子被同时保留在糖基化检测探针中。随后,糖基化的cy5/生物素修饰的检测探针与链霉亲和素包被的605qd反应,形成一个具有单供体/多受体的605qd-dna-cy5纳米结构。在488nm的激发波长下,605qd与cy5之间发生高效的fret,从而导致明显cy5荧光发射信号。测得单分子检测图像后,可以简单地对cy5进行计数,从而定量tet1活性。在没有tet1存在时,羟甲基化反应不能发生,5mc维持原有状态。检测探针中的5'-c-5mc-g-g-3'/3'-g-g-c-c-5'位点可以被mspi剪切,产生三个片段:cy5标记的dna片段、生物素标记的dna片段、发夹状的dna片段。由于cy5与生物素发生分离,605qd表面无法组装cy5,605qd与cy5之间不会发生fret,因而cy5信号不能被检测到。因此无抗体的单量子点荧光共振能量转移传感器可以用于灵敏的检测tet1。
可行性验证:
如图2a,12%的page电泳分析被用于确定tet1是否诱导检测探针羟甲基化。当发夹检测探针单独存在时,只能观察到35nt的条带(图2a,lane1)。在有mspi但没有tet1的情况下,出现了cy5标记的dna片段的新条带(图2a,lane2,b)和dna片段的新条带(图2a,lane2,c),这表明mspi切割反应的发生。与此相反,tet1和mspi同时存在时,只观察到35nt的糖基化检测探针的条带(图2a,lane3,a)。
为了验证实验可行性,荧光光谱被用于验证该传感器(图2b)。在没有tet1的情况下,由于没有发生fret,无法观察到cy5荧光强度。与此相反,tet1存在时,可以观察到明显的cy5荧光强度。有tet1存在时的605qd的荧光强度明显低于没有tet1时的荧光强度,说明605qd和cy5之间发生了fret。
为了验证实验中605qd与cy5之间的高fret效率,605qd的荧光寿命曲线被研究。如图2c,可以观察到在tet1存在时荧光寿命较短。
为了进一步验证实验可行性,在单分子成像系统下检测tet1(图3)。在没有tet1的情况下,只有605qd信号存在(a)。在tet1存在下,605qd(d)和cy5(e)信号被同时检测到,且cy5信号与605qd信号发生明显的共定位(f)。tet1存在条件下的605qd信号(d)与tet1不存在条件下的605qd信号(a)相比明显减弱。这些结果表明通过cy5计数可以用于tet1检测。
优化实验条件:
为了得到最佳的实验结果,限制性内切酶mspi用量和检测探针与605qd的比率被逐一优化。如图4a,cy5的计数随着mspi用量从5到30u的增加而减少,在超过30u时达到平台期,因此30u被选择为mspi的最佳用量。如图4b,随着检测探针与605qd的比率从12增加到48,fret效率逐渐提高,在超过48时达到平台;该比率在12~48范围内与cy5计数呈线性关系,超过48时cy5计数达到平台。因此48被选择为检测探针与605qd的最优比率。
检测的灵敏度:
为了验证该方法的高灵敏度,研究了在最佳条件下不同浓度tet1对cy5计数的影响。如图5a所示,随着tet1浓度从0增加到2.3×10-7m,cy5的数量相应增加。在5.0×10-12到5.0×10-9m范围内,cy5计数与tet1浓度的对数呈现线性相关(图5a的插图)。线性回归方程为n=5082.18+429.94log10c(r2=0.994),其中c为tet1浓度(m),n为cy5计数。根据对照的均值和3倍标准差计算出检出限为1.68×10-12m(1.34×10-7μg/μl)。该检测限比电化学传感法高约3个数量级(9.8×10-4μg/μl)。
检测的特异性:
利用m.sssicpg甲基转移酶(m.sssi)、dam甲基转移酶(dam)、sirtuin1去乙酰化酶(sirt1)和t4多聚核苷酸激酶(pnk)4种非特异性蛋白对传感器的特异性进行验证。如图5b,这4种非特异性蛋白均不能观察到cy5信号。与之相反,tet1产生了高的cy5信号。这一结果表明该传感器对tet1具有较高的特异性。
抑制剂分析:
用镍(ni(ii))离子作为tet1模型抑制剂来验证抑制试验的可行性。如图6,随着ni(ii)离子浓度的增加,tet1相对活性逐渐降低。通过相对活性与抑制剂浓度的关系曲线计算ic50值为3.30μm。该ic50值与uhplc-ms/ms分析结果相当(1.2μm),这表明该方法可用于tet1抑制剂的筛选。
实际样品分析:
为了验证该方法在实际样品方面的应用,sk-n-be(2)和hela细胞提取物被用于检测。图7a,sk-n-be(2)细胞样品得到cy5信号远高于hela细胞样品。如图7b,随着sk-n-be(2)细胞数量的增加,cy5数量增加。在1-7200细胞范围内,cy5数量与细胞数的对数呈线性相关。回归方程为n=81.93+210.56log10x(r2=0.998),其中n是cy5的计数,n是sk-n-be(2)细胞数,检测限为1个细胞。这些结果表明该方法可以用于检测细胞中的tet1酶。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>山东师范大学
<120>一种检测dna羟化酶tet1的纳米传感器及其检测方法和应用
<130>
<160>1
<170>patentinversion3.3
<210>1
<211>35
<212>dna
<213>人工序列
<400>1
tttttcactccggtcacgttttcgtgaccggagtg35
- 还没有人留言评论。精彩留言会获得点赞!