一种定量检测前列腺癌生物标志物miRNA-141的组件、系统及其应用
本申请涉及生物检测技术领域,具体涉及一种定量检测前列腺癌生物标志物mirna-141的组件、系统及其应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本申请的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
mirna是小的非蛋白质编码单链rna片段,具有19-23个核苷酸,并且mirna能够以蛋白质-rna复合物的形式从细胞释放到血液循环中。mirna参与了许多基本的细胞过程,包括细胞的发育、凋亡和代谢等,具有重要研究意义。此外,各种分子生物学实验证明了几种mirna在癌症的发生和发展中的重要作用,使其成为癌症的重要分子。mirna作为一种早期癌症诊断中重要的敏感指标及依据,对癌症标志物mirna进行灵敏分析方法的开发不仅具有基础科学意义,而且可以大大有益于临床诊断解决方案在实际应用中。
迄今为止,有多种方法可证明mirna检测可以满足对临床诊断分析不断增长的需求,例如荧光检测法、比色法、电化学发光法、基于表面等离振子共振的传感器、表面增强拉曼散射(sers)等。通过这些方法虽然可以达到检测mirna的目的,但是其过程十分复杂繁琐,且需要经过培训的专业人员进行检测。同时,由于mirna的含量低且血液中的背景非常复杂,因此开发一种直接在人类血液样品中定量检测mirna的方法仍然是一个挑战性问题。
技术实现要素:
为了改善现有技术的不足,本发明提供了一种定量检测前列腺癌生物标志物mirna-141的组件、系统及其应用和检测方法。本发明的多重信号放大纸喷雾质谱方案基于微量血样,即可达到高灵敏度、特异性和可重复性,为通过质谱实现对复杂体液的检测提供了良好的平台。
具体地,本发明提供了下述的技术特征,以下技术特征的一个或多个的结合构成本发明的技术方案。
在本发明的第一方面,本发明提供了一种定量检测前列腺癌生物标志物mirna-141的组件,其包括:pcs-aunps纳米探针、经巯基化修饰的纸基底,可移动检测纸基和直流电源;其中,pcs-aunps纳米探针可与前列腺癌标志物mirna-141反应,其经au-s键固定在经巯基化修饰的纸基底上;可移动检测纸基位于所述纸基底的下层,经移动可与经巯基化修饰的纸基底接触;直流电源为可移动检测纸基供电。
在本发明的实施方式中,所述pcs-aunps纳米探针由金纳米颗粒与三元dna双链体探针经au-s键连接获得;其中,三元dna双链体探针由dna链sh-l与信号链pcs-srna反应形成。
其中,sh-l为经硫醇化的,序列在5’端修饰有sh(ch2)6-基团,具体序列信息如下所示:
sh(ch2)6-5’-tttttttttttttttttccaccccatctttaccagaccaccccatctttaccagacagtgtta-3’(seqidno.1)。
其中,pcs-srna信号链为经氨基基团修饰的,序列在5’和3’端修饰有nh2(ch2)6-基团,具体序列信息如下所示:
nh2(ch2)6-5’-/ipclink/tctggtaaagatggggtgg/ipclink/-3’-(ch2)6nh2(seqidno.2)。
金纳米颗粒可按照本领域的已知方法进行制备,三元dna双链体探针的制备方法包括:将dna链sh-l、信号链pcs-srna在tris-hcl缓冲液中混合加热反应,然后将其冷却至室温即形成三元dna双链体探针。
在本发明的实施方式中,金纳米颗粒、三元dna双链体探针、硫醇还原剂(比如tcep)混合,在该过程中,金纳米颗粒与sh-l链形成au-s键,实现了金纳米颗粒与三元dna双链体探针的连接,合成pcs-aunps纳米探针。
在本发明的实施方式中,所述直流电源可以为外接电源或内置电源,其通过导电器件与可移动检测纸基接触实现供电。所述导电器件比如导电夹、导电线等等,其能够实现电源与可移动检测纸基的接触或连接。所述导电夹比如可以为铜夹、铝夹、铁夹等可导电金属材质的夹子中的任意一种,所述导电线可采用采用耐高压的硅胶线、聚氯乙烯绝缘电线中的一种。
在本发明的一些实施方式中,所述直流电源可提供3-6kv的电压,0-30μa的电流。
在本发明的实施方式中,所述可移动检测纸基设有尖端,可作为输入部件将喷雾输入质谱内进行分析。
在本发明的实施方式中,在高压直流电的作用下,可以促使驱动溶剂(喷雾溶剂),比如甲醇:水=3:1(v/v)溶解复杂生物样品中的分析物,使其发生迁移、电离,最终在可移动检测纸基的尖端发生电喷雾,使分析物完成离子化,从而进入质谱进行分析。
在本发明的第二方面,本发明提供给了一种定量检测前列腺癌生物标志物mirna-141的系统,其包括上述第一方面中所述的组件、紫外装置和质谱仪。
在本发明的第三方面,本发明提供了上述第一方面中所述的组件或者上述第二方面中所述的系统在生物定量检测领域中的应用,尤其为在mirna定量检测领域中的应用,更尤其为在定量检测前列腺癌标志物mirna-141中的应用。
在本发明的一些实施方式中,存在mirna-141时,pcs-aunps探针可使连接的dna链(sh-l)发生链置换循环反应,置换出大量的信号链pcs-srna,移动可移动检测纸基使其与上层纸基底接触,可将信号链pcs-srna转移至可移动检测纸基,向其照射紫外光,可切断pcs-srna链两个末端小分子,释放出质谱pc信号分子,其结构为
在本发明的第四方面,本发明提供了一种定量检测前列腺癌标志物mirna-141的方法,其采用上述第一方面中所述的组件,所述方法包括:将待检测样品滴加至固定有pcs-aunps纳米探针的纸基底上,保持该纸基底湿润,孵育;然后继续在该纸基底上滴加f链,其序列为:5’-3’方向tctggtaaagatggggtggtctggtaaagatggggtgg(seqidno.4),保持该纸基底湿润,孵育;移动可移动检测纸基使其与上层纸基底接触,实现上层纸基底对可移动检测纸基的浸润;进行紫外照射,然后在滴加内标并施加喷雾溶剂后通电进行纸喷雾质谱检测。
存在mirna-141时,pcs-aunps探针可使连接的dna链(sh-l)发生链置换循环反应,置换出大量的信号链pcs-srna,加入f链后,pcs-srna与mirna-141被置换下来,mirna-141用于循环链置换反应,移动可移动检测纸基使其与上层纸基底接触,可将信号链pcs-srna转移至可移动检测纸基(可减少杂质)。
在本发明的实施方式中,紫外照射可以触发信号分子的释放(可切断pcs-srna链,释放出质谱pc信号分子),改善质谱信号的灵敏度。具体地,可移动纸基经过紫外照射后,向其滴加内标和喷雾溶剂,可以实现pc信号分子与内标分子的解离,pc信号分子、内标分子被溶剂提取、传递,当溶剂到达纸基底尖端时,在高压直流电场驱动的作用下发生电喷雾,离子化后,进入质谱进行分析,被检测装置捕获后定量检测pc信号分子与内标分子的信号比,从而实现对前列腺癌标志物mirna-141的定量检测。
在本发明的实施方式中,所述待检测样品可以为细胞提取物、血清和全血。本发明的方法灵敏度高,以细胞提取物、血清和全血作为样品均可实现检测。在本发明的一些实施方式中,本发明分别以细胞裂解液的提取液(可采用试剂盒提取rna)、稀释35倍的血清裂解液的提取液(可采用试剂盒提取rna)、稀释35倍的血清以及稀释35倍后的全血作为待检测样品采用本发明的方法进行定量检测,结果发现对359.13(pc信号分子的[m+h]+峰)在进行质谱分析时,均具有明显的峰值。以及,在本发明的一些实施方式中,本发明分别以不同数目的宫颈癌癌细胞和前列腺癌细胞制作检测样本,细胞数目分别为103、104和105个,结果发现本发明的方法均能实现灵敏的定量检测,并且对于前列腺癌标志物mirna-141具有更明显的特异性选择。
在本发明的实施方式中,保持纸基底湿润可施加ph=7.4的醋酸铵缓冲溶液。在本发明的实施方式中,两次孵育时间相同,两次孵育时间可在60-75min范围内,总时长为120-150min,其中以总时长120min为较优,孵育温度接近生理环境,以37±0.2℃为宜。
在本发明的实施方式中,紫外照射波长为320-375nm,紫外照射时间为8-15min以10min为较优,该条件可保证pc信号分子完全断裂下来。
在本发明的实施方式中,所述内标溶液为甘油磷酰胆碱;所述喷雾溶剂为甲醇和水的混合溶液,甲醇和水的体积比为4:1-3:1,优选为3:1,该喷雾溶液能够更好的将pc信号分子洗脱至可移动检测纸基,且获得更好的质谱信号值。
通过上述技术手段,可实现以下有益效果:
(1)本发明基于纸基底的特点以及质谱精确快速高通量的优势,建立了一种高效的集反应和检测于一体的前列腺癌标志物mirna-141的组件及含有该组件的检测系统,在序列合适的前提下,可应用于检测不同的mirna。
(2)本发明使用金纳米颗粒与设计合适的三元dna链连接的纳米探针,可实现对前列腺癌标志物mirna-141特异性链置换反应,具有操作简单、分析结果可靠的优势。同时,利用dna链置换反应用于扩增信号并确保检测特异性,利用紫外激光照射触发信号分子的释放,以改善质谱信号的灵敏度,同时采用纸喷雾来过滤掉血液中的干扰信号。
(3)本发明将链置换驱动反应集成归置经巯基化修饰的纸基底上,该纸基底面积小,便于携带和运输、价格低且可循环使用并能保存一定时间,同时使用合适溶液将经修饰的纸基底转移到下层可移动检测装置,减少经巯基化修饰的纸基底过多杂质峰的出现,以方便检测。
(4)本发明使用合适溶液将经修饰的纸基底转移到下层可移动检测装置,将下层可移动检测装置经过紫外光照射后,获得pc信号分子,避免直接检测mirna的繁琐,可间接对前列腺癌标志物mirna-141进行定量。
(5)本发明只需微量血样,即可达到对mirna的高灵敏度、高特异性和可重复性的定量检测,为通过质谱实现对复杂体液的检测提供了良好的平台。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。以下,结合附图来详细说明本申请的实施方案,其中:
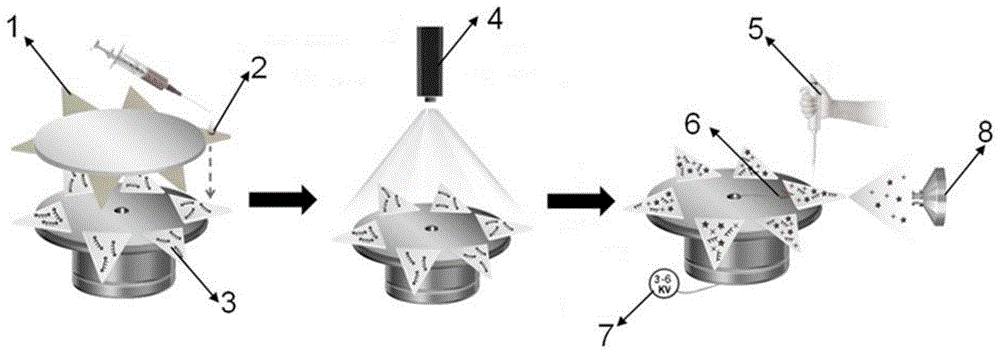
图1为本发明定量检测前列腺癌标志物mirna-141的基本示意图,1为上层纸基底,2为实验过程中所滴加的样品,3为下层可移动纸基,4为紫外激光器,5为微量注射器(体积为20μl,可滴加内标与喷雾溶剂),6为铜夹(通过导电线连接电源),7为内接或外接直流电源,8为质谱分析器。
图2为page胶验证链置换序列(pcs为pcs-srna,mir为mirna-141),其中,图2a中混合溶液条带位置明显偏上,验证三元dna链已连接成功;图2b在加入mirna-141的泳道中在对应pcs-srna处有对应条带,证明加入mirna-141后,可置换出pcs-srna;图2c在加入f链的泳道中,在mirna-141及pcs-srna条带处有对应条带,证明在加入f链后,可置换出mirna-141及pcs-srna。
图3为实施例2中经紫外光照射10min后,pcs-srna断裂释放pc信号分子的反应式。
图4为定量标准曲线,黑色虚线为血清基质中,灰色实线为ph=7.4的醋酸铵缓冲溶液中。
图5为不同数目癌细胞检测的质谱分析数据,其中,ii:癌细胞数目为103个;iii:癌细胞数目为104个,iv:癌细胞数目为105个。
图6为三种检测前列腺癌病人血样方法得到的质谱分析数据;其中,i、ii、iii为健康人血样,iv为前列腺癌中期病人血样,v为前列腺癌晚期病人血样。
图7为实施例4中生物样品检测的质谱图,内标浓度及用量均相同(1mm,3μl);a:检测样品为使用试剂盒提取105个宫颈癌细胞得到的提取溶液;b:检测样品为使用试剂盒提取105个前列腺癌细胞得到的提取溶液;c:检测样品为使用试剂盒提取前列腺癌晚期病人血清得到的提取溶液;d:检测样品为前列腺癌晚期病人经35倍稀释后的血清;其中,359.13峰为pc信号分子的[m+h]+峰,258.22峰为内标分子甘油磷酰胆碱的[m+h]+峰。
具体实施方式
下面结合具体实施例,进一步阐述本申请。应理解,这些实施例仅用于说明本申请而不用于限制本申请的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本申请所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本申请所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本申请方法中。文中所述的较佳实施方法与材料仅作示范之用。
文中术语“和/或”,仅仅是一种描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,单独存在b,同时存在a和b三种情况,本文中术语“/和”是描述另一种关联对象关系,表示可以存在两种关系,例如,a/和b,可以表示:单独存在a,单独存在a和b两种情况,另外,本文中字符“/”,一般表示前后关联对象是一种“或”的关系。
本文使用的术语仅用于描述特定实施例,并且不意在限制本申请的示例实施例。如本文所使用的,单数形式“一”、“一个”以及“该”意在包括复数形式,除非上下文明确指示相反意思。还应当理解术语“包括”、“包括了”、”包含”、和/或“包含了”当在本文中使用时,指定所声明的特征、整数、步骤、操作、单元和/或组件的存在性,并且不排除一个或多个其他特征、数量、步骤、操作、单元、组件和/或他们的组合的存在或增加。
应当理解,尽管在本申请可能采用术语第一、第二、第三等来描述各种信息,但这些信息不应限于这些术语。这些术语仅用来将同一类型的信息彼此区分开。例如,在不脱离本申请范围的情况下,第一信息也可以被称为第二信息,类似地,第二信息也可以被称为第一信息。取决于语境,如在此所使用的词语“如果”可以被解释成为“在……时”或“当……时”或“响应于确定”。
此外,特定特征、结构、功能或特性可以以任何适合的方式组合到一个或多个实施例中。例如,第一实施例(也可称为实施例1)可以结合第二实施例(也可称为实施例2),只要与这两个实施例相关联的特定特征、结构、功能或特性不互相排斥。
定量检测前列腺癌标志物mirna-141如图1所示,定量检测前列腺癌标志物mirna-141的系统包括:pcs-aunps纳米探针、经巯基化修饰的纸基底,可移动检测纸基和直流电源、紫外装置和质谱仪。其中,pcs-aunps纳米探针、经巯基化修饰的纸基底,可移动检测纸基和直流电源构成定量检测前列腺癌标志物mirna-141的组件。
pcs-aunps纳米探针可与前列腺癌标志物mirna-141反应,其经au-s键固定在经巯基化修饰的纸基底上;可移动检测纸基位于所述纸基底的下层,经移动可与经巯基化修饰的纸基底接触;直流电源为可移动检测纸基供电。
所述直流电源可以为外接电源或内置电源,其通过导电器件与可移动检测纸基接触实现供电。所述导电器件比如导电夹、导电线等等,其能够实现电源与可移动检测纸基的接触或连接。所述导电夹比如可以为铜夹、铝夹、铁夹等可导电金属材质的夹子中的任意一种,所述导电线可采用采用耐高压的硅胶线、聚氯乙烯绝缘电线中的一种。
所述直流电源可提供3-6kv的电压,0-30μa的电流。
所述可移动检测纸基设有尖端,可作为输入部件将喷雾输入质谱内进行分析。
上述定量检测前列腺癌标志物mirna-141的组件和/或含有该组件的系统用于下述检测实例中。
表1示出了本发明所用dna及rna的基本信息。
表1
实施例1
纸基底的制备方法,包括如下步骤:
通过turkevich方法合成金纳米颗粒。柠檬酸三钠还原haucl4·3h2o来合成柠檬酸盐的金纳米颗粒。具体合成步骤为,将94ml的haucl4水溶液(2mm)加热至110℃,搅拌直至剧烈沸腾,然后立即添加19ml柠檬酸三钠溶液(38.8mm)。将混合物保持沸腾一定时间,直到溶液的颜色逐渐从黄色变为酒红色。当悬浮液冷却至室温时,该反应终止。合成的金纳米颗粒的浓度经计算为6×10-8m,并保存在4℃以便进一步使用。
合成含有金纳米颗粒与dna链的pcs-srna探针,其中金纳米颗粒能够与巯基修饰的dna链sh-l形成au-s键,因此实现金纳米颗粒与三元dna链进行连接。
三(2-羧乙基)膦(tcep)溶解在1mltris-hcl缓冲液缓冲中,其浓度为2.5mm。混合溶液所需dna链(sh-l)与rna链(pcs-srna)的浓度及体积如下表2所示。混合溶液在5ml样品瓶中进行配置,搅拌过程中采用样品瓶包裹锡箔纸的方法进行避光。
表2
将20μltcep溶液加入进上述的混合溶液中,室温下搅拌3h,之后加入2ml6×10-8m的金纳米颗粒溶液,5min后加入60μl柠檬酸三钠溶液(ph=3.0,500mm),随后混合溶液持续搅拌30min可合成pcs-aunps纳米探针。
使用时在4℃、14000rpm条件下离心5min,弃去上清液,使用ph=7.4的醋酸铵溶液进行清洗后进行下一步实验。若立即进行下一步实验,则将合成的pcs-aunps纳米探针保存在4℃条件下。
实施例2
验证链置换反应具体步骤如下(实验结果如图2所示):
(1)配置将硫醇化的dna链(sh-l)、信号链(pcs-srna),将sh-l(3.0μm)和pcs-srna(6.2μm)在20mmtris-hcl缓冲液(100mmna+,ph=7.4)中的混合物加热至90℃5min,然后将其冷却至室温2小时以形成三元dna双链体探针。以marker为基准,sh-l、pcs-srna、三元dna进行page胶验证。此步骤验证三元dna双链结合成功。
(2)将剩余三元dna溶液一分为二,一份溶液加入mirna-141(50pm),另一份溶液加入等体积的水,两种混合溶液加热至90℃5min,然后将其冷却至室温2小时。以marker为基准,sh-l、pcs-srna、mirna-141、此步骤中加入水的混合溶液以及加入mirna-141的混合溶液进行跑胶验证。此步骤验证加入mirna-141后,pcs-srna被置换下来。
(3)将上一步剩余加入mirna-141的混合溶液一分为二,一份溶液加入f链(3.0μm),另一份溶液加入等体积的水,两种混合溶液加热至90℃5min,然后将其冷却至室温2小时。以marker为基准,sh-l、pcs-srna、mirna-141、f链、此步骤中加入水的混合溶液以及加入f链1的混合溶液进行跑胶验证。此步骤验证加入f链后,pcs-srna与mirna-141被置换下来,mirna-141用于循环链置换反应。
该定量检测前列腺癌生物标志物mirna141的纸喷雾质谱方法(如图1):在经巯基修饰的纸基底上滴加pcs-aunps纳米探针后,滴加前列腺癌标志物mirna-141,然后使用ph=7.4的醋酸铵缓冲溶液保证修饰的纸基底湿润,之后滴加相对应当量的f链,孵育时间与滴加mirna-141后孵育的时间相同,同样使用ph=7.4的醋酸铵缓冲溶液保证修饰纸基底的湿润,在孵育期间,保证反应温度为37℃。合成的纳米探针pcs-aunps可与后面加入的rna链在巯基化修饰的纸基底上完成链置换反应。之后采用上层纸浸润到下层纸的方式减少杂质。再经过355nm的紫外激光器照射10min后(紫外照射后释放出pc信号分子,如图3所示),通过滴加内标溶液(甘油磷酰胆碱,1mm),之后使用甲醇:水=3:1(v/v)的喷雾溶剂进行纸喷雾检测,利用铜夹给经探针修饰的纸基底加上高压直流电,实现上述信号分子的纸喷雾质谱检测。在检测过程中通过使用thermoscientificlcq-f1eettm离子阱质谱仪本身的选定反应监测(srm)模式,对pc信号分子及内标进行检测,并计算信号比值以进行对前列腺癌标志物mirna-141的定量检测。
实施例3
在37℃条件下,在经巯基修饰的纸基底上滴加pcs-aunps纳米探针后滴加不同浓度的mirna-141(18μl)孵育60min后,滴加f链(1μm,18μl)孵育相同时间,期间用不同的基质溶液(此处分别为血清基质溶液及ph=7.4的醋酸铵缓冲溶液)保持纸基底的湿润,后浸润到下层纸基,进行纸喷雾质谱检测。以lgc为横坐标,信号分子与内标的质谱峰强度比为纵坐标绘制标准曲线,具体浓度为50fm,500fm,1pm,5pm,10pm,50pm,结果如图4所示,可见本发明的方法在进行定量分析时具有良好的线性关系。
实施例4
一种定量检测前列腺癌生物标志物mirna-141的方法,采用实施例1和2的定量检测mirna-141的巯基化修饰的纸基底、探针及实施例2中涉及的其他组件执行,包括以下步骤:
将待检测样品(18μl)滴加至固定有pcs-aunps纳米探针的纸基底上,然后使用ph=7.4的醋酸铵缓冲溶液保证修饰的纸基底湿润,孵育60min,之后滴加f链(1μm,18μl),使用ph=7.4的醋酸铵缓冲溶液保证修饰纸基底的湿润,孵育相同时间,孵育期间保持反应温度为37℃;移动可移动检测纸基使其与上层纸基底接触,实现上层纸基底对可移动检测纸基的浸润;经355nm紫外激光器照射10分钟,滴加内标溶液(甘油磷酰胆碱,1mm),之后使用甲醇:水=3:1(v/v)的喷雾溶剂进行纸喷雾检测,利用铜夹给经探针修饰的纸基底加上高压直流电,实现对pc信号分子和内标的纸喷雾质谱检测。在检测过程中通过使用thermoscientificlcq-f1eettm离子阱质谱仪本身的选定反应监测(srm)模式,对pc信号分子及内标进行检测,并计算信号比值以进行对前列腺癌标志物mirna-141的定量检测。
待检测样品分别采用以下方式制备:
1、在细胞培养箱内分别培养宫颈癌细胞(hela细胞)及前列腺癌细胞(22rv1细胞),收集后使用细胞计数器分别对两种细胞进行计数,两种细胞均获得细胞数量分别为103、104和105的三组细胞。按照trizol试剂盒说明书中提供的步骤进行提取rna,使用dnase水溶解后,使用nanodrop进行检测。分别将上述提取后的溶液作为待检测样品进行检测。并以相同条件与步骤下不添加待检测样品作为空白实验(blank),检测结果如图5所示。结果表明本发明的方法具有高灵敏度和对前列腺癌标志物mirna-141的特异性。
2、分别取健康人、前列腺癌中期病人和前列腺癌晚期病人的全血制备待检测样品,其中,健康人全血设置3组,前列腺癌中期病人设置1组,前列腺癌晚期病人设置1组,每组中的全血分别进行以下三种处理获得待检测样品,所述三种处理方式如下:
(1)将全血在4℃下以1600×g离心10min收集血清,若后续使用,则在-80℃条件下储存。血清均分为100μl/管。在本实验中,将分装好后的血清稀释35倍后,按照trizol试剂盒说明书中提供的步骤进行提取rna,使用dnase水溶解后,使用nanodrop进行检测。将该提取后的溶液作为待检测样品进行检测。
(2)将全血在4℃下以1600×g离心10min收集血清,若后续使用,则在-80℃条件下储存。血清均分为100μl/管。在本步骤中,将分装好后的血清稀释35倍后,将该稀释后的血清作为待检测样品进行检测。
(3)将全血均分为100μl/管。将分装好后的全血稀释35倍后,将该稀释后的全血作为待检测样品进行检测。
结果如图6所示,实验结果表明健康人血样信号比值接近于0,中期前列腺癌病人及晚期前期前列腺病人信号值虽有不同,但趋势相同,证明此发明对检测前列腺癌标志物mirna-141具有良好的检测特性。
结论:对上述待检测样品分别进行检测,在359.13(pc信号分子的[m+h]+峰)位置均具有明显的峰值,如图7所示,显示了良好的检测信号,说明使用以上样品均能够实现良好的检测,体现了本发明设计的装置在检测具体生物样品时具有良好的减少杂质的相关特性,且对前列腺癌标志物mirna-141具有明显的特异性选择。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,尽管参照前述实施例对本申请进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
sequencelisting
<110>山东师范大学
<120>一种定量检测前列腺癌生物标志物mirna-141的组件、系统及其应用
<130>202121212
<160>4
<170>patentinversion3.5
<210>1
<211>63
<212>dna
<213>人工序列
<400>1
tttttttttttttttttccaccccatctttaccagaccaccccatctttaccagacagtg60
tta63
<210>2
<211>19
<212>rna
<213>人工序列
<400>2
tctggtaaagatggggtgg19
<210>3
<211>22
<212>rna
<213>人工序列
<400>3
taacactgtctggtaaagatgg22
<210>4
<211>38
<212>dna
<213>人工序列
<400>4
tctggtaaagatggggtggtctggtaaagatggggtgg38
- 还没有人留言评论。精彩留言会获得点赞!