枇杷三萜酸合成关键酶基因EjCYP716A1/2和EjCYP716C1/2及应用
枇杷三萜酸合成关键酶基因ejcyp716a1/2和ejcyp716c1/2及应用
技术领域
1.本发明涉及生物技术领域,更具体地,涉及枇杷三萜酸合成关键酶基因ejcyp716a1/2和ejcyp716c1/2及应用。
背景技术:
2.枇杷是重要的药食两用的常绿果树,除果实鲜美备受消费者喜爱外,干叶是部分重要天然产物的主要供体之一,不但在传统中药中被广泛利用,在现代生物医药开发中也同样颇受关注。三萜酸是枇杷叶中含量最为丰富的一类天然活性化合物,随着检测技术的不断发展,近二十年来科研人员已从枇杷叶中鉴定到了几十种三萜酸组分。生物活性评价及药理研究表明,熊果酸、科罗索酸等主要三萜酸在癌细胞抑制、杀菌消炎、降血糖等疾病治疗中发挥重要活性,在医药、食品等领域得到广泛重视与利用。对枇杷而言,其常用药源叶片采自果品生产树,各种组分的生产需要通过繁琐的工艺流程从大量叶片中分离单独三萜酸组分。传统制备工艺的使用影响枇杷鲜果生产,同时提取环节消耗大量人力物力,且容易带来工业污染。利用工程菌或植物等生物底盘表达代谢产物合成相关基因,既可以减少叶片采摘对果品生产的影响,又可以批量定向生产靶标组分,是一种环境友好型化合物合成途径。
3.鉴定三萜酸生物合成结构基因并建立表达系统是保障生物合成及定向生产靶标组分的关键。虽然已有研究人员报道了几个枇杷三萜酸合成相关基因的片段,但这些研究都未在空白对照下鉴定相关合成基因的功能。专利cn110938640a公开了一个合成α-香树精的氧化鲨烯环化酶基因ejaas1,但未鉴定其他具有相似功能的同源基因;对于叶片中高含量的熊果酸和科罗索酸以及齐墩果酸和山楂酸等三萜酸的合成酶基因也还没有鉴定和挖掘。
技术实现要素:
4.本发明的目的是为了克服现有技术的不足,提供枇杷三萜酸合成关键酶基因ejcyp716a1/2和ejcyp716c1/2及应用。
5.本发明的第一个目的是提供核苷酸序列如seq id no.1~2所示的任一基因,和/或氨基酸序列如seq id no.3~4所示的任一蛋白,在促进枇杷生成三萜酸中的应用。
6.本发明的第二个目的是提供核苷酸序列如seq id no.1~2所示的任一基因,和/或氨基酸序列如seq id no.3~4所示的任一蛋白,在促进α-香树精生成熊果酸、α-香树精生成科罗索酸、β-香树精生成齐墩果酸、和/或β-香树精生成山楂酸方面的应用。
7.本发明的第三个目的是提供一种提高乌苏烷型和/或齐墩果烷型三萜酸产量的方法。
8.本发明的第四个目的是提供核苷酸序列如seq id no.5~6所示的任一基因,和/或氨基酸序列如seq id no.7~8所示的任一蛋白,在促进枇杷生成乌苏烷型和/或齐墩果
烷型三萜酸中的应用。
9.本发明的第五个目的是提供核苷酸序列如seq id no.5~6所示的任一基因或氨基酸序列如seq id no.7~8所示的任一蛋白,在促进熊果酸生成科罗索酸,和/或促进齐墩果酸生成山楂酸中的应用。
10.本发明的第六个目的是提供一种提高科罗索酸和/或山楂酸产量的方法。
11.为了实现上述目的,本发明是通过以下技术方案予以实现的:
12.本发明从
‘
解放钟’枇杷中克隆到一个枇杷氧化鲨烯环化酶基因ejosc2,其核苷酸序列如seq id no.9所示,包含2283bp的开放阅读框,编码760个氨基酸,其编码的氨基酸序列如seq id no.10所示,在烟草叶片瞬时表达该基因可催化合成α-香树精和β-香树精。
13.同时克隆到2个枇杷α/β-香树精c-28位氧化酶基因ejcyp716a1和ejcyp716a2,其核苷酸序列分别如seq id no.1和seq id no.2所示,都包含1455bp的开放阅读框,编码484个氨基酸,其编码的氨基酸序列分别如seq id no.3和seq id no.4所示,这两个基因在烟草叶片中与基因ejosc2瞬时共表达,都可催化形成熊果酸和齐墩果酸。
14.本发明还克隆到2个枇杷熊果酸/齐墩果酸c-2位羟化酶基因ejcyp716c1和ejcyp716c2,其核苷酸序列分别如seq id no.5和seq id no.6所示,它们都包含1443bp的开放阅读框,编码480个氨基酸,其编码的氨基酸序列分别如seq id no.7和seq id no.8所示,两个基因在烟草叶片中与基因ejosc2-ejcyp716a1和/或ejosc2-ejcyp716a2瞬时共表达,都可催化形成科罗索酸和山楂酸。
15.因此本发明要求保护以下内容:
16.核苷酸序列如seq id no.1~2所示的任一基因,和/或氨基酸序列如seq id no.3~4所示的任一蛋白,在促进枇杷生成三萜酸中的应用。
17.所述三萜酸为乌苏烷型和/或齐墩果烷型三萜酸。
18.所述乌苏烷型三萜酸为熊果酸和/或科罗索酸,所述齐墩果烷型三萜酸为齐墩果酸和/或山楂酸。
19.核苷酸序列如seq id no.1~2所示的任一基因,和/或氨基酸序列如seq id no.3~4所示的任一蛋白,在促进α-香树精生成熊果酸、α-香树精生成科罗索酸、β-香树精生成齐墩果酸、和/或β-香树精生成山楂酸方面的应用。
20.一种提高乌苏烷型和/或齐墩果烷型三萜酸产量的方法,过表达核苷酸序列如seq id no.1~2所示的一种或两种基因,和/或提高氨基酸序列如seq id no.3~4所示的一种或两种蛋白的表达量。
21.所述乌苏烷型三萜酸为熊果酸和/或科罗索酸,所述齐墩果烷型三萜酸为齐墩果酸和/或山楂酸。
22.优选地,所述方法包括:制备含有核苷酸序列如seq id no.1和/或seq id no.2所示的基因的重组工程菌,导入到能产生α-香树精和/或β-香树精的生物体中,得到重组生物体;培养所述重组生物体,过表达氨基酸序列如seq id no.3和/或seq id no.4所示的蛋白。
23.核苷酸序列如seq id no.5~6所示的任一基因,和/或氨基酸序列如seq id no.7~8所示的任一蛋白,在促进枇杷生成乌苏烷型和/或齐墩果烷型三萜酸中的应用。
24.优选地,所述乌苏烷型三萜酸为科罗索酸,所述齐墩果烷型三萜酸为山楂酸。
25.核苷酸序列如seq id no.5~6所示的任一基因或氨基酸序列如seq id no.7~8所示的任一蛋白,在促进熊果酸生成科罗索酸,和/或促进齐墩果酸生成山楂酸中的应用。
26.一种提高科罗索酸和/或山楂酸产量的方法,过表达核苷酸序列如seq id no.5~6所示的一种或两种基因,和/或提高氨基酸序列如seq id no.7~8所示的一种或两种蛋白的表达量。
27.优选地,所述方法包括:制备含有核苷酸序列如seq id no.5和/或seq id no.6所示的基因的重组工程菌,导入到能产生熊果酸和/或齐墩果酸的生物体中,得到重组生物体;培养所述重组生物体,过表达氨基酸序列如seq id no.7和/或seq id no.8所示的蛋白。
28.与现有技术相比,本发明具有如下有益效果:
29.本发明建立了枇杷中主要三萜酸的积累模型,首次克隆了一个新的α-香树精合成酶基因ejosc2,其在烟草叶片瞬时表达可合成α-香树精和少量β-香树精;同时克隆到2个枇杷α/β-香树精c-28位氧化酶基因ejcyp716a1和ejcyp716a2,烟草瞬时表达都可催化形成熊果酸和齐墩果酸;还克隆到2个枇杷熊果酸/齐墩果酸c-2位羟化酶基因ejcyp716c1和ejcyp716c2,烟草瞬时表达都可催化形成科罗索酸和山楂酸。这些基因的表达能够促进枇杷α-香树精、β-香树精、熊果酸、齐墩果酸、科罗索酸和山楂酸的合成和体外生物合成α-香树精、β-香树精、熊果酸、齐墩果酸、科罗索酸和山楂酸及它们衍生而来的其他乌苏烷型和齐墩果烷型三萜酸。本发明为结构基因调控、代谢合成通路关键基因共表达等环境友好型技术批量获取枇杷重要天然活性化合物奠定基础,为三萜酸特异功能组分的修饰及产品开发提供理论支撑。
附图说明
30.图1为5个不同发育阶段的枇杷叶片中三萜酸组分的gc-ms色谱检测结果;a为gc-ms色谱色谱图,b为枇杷成熟叶片中三萜酸组分的比例。
31.图2为ejosc2与其他植物的osc蛋白聚类进化树。
32.图3为ejcyp716a1/2、ejcyp716c1/2与其他植物的cyp716蛋白聚类进化树。
33.图4为ejosc2烟草瞬时表达产物gc-ms的检测色谱图和质谱图;a图中以psak277空载体做空白对照,以ejaas1作为阳性对照,三萜酸标准品作外标,粪甾醇作内标;b图为α-香树精和β-香树精标准品和ejosc2表达产物的质谱离子碎片比对图。
34.图5为ejcyp716a1和ejcyp716a2烟草瞬时表达产物的gc-ms检测色谱图和质谱图;a图中以psak277空载体做空白对照,ejosc2表达为ejcyp716a1/2提供α-香树精和β-香树精底物,三萜酸标准品作为外标,粪甾醇作为内标;b图为熊果酸/齐墩果酸标准品和ejcyp716a1或ejcyp716a2表达产物的质谱离子碎片比对。
35.图6为ejcyp716c1和ejcyp716c2烟草瞬时表达产物的gc-ms检测色谱图和质谱图;a图中以psak277空载体做空白对照,ejosc2表达可为ejcyp716a提供α-香树精和β-香树精底物,ejosc2-ejcyp716a1或ejosc2-ejcyp716a2表达为ejcyp716c提供熊果酸和齐墩果酸底物。三萜酸标准品作外标,粪甾醇作内标;b图为科罗索酸/山楂酸标准品和ejcyp716c1或ejcyp716c2表达产物的质谱离子碎片比对。
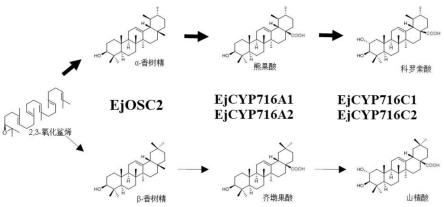
36.图7为以ejosc2为支点合成枇杷主要三萜酸的代谢通路。
具体实施方式
37.下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
38.实施例1枇杷叶片三萜酸组分的检测
39.一、实验方法
40.1、样本采集
41.采集
‘
解放钟’枇杷刚萌发的幼叶(时期1)到完全成熟的叶片(时期5)5个发育时期的叶片样品(每个样品3个生物学重复),样品采自华南农业大学枇杷属植物种质资源圃。新鲜样品用液氮速冻后,在-80℃冰箱中保存备用。
42.2、三萜酸组分的提取和检测
43.以上枇杷叶片样品在frerzone 12l冻干机(labconco,美国)中于-80℃、0.1兆帕条件下过夜冻干。冻干后的材料剪碎后用植物研磨仪研磨成细粉。称取5.0mg样品干粉到加1.5ml离心管并加入500μl乙醇混合液(体积比为乙醇:水:koh=9:1:1)中;剧烈震荡,70℃水浴1个小时;在微量浓缩仪(eppendorf,德国)中40℃旋转蒸发2小时蒸干乙醇;加入500μl乙酸乙酯,剧烈震荡1min;加入500μl水,继续剧烈震荡1min;16000g离心5min;取上层乙酸乙酯层;取50μl乙酸乙酯提取层在氮吹仪中用氮气干燥;加入30μl甲氧胺盐酸盐吡啶溶液溶解干燥物并在37℃水浴2小时;加入20μl n-甲基-n-(三甲基硅烷基)三氟乙酰胺并于37℃孵育0.5小时对三萜酸提取物进行硅烷化衍生。
44.将衍生物转入进样瓶,用agilent 7890a/5975c gc-ms联用仪(ca,美国)检测提取物中的三萜酸组分,测定的色谱条件为:hp-5m(30m
×
0.25mm
×
0.25μm)色谱柱,程序升温至40℃保持1min,以20℃/min升温至320℃,保持15min;不分流进样,进样量为1μl,氦气流速1ml/min;质谱条件为:接口温度250℃,离子源温度200℃,四级杆温度150℃,溶剂延迟15min,电压1500v,质量扫描范围60~800m/s。用β-香树精(cas号:559-70-6)、α-香树精(cas号:508-04-3)、齐墩果酸(cas号:508-02-1)、熊果酸(cas号:77-52-1)、科罗索酸(4547-24-4)、和山楂酸(cas号:4373-41-5)等作为标准品(sigma-aldrich),粪甾醇(cas号:360-68-9)做内标,并都在相同条件下进行检测。
45.二、实验结果
46.结果如图1所示,gc-ms分析发现,5个时期的叶片中都能检测到三萜酸;第1时期(刚萌发的幼叶)的样品只能检测到少量α-香树精和β-香树精,随后熊果酸和齐墩果酸含量逐渐增加,并开始出现科罗索酸和山楂酸;临近成熟的叶片中科罗索酸与熊果酸等主要三萜酸的含量都达到最高峰(图1a)。进一步比较成熟叶片中三萜酸的比例发现,枇杷叶中积累的是乌苏烷型和齐墩果烷型2种类型的三萜酸;乌苏烷型占总三萜酸的76%左右,其中55%为科罗索酸,20%为熊果酸;在24%的齐墩果烷型三萜酸中,将近18%为山楂酸,约3.4%为齐墩果酸(图1b)。组分比例分析预示,占主要比重的科罗索酸、熊果酸、山楂酸可能是枇杷作为传统中药使用过程中发挥关键作用的核心组分,这些组分生物合成基因的挖掘有利于相关化合物的开发利用。
47.实施例2枇杷ejosc2、ejcyp716a1/2、ejcyp716c1/2基因克隆与载体构建
48.一、实验方法
49.1、样本采集
50.按实施例1的方法采集、保存叶片样品。
51.2、rna的提取
52.取-80℃保存的成熟叶片,液氮下研磨成粉末,取100mg粉末转到1.5ml离心管中,加入1.0ml rlt裂解液,按easyspin plus植物rna快速提取试剂盒(艾德莱,中国)说明书提取rna,具体如下:将加有样品的各管裂解液在振荡器上分别剧烈震荡20s,之后在55℃水浴裂解20min;将裂解物在13000rpm离心10min;取上清,转入新的离心管,并加入上清体积一半的无水乙醇,轻轻吸打混匀;将混合物加入到ra吸附柱中,静置30s后13000rpm离心2min;弃废液,重复前一步操作,将所有混合物经ra吸附柱过滤;弃废液,往吸附柱中加入700μl去蛋白液rw1,静置1min,13000rpm离心30s;弃废液,往吸附柱中加入500μl漂洗液rw,静置1min,13000rpm离心30s;弃废液,加入漂洗液rw重复一遍;弃废液,将吸附柱放回空管中13000rpm离心2min;取出吸附柱,放入一个新的rnase free离心管中,在吸附膜中间加入50μl rnase free water,室温静置2min,12000rpm离心1min;将洗脱的rna吸回原来的吸附膜中间,室温再静置2min,12000rpm离心1min,获得总rna。
53.3、反转录合成cdna
54.用nanodrop2000超微量分光光度计(thermo fisher scientific,美国)检测rna浓度,取rnase-free水将rna稀释到100ng
·
μl-1
,按primescript
tm rt reagent kit with gdna eraser反转录系统(takara,日本)的说明书合成cdna第一链,去dna的反应体系包括2μl gdna eraser buffer、1μl gdna eraser和7μl rna,混匀后在42℃去除gdna;反应后往各体系中加入以下组分:1μlprimescript rt enzyme mix i+1μl rt primer mix+4μl 5
×
primescript buffer 2+4μl rnase free dh2o,混匀,在pcr仪上进行以下温度孵育反应:37℃,15min
→
85℃,10s
→
4℃;完成反转录反应。
55.4、三萜酸合成相关基因的扩增
56.调取枇杷基因组注释的osc2、cyp716a1/2和cyp716c1/2基因编码区序列全长,用primer premier 5.0设计出引物,并在上下游引物两侧分别加上表达载体psak277上酶切位点(ecori和xhoi)两侧的同源序列接头,最终引物委托上海生物工程有限公司合成序列全长扩增引物对,扩增引物对分别如表1所示。
57.表1.扩增引物序列
58.[0059][0060]
用hs dna polymerase(takara,日本)扩增目标基因。扩增体系为20μl,包括:10μl高保真dna polymerase mix、1μl正向引物、1μl反向引物、1μl叶片cdna、7μl ddh2o;扩增程序为95℃,5min;95℃,30s;56℃,30s;72℃,1min 30s~2min 30s;跑34个循环;72℃后延伸,10min;12℃,保存。
[0061]
psak277载体线性化:5μl cutsmart buffer(neb,美国),1μl ecori,1μlxhoi,1μg质粒,用水补至10μl。用枪头小心吸打、混匀,金属浴37℃酶切3h后,65℃水浴20min使内切酶失活。琼脂糖凝胶电泳,回收目的条带。
[0062]
用hieffplus one step cloning kit(上海翊圣生物,中国)将回收好的pcr产物连接到线性化psak277表达载体上,具体为:150ng纯化回收的pcr扩增产物,200ng线性化psak277载体,5μl hieffenzyme premix,用ddh2o补至10μl。枪头轻轻吸打、混匀,反应体系于50℃反应半小时后先于冰上孵育5min,之后取5μl连接产物转入50μl大肠杆菌dh5α感受态细胞;卡那霉素筛选阳性大肠杆菌克隆,挑均pcr检测阳性克隆后交由上海生物工程有限公司进行sanger测序,测序正确后返还的质粒即为对应的表达载体。
[0063]
二、实验结果
[0064]
1、用所设计的特异引物对可以从叶片中分离到单一的ejosc2序列,其编码区长度为2283bp(核苷酸序列如seq id no.9所示),该序列编码760个氨基酸残基(氨基酸序列如seq id no.10所示);分离到特异的ejcyp716a1和ejcyp716a2序列,其编码区长度都是1455bp(核苷酸序列分别如seq id no.1和seq id no.2所示),都编码484个氨基酸残基(氨基酸序列分别如seq id no.3和seq id no.4所示);分离到特异的ejcyp716c1和ejcyp716c2序列,它们的编码区长度都是1443bp(核苷酸序列分别如seq id no.5和seq id no.6所示),都编码480个氨基酸残基(氨基酸序列分别如seq id no.7和seq id no.8所示)。
[0065]
2、用mega6软件分别构建osc和cyp716同源基因进化树,结果如图2和图3所示,发现枇杷ejosc2与苹果mdosc1-mdosc3及拟南芥atbas等聚在一起。ejosc2及之前鉴定的ejaas1与苹果mdosc1/3聚在一个小枝,它与苹果mdosc3亲缘关系最近,编码氨基酸的一致性为98.95%;与ejaas1和苹果mdosc1编码氨基酸的一致性分别为96.32%和96.84%,与拟南芥atbas的序列一致性则为63%(图2)。ejcyp716a1/2与ejcyp716c1/2都处于植物cyp716亚家族大分枝中,但各自分布在不同小枝。ejcyp716a1/2与mdcyp716a175离得最近,其中ejcyp716a1与mdcyp716a175编码氨基酸的一致性达到98.97%,ejcyp716a2与mdcyp716a175编码氨基酸的一致性为97.73%。ejcyp716c1/2与两个已知功能的cyp716c聚在一起形成另一个小分枝,但它们二者之间最为相似,氨基酸序列一致性达到93.33%;它们与紫薇lscyp716c55编码氨基酸的序列一致性分别为75.67%和76.08%(图3)。
[0066]
实施例3ejosc2基因烟草瞬时表达及三萜酸产物检测
[0067]
一、实验方法
[0068]
载体的构建参考实施例2,将扩增到的ejosc2全长插入到psak277表达载体,构建psak277-ejosc2重组质粒。构建好的表达载体转入gv3101(psoup)农杆菌中,同时转化未插入任何基因的psak277载体做空白对照,阳性克隆菌液加入甘油后保存在-80℃冰箱中备用。在温室中培养本氏烟草,待烟草5~6片真叶完全展开后,取甘油菌在含有卡那霉素和利福平抗生素的平板上划线活化。挑取菌落到600μl液体培养基中,在30℃下200rpm振荡6个小时,进行菌液pcr检测。取400μl阳性克隆新活化的菌液,接种到10ml含50μl kan(50μm)和100ml rif(50μm)的yep液体培养基中,振荡过夜,至菌液a
600
值达到0.8~1.0。用30ml mes(100mm),30ml mgcl2(100mm),150μl乙酰丁香酮(acetosyringone浓度为100mm),加无菌水定容到150ml,混均制成mma工作液。取5ml菌液,5000rpm离心10min;弃上清,加入2ml mma工作液,悬浮菌体;5000rpm,离心10min;弃上清,重复悬浮-离心1次;加入2ml mma工作液,悬浮菌体并转入15ml试管中;加mma工作液将菌液稀释至a
600
=0.2左右;稀释好的菌液在避光、室温条件下孵育3小时左右。用去针头的1ml注射器将稀释后菌液注射入叶片背面,用psak277空载体菌液注射的叶片作对照。注射后将烟草移到弱光条件下培养1天,之后转入正常光照培养。
[0069]
3天后采集少量叶片样品,采用实施例2的方法提取rna反转录成cdna,检测基因的表达情况。1周后,收集烟草叶片,用液氮速冻并转移到冷冻干燥机中,于-80℃、0.1兆帕条件下干燥至叶片衡重,参考实施例1的方法提取烟草叶片中的三萜酸组分,并在相同色谱条件下用gc-ms检测ejosc2瞬时表达的三萜酸产物。
[0070]
二、实验结果
[0071]
结果如图5所示,ejosc2瞬时表达后,本氏烟草叶片提取物中可检测到大量α-香树精和少量β-香树精,而空载体处理的对照叶片中未检测到相应产物(图4a)。用粪甾醇均一化后,比较α-香树精和β-香树精色谱峰面积发现,ejosc2表达产物中α-香树精:β-香树精=89:11。之后,比对ejosc2表达产物和标准品(α-香树精/β-香树精)的总离子碎片(tic),发现ejosc2表达后检测到的2种产物的离子碎片结构分别与标准品β-香树精、α-香树精一样(图4b)。gc-ms三萜酸产物保留时间和产物总离子碎片比对双重检测结果表明,ejosc2是三萜酸前体的合成基因,其编码的蛋白可以催化生成α-香树精和β-香树精。
[0072]
实施例4ejcyp716a1和ejcyp716a2基因烟草瞬时表达及三萜酸产物检测
[0073]
一、实验方法
[0074]
载体的构建参考实施例2,将扩增到的ejcyp716a1和ejcyp716a2全长分别插入到psak277表达载体,构建psak277-ejcyp716a1和psak277-ejcyp716a2重组质粒。构建好的表达载体转入gv3101(psoup)农杆菌中,同时取实施例3的psak277-ejosc2甘油菌进行活化,以便为目标基因编码氧化酶提供α/β-香树精催化底物。参考实施例3进行目的基因烟草瞬时表达。1周后,参考实施例3收集烟草叶片并检测三萜酸产物。
[0075]
二、实验结果
[0076]
ejosc2瞬时表达可持续提供α-香树精和β-香树精底物,在ejosc2基础上同时注射ejcyp716a1或ejcyp716a2则在19.6和20.0min左右检测到新产物齐墩果酸和熊果酸,结果如图5所示,ejosc2-ejcyp716a1和ejosc2-ejcyp716a2两个组合共表达产物中熊果酸:齐墩果酸的比例分别为81:19和88:12(图5a)。比对ejosc2-ejcyp716a1和ejosc2-ejcyp716a2表达产物和标准品(熊果酸和齐墩果酸)的总离子碎片(tic)发现,ejosc2-ejcyp716a1、
ejosc2-ejcyp716a2表达后检测到的2个产物的离子碎片结构与标准品熊果酸/齐墩果酸一样(图5b)。gc-ms三萜酸产物保留时间和总离子碎片比对双重检测结果表明,ejcyp716a1和ejcyp716a 2是三萜酸合成相关基因,其编码的蛋白可以催化生成熊果酸和齐墩果酸。
[0077]
实施例5ejcyp716c1和ejcyp716c2基因烟草瞬时表达及三萜酸产物检测
[0078]
一、实验方法
[0079]
参考实施例2构建载体,将扩增到的ejcyp716c1和ejcyp716c2编码区序列全长分别连接到psak277表达载体上,构建psak277-ejcyp716c1和psak277-ejcyp716c2重组质粒。构建好的表达载体转入gv3101(psoup)农杆菌中,同时取实施例3的psak277-ejosc2和实施例4的psak277-ejcyp716a1/2甘油菌进行活化,以便为目标基因编码催化酶提供α/β香树精和熊果酸/齐墩果酸底物。参考实施例3进行目的基因瞬时表达。1周后,参考实施例3收集烟草叶片并检测三萜酸产物。
[0080]
二、实验结果
[0081]
ejosc2瞬时表达可持续提供α-香树精和β-香树精底物,ejosc2-ejcyp716a1或ejosc2-ejcyp716a2表达可持续提供熊果酸和齐墩果酸底物。在ejosc2-ejcyp716a1或ejosc2-ejcyp716a2基础上注射ejcyp716c1或ejcyp716c2,则在21.2和21.5min检测到山楂酸与科罗索酸,结果如图6所示,ejosc2-ejcyp716a1-ejcyp716c1、ejosc2-ejcyp716a1-ejcyp716c2和ejosc2-ejcyp716a2-ejcyp716c1、ejosc2-ejcyp716a2-ejcyp716c2四个组合的表达产物中科罗索酸与山楂酸的比值在85:15~86:14之间(图6a)。比对ejosc2-ejcyp716a1-ejcyp716c1/2、ejosc2-ejcyp716a2-ejcyp716c1/2表达产物和标准品(科罗索酸和山楂酸)的总离子碎片(tic)发现,ejosc2-ejcyp716a1-ejcyp716c1/2、ejosc2-ejcyp716a2-ejcyp716c1/2表达后检测到的2个产物的离子碎片结构与标准品酸一样(图6b)。gc-ms三萜酸产物保留时间和产物总离子碎片比对双重检测结果表明,ejcyp716c1/2是三萜酸合成相关基因,其编码的蛋白可催化生成科罗索酸和山楂酸。
[0082]
通过实施例3、4、5的研究,本发明系统报道了枇杷主要三萜酸的合成通路:ejosc2为氧化鲨烯环化酶基因,可催化合成α-香树精和β-香树精;ejcyp716a1和ejcyp716a2为α/β-香树精c-28位氧化酶基因,都可催化α-香树精形成熊果酸、催化β-香树精形成齐墩果酸;ejcyp716c1和ejcyp716c2为熊果酸/齐墩果酸c-2位羟化酶基因,都可催化熊果酸生成科罗索酸、催化齐墩果酸形成山楂酸,具体如图7所示。
[0083]
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1