针对新型冠状病毒核衣壳蛋白的抗体或其抗原结合片段及其应用的制作方法
1.本发明属于生物医药技术领域,具体涉及针对新型冠状病毒的抗体,尤其涉及一种针对新型冠状病毒核衣壳蛋白的抗体或其抗原结合片段及其应用。
背景技术:
2.新型冠状病毒(sars
‑
cov
‑
2)属于β冠状病毒属,已知可引起中东呼吸综合征的mers病毒和严重急性呼吸综合征的sars病毒均属于该种属。新型冠状病毒引起的急性呼吸道传染病为新型冠状病毒肺炎(covid
‑
19),其临床表现以发热、乏力、干咳为主,鼻塞、流涕等上呼吸道症状少见,且会出现缺氧低氧状态。
3.目前,已经有的临床新型冠状病毒检测试剂有针对血清抗体检测的酶联免疫方法和针对病毒遗传物质检测的rt
‑
pcr方法。由于感染后抗体产生需要1
‑
3周的窗口期,基于目前的流行病学调查,新型冠状病毒潜伏期一般为3
‑
7天,最长不超过14天,所以抗体检测对早期诊断没有意义。加之目前的抗体检测具有较高的假阳性率,特异性无法满足需要。
4.核酸检测有较高的特异性和灵敏度,但是该检测方法对技术要求高,容易出现假阴性,标本需要特殊处理,要求具备pcr扩增仪及凝胶电泳等专业的仪器设备,对新型冠状病毒的检测用时长,需专业技术人员操作和判断检测结果,无法应用于社区、基层医院、机场、海关甚至家庭等基层的早期初步筛查。因此,针对新型冠状病毒的抗原诊断方法,尤其是快速、敏感、特异的抗原诊断方法在covid
‑
19诊断中具有无可取代的意义。
5.在病毒体组装过程中,核衣壳蛋白(n蛋白)与病毒rna结合并导致螺旋核衣壳的形成。核衣壳蛋白是一种高度免疫原性的磷蛋白,与病毒基因组复制和调节细胞信号通路有关。核衣壳蛋白也是冠状病毒中含量最丰富的蛋白。由于核衣壳蛋白的序列保守性和强大的免疫原性,核衣壳蛋白常被作为冠状病毒的诊断检测工具。
6.因此,迫切需要开发一种可在感染早期测定样品是否存在新型冠状病毒抗原的产品,从而满足临床需要。
技术实现要素:
7.针对现有技术存在的不足,本发明的目的在于提供一种针对新型冠状病毒核衣壳蛋白的抗体或其抗原结合片段及其应用。使用新型冠状病毒核衣壳蛋白为抗原免疫小鼠,得到免疫血清效价最高的小鼠,获取杂交瘤细胞并保藏;所得杂交瘤细胞分泌的抗体或其抗原结合片段能够特异性地结合核衣壳蛋白,进而能够将其制成试剂盒用于检测新型冠状病毒。
8.为达此目的,本发明采用以下技术方案:第一方面,本发明提供一种针对新型冠状病毒核衣壳蛋白的抗体或其抗原结合片段,所述抗体选自mab6抗体、mab7抗体、mab8抗体和mab9抗体中的任意一种;其中,所述mab6抗体由保藏号为cctcc no:c2020236的杂交瘤细胞株#mab6分泌,
所述mab7抗体由保藏号为cctcc no:c2020237的杂交瘤细胞株#mab7分泌,所述mab8抗体由保藏号为cctcc no:c2020238的杂交瘤细胞株#mab8分泌,所述mab9抗体由保藏号为cctcc no:c2020239的杂交瘤细胞株#mab9分泌。
9.本发明发现,所述针对sars
‑
cov
‑
2病毒n蛋白的特异性抗体可以用于测定样品中sars
‑
cov
‑
2病毒或其相应抗原的存在情况或者含量,并可达到很高的灵敏度和稳定性。
10.本发明的单克隆抗体可以使用新型冠状病毒的核衣壳蛋白作为免疫原来获得。核衣壳蛋白的氨基酸序列是公知的,该氨基酸序列如seq id no:1所示。编码seq id no:1所示的氨基酸序列的核酸的碱基序列如seq id no:2所示。同样地,本发明的单克隆抗体可以使用具有seq id no:1所示的氨基酸序列的多肽作为免疫原来获得。还可以是seq id no:1的氨基酸序列的天然突变体。
11.此外需要说明的是,用木瓜蛋白酶分解或胰蛋白酶分解,可得到如fab片段或f(ab')2片段等具有与对应抗原的结合性的抗体片段(本发明中称为“抗原结合片段”),本发明的抗原结合片段也可以与本发明的单克隆抗体同样地使用,包含在本发明的范围内。
12.第二方面,本发明提供一种分泌如第一方面所述的抗体或其抗原结合片段的杂交瘤细胞株,所述杂交瘤细胞株的保藏号为cctcc no:c2020236、cctcc no:c2020237、cctcc no:c2020238或cctcc no:c2020239中的任意一种。
13.本发明生物材料保藏信息如下:保藏号为cctcc no:c2020236的杂交瘤细胞株已于2020年11月26日在中国典型培养物保藏中心 (地址:武汉市武汉大学) 注册保藏,分类命名为:杂交瘤细胞株#mab6。
14.保藏号为cctcc no:c2020237的杂交瘤细胞株已于2020年11月26日在中国典型培养物保藏中心 (地址:武汉市武汉大学) 注册保藏,分类命名为:杂交瘤细胞株#mab7。
15.保藏号为cctcc no:c2020238的杂交瘤细胞株已于2020年11月26日在中国典型培养物保藏中心 (地址:武汉市武汉大学) 注册保藏,分类命名为:杂交瘤细胞株#mab8。
16.保藏号为cctcc no:c2020239的杂交瘤细胞株已于2020年11月26日在中国典型培养物保藏中心 (地址:武汉市武汉大学) 注册保藏,分类命名为:杂交瘤细胞株#mab9。
17.本发明的杂交瘤可以用本领域已知的细胞融合技术产生:用免疫原免疫动物通过常规方法,将由该动物得到的抗核衣壳蛋白抗体产生细胞和肿瘤细胞进行细胞融合,通过由此得到的杂交瘤来产生上述抗体。经免疫产生本发明的杂交瘤的动物不受特别限制,包括但不限于山羊、绵羊、豚鼠、小鼠、大鼠和家兔。在其中优选的是小鼠。
18.上述杂交瘤例如可通过以下的方法获得:将新型冠状病毒的核衣壳蛋白与弗氏完全佐剂一起分数次、间隔2~3周、仅皮下多点注射给予小鼠等动物,由此进行免疫。接着,使抗体产生细胞和肿瘤细胞融合,其中所述抗体产生细胞来自由免疫的动物获得的脾脏等,肿瘤细胞是选自骨髓瘤细胞株等的无限增殖性细胞的骨髓瘤细胞等可在体外培养的肿瘤细胞。上述融合方法例如可按照khler和milstein的常规方法(g. kohler和c. milstein, nature, 1975, 256: 495
‑
497),采用聚乙二醇法,或可采用仙台病毒法等。
19.本发明的单克隆抗体可通过本发明的杂交瘤产生。从本发明的杂交瘤产生本发明的单克隆抗体的方法可以是本领域常规或已知的方法,例如:可以从培养本发明的杂交瘤的组织培养液中获得,也可以通过接种到小鼠体内增殖、从收集的腹水或血清中分离获得。所述培养本发明的杂交瘤可以按照本领域常规或已知的方法进行。所述接种、收集腹水或
血清、从腹水或血清中分离本发明的单克隆抗体的方法可以是本领域常规或已知的方法。
20.第三方面,本发明提供如第一方面所述的抗体或其抗原结合片段或如第二方面所述的杂交瘤细胞株在制备新型冠状病毒检测试剂盒中的应用。
21.本发明中的单克隆抗体或其抗原结合片段的应用领域不受特别限制,尤其能够应用于免疫测定,用于判断sars
‑
cov
‑
2病毒的感染情况。
22.第四方面,本发明还提供一种非疾病的诊断和治疗目的、检测样品中新型冠状病毒或者其相应抗原的存在情况的方法,所述方法包括如下步骤:将待测样品与如第一方面所述的抗体或其抗原结合片段混合,孵育,检测得到新型冠状病毒或者其相应抗原的存在情况。
23.本发明中提供了一种利用上述抗体检测或测定生物样品和/或环境样品中sars
‑
cov
‑
2病毒或其抗原的存在情况或进行定量的免疫测定方法;该方法包括将待测生物样品和/或环境样品与本发明的抗sars
‑
cov
‑
2病毒n蛋白单克隆抗体或其抗原结合片段孵育,形成抗原
‑
抗体复合物,对形成的结合复合物进行定性检测和定量测定,该复合物的存在或数量指示了sars
‑
cov
‑
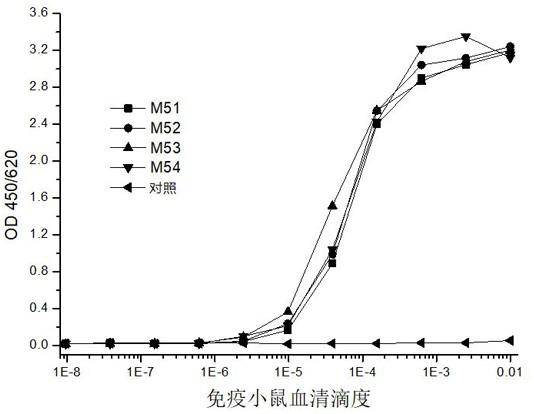
2病毒的存在情况或者含量。
24.所述免疫测定方法本身是公知的,可以采用任何周知的免疫测定方法,本说明书中无须赘述。即,如果以测定形式进行分类,有夹心法、竞争法、凝聚法、蛋白质印迹法等,如果以所使用的标记进行分类,则有荧光法、酶法、放射法、生物素法等,这些都可使用。还可通过免疫组织染色进行诊断。免疫测定方法中使用标记抗体时,抗体的标记方法本身是周知的,可以采用周知的任何方法。
25.本发明的免疫测定法使用至少一种由上述杂交瘤细胞株分泌的单克隆抗体或其抗原结合片段进行。用于检测抗原的免疫测定法是本领域中众所周知的。根据本发明的单克隆抗体或其抗原结合片段可不依赖于使用的标记物(例如酶、荧光等),并且不依赖于检测模式(例如荧光免疫测定法、酶联免疫吸附测定法或化学发光测定法等)或测定法原理(例如夹心法、竞争法等)而被用于上述免疫测定方法中。
26.上述免疫测定法,包括酶免疫测定、放射免疫测定、荧光免疫测定、化学发光免疫测定、蛋白质印迹、免疫层析、乳胶凝集实验等等;并且,上述免疫测定法都可用于以竞争法或夹心法,用标记物标记的抗原或抗体测定生物样品和/或环境样品中的靶抗原。
27.在上述各种免疫测定法中,酶免疫测定、荧光免疫测定和化学发光免疫测定是优选的。竞争性方法是基于检测标本中sars
‑
cov
‑
2病毒和已知量的标记的sars
‑
cov
‑
2病毒n蛋白与本发明单克隆抗体或其抗原结合片段进行定量竞争性结合反应;即本发明包括利用测定颜色、荧光、时间分辨荧光、化学发光、电化学荧光或放射性而定性或定量测定生物成分中的sars
‑
cov
‑
2病毒的存在情况或含量。夹心法是将本发明的抗体或抗原结合性片段作为第一抗体固定为固相,与待测生物样品和/或环境样品反应,漂洗后,再使其与第二抗体反应,漂洗后测定与固相结合的第二抗体。将第二抗体用酶、荧光物质、放射性物质、生物素等标记,可以测定与固相结合的第二抗体。凝聚法中,将本发明的抗体或其抗原结合性片段固定在胶乳等颗粒上,与样品反应,测定吸光度。通过上述方法对已知浓度的多个标准品进行测定,根据测定的标记量与标准品含量的关系制作标准曲线,将对未知浓度的受检样品的测定结果对照该标准曲线,可以对受检样品中sars
‑
cov
‑
2病毒抗原进行定量。
28.根据上述竞争法和夹心法进行sars
‑
cov
‑
2免疫测定时,都需要充分洗涤固相,测
量与标记物结合的活性。
29.当标记物是放射性同位素时,用孔计数器或液相闪烁计数器进行测量。例如,当标记物是酶时,加入底物,在显色后用比色或荧光测定酶活性。当标记物是荧光物质、磷光物质或着色物质时,可分别通过本领域已知的方法进行测量。
30.通过上述方法对已知浓度的多个标准品进行测定,根据测定的标记量与标准品含量的关系制作标准曲线,将对未知浓度的受检样品的测定结果对照该标准曲线,可以对受检样品中sars
‑
cov
‑
2病毒抗原进行定量。
31.作为本发明优选的技术方案,所述待测样品包括生物样品和/或环境样品。
32.供给上述免疫测定法的样品只要是含有sars
‑
cov
‑
2病毒的核衣壳蛋白的样品即可,没有特别限定,例如可以来自人和动物的血清、血浆、全血,除此之外还有鼻腔拭液(鼻腔拭子)、鼻腔吸引液、咽拭液(咽拭子)等体液提取液,呼吸道分泌物,细胞或组织匀浆液等。
33.其中,所述生物样品包括血浆、全血、嗽口液、咽拭子、尿液、粪便或支气管灌流液中的任意一种或至少两种的组合。
34.作为本发明优选的技术方案,所述方法包括夹心法或竞争法。简单来讲,夹心法是将本发明的抗体或抗原结合性片段作为第一抗体固定为固相,与待测样品反应,漂洗后,再使其与第二抗体反应,漂洗后测定与固相结合的第二抗体。将第二抗体用酶、荧光物质、放射性物质、生物素等标记,可以测定与固相结合的第二抗体。
35.其中,所述夹心法包括如下步骤:(1)将如第一方面所述的抗体或其抗原结合片段作为第一抗体与固相载体结合;(2)将步骤(1)中所得的固相载体与待测样品混合,孵育,并以对照样品进行对照;(3)所述孵育完成后,洗涤所述的固相载体,加入标记物标记的第二抗体并再次孵育,所述第二抗体与新型冠状病毒或者其相应抗原结合;(4)再次洗涤所述的固相载体,并检测与第二抗体结合的标记物的信号值;(5)将所测得的信号值与对照样品的信号值相比较,确定所述待测样品中新型冠状病毒的存在情况及其相对量。
36.优选地,所述夹心法中还包括:步骤(3)中所述第二抗体先用生物素进行标记,再与酶标记的亲和素或链霉亲和素结合;而后,在步骤(4)中加入所述酶的底物进行显色。
37.上述夹心法是基于作为俘获抗体(或固相抗体)的本发明的单克隆抗体或其抗原结合片段以及能够配合使用的标记抗体都能特异性结合待测样品中的sars
‑
cov
‑
2病毒,通过对标记抗体进行定量来测定样品中sars
‑
cov
‑
2病毒的含量。具体来说,夹心法将本发明的针对sars
‑
cov
‑
2病毒n蛋白的特异性单克隆抗体或其抗原结合片段结合到固相载体上形成固相抗体(也称俘获抗体或第一抗体),然后向被包被的固相载体上分别加入待检样品和对照样品并于适当的条件下孵育足够长的时间;反应后充分洗涤所述的固相并加入适量标记物标记的、可与sars
‑
cov
‑
2病毒n蛋白结合的第二抗体并再次孵育;反应后充分洗涤所述的固相并以适合的方法检测与第二抗体结合的标记物的信号值;将所测得的信号值与平行测得的预定量的对照样品的信号值相比较以确定样品中sars
‑
cov
‑
2病毒的存在及其相对量。
38.此外,所述竞争法包括如下步骤:(1')将预定量的如第一方面中所述的抗体或其抗原结合片段与固相载体结合;(2')向步骤(1')中所得的固相载体上加入待测样品和预定量的标记物标记的新型冠状病毒或者其相应抗原,孵育,并以对照样品进行对照;(3')反应后洗涤所述的固相载体,检测与新型冠状病毒或者其相应抗原结合的标记物的信号值;(4')将所测得的信号值与对照样品的信号值相比较,确定所述待测样品中新型冠状病毒的存在情况及其相对量。
39.标记病毒单克隆抗体可以通过使抗sars
‑
cov
‑
2病毒单克隆抗体与标记物结合来制备。标记物可以是酶、胶体金属颗粒、着色胶乳颗粒、荧光胶乳颗粒、发光物质、荧光物质等。酶可以是酶联免疫测定法(eia)中使用的各种酶,例如碱性磷酸酶、过氧化物酶、β
‑
d
‑
半乳糖苷酶等;胶体金属颗粒例如可以使用胶体金颗粒、胶体硒颗粒等。
40.其中,标记物与抗sars
‑
cov
‑
2病毒单克隆抗体的结合方法可以利用公知的产生共价键或非共价键的方法。结合的方法例如有:戊二醛法、高碘酸法、马来酰亚胺法、吡啶基
·
二硫法、使用各种交联剂的方法等(例如参照“蛋白质核酸酵素”, 1985, 别册31号,37
‑
45页)。
41.其中,使用交联剂的结合方法中,交联剂例如可使用n
‑
琥珀酰亚氨基
‑4‑
马来酰亚氨基丁酸(gmbs)、n
‑
琥珀酰亚氨基
‑6‑
马来酰亚氨基己酸、n
‑
琥珀酰亚氨基
‑4‑
(n
‑
马来酰亚氨基甲基)环己烷
‑1‑
羧酸等。通过共价键结合的方法中,可以依赖使用存在于抗体中的官能团,除此之外可以按照常规方法例如将硫羟基、氨基、羧基、羟基等官能团导入抗体中,然后采用上述结合方法,使该官能团与标记物结合,由此制备标记的抗sars
‑
cov
‑
2病毒单克隆抗体。通过非共价键结合的方法还有物理吸附法等。
42.底物可以使用对应于标记物的酶并如下表示的各种显色底物、荧光底物、发光底物等。例如:(a)显色底物:与过氧化氢组合的2,2
′‑
连氮基
‑
双(3
‑
乙基苯并噻唑啉
‑6‑
磺酸)(abts)、3,3
′
,5,5
′‑
四甲基联苯胺(tmb)、二氨基联苯胺(dab)用于过氧化物酶;5
‑
溴
‑4‑
氯
‑3‑
吲哚基磷酸(bcip)、对硝基苯磷酸酯(p
‑
npp)、5
‑
溴
‑4‑
氯
‑3‑
吲哚基磷酸钠(bcip
·
na)用于碱性磷酸酶。
43.(b)荧光底物:4
‑
甲基伞形苯基磷酸酯(4
‑
mup) 用于碱性磷酸酶;4
‑
甲基伞形基苯基
‑
β
‑
d
‑
半乳糖苷(4mug)用于β
‑
d
‑
半乳糖苷酶。
44.(c)发光底物:3
‑
(2
′‑
螺旋金刚烷)
‑4‑
甲氧基
‑4‑
(3'
‑
磷酰氧基)苯基
‑
1,2
‑
二氧杂环丁烷
·
2钠盐(amppd)用于碱性磷酸酶;3
‑
(2
′‑
螺旋金刚烷)
‑4‑
甲氧基
‑4‑
(3'
‑
β
‑
d
‑
吡喃半乳糖基)苯基
‑
1,2
‑
二氧杂环丁烷(amgpd)用于β
‑
d
‑
半乳糖苷酶;与过氧化氢组合得到的鲁米诺、异鲁米诺用于过氧化物酶。
45.本发明的优选实施例中,提供一种双抗体夹心法elisa检测试剂盒,并提供利用所述试剂盒检测样品中是否存在的sars
‑
cov
‑
2病毒的方法,包括:(1)提供可与sars
‑
cov
‑
2病毒n蛋白结合的单克隆抗体或其抗原结合片段(第一抗体或固相抗体)并用所述的第一抗体包被固相载体;(2)向步骤(1)中经包被的固相载体上加入待测样品和对照样品(或标准品)并于
适当的条件下孵育;(3)反应后充分洗涤以去除任何未结合的样品,并加入适量的生物素标记的、可与sars
‑
cov
‑
2病毒n蛋白另一表位结合的单克隆抗体或其抗原结合片段(第二抗体或标记抗体)并再次孵育;(4)反应后充分洗涤以去除任何未结合的第二抗体,生物素化的第二抗体再与酶标记的亲和素或链霉亲和素结合,然后再加酶底物显色,然后使用酶标仪测定相应的吸光值;(5)将所测得的吸光值与平行测得的已知量标准品的吸光度相比较以确定样品中sars
‑
cov
‑
2病毒的存在情况及其相对量。
46.优选地,所述待测样品为生物样品,进一步的,所述样品为血浆、血清和全血;所述固相载体为微量滴定板;所述亲和素或链霉亲和素以辣根过氧化物酶标记;所述酶底物为tmb。
47.第五方面,本发明还提供一种新型冠状病毒检测试剂盒,所述新型冠状病毒检测试剂盒包括如第一方面所述的抗体或其抗原结合片段。
48.通过使用本发明针对sars
‑
cov
‑
2病毒的核蛋白的单克隆抗体测定来自人或动物的各种生物样品和/或环境样品,可以实施sars
‑
cov
‑
2病毒感染的诊断。使用本发明的单克隆抗体,通过免疫化学方法或免疫组织化学方法,可以直接测定来自人或动物的各种体液、细胞、组织等和/或环境样品中的sars
‑
cov
‑
2病毒的核衣壳蛋白。
49.作为本发明优选的技术方案,所述新型冠状病毒检测试剂盒还包括固相载体,且所述抗体或其抗原结合片段包埋于固相载体中。
50.该试剂盒为使用竞争法进行检测的试剂盒,其中的免疫测定试剂例如可以制备成用酶、胶体金属颗粒、着色胶乳颗粒、发光物质、荧光物质、放射性物质等标记的一定量的病毒抗原。使用该试剂,可以与例如含有一定量的本发明的单克隆抗体、上述标记病毒抗原和待测定的抗原的样品进行竞争性反应,由与抗体结合的或未结合的标记病毒抗原的量相对待测定样品中抗原的量进行定量,从而实施免疫测定。
51.或者,所述新型冠状病毒检测试剂盒还包括固相载体和第二抗体,所述单克隆抗体或其抗原结合片段作为第一抗体结合在固相载体上,所述第二抗体携带标记物与第一抗体联用。
52.该检测试剂盒为使用夹心法进行检测的试剂盒,在夹心法的免疫测定试剂中,可以使用一种单克隆抗体作为固相抗体和标记抗体(例如抗原为多聚物时),但通常优选使用可分别识别待测定的抗原的两个不同的表位的2种或以上的抗体。并且,对于任何的固相抗体和标记抗体,可以从2种或以上的单克隆抗体中选择组合使用。
53.本发明中,可以使用以下的试剂:例如准备两种本发明的单克隆抗体,以其中一种为上述标记抗体,以另外一种为与固相载体结合的固相抗体。
54.首先,使含有待测定的抗原的样品与该固相抗体反应,接着使标记抗体(第二抗体)与被捕捉到该固相抗体上的抗原反应,通过检测与不溶性载体结合的标记物的存在或活性,可以实施免疫测定。同样,使含有待测定的抗原的样品与固相抗体反应,接着使标记抗体(第二抗体)与被捕捉到该固相抗体上的抗原反应,通过测定与不溶性载体结合的标记物的存在或活性,即通过标记抗体的量对待测定的抗原的量进行定量,可以实施免疫测定。
55.优选地,所述第二抗体选自本发明的任意一个能够与第一抗体相配合的抗体,即能够配对使用的单克隆抗体或其抗原结合片段。需要说明的是,在本发明的上下文中,“能够相配合”及“能够配对使用”的抗体是指所述抗体针对的是新型冠状病毒n蛋白抗原中不同的表位、在与n蛋白抗原的结合中不发生相互干扰或拮抗的抗体组合。
56.此外,第二抗体也可以是其它多克隆抗体。
57.作为本发明优选的技术方案,所述第一抗体和第二抗体选自如下组合中的任意一种:组合i:第一抗体为杂交瘤细胞株#mab7分泌的单克隆抗体或其抗原结合片段,第二抗体为杂交瘤细胞株#mab6分泌的单克隆抗体或其抗原结合片段;组合ii:第一抗体为杂交瘤细胞株#mab7分泌的单克隆抗体或其抗原结合片段,第二抗体为杂交瘤细胞株#mab8分泌的单克隆抗体或其抗原结合片段;组合iii:第一抗体为杂交瘤细胞株#mab7分泌的单克隆抗体或其抗原结合片段,第二抗体为杂交瘤细胞株#mab9分泌的单克隆抗体或其抗原结合片段。
58.作为本发明优选的技术方案,所述标记物包括:放射性同位素、酶、酶底物、磷光物质、荧光物质、生物素或着色物质中的任意一种或至少两种的组合。
59.优选地,所述放射性同位素包括
125
i、3h、
14
c或
32
p中的任意一种或至少两种的组合。
60.优选地,所述酶包括碱性磷酸酶、辣根过氧化物酶、β
‑
半乳糖苷酶、脲酶或葡萄糖氧化酶中的任意一种或至少两种的组合。
61.优选地,所述荧光物质包括荧光素衍生物、罗丹明衍生物、稀土元素或稀土元素复合物中的任意一种或至少两种的组合。
62.优选地,所述磷光物质包括丫啶酯和/或异鲁米诺。
63.作为本发明优选的技术方案,所述固相载体包括:硝酸纤维素膜、胶乳颗粒、磁性颗粒、胶体金、玻璃、纤维玻璃、聚合物或纤维光学传感器中的任意一种或至少两种的组合。
64.通过使用上述本发明的单克隆抗体,可将该抗体用作固相抗体和标记抗体的至少一方,制备sars
‑
cov
‑
2病毒免疫测定试剂。
65.与上述单克隆抗体结合的固相可以使用以往免疫测定中使用的各种固相,例如有:elisa板、胶乳、明胶颗粒、磁性颗粒、聚苯乙烯、玻璃等各种固相珠,可传输液体的基质等不溶性载体等。另外,可用酶、胶体金属颗粒、着色胶乳颗粒、发光物质、荧光物质、放射性物质等标记抗体,来制备标记抗体。将这些固相抗体和/或标记抗体等试剂组合,可以制备在酶联免疫测定法、放射免疫测定法、荧光免疫测定法等中使用的试剂。这些测定试剂是通过夹心法或竞争性结合测定法测定试样中的目标抗原的试剂。
66.此外,本发明的另一方面,提供了上述免疫测定试剂在诊断sars
‑
cov
‑
2病毒感染所致疾病中的应用。
67.优选地,所述疾病为新型冠状病毒性肺炎(covid
‑
19)。
68.与现有技术相比,本发明的有益效果为:(1)本发明的单克隆抗体或其抗原结合片段由四种杂交瘤细胞株cctcc no:c2020236、cctcc no:c2020237、cctcc no:c2020238或cctcc no:c2020239分泌,所述单克隆抗体或其抗原结合片段可特异性地识别sars
‑
cov
‑
2病毒的n蛋白,亲和力高达pm级,具有非常高的灵敏度和特异性;
(2)本发明还提供了sars
‑
cov
‑
2病毒检测试剂盒,所述检测试剂盒可利用多种免疫测定法检测sars
‑
cov
‑
2病毒的存在情况,尤其是利用夹心法和竞争法检测sars
‑
cov
‑
2病毒的检测试剂盒,由于其使用的单克隆抗体或其抗原结合片段具有高亲和力和特异性,所得检测结果较为准确;其中,本发明还提供了一种双抗体夹心elisa检测试剂盒,以最佳配对的三组抗体(mab7/bio
‑
mab6、mab7/bio
‑
mab8和mab7/bio
‑
mab9)构建得到,其检出低限为12.5 pg/ml,其重复性较好;(3)本发明中构建的双抗体夹心elisa免疫测定法是一种非常灵敏的病毒检测技术,在检测大多数病毒时比其它血清学方法特异性更高,并且elisa敏感性高、操作简便,配套仪器设备的发展使操作程序规范化和自动化,从而进一步提高了稳定性。因此,本发明提供的新型冠状病毒的抗原检测试剂盒能在病人感染病毒早期就能检测出核衣壳蛋白,解决了临床对新型冠状病毒感染者的快速诊断问题,具有较高的准确性,为临床检测该病提供了快速、准确的诊断方法。
附图说明
69.图1为实施例1中小鼠免疫血清效价测定结果曲线图。
70.图2为实施例3中抗新型冠状病毒核衣壳蛋白的抗体与sars病毒的交叉反应性测定结果曲线图。
71.图3为实施例3中抗新型冠状病毒核衣壳蛋白的抗体与mers病毒的交叉反应性测定结果曲线图。
72.图4为实施例5中捕获抗体mab7与标记抗体bio
‑
mab6的双抗体夹心elisa试验的结果曲线图。
73.图5为实施例5中捕获抗体mab7与标记抗体bio
‑
mab8的双抗体夹心elisa试验的结果曲线图。
74.图6为实施例5中捕获抗体mab7与标记抗体bio
‑
mab9的双抗体夹心elisa试验的结果曲线图。
具体实施方式
75.下面结合附图并通过具体实施方式来进一步说明本发明的技术方案,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
76.除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
77.除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见如:sambrook等, molecular cloning: a laboratory manual, 第二版, cold spring harbor laboratory press, 2001;ausubel等,current protocols in molecular biology, john wiley&
sons, new york, 1987 and periodic updates;methods in enzymology, academic press, san diego; wolffe, chromatin structure and function, 第三版, academic press, san diego, 1998;methods in enzymology, vol.304, chromatin (p.m.wassarman and a.p.wolffe,eds.),academic press, san diego, 1999和methods in molecular biology, vol.119, chromatin protocols (p.b.becker, ed.) humana press, totowa, 1999等在内的相关文献。
78.实施例1杂交瘤细胞株的获取以及单克隆抗体的制备本实施例用于获取杂交瘤细胞株以及制备单克隆抗体,具体步骤如下:1.1动物免疫将sars
‑
cov
‑
2 n蛋白抗原(sino biological,40588
‑
v08b)以完全弗氏佐剂充分乳化后,采用多点免疫方式免疫雄性balb/c小鼠(上海斯莱克实验动物有限公司),50 μg/只,免疫周期为三周一次;在第3次免疫后第10天,通过眼窝取血,根据间接elisa方法测试血清抗体滴度以监测小鼠免疫应答程度。
79.1.2免疫血清效价测定建立间接elisa法测定免疫血清效价:以0.1 μg/ml重组sars
‑
cov
‑
2 n蛋白包被聚苯乙烯微96孔板,100 μl/孔,4℃过夜;次日,加入质量分数为1%牛血清白蛋白(bsa,sigma)的封闭液,0.3 mg/孔,4℃过夜,次日再用含10%蔗糖的10 mm pbs缓冲液处理包被板条,真空干燥后用铝膜袋真空包装4℃保存,用于鼠免疫血清效价测定;于第3次免疫后10天眼眶采血,将采集的小鼠血清用含质量分数为1.5% bsa的10 mm pbs以1:100三倍稀释一系列浓度梯度后,加入96孔板,100 μl/孔,37℃ 30分钟,用10 mm pbs含0.1% tween
‑
20洗涤液洗板3次后,加入1:5000倍稀释辣根过氧化物酶(hrp)标记羊抗鼠igg(jackson laboratory inc,货号115
‑
035
‑
07),100 μl/孔,37℃ 30分钟;同上洗板后,加入含有0.05%(w/v) tmb和0.06% (w/v)双氧ph5.0柠檬酸缓冲液,100 μl/孔,室温避光10分钟,加0.2 m h2so4终止反应,100 μl/孔,酶标仪在双波长450/620 nm处读取吸收值,以免疫前小鼠血清作为阴性对照,以测定值与对照值的比≥2.0为阳性来判断免疫血清的效价;四只小鼠在第三次免疫后都产生了较强的特异性免疫应答,反应结果示于图1,小鼠m51、m52、m53和m54的免疫血清的效价均较高。
80.1.3杂交瘤制备在融合前3天,对产生抗体滴度最高的小鼠加强免疫一次;3天后,处死小鼠,无菌条件下取小鼠脾脏,制成脾细胞悬液,然后按1:1比例与2
×
108个于对数生长期的小鼠骨髓瘤sp2/0细胞株混合,然后在含50%聚乙二醇(分子量为1450)和5%二甲基亚砜(dmso)的溶液中融合;用iscove培养基(含10%胎牛血清、100 u/ml青霉素、100 μg/ml链霉素、0.1 mm次黄嘌呤、0.4 μm氨基蝶呤和16 μm胸苷)来调整脾脏细胞数至5
×
10
5 /ml,以0.3 ml加入96孔培养板孔内,并置于37
°
c,5% co2培养箱内培养;1天以后,于每孔加入100 μl含次黄嘌呤、氨基喋呤
‑
胸腺嘧啶脱氧核苷(hat,sigma)筛选培养基,以后每3天用此筛选培养基给培养物换液一次,直到克隆细胞形成。
81.1.4筛选分泌新型冠状病毒n蛋白抗体的杂交瘤细胞为筛选产生抗体的阳性克隆,用间接elisa法检测细胞培养上清,简述如下:将杂交瘤细胞培养上清加入预先包被抗原的elisa板中,100 μl/孔,以sp2/0细胞培养上清作为阴性对照,免疫多抗血清作为阳性对照,室温一小时;pbst洗涤3次;加入工作浓度的hrp标记的羊抗鼠igg抗体(jackson laboratory inc,货号115
‑
035
‑
07),100 μl/孔,37℃ 30分钟,同上洗板后,加入底物tmb,100 μl/孔,室温避光10分钟,按100 μl/孔加入0.2m h2so4终止反应,酶标仪在双波长450/620 nm处读取吸收值。被测孔od 450/620 nm读数大于阴性对照两倍以上判定为阳性;1.5阳性杂交瘤细胞的克隆采用有限稀释法对筛选到的强阳性细胞克隆进行2~3次的亚克隆,共获得6株稳定分泌抗体的杂交瘤细胞株,分别命名为#mab6、#mab7、#mab8、#mab9、#mab10和#mab11,并对其中4株进行了生物保藏,#mab6、#mab7、#mab8和#mab9分别对应保藏号为cctcc no:c2020236、cctcc no:c2020237、cctcc no:c2020238和cctcc no:c2020239的杂交瘤细胞株。
82.1.6抗体的纯化在补充10% fcs的rpmi 1640培养基中培养上述筛选获得的阳性杂交瘤细胞克隆#mab6、#mab7、#mab8、#mab9、#mab10和#mab11。
83.当细胞密度达到大约5
×
105个细胞/ml时,用无血清培养基替换该培养基。培养后离心并收集培养物上清液,然后使用protein g亲和层析柱纯化抗体,用150 mm nacl透析单克隆抗体洗脱液,并通过0.2 μm滤器将透析的溶液过滤除菌,获得纯化的抗体样品。
84.1.7抗体标记生物素标记:n
‑
n
‑
羟基琥珀酰亚胺酯(nhs)是最常见的生物素标记试剂,nhs激活的生物素能够在碱性缓冲液中与伯胺基团(
‑
nh2)反应,形成稳定的酰胺键。蛋白(例如抗体)通常具有许多伯胺基,因此可作为生物素标记的靶点;本实施例以生物素衍生物nhs
‑
lc
‑
biotin(thermo scientific,货号21435)进行抗体标记,按照thermo scientific ez
‑
link生物素标记试剂盒说明书中描述的方法对单克隆抗体进行生物素标记,获得生物素标记的抗体bio
‑
mab6、bio
‑
mab7、bio
‑
mab8、bio
‑
mab9、bio
‑
mab10和bio
‑
mab11。
85.本发明的单克隆抗体也可以使用本领域公知的其它方法进行标记,例如用hrp(辣根过氧化物酶)标记,具体方法如下:将上述步骤所得纯化抗体8
‑
10 mg装入透析袋,用0.01 m ph9.6的碳酸盐缓冲液4℃透析过夜。取hrp 4 mg,溶于1 ml的纯水中,缓慢加入0.1m naio
4 0.1 ml,室温下避光搅拌20分钟,装入透析袋,用0.001m ph4.4的醋酸盐缓冲液4℃透析过夜;向hrp中加入0.2 m的na2co
3 0.05ml调ph至9.6,然后与抗体混合,避光搅拌2小时,加入4 mg/ml的nabh
4 0.1ml,4℃静置2小时,4℃ pbs透析过夜。
86.加入等体积的饱和硫酸铵,搅拌30分钟,4℃静置2小时,3000rpm离心20分钟,弃上清。所得沉淀再用50%的饱和硫酸铵重复前述操作一遍。所得沉淀溶于1 ml pbs中,4℃ pbs透析48小时,得酶标单克隆抗体hrp
‑
mab6、hrp
‑
mab7、hrp
‑
mab8、hrp
‑
mab9、hrp
‑
mab10和hrp
‑
mab11。
87.实施例2 双抗体夹心elisa筛选最佳配对单克隆抗体单克隆的杂交瘤细胞产生抗体只针对抗原的一个表位,运用“双抗体夹心法”筛选最佳配对使用的固相抗体和标记抗体。
88.采用6
×
6矩阵进行抗体两两配对筛选,以上述6株单克隆抗体分别进行包被作为捕获抗体,分别与6株生物素标记的单克隆抗体bio
‑
mab6、bio
‑
mab7、bio
‑
mab8、bio
‑
mab9、bio
‑
mab10和bio
‑
mab11进行配对,以快速筛选夹心elisa中捕获和标记的单克隆抗体对。
89.通过比较检测的灵敏度,显示以单克隆抗体mab7或mab11作为捕获抗体,分别与bio
‑
mab6、bio
‑
mab8、bio
‑
mab9和bio
‑
mab10配对时,都可产生较强的信号。
90.实施例3 抗n蛋白单克隆抗体功能鉴定3.1单克隆抗体亲和常数测定采用生物薄膜干涉技术(bli)对纯化的鼠单克隆抗体mab6、mab7、mab8、mab9与新型冠状病毒n蛋白的结合亲和力常数进行测定。使用pall公司fortebio octet red&qk平台进行测定,方法参照平台使用说明书。
91.首先将生物素化的sars
‑
cov
‑
2 n蛋白固定在sa传感器表面,用上述抗sars
‑
cov
‑
2 n蛋白的单抗作为分析物。处理数据,并用分析软件1:1结合的模型进行拟合,拟合数据与实验数据基本重叠,得到结合和解离速率常数k
a
和k
d
,用k
d
除k
a
得到平衡解离常数k
d
(见表1)。
92.结果显示,鼠单抗mab7亲和力最高,而mab6、mab8和mab9的亲和力相当,k
d
值均低于pm级。
93.表1抗体名称k
d
(m)k
a
(1/ms)k
d
(1/s)mab63.86e
‑
122.133+058.24+07mab7<1.0e
‑
122.174e+05<1.0e
‑
07mab87.797e
‑
112.117e+051.65e
‑
05mab91.017e
‑
112.450e+052.492e
‑
063.2单克隆抗体与sars、mers病毒的交叉反应性本实施例中还检测了上述抗sars
‑
cov
‑
2单克隆抗体mab6、mab7、mab8、mab9、mab10和mab11对于人sars和mers冠状病毒核衣壳蛋白的交叉反应性。
94.用pbs缓冲液将sars病毒n蛋白(北京义翘神州生物技术有限公司,货号40143
‑
v08b)或mers病毒n蛋白(北京义翘神州生物技术有限公司,货号40068
‑
v08b),稀释至0.1 μg/ml,以100 μl/孔的体积加于96孔板中,4℃放置20 h。将96孔板中pbs缓冲液吸掉,pbst (ph 7.4,pbs含0.05% 吐温20) 缓冲液洗板1次后,加入200 μl/孔pbst/1%脱脂奶粉,室温孵育1 h封闭。
95.移去封闭液,pbst缓冲液洗板3次后,将初始浓度为10 μg/ml的单克隆抗体按1:4比例稀释成梯度浓度后加入微孔板,100 μl/孔,室温孵育1.5 h。移去反应体系,pbst洗板3次后,50 μl/孔加入1:5000稀释的hrp标记的羊抗鼠igg fc的二抗(jackson laboratory inc,货号115
‑
035
‑
07),室温孵育1小时。pbst洗板3次后,加入100 μl/孔tmb,室温孵育后加入50 μl/孔0.2 m 硫酸终止反应;酶标仪在双波长450/620 nm处读取吸收值。
96.如图2所示,上述6种单抗中均能够特异性结合sars病毒n蛋白抗原。另外,6种单抗都不能特异性结合mers病毒n蛋白(见图3)。
97.实施例4 用抗sars
‑
cov
‑
2 n蛋白单克隆抗体检测sars
‑
cov
‑
2抗原的双抗体夹心elisa法试剂盒建立用本发明提供的抗体mab7和生物素标记的本发明单克隆抗体bio
‑
mab8为例,建立sars
‑
cov
‑
2病毒的双抗夹心elisa免疫测定方法。
98.洗涤液为pbs
‑
tween20,ph7.4(pbst);封闭液为含1.5%牛血清白蛋白(bsa)的pbst;标准品、待测样品稀释液为含1.5% bsa的pbst;生物素标记抗体稀释液为含1.5% bsa的pbst;streptavidin
‑
hrp(thermo scientific,lot:21130)用含1.5% bsa的pbst按其配套的说明书方法配制成工作溶液。
99.检测方法如下:(1)将抗体mab7用1
×
pbs稀释至终浓度为5 μg/ml,每孔100 μl包被聚苯乙烯微量反应板,室温震荡1小时,500 rpm,用洗涤液洗涤,拍干;(2)加封闭液,200
ꢀµ
l/孔,室温静置1小时。
100.(3)将sars
‑
cov
‑
2 n蛋白标准品稀释不同浓度作为标准曲线(取标准品用1.5% bsa的pbst溶液稀释为下列浓度:400 pg/ml、200 pg/ml、100 pg/ml、50 pg/ml、25 pg/ml、12.5 pg/ml),每孔100 μl加入反应板;将待测样品稀释100倍后也加入不同的孔中,以1.5% bsa
‑
pbs溶液阴性对照,室温静置1小时,洗涤液洗涤3遍,拍干。
101.(4)各孔加生物素标记二抗bio
‑
mab8(以1.5% bsa
‑
pbs溶液按1:5000比例稀释)100
ꢀµ
l,室温静置1小时,洗涤液洗涤3遍,拍干。
102.(5)加入配制好的streptavidin
‑
hrp溶液,每孔100
ꢀµ
l,室温静置1小时。
103.(6)洗涤液洗涤3遍,拍干,然后加配制好的tmb,100
ꢀµ
l/孔,室温显色20~30分钟。
104.(7)加0.2 m h2so4终止,50
ꢀµ
l/孔。
105.(8)酶标仪在双波长450/620 nm处读取吸收值,根据测得样品的od值与标准品浓度绘制标准曲线,得出直线回归方程。代入受检样品的od值即可得到样品中sars
‑
cov
‑
2 n蛋白的含量。
106.实施例5 elisa方法及其试剂盒的性能我们对由上述实施例2中筛选到的最佳配对的3组抗体,mab7/bio
‑
mab6、mab7/bio
‑
mab8、mab7/bio
‑
mab9,建立的测定sars
‑
cov
‑
2病毒含量的双抗体夹心elisa方法及试剂盒进行性能评价。
107.5.1检测范围从图4
‑
图6中可见,其中图4为mab7/bio
‑
mab6、图5为mab7/bio
‑
mab8图6为mab7/bio
‑
mab9,随sars
‑
cov
‑
2 n蛋白(np)浓度增加,od值也增加,当检测np浓度范围在1
‑
400 ng/ml时,用建立的夹心法所测od值与np的浓度呈线性正相关(r2≥0.988)。上述筛选到的最佳配对的三组抗体的检出下限都低至12.5 pg/ml。
108.5.2特异性测定上述筛选到的三个抗体对所组成的elisa试剂盒与几种其它血清物质的反应,观察反应特异性。包被捕获抗体4 μg/ml,人血清白蛋白和牛血清白蛋白100 ng/ml,1:100稀释的sars
‑
cov
‑
2 n蛋白阴性血清样本(np阴性血清) 5份,np阳性对照纯品100 ng/ml,生物素标记抗体(1:5000稀释),显色后,判定结果,见表2。
109.表2
样品人白蛋白牛白蛋白np阴性血清(5份)阳性对照(np纯品)mab7/bio
‑
mab6
‑‑‑ꢀ‑ꢀ‑ꢀ‑ꢀ‑
+mab7/bio
‑
mab8
‑‑‑ꢀ‑ꢀ‑ꢀ‑ꢀ‑
+mab7/bio
‑
mab9
‑‑‑ꢀ‑ꢀ‑ꢀ‑ꢀ‑
+备注:“+”表示样品检测结果为阳性,
“‑”
表示样品检测结果为阴性。
110.5.3灵敏度根据前述建立的实验方法,进行参考品/标准品的检测。检出低限为12.5 pg/ml,其条件满足od值>空白对照od值的3倍sd,且od值>2倍空白对照od值。说明本发明的方法有很好的灵敏度。
111.5.4重复性对一个样本重复检测,共测定4次,同次同一板内8个结果的cv值均小于4%,不同次不同人操作4个结果平均值的cv值为1.63%,可见按照本发明方法的试剂盒测定新型冠状病毒n蛋白重复性较好。
112.上述双抗体夹心酶联免疫法可用于检测人或动物的血清或血浆样品中的sars
‑
cov
‑
2 n蛋白抗原,用于sars
‑
cov
‑
2感染的早期诊断,达到早期发现、早期隔离,避免传播的目的。用本发明的抗体标记荧光后采用免疫荧光方法检测被sars
‑
cov
‑
2感染的生物样品和/或环境样品中的病毒抗原,同样也可用于鉴定新型冠状病毒的存在情况。
113.申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1