一种1,2,4-三嗪-3,5-二酮类化合物的盐型、晶型及其制备方法与流程
1.本发明涉及一种1,2,4-三嗪-3,5-二酮类化合物的盐型、晶型及其制备方法。
背景技术:
2.甲状腺激素在机体正常生长和发育以及维持代谢平衡中起到关键作用(physiological reviews 2001,81(3),1097-1126.)。甲状腺激素由甲状腺产生且以t4和t3两种不同形式分泌到循环系统(下丘脑/垂体/甲状腺系统)中,其中t4是甲状腺分泌的主要形式,而t3是生理上更活跃的形式。t4通过组织特异性脱碘酶被转化为t3,组织特异性脱碘酶存在于所有组织中,但主要存在于肝肾组织。
3.甲状腺激素的生理活性主要由甲状腺激素受体(thr)介导(endocrine reviews 1993,14,348-399.)。thr属于核受体超家族,它与担当配体-诱导的转录因子的类维生素a受体形成杂二聚体。thr具有配体结合结构域,dna结合结构域和氨基末端结构域,并通过与dna响应要素以及与各种核共-活化剂和共-阻遏剂的相互作用而调节基因表达。thr由位于人类染色体17和3上的不同基因表达α和β编码而来,通过对初级转录物进行选择性剪切后产生不同的蛋白亚型,每个基因产生两个亚型,即thrα1、thrα2、thrβ1、thrβ2。thrβ1和thrβ2由启动子差异表达得到,这两个亚型仅在氨基末端存在差异。thrα1和thrα2由前体mrna的差异剪接而来,主要在羧基末端存在差异。thrα1、thrβ1和thrβ2可以结合甲状腺激素。研究表明,甲状腺激素受体亚型在特殊生理响应的贡献方面可以不同。thrβ1在肝脏中的调节促甲状腺激素和甲状腺激素方面起重要作用,thrβ2在调节甲状腺刺激激素方面起主要作用。研究表明,thr的两种亚型α和β在肝脏中并存,其中与脂代谢有关的thrβ占70-80%,在心脏中,thrα与心跳增加和心输出量增加有关(endocrinology 2001,142,544;j.biol.chem.1992,267,11794.)。
4.甲状腺激素在靶器官中新陈代谢并主要在胆汁中排泄,其在哺乳动物中的生理作用主要表现在生长和分化以及维持生命机能方面,如心率、血液中的胆固醇和甘油三酯浓度、以及全身代谢速度和体重等的控制和调节。从病理生理学角度,在甲状腺机能亢进症如graves病中观察到心动过速、心律不齐、心脏衰竭,以及疲劳感、呼吸急促、骨骼肌减少和骨质酥松症等(physiol.rev.2001,81,1097;j.steroid.biochem.mol.biol.2001,76,31.)。
5.甲状腺激素本身的治疗用途受到与甲状腺机能亢进、特别是心血管毒性有关的不利副作用的限制。一种甲状腺激素类似物,如果可以避免甲状腺机能亢进和甲状腺功能减退的不良效果,同时保持甲状腺激素的有益效果,则可能应用于响应疾病的治疗,如代谢类疾病包括肥胖、高血脂症、高胆固醇血症、糖尿病和其它病症如肝脏脂肪变性和非酒精性脂肪性肝炎(nash)、动脉粥样硬化、心血管疾病、甲状腺功能减退、甲状腺癌、甲状腺疾病等。
6.与本发明化合物结构不同的甲状腺激素类似物wo2007009913公开了一种哒嗪酮衍生物,尤其是其中的实施例8(化合物31,即mgl-3196),作为具有thrβ选择性和肝脏组织选择性的甲状腺激素类似物,取得了良好的效果,可能用于治疗多种疾病,但mgl-3196仍存
在活性不足,体内代谢快等问题。
[0007][0008]
根据本发明提供的一种如式i所示哒嗪酮化合物作为甲状腺激素抑制剂,即2-(3,5-二氯-4-((5-异丙基-6-氧基-1,6-二氢吡啶-3-基)氧基)苯基)-(氟甲基)-1,2,4-三嗪-3,5(2h,4h)-二酮,进一步提供该化合物的盐型、晶型及其制备方法。但是式i化合物游离碱溶解度较差、游离碱的结晶度较差,为成药性带来巨大的挑战。例如,结晶度差导致制剂处方工艺中流动性差难以制剂成型或者化学稳定性差等,溶解度低导致药物的生物利用度降低。作为公知的是作为活性化合物可通过结晶形成可药用稳定、流动性佳的晶型化合物,或者选择其适当盐的形式得以改善。然而为具体活性物质能否呈现稳定的晶态,选择适当的盐并不总是简单易行,因为不同的化合物与相同的成盐剂形成的盐的性质有很大不同。因此本发明目的提供式i化合物晶型及盐的形式,满足上述溶解度、处理性和稳定性的要求;进一步令人惊讶的发现,该化合物部分形成的加成盐与游离的式i化合物相比具有更好的小鼠体内药代动力学性质。
[0009]
技术实现要素:
[0010]
本发明一方面提供式(i)化合物的晶型a,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:12.30
±
0.20、14.02
±
0.20、24.66
±
0.20、25.22
±
0.20、28.58
±
0.20,
[0011][0012]
在本发明的一些方案中,上述式(i)化合物晶型a的x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:12.30
±
0.20、14.02
±
0.20、17.02
±
0.20、20.18
±
0.20、23.52
±
0.20、24.66
±
0.20、25.22
±
0.20、25.86
±
0.20、28.30
±
0.20、28.58
±
0.20。
[0013]
在本发明的一些方案中,上述式(i)化合物晶型a的x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:12.30
±
0.20、14.02
±
0.20、17.02
±
0.20、18.86
±
0.20、20.18
±
0.20、22.36
±
0.20、23.52
±
0.20、23.72
±
0.20、24.66
±
0.20、25.22
±
0.20、25.86
±
0.20、
28.30
±
0.20、28.58
±
0.20、29.74
±
0.20、32.86
±
0.20。本发明中x射线粉末衍射图谱所表述的2θ角由于设备检测存在误差等原因,通常采用
±
0.20表示偏差,进一步采用
±
0.10表示偏差,更进一步采用
±
0.05表示偏差,更进一步采用
±
0.02表示偏差,以上表述方式均代表本发明所要表述的x射线粉末衍射图谱2θ角具体数字,不改变本发明的本意,以下x射线粉末衍射图谱2θ角描述均以此意。
[0014]
在本发明的一些方案中,上述式(i)化合物晶型a,具有与图1本质上相同的xrpd图谱。
[0015]
本发明的一些方案中,上述式(i)化合物晶型a的xrpd图谱解析数据如表1所示:
[0016]
表1.a晶型的xrpd图谱解析数据
[0017][0018][0019]
在本发明的一些方案中,上述式(i)化合物晶型a,其差示扫描量热曲线在308.85℃处有一个最大吸热峰的峰值;在本发明的一些方案中,上述式(i)化合物晶型a的dsc图谱如图2所示。
[0020]
在本发明的一些方案中,上述式(i)化合物晶型a,其热重分析曲线在120℃时失重达0.0494%,在250℃时失重为0.5069%。在本发明的一些方案中,上述式(i)化合物晶型a的tga图谱如图3所示。
[0021]
在本发明的一些方案中,上述晶型a的制备方法:称取式(i)化合物至反应瓶中,加入适量的冰醋酸,加热至澄清状态;然后缓慢降温至室温,有大量白色固体析出;该固体放置于反应瓶中,加入适量无水乙醇,加热至得到一个悬浊液;缓慢冷却至室温,固体分离后得到式(i)化合物晶型a。
[0022]
本发明另一方面还提供了式(i)化合物的药学可接受的盐,所述药学可接受的盐选自:钠盐、钾盐、l-精氨酸盐、胆碱盐、葡甲胺盐、二乙胺盐和l-赖氨酸盐,优选钠盐、胆碱盐和l-赖氨酸盐,更优选钠盐和胆碱盐。
[0023]
本发明进一步提供式(i)化合物的钠盐如式(ii)所示,式(i)化合物对该盐的阳离子或阴离子的摩尔比例为1:1,
[0024][0025]
本发明提供式(i)化合物的钠盐式(ii)在其中一个实施例中的晶型,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:10.48
±
0.20、19.14
±
0.20、22.30
±
0.20、23.60
±
0.20、26.92
±
0.20;进一步本发明式(i)化合物的钠盐式(ii)其中一个实施例中提供的晶型,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰10.48
±
0.20、11.28
±
0.20、17.26
±
0.20、19.14
±
0.20、22.30
±
0.20、23.60
±
0.20、25.26
±
0.20、26.92
±
0.20、28.28
±
0.20、28.66
±
0.20。
[0026]
在本发明的一些方案中,上述式(i)化合物的钠盐式(ii)的晶型,其x射线粉末衍射图谱,与图4本质上相同的xrpd图谱。
[0027]
本发明的一些方案中,上述式(i)化合物的钠盐式(ii)的晶型xrpd图谱解析数据如表2所示:
[0028]
表2.式(i)化合物的钠盐式(ii)的晶型的xrpd图谱解析数据
[0029][0030]
在本发明的一些方案中,上述式(i)化合物的钠盐式(ii)的晶型,其差示扫描量热曲线在326.25℃处有一个最大放热峰的峰值。在本发明的一些方案中,上述式(i)化合物的钠盐式(ii)晶型的dsc图谱如图5所示。
[0031]
在本发明的一些方案中,上述式(i)化合物的钠盐式(ii)的晶型,其热重分析曲线在120℃时失重达0.6243%。在本发明的一些方案中,上述晶型的tga图谱如图6所示。
[0032]
在本发明的一些方案中,上述式(i)化合物的钠盐式(ii)制备方法:将式(i)化合物至反应瓶中,加入有机溶剂中,室温下搅拌成混悬状态。然后将na的碱盐水溶液按摩尔比1:1-1.5缓慢滴加到反应液中,在室温下磁力搅拌,析出固体收集固体,得到式(i)化合物的钠盐式(ii)。
[0033]
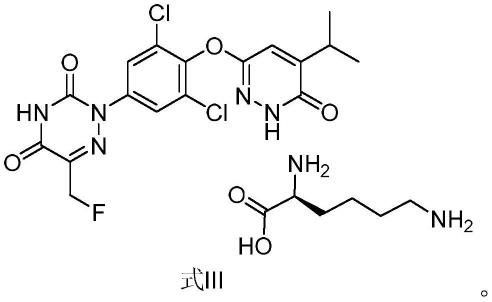
本发明进一步提供式(i)化合物的l-赖氨酸盐如式(iii)所示,式(i)化合物对该盐的阳离子或阴离子的摩尔比例为1:1,
[0034][0035]
本发明提供式(i)化合物的l-赖氨酸盐式(iii)其中一个实施例中的晶型,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:8.86
±
0.20、16.32
±
0.20、22.62
±
0.20、25.00
±
0.20、25.80
±
0.20;进一步本发明(i)化合物的l-赖氨酸盐式(iii)其中一个实施例中提供的晶型,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:6.71
±
0.20、8.86
±
0.20、10.98
±
0.20、13.82
±
0.20、16.32
±
0.20、18.92
±
0.20、20.72、22.62
±
0.20、25.00
±
0.20、25.80
±
0.20。
[0036]
在本发明的一些方案中,上述式(i)化合物的l-赖氨酸盐式(iii)的晶型,其x射线粉末衍射图谱,与图7本质上相同的xrpd图谱。
[0037]
本发明的一些方案中,上述式(i)化合物的l-赖氨酸盐式(iii)晶型的xrpd图谱解析数据如表3所示:
[0038]
表3.式(i)化合物的l-赖氨酸盐式(iii)化合物晶型的xrpd图谱解析数据
[0039][0040][0041]
在本发明的一些方案中,上述式(i)化合物的l-赖氨酸盐式(iii)的晶型,其差示扫描量热曲线在244.18℃处有一个最大吸热峰的峰值,在252.63℃处有一个放热峰的峰值。在本发明的一些方案中,上述晶型的dsc图谱如图8所示。
[0042]
在本发明的一些方案中,上述式(i)化合物的l-赖氨酸盐式(iii)的晶型,其热重分析曲线在120℃时失重达0.5199%。在本发明的一些方案中,上述晶型的tga图谱如图9所示。
[0043]
在本发明的一些方案中,上述式(i)化合物的l-赖氨酸盐式(iii)制备方法:将式(i)化合物至反应瓶中,加入有机溶剂中,室温下搅拌成混悬状态。然后将l-赖氨酸(l-lysine)水溶液按摩尔比1:1-1.5缓慢滴加到反应液中,在室温下磁力搅拌,析出固体收集固体,得到式(i)化合物的l-赖氨酸盐式(iii)。
[0044]
本发明进一步提供式(i)化合物的胆碱盐如式(iv)所示,式(i)化合物对该盐的阳
离子或阴离子的比例可为1:1,
[0045][0046]
本发明提供式(i)化合物的胆碱盐式(iv)其中一个实施例中的晶型,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:15.46
±
0.20、19.02
±
0.20、19.60
±
0.20、21.68
±
0.20、23.64
±
0.20;进一步本发明式(i)化合物的的胆碱盐式(iv)其中一个实施例中提供的晶型,其x射线粉末衍射图谱在下列2θ角处具有特征衍射峰:7.78
±
0.20、15.46
±
0.20
±
0.20、18.00
±
0.20、19.02
±
0.20、19.60
±
0.20、21.68
±
0.20、23.64
±
0.20、24.02
±
0.20、25.76
±
0.20、29.16
±
0.20。
[0047]
在本发明的一些方案中,上述式(i)化合物的胆碱盐式(iv)的晶型其x射线粉末衍射图谱,与图10本质上相同的xrpd图谱。
[0048]
本发明的一些方案中,上述式(i)化合物的胆碱盐式(iv)的晶型的xrpd图谱解析数据如表4所示:
[0049]
表4.式(i)化合物的胆碱盐式(iv)晶型的xrpd图谱解析数据
[0050][0051]
在本发明的一些方案中,上述式(i)化合物的胆碱盐式(iv)的晶型,其差示扫描量
热曲线在202.26℃处有一个最大吸热峰的峰值。在本发明的一些方案中,上述晶型的dsc图谱如图11所示。
[0052]
在本发明的一些方案中,上述式(i)化合物的胆碱盐式(iv)的晶型,其热重分析曲线在120℃时失重达0.0128%。在本发明的一些方案中,上述晶型的tga图谱如图12所示。
[0053]
在本发明的一些方案中,上述式(i)化合物的胆碱盐式(iv)制备方法:将式(i)化合物至反应瓶中,加入有机溶剂中,室温下搅拌成混悬状态。然后将胆碱(choline)水溶液按摩尔比1:1-1.5缓慢滴加到反应液中,在室温下磁力搅拌,析出固体收集固体,得到式(i)化合物的胆碱盐式(iv)。
[0054]
在一个实施方案中,本发明上述所提供的式(i)化合物的盐及其晶型在治疗和或药物制备中的用途,所述的用途是治疗与甲状腺激素受体相关的疾病。
[0055]
在一个实施方案中,本发明上述所提供的式(i)化合物的盐及其晶型的药物组合物。
[0056]
在一个实施方案中,本发明提供了治疗方法,该方法包括向需要上述所提供的式(i)化合物的盐及其晶型的患者给药有效量的上述所提供的式(i)化合物的盐及其晶型。
[0057]
本发明有益效果如下:已经令人惊讶的发现,游离碱晶型具有更好的稳定性、晶型稳定性,有助于制成药物相应的制剂剂型;该式(i)化合物的加成盐与游离碱相比具有更好的小鼠体内药代动力学性质,其中最优的为胆碱盐。
[0058]
定义和说明
[0059]
除非另有说明,本文所用的下列术语和短语旨在含有下列含义。一个特定的短语或术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文出现商品名时,旨在指代其对应的商品或其活性成分。
[0060]
本发明的中间体化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其他化学合成方法的结合所形成的实施方式以及本领域技术上人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
[0061]
本发明具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于本发明的化学变化及其所需的试剂和物料。为了获得本发明的化合物,有时需要本领域技术人员在已有实施方式的基础上对合成步骤或者反应流程进行修改或选择。
[0062]
下面会通过实施例具体描述本发明,这些实施例并不意味着对本发明的任何限制。
[0063]
本发明所使用的所有溶剂是市售的,无需进一步纯化即可使用。
[0064]
化合物依据本领域常规命名原则或者使用软件命名,市售化合物采用供应商目录名称,式(i)化合物游离碱描述均表示式(i)化合物本身未成任何阳离子或者阴离子的盐。
[0065]
实验试剂
[0066][0067][0068]
实验设备
[0069][0070]
试验仪器参数
[0071]
x-射线粉末衍射(xrpd)
[0072]
设备为shimadzu xrd-6000,按以下参数扫描样品:
[0073]
射线源为cu~kα靶
[0074]
光管的最小操作电压与电流分别为40kv和30ma,
[0075]
样品扫描范围的2-theta值从5
°
到50
°
或者(2
°
到50
°
)。扫描速度为5deg/min。
[0076]
热重分析(tga)
[0077]
称取大约5mg样品于坩埚中,氮气保护,从30℃升温至400℃,升温速率为20℃/min,400℃保持1min。
[0078]
差示扫描量热仪(dsc)
[0079]
称取大约1~5mg粉末样品放置在一个封闭的铝坩埚中,坩埚盖上扎一针孔。氮气保护,从30℃升温到350℃进行差示热量扫描,350℃保持1min。升温速率为20℃/min。
[0080]
偏光显微镜(plm)
[0081]
样品分散在介质中(硅油),使用10x目镜、10x物镜观察样品,用照相机计算机系统记录图像。
附图说明
[0082]
图1为式(i)化合物晶型a的cu-kα辐射的xrpd谱图;
[0083]
图2为式(i)化合物晶型a的dsc谱图;
[0084]
图3为式(i)化合物晶型a的tga谱图;
[0085]
图4为式(i)化合物的钠盐式(ii)晶型的cu-kα辐射的xrpd谱图;
[0086]
图5为式(i)化合物的钠盐式(ii)晶型的dsc谱图;
[0087]
图6为式(i)化合物的钠盐式(ii)晶型的tga谱图;
[0088]
图7为式(i)化合物的l-赖氨酸盐式(iii)晶型的cu-kα辐射的xrpd谱图;
[0089]
图8为式(i)化合物的l-赖氨酸盐式(iii)晶型的dsc谱图;
[0090]
图9为式(i)化合物的l-赖氨酸盐式(iii)晶型的tga谱图;
[0091]
图10为式(i)化合物的胆碱盐式(iv)晶型的cu-kα辐射的xrpd谱图;
[0092]
图11为式(i)化合物的胆碱盐式(iv)晶型的dsc谱图;
[0093]
图12为式(i)化合物的胆碱盐式(iv)晶型的tga谱图;
[0094]
图13为式(i)化合物的l-赖氨酸盐式(iii)的h-nmr结果。
具体实施方式
[0095]
下面结合说明书附图对本发明实施例作进一步详细描述,但具体的实施方式并不是对本发明的内容所做的限制。
[0096]
实施例1
[0097]
2-(3,5-二氯-4-((5-异丙基-6-氧基-1,6-二氢吡啶-3-基)氧基)苯基)-(氟甲基)-1,2,4-三嗪-3,5(2h,4h)-二酮(式i)化合物的制备
[0098][0099]
第一步
[0100]
2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-羧酸1b
[0101]
将2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-氰1a(300mg,0.69mmol,合成方法见wo2014043706a1)溶于10ml冰醋酸中,加入浓盐酸(2ml),加热至120℃反应5小时。反应完毕后反应液冷却至室温,加入20ml水稀释搅拌并过滤,烘干后得到2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-羧酸1b(260mg,淡黄色固体),产率:84%。
[0102]1h nmr(400mhz,dmso-d6)δ12.71(s,1h),12.21(s,1h),7.82(s,2h),7.45(s,1h),3.21(m,1h),1.19(d,j=6.4hz,6h)。ms m/z(esi):453.8[m+1]
+
。
[0103]
第二步
[0104]
甲基2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-羧酸酯1c
[0105]
将2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-羧酸1b(200mg,0.44mmol)溶于20ml甲醇中,冰浴下缓慢加入氯化亚砜(2ml),将反应液加热至100℃反应5小时。反应完毕后,将反应液减压浓缩,残留固体用石油醚:乙酸乙酯(10:1)打浆过滤,烘干后得到甲基2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-羧酸酯1c(200mg,淡黄色固体),产率:97%。ms m/z(esi):466.2[m-1]-。
[0106]
第三步
[0107]
2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-(羟甲基)-1,2,4-三嗪-3,5(2h,4h)-二酮1d
[0108]
将甲基2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-3,5-二氧-2,3,4,5-四氢-1,2,4-三嗪-6-羧酸酯1c(200mg,0.43mmol)溶于20ml四氢呋喃中,室温下加入硼氢化钠(82mg,2.15mmol),然后缓慢滴加甲醇。反应完毕后,加入20ml水并用3m稀盐酸调到ph=6,用乙酸乙酯(30ml
×
3)萃取,合并有机相,用饱和氯化钠溶液(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩,残留物用硅胶柱层析法(洗脱剂:石油醚:乙酸乙酯=5:1~0:1)纯化,得到2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-(羟甲基)-1,2,4三嗪-3,5(2h,4h)-二酮1d(150mg,白色固体),产率:79%。
[0109]1h nmr(400mhz,dmso-d6)δ12.49(s,1h),12.25(s,1h),7.86(s,2h),7.45(s,1h),5.33(t,j=6.4hz,1h),4.40(d,j=6.0hz,2h),3.21(m,1h),1.19(d,j=6.4hz,6h)。ms m/z(esi):438.2[m-1]-。
[0110]
第四步
[0111]
2-(3,5-二氯-4-((5-异丙基-6-氧基-1,6-二氢吡啶-3-基)氧基)苯基)-(氟甲基)-1,2,4-三嗪-3,5(2h,4h)-二酮(式i)化合物
[0112]
将甲基2-(3,5-二氯-4-((5-异丙基-6-氧-1,6-二氢哒嗪-3-基)氧基)苯基)-(羟甲基)-1,2,4-三嗪-3,5(2h,4h)-二酮1d(100mg,0.23mmol)溶于20ml二氯甲烷中,冰浴下加入dast(5滴),反应液在该温度反应30分钟。反应完毕后,将反应液加入20ml冰水中,用二氯甲烷(20ml
×
3)萃取,合并有机相,用饱和氯化钠溶液(100ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩,残留物用制备色谱纯化,得到2-(3,5-二氯-4-((5-异丙基-6-氧基-1,6-二氢吡啶-3-基)氧基)苯基)-(氟甲基)-1,2,4-三嗪-3,5(2h,4h)-二酮(式i)(45mg),产率:45%。1h nmr(400mhz,dmso-d6)δ12.48(s,1h),12.21(s,1h),7.81(s,2h),7.43(s,1h),5.29(d,j=48.0hz,1h),3.21(m,1h),1.19(d,j=6.4hz,6h)。
19
f nmr(400mhz,dmso-d6)δ-219.9ppm。ms m/z(esi):442.2[m+1]
+
。
[0113]
实施例2
[0114]
式(i)化合物晶型a的制备
[0115]
称使用实施例1中方法获得的7.0g的式(i)化合物游离碱至250ml烧瓶中,加入150ml的冰醋酸,加热至120℃至澄清状态。然后缓慢降温至室温,该过程持续约2h,有大量白色固体析出。固体分离后在50℃条件下减压真空干燥约2h,得到白色固体。该固体放置于250ml烧瓶中,加入50ml无水乙醇,加热至90℃保持1h,得到一个悬浊液。缓慢冷却至室温,
固体分离后在50℃条件下减压真空干燥约2h,得到式(i)化合物晶型a。
[0116]
本实施例中其获得的晶型a的cu-kα辐射的xrpd谱图、dsc谱图、tga谱图分别如图1、2、3所示。
[0117]
实施例3
[0118]
式(i)化合物的钠盐式(ii)的制备
[0119]
称使用实施例1中方法获得的502.95mg的式(i)化合物至40ml小瓶中,加入8ml的异丙醇,室温下搅拌成混悬状态。然后将naoh水溶液(2n水溶液)按摩尔比1:1.05(600μl)缓慢滴加到反应液中,大致溶清,部分粘壁,约0.5h大量析出,最后将样品在室温下磁力搅拌过夜(约20h),采用离心法(12000rpm,离心5min)收集固体,50℃条件下减压真空干燥过夜约20h,得到式(i)化合物的钠盐式(ii)。
[0120]
该实施例式(i)化合物的钠盐式(ii)所获得晶型的cu-kα辐射的xrpd谱图、dsc谱图、tga谱图分别如图4、5、6所示。
[0121]
实施例4
[0122]
式(i)化合物的l-赖氨酸盐式(iii)的制备
[0123]
称使用实施例1中方法获得的509.65mg的式(i)化合物至40ml小瓶中,加入10ml的异丙醇,室温下搅拌成混悬状态。然后将l-赖氨酸(l-lysine)水溶液(2n in water)按摩尔比1:1.05(607μl)缓慢滴加到反应液中,呈乳状,最后将样品在室温下磁力搅拌过夜(约20h),采用离心法(12000rpm,离心5min)收集固体;50℃条件下减压真空干燥过夜约20h,得到式(i)化合物的l-赖氨酸盐式(iii)。
[0124]
该实施例式(i)化合物的l-赖氨酸盐式(iii)获得晶型的cu-kα辐射的xrpd谱图、dsc谱图、tga谱图分别如图7、8、9所示。
[0125]
实施例5
[0126]
式(i)化合物的胆碱盐式(iv)的制备
[0127]
称使用实施例1中方法获得的501.02mg的式(i)化合物至40ml小瓶中,加入10ml的异丙醇,室温下搅拌成混悬状态。然后将胆碱(choline)水溶液(48%in water)按摩尔比1:1.05(302μl)缓慢滴加到反应液中,澄清,最后将样品在室温下磁力搅拌过夜析出(约20h),采用离心法(12000rpm,离心5min)收集固体;50℃条件下减压真空干燥过夜约20h,得到式(iv)化合物晶型。
[0128]
该实施例式(i)化合物的胆碱盐获得晶型的cu-kα辐射的xrpd谱图、dsc谱图、tga谱图分别如图10、11、12所示。
[0129]
实施例6
[0130]
式(i)化合物的镁盐的制备
[0131]
称使用实施例1中方法获得的50.0mg的式(i)化合物至10ml小瓶中,加入2ml的丙酮,室温下搅拌成混悬状态。然后将氯化镁水溶液按摩尔比1:1.05缓慢滴加到反应液中,得到一个混悬液。该混悬液在室温下磁力搅拌过夜(约20h),采用离心法(12000rpm,离心5min)收集固体;50℃条件下减压真空干燥过夜约20h,得到固体。经xrpd谱图分析,没有形成相应理想的盐。
[0132]
实施例7
[0133]
式(i)化合物的钙盐的制备
[0134]
称使用实施例1中方法获得的50.0mg的式(i)化合物至10ml小瓶中,加入2ml的丙酮,室温下搅拌成混悬状态。然后将氯化钙水溶液按摩尔比1:1.05缓慢滴加到反应液中,得到一个混悬液。该混悬液在室温下磁力搅拌过夜(约20h),采用离心法(12000rpm,离心5min)收集固体;50℃条件下减压真空干燥过夜约20h,得到固体。经xrpd谱图分析,没有形成相应理想的盐。
[0135]
实施例8
[0136]
按照实施例2-7同样类似的方法,采用相应的阳离子或者阴离子盐完成制备l-精氨酸、葡甲胺、二乙胺盐的制备。
[0137]
实施例9 thrβ结合实验
[0138]
实验方法:化合物对thrβ的激动作用的活体外分析是采用时间分辨荧光共振能量转移共激活肽的招募实验进行的。该实验采用eu-anti-gst抗体,biotin-src2-2共激活肽,streptavidin-d2,rxrα和带gst标签的thrβ-lbd。eu-anti-gst抗体通过结合到gst标签来间接标记thrβ-lbd。streptavidin-d2通过结合到biotin标签来间接标记src2-2共激活肽。在rxrα存在时,thrβ-lbd可以与其形成异质二聚体thrβ-lbd/rxrα。激动剂与thrβ-lbd/rxrα结合并导致thrβ-lbd构象的变化,从而增加了异质二聚体对src2-2共激活肽的招募能力。同时,由此引起的d2-labeled src2-2共激活肽和eu-anti-gst抗体的距离减小,增加了thr-fret信号。根据不同浓度的化合物对thrβ活性的影响,可以评估化合物的激动能力。
[0139]
详细程序如下。
[0140]
用dmso制备100x参比化合物或化合物,并进行1:3等比稀释。
[0141]
用1x反应缓冲液将100x梯度稀释参比化合物或化合物稀释为4x,并加入实验板中。
[0142]
用1x反应缓冲液制备4x thrβ-lbd,4x rxrα的混合溶液,并加入实验板中。
[0143]
用1x反应缓冲液制备2x biotin-src2-2,2x eu-anti-gst,2xstreptavidin-d2的混合溶液,并加入实验板中。
[0144]
1000rpm离心1min并在室温及避光条件下孵育4小时。
[0145]
在envision 2104板读取器上读取665nm和615nm荧光信号值,并计算ratio
665nm/615nm
。
[0146]
实验结果:见表5
[0147]
表5:thrβ结合实验测试结果
[0148]
实施例编号ec50(nm)emax(%)式i化合物592.76*对照化合物10.697.3*对照化合物2204105.4*对照化合物3663125
[0149]
*对照化合物1为t3;对照化合物2为wo2007009913实施例8(化合物31);
[0150]
*对照化合物3为wo2020239076 al实施例4相应化合物。
[0151]
实施例10 thrα结合实验
[0152]
实验方法:化合物对thrα的激动作用的活体外分析采用实施例9种thrβ结合实验的类似方法,区别是用thrα代替thrβ。
[0153]
实验结果:见表6
[0154]
表6:thrα结合实验测试结果
[0155]
实施例编号ec50(nm)emax(%)式i化合物190106.6*对照化合物10.291.4*对照化合物22690111.4
[0156]
*对照化合物1为t3,对照化合物2为wo2007009913实施例8(化合物31)。
[0157]
实施例11
[0158]
体外肝微粒体稳定性实验
[0159]
实验方法:
[0160]
(一)溶液配制
[0161]
将受试物与阳性对照物维拉帕米分别用dmso溶解至10mm作为储备液,将上述10mm的储备液用70%乙腈水溶液稀释至0.25mm浓度。
[0162]
配制最终含有浓度分别为6.5mm nadp,16.5mm g-6-p,3u/ml g-6-pdh和3.3mm氯化镁的nadph再生系统。
[0163]
终止液为含有甲苯磺丁脲和普萘洛尔(均为内标)的乙腈溶液。
[0164]
磷酸盐缓冲液为100mm含3.3mm mgcl2的k3po4(ph=7.4)缓冲液。
[0165]
肝微粒体孵育体系在100mm磷酸盐缓冲液中,包含0.2mg/ml肝微粒体蛋白和1μm受试物/阳性对照
[0166]
(二)孵育过程
[0167]
从孵育体系中取80μl混合液,加入400μl终止液沉淀蛋白,涡旋后加入20μl nadph再生系统作为0min样品点。
[0168]
在剩余520μl蛋白药物混合液中加入nadph再生系统130μl,混匀,开始孵育。最终孵育体系为650μl,包含0.2mg/ml肝微粒体蛋白、1μm受试物/阳性对照、1.3mm nadp,3.3mm g-6-p,0.6u/ml g-6-pdh。
[0169]
.混合体系在37℃水浴中缓慢振摇孵育,分别在5,10,30,60min,各取100μl孵育液到每孔装有400μl终止液的新96孔板中,混匀,沉淀蛋白(4000
×
g,4℃条件下离心15分钟)。
[0170]
取上清液100μl,按照1:2的比例用水稀释后用lc-ms/ms方法进行样品分析。
[0171]
实验结果:见表7.
[0172]
表7:体外肝微粒体稳定性实验结果
[0173][0174][0175]
实施例12
[0176]
药代动力学评价:
[0177]
以小鼠为受试动物,测试了小鼠灌胃给予式(i)-式(iv)化合物后不同时刻血浆中药物浓度。研究本发明化合物在小鼠体内药物代谢动力学行为,评价其药物代谢特征。每组实施例选用9只体重相近的健康成年雄性icr小鼠,口服给予剂量为15.0mg/kg(或等效为15.0mg/kg),单次给药,分别于给药前及给药1h,2h,4h,6h,8h,12h,24h,48h采集全血。建立lc/ms/ms法测定血浆样品中的原形药物浓度。采用winnonlin 6.3nca模型计算主要药动学参数,具体见下表8。
[0178]
实验方法:
[0179]
实验药品:上述实施例获得的式(i)化合物、式(i)化合物的钠盐式(ii)、式(i)化合物的l-赖氨酸盐式(iii)和式(i)化合物的胆碱盐式(iv)。
[0180]
实验动物:健康成年雄性icr小鼠9只,平均分成3组,每组3只,上海西普尔-必凯实验动物有限公司,动物合格证号:scxk(沪)2018-0006 2018 0006 010467。
[0181]
药物配置:分别精密称取一定量式(i)-式(iv)化合物,置于15ml样品管中,加入吐温80 5ul使润湿,再加入2%羟丙基纤维素(klucel lf)溶液4ml,超声并涡旋混匀,获得均匀的混悬液。临用前新鲜配制。
[0182]
给药:icr小鼠禁食过夜后灌胃给药,给药剂量为15.0mg/kg(或等效为15.0mg/kg)。
[0183]
操作:小鼠灌胃给药式(i)-式(iv)化合物,于给药前及给药后1h,2h,4h,6h,8h,12h,24h,48h采集全血,经肝素钠抗凝后于4℃离心5min分离血浆,于-80℃保存待测,给药后4小时进食。
[0184]
测定不同浓度药物灌胃给药后小鼠血浆中待测化合物的含量:分别取式(i)-式(iv)化合物给药后各时刻待测小鼠血浆12.5ul,两两混合,加入内标溶液100ul,甲醇125ul,涡旋混合2min,4℃ 13000rpm离心10min,取上清液用于lc-ms/ms分析。
[0185]
药代动力学参数结果见表8。
[0186]
表8:小鼠药物代谢数据
[0187][0188]
结论:本发明(式i)化合物的钠盐式(ii)、l-赖氨酸盐式(iii)和胆碱盐式(iv)化合物药代吸收良好,具有明显的药代动力学优势。同式(i)化合物相比,在同等剂量和制剂情况下,本发明的有些化合物出乎意料的显示了更高的cmax值和暴露量,以及更长的半衰期。所有以上pk结果表明,本发明提供的化合物有良好的pk性质可以作为代谢相关疾病的治疗药物。
[0189]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1