N-芳基磺胺-N-β-D-吡喃葡萄糖二酰胺类化合物及其用途
n
‑
芳基磺胺
‑
n
‑
β
‑
d
‑
吡喃葡萄糖二酰胺类化合物及其用途
技术领域
1.本发明属于医药技术领域,涉及具有n1‑
芳基磺胺
‑
n4‑
β
‑
d
‑
吡喃葡萄糖二酰胺类化合物的制备方法和医药用途。
背景技术:
2.碳酸酐酶(carbonic anhydrases,cas)是一类广泛存在于生物体内的含锌金属酶,其主要功能是催化生物体内co2的可逆水合反应,进而参与到一系列相关生理活动中。目前,人体内已发现cas有15种亚型,其中碳酸酐酶ix(ca ix)和xii(ca xii)在正常组织或细胞中几乎不表达,但是在多种实体瘤中高度表达,因ca ix和xii参与到肿瘤组织微环境酸化、肿瘤细胞侵袭和迁移,二者已被鉴定为是肿瘤相关蛋白(m.y.mboge,et al.top anti canc res,2015,5:3;a.nocentini,et al.expert opin ther pat,2018,28:729
‑
740)。将其作为抗肿瘤药物作用靶点,其抑制剂的研究已经发展成为一种备受关注的新型抗肿瘤策略。
3.ca ix和xii均为跨膜蛋白,其细胞膜外的催化域是二者发挥活性的关键区域,各亚型cas的催化域相似度较高,其结构特征均为一个约深的锥形空腔,在空腔底部有一个锌离子(zn
2+
)与三个组氨酸(his 94、his 96、his 119)及一个水分子/氢氧根离子组成四面体结构。cas各亚型高度的同源性及基本相同的生物功能为设计高选择性ca ix和xii抑制剂造成了极大的困扰(m.a.said,et al.eur j med chem,2020,185:111843)。
4.由于人体中各cas结构的高度相似性,基于蛋白结构设计、开发选择性ca ix或ca xii抑制剂极具难度。为解决这一问题,科学家提出“尾端修饰”的“非膜渗透性”理论,依据cas亚细胞定位不同,通过在药效团尾端进行结构改造修饰,达到靶向不同cas亚型的目的。通过这一理论方法已经取得多种单尾端、双尾端甚至三尾端活性高、选择性好的候选cas抑制活性化合物(m.a.abdelrahman,et al.eur j med chem,2021,209:112897;a.bonardi,et al.j med chem,2020,63:7422
‑
7444)。运用“非膜渗透理论”,合理提高化合物极性,降低其细胞膜透过性已经成为发展靶向胞外ca亚型抑制剂的重要手段。其较少影响细胞质亚型活性,有效减少药物脱靶产生副作用,提高抑制剂成药性的特点使其在cas抑制剂的研发中广泛使用、备受青睐。
技术实现要素:
5.本发明的目的在于设计与合成一类新型的具有n1‑
芳基磺胺
‑
n4‑
β
‑
d
‑
吡喃葡萄糖二酰胺化合物,进行具有治疗癌症效力的药物创制研究。
6.为完成本发明之目的,可采用如下技术方案:
7.一种n
‑
芳基磺胺
‑
n
‑
β
‑
d
‑
吡喃葡萄糖二酰胺类化合物,化合物如通式(i)所示
[0008][0009]
式中,
[0010]
其中:
[0011]
n为0
‑
5的整数,r为h、卤素、氰基、羟基、nh2、no2、c1
‑
c6的烷基、c1
‑
c6的烷氧基、c1
‑
c6的卤代烷基或苄基,m为0
‑
3的整数,linker为芳基或羧酸衍生物,zbg为芳基磺胺;
[0012]
或,通式(i)所示化合物及其光学活性体,非对映异构体和药学上可接受的盐。
[0013]
优选,所述通式(i)所示n1‑
芳基磺胺
‑
n4‑
β
‑
d
‑
吡喃葡萄糖二酰胺类化合物中,n为1
‑
4,r为h、卤素、cn、oh、nh2、苄基、ch3、c2h5、c3h7、och3、oc2h5、oc3h7、cf3或no2,m为1
‑
3的整数,linker为芳基、酰胺或酯基,zbg为芳基磺胺;或,通式(i)所示化合物及其光学活性体,非对映异构体和药学上可接受的盐。
[0014]
进一步优选,所述通式(i)中,n为2或3,r为h、卤素、cn、oh、nh2、bn、ch3、c2h5、c3h7、och3、oc2h5、oc3h7、cf3或no2,m为1或2,linker为1,2,3
‑
三氮唑、酯或酰胺,zbg为苯磺酰胺或噻唑磺胺;或,通式(i)所示化合物及其光学活性体,非对映异构体和药学上可接受的盐。
[0015]
在进一步优选,所述通式(i)中,n为2或3,r为h、f、cl、br、ch3、och3、2,6
‑
2f、2,6
‑
2cl、2,6
‑
2br或no2,linker为1,2,3
‑
三氮唑或酰胺,zbg为苯磺酰胺或噻唑磺胺;或,通式(i)所示化合物及其光学活性体,非对映异构体和药学上可接受的盐。
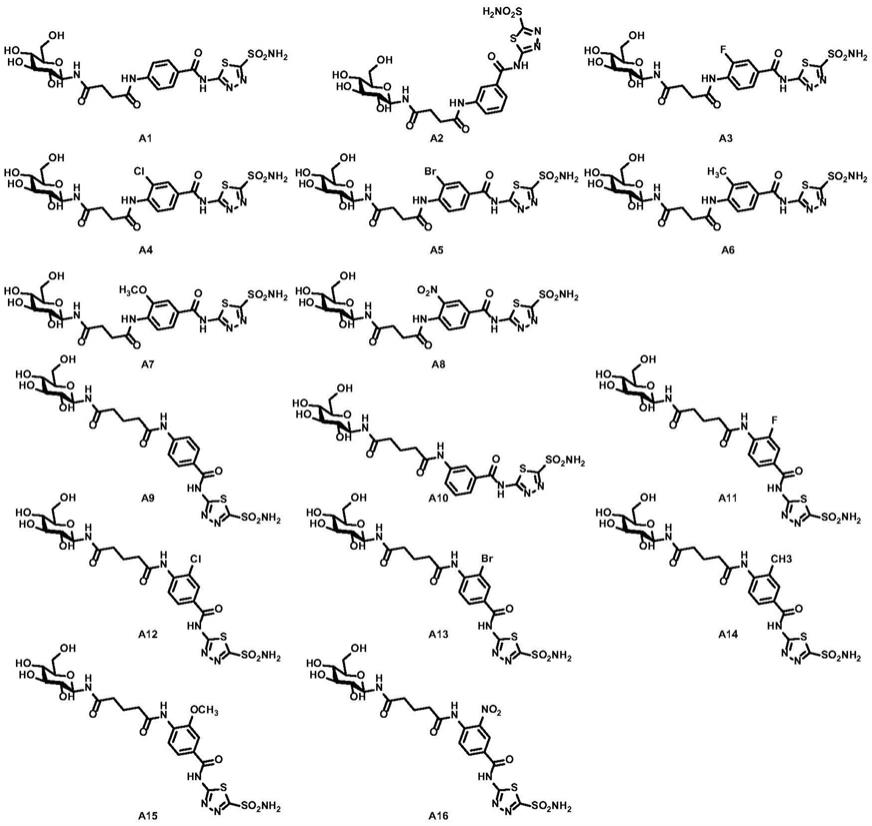
[0016]
更进一步优选,所述化合物为下述a1
‑
a16、b1
‑
b15中任意所示化合物
[0017]
[0018][0019]
一种n
‑
芳基磺胺
‑
n
‑
β
‑
d
‑
吡喃葡萄糖二酰胺类化合物的制备方法:
[0020]
将葡萄糖进行苯甲酰基保护得到全苯甲酰化葡萄糖,全苯甲酰化葡萄糖经端基溴代、端基叠氮取代得到端基叠氮取代苯甲酰化葡萄糖,叠氮取代苯甲酰基葡萄糖在碱性条件下与相应酸酐反应制备含有脂肪链的糖给体;
[0021]
当linker为羧酸衍生物时,将各种取代的氨基苯甲酸经fmoc保护后,在二氯亚砜作用下生成相应酰氯,与经由乙酰唑胺脱除乙酰基得到的5
‑
氨基
‑
1,3,4
‑
噻二唑
‑2‑
磺酰胺缩合得到相应噻二唑磺胺结构,噻二唑磺胺脱除fmoc保护得到后,与上述获得糖给体在edci存在下缩合,最后在碱性条件下脱除苯甲酰基保护得到linker为羧酸衍生物的通式(i)化合物;
[0022]
当linker为芳基时,
[0023]
将对氨基苯磺酰胺经重氮化得到叠氮苯磺酰胺,h各种取代的溴苯胺经乙酰化保护、sonogashira偶联反应、脱除保护得到乙炔基取代相应结构,炔基取代化合物与叠氮基苯磺酰胺在催化剂作用下经由click反应制备相应三氮唑磺胺结构,三氮唑磺胺结构脱除乙酰基保护后在edci作用下与上述获得糖给体缩合,最后在碱性条件下脱除保护得到linker为芳基的通式(i)化合物。
[0024]
一种化合物的应用,所述通式(i)化合物及其光学活性体,非对映异构体和药学上可接受的盐在制备抗肿瘤药物中的应用。
[0025]
一种抗肿瘤组合物,组合物活性成分和药用上可接受的载体;其中,活性成分含所述通式(i)化合物及其光学活性体,非对映异构体和药学上可接受的盐。
[0026]
本发明所具有的有限:
[0027]
本发明基于ca ix和xii的药效团特征和亚细胞定位,设计合成选择性ca ix和xii抑制剂,选用多羟基高极性葡萄糖为尾端,通过柔性脂肪链和刚性芳香结构引入靶向cas活性中心经典药效团芳基磺胺片段,整体结构可以选择性抑制胞外ca ix和xii催化活性,发挥抗肿瘤作用;同时在中间体的制备中采用“一锅法”由端基叠氮糖一次性完成叠氮基还原、开环反应完成重要糖给体片段的制备,在药理实验中所得化合物表现出一定肿瘤细胞株活力抑制活性,具有良好的应用前景。
具体实施方式
[0028]
联系如下实施例,将更好地理解本发明的化合物和它们的制备,这些实施例旨在阐述而不是限制本发明的范围。
[0029]
实施例1:n1‑
(4
‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a1)
[0030]
将葡萄糖(9.0g,50.0mmol)溶于50ml吡啶中,加入催化量dmap,冰浴下缓慢滴加苯甲酰氯(34.6ml,300.0mmol),滴加完毕后,撤去冰浴,室温反应5h后加入200ml水搅拌10min,用二氯甲烷萃取(3x100ml),有机层水洗(2x100ml),稀盐酸调ph至弱酸性,饱和碳酸氢钠溶液调ph至中性,无水硫酸钠干燥过夜。过滤,减压除去溶剂得中间体2。
[0031]
将上述粗品溶于适量二氯甲烷,冰浴下滴加25ml的hbr
‑
hoac溶液,滴加完毕,撤去冰浴,室温反应4h后加入50ml水搅拌10min,用二氯甲烷萃取(3x100ml),有机层水洗(2x100ml),饱和碳酸氢钠溶液调ph至中性,无水硫酸钠干燥过夜。柱层析(石油醚:乙酸乙酯=5:1(v/v))得22.0g中间体3,两步收率66.9%。
[0032]
称取中间体3(10.0g,15.2mmol)溶于适量n,n
‑
二甲基甲酰胺中,加入nan3(4.9g,76.0mmol),加热至50℃反应6h后,停止加热,冷却到室温,加入200ml水搅拌10min,用二氯甲烷萃取(2x100ml),饱和氯化钠溶液洗涤,无水硫酸钠干燥过夜。柱层析(石油醚:乙酸乙酯=6:1(v/v))得7.2g中间体4,收率76.3%。
[0033]
将中间体4(3.6g,5.8mmol)溶解于30ml二氯甲烷中,加入催化量dmap和钯碳后,冰浴下加入丁二酸酐(1.2g,11.6mmol),撤去冰浴,通入氢气室温反应8h,滤除钯碳,滤液以10ml稀盐酸洗涤,无水硫酸钠干燥过夜。柱层析(二氯甲烷:甲醇=50:1)得3.3g丁二酸酐中间体5,收率81.8%。
[0034]
将对氨基苯甲酸(1.0g,7.3mmol)和碳酸氢钠(0.9g,10.7mmol)溶于四氢呋喃和水1:1的混合溶液中(20ml),向其中缓慢滴加fmoccl(2.8g,10.8mmol)的四氢呋喃溶液,滴加完毕,50℃反应5h,冷却至室温,浓缩反应液,加入乙酸乙酯(80ml),分液得到有机层,饱和氯化钠溶液洗涤有机层,无水硫酸钠干燥过夜。过滤,减压除去溶剂得粗品中间体7。
[0035]
将上述粗品分布于20ml的socl2中,80℃回流反应5h,待反应液变澄清后,停止加热,静置冷却至室温,浓缩除去溶剂,得2.0g粗品中间体8。
[0036]
将乙酰唑胺(10.0g,45.0mmol)分布在150ml乙醇中,加入12ml浓盐酸后回流反应10h,待反应液变澄清后,冷却至室温,浓缩反应液,加入饱和碳酸氢钠溶解调节ph至中性,
抽滤,收集滤饼,得6.9g中间体10,收率85.2%。
[0037]
将中间体10(1.8g,10.0mmol)溶于丙酮中,加入吡啶(1.9ml,23.2mmol)后,冰浴下缓慢滴加中间体8的丙酮溶液,滴加完毕,室温反应过夜,抽滤,收集滤饼,得3.0g中间体11,收率57.6%。
[0038]
将中间体11(3.0g,5.8mmol)溶于15ml n,n
‑
二甲基甲酰胺中,加入10ml二乙胺(97.1mmol),室温反应3h,加入50ml水,用乙酸乙酯萃取(2x50ml),合并有机相,饱和氯化钠溶液洗涤有机相,无水硫酸钠干燥过夜。柱层析(二氯甲烷:甲醇=40:1)得0.8g中间体12,收率46.5%。
[0039]
将中间体5(0.5g,0.7mmol)、中间体12(0.3g,1.0mmol)和edci(0.2g,1.0mmol)溶于15ml吡啶中,60℃反应48h,冷却至室温,浓缩反应液,得到中间体13。
[0040]
将中间体13溶于丙酮中,冰浴下加入1n的甲醇钠的甲醇溶液0.5ml,室温反应2h。加入阳离子交换树脂调节ph至中性,过滤,浓缩滤液,柱层析(二氯甲烷:甲醇=9:1),得到白色固体40.0mg,两步收率10.2%。
[0041]1h nmr(600mhz,dmso
‑
d6)δ13.36(s,1h),10.39(s,1h),8.44(d,j=9.1hz,1h),8.35(s,2h),8.13(d,j=8.7hz,2h),7.78(d,j=8.7hz,2h),4.87(s,1h),4.71(t,j=9.1hz,1h),3.67
–
3.59(m,1h),3.41(dd,j=11.8,5.1hz,1h),3.35(s,1h),3.17(t,j=8.6hz,1h),3.11
–
3.01(m,3h),2.65
–
2.59(m,2h),2.56
–
2.51(m,2h).esi
‑
ms(m/z):559.0[m
‑
h]
‑
。
[0042]
实施例2:n1‑
(3
‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a2)
[0043]
实施例2的化合物制备方法同实施例1,只是使用了间氨基苯甲酸替代了对氨基苯甲酸,得白色固体45.1mg,收率11.5%。
[0044]1h nmr(600mhz,dmso
‑
d6)δ13.55(s,1h),10.24(s,1h),8.44(d,j=9.1hz,1h),8.35(d,j=18.7hz,3h),7.94
–
7.74(m,2h),7.49(t,j=7.9hz,1h),4.98(d,j=4.5hz,1h),4.87(dd,j=11.3,5.2hz,2h),4.71(t,j=9.1hz,1h),4.51(t,j=5.7hz,1h),3.63(dd,j=11.5,4.0hz,1h),3.48
–
3.37(m,1h),3.17(td,j=8.6,4.4hz,1h),3.12
–
2.99(m,3h),2.66
–
2.56(m,2h),2.50
–
2.44(m,2h).esi
‑
ms(m/z):559.3[m
‑
h]
‑
。
[0045]
实施例3:n1‑
(2
‑
氟
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a3)
[0046]
实施例3的化合物制备方法同实施例1,只是使用了3
‑
氟
‑
4氨基苯甲酸替代了对氨基苯甲酸,得白色固体26.1mg,收率6.4%。
[0047]1h nmr(600mhz,dmso
‑
d6)δ9.95(s,1h),8.43(d,j=9.1hz,1h),8.12(t,j=7.9hz,1h),7.99
–
7.88(m,4h),4.97(s,1h),4.86(dd,j=9.3,5.2hz,3h),4.75
–
4.65(m,2h),4.51(t,j=6.0hz,2h),3.63(dd,j=10.3,5.0hz,2h),3.45
–
3.38(m,2h),3.21
–
3.13(m,2h),3.11
–
2.99(m,5h),2.72
–
2.62(m,2h),2.46
–
2.32(m,2h).esi
‑
ms(m/z):577.2[m
‑
h]
‑
。
[0048]
实施例4:n1‑
(2
‑
氯
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a4)
[0049]
实施例4的化合物制备方法同实施例1,只是使用了3
‑
氯
‑
4氨基苯甲酸替代了对氨基苯甲酸,得白色固体35.4mg,收率8.5%。
[0050]1h nmr(600mhz,dmso
‑
d6)δ13.26(s,1h),8.42(d,j=9.0hz,1h),8.14(d,j=2.0hz,1h),7.88(dd,j=8.6,2.0hz,1h),6.87(d,j=8.6hz,1h),6.43(s,2h),4.65(t,j=9.0hz,1h),3.60(d,j=11.3hz,1h),3.40(dd,j=11.8,4.5hz,1h),3.25
–
3.10(m,1h),3.03(dd,j=16.3,7.9hz,3h),2.61
–
2.53(m,2h),2.44
–
2.27(m,2h).esi
‑
ms(m/z):593.3[m
‑
h]
‑
。
[0051]
实施例5:n1‑
(2
‑
溴
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a5)
[0052]
实施例5的化合物制备方法同实施例1,只是使用了3
‑
溴
‑
4氨基苯甲酸替代了对氨基苯甲酸,得白色固体22.3mg,收率5.0%。
[0053]1h nmr(600mhz,dmso
‑
d6)δ13.25(s,1h),8.39(d,j=9.1hz,1h),8.29(d,j=2.0hz,1h),7.90(dd,j=8.6,2.0hz,1h),6.85(d,j=8.6hz,1h),6.37(s,2h),4.66(t,j=9.1hz,1h),3.61(d,j=10.5hz,1h),3.39(dd,j=11.8,4.9hz,2h),3.15(dd,j=15.2,6.6hz,1h),3.10
–
2.95(m,3h),2.56
–
2.51(m,2h),2.35(td,j=16.8,9.6hz,2h).esi
‑
ms(m/z):637.5[m
‑
h]
‑
。
[0054]
实施例6:n1‑
(2
‑
甲基
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a6)
[0055]
实施例6的化合物制备方法同实施例1,只是使用了3
‑
甲基
‑
4氨基苯甲酸替代了对氨基苯甲酸,得白色固体33.5mg,收率8.3%。
[0056]1h
‑
nmr(600mhz,dmso
‑
d6)δ13.36(s,1h),9.50(s,1h),8.45(d,j=9.0hz,1h),8.36(s,1h),8.04(s,1h),7.91(dd,j=83.8,8.5hz,2h),4.72(t,j=9.0hz,1h),3.64(d,j=11.0hz,1h),3.42(dd,j=11.7,5.1hz,1h),3.22
–
3.15(m,3h),3.12
–
3.02(m,4h),2.75(dd,j=11.7,4.4hz,2h),2.68
–
2.61(m,2h),2.33(s,3h).esi
‑
ms(m/z):573.1[m
‑
h]
‑
。
[0057]
实施例7:n1‑
(2
‑
甲氧基
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a7)
[0058]
实施例7的化合物制备方法同实施例1,只是使用了3
‑
甲氧基
‑
4氨基苯甲酸替代了对氨基苯甲酸,得白色固体40.5mg,收率9.8%。
[0059]1h nmr(600mhz,dmso
‑
d6)δ13.43(s,1h),9.48(s,1h),8.42(d,j=9.1hz,1h),8.36(s,2h),8.30(d,j=8.3hz,1h),7.85(s,1h),7.78(d,j=9.9hz,1h),4.85(s,1h),4.71(t,j=9.1hz,1h),3.97(s,3h),3.63(d,j=10.5hz,1h),3.60(s,1h),3.41(dd,j=11.8,5.1hz,2h),3.17(t,j=8.7hz,1h),3.12
–
3.01(m,3h),2.77(t,j=6.6hz,1h),2.75
–
2.64(m,2h),2.49
–
2.41(m,2h).esi
‑
ms(m/z):589.0[m
‑
h]
‑
。
[0060]
实施例8:n1‑
(2
‑
硝基
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(a8)
[0061]
实施例8的化合物制备方法同实施例1,只是使用了3
‑
硝基
‑
4氨基苯甲酸替代了对氨基苯甲酸,得白色固体30.2mg,收率7.1%。
[0062]1h nmr(600mhz,dmso
‑
d6)δ13.64(s,1h),9.00(d,j=2.1hz,1h),8.41(d,j=9.0hz,1h),8.09(dd,j=8.9,2.2hz,3h),7.13(d,j=9.0hz,1h),4.65(t,j=9.0hz,1h),3.60(d,j=10.5hz,2h),3.39(dd,j=11.8,4.7hz,2h),3.21
–
3.11(m,1h),3.11
–
2.97(m,3h),2.58
–
2.51(m,3h),2.43
–
2.28(m,2h).esi
‑
ms(m/z):604.1[m
‑
h]
‑
。
[0063]
实施例9:n1‑
(4
‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a9)
[0064]
实施例9的化合物制备方法同实施例1,只是使用了戊二酸酐替代了丁二酸酐,得白色固体46.7mg,收率11.6%。
[0065]1h nmr(600mhz,dmso
‑
d6)δ10.05(s,1h),8.35(d,j=9.1hz,1h),8.24(s,1h),8.07(d,j=8.7hz,2h),7.74(s,2h),7.64(d,j=8.6hz,2h),4.72(t,j=9.1hz,1h),3.64(dd,j=11.7,1.8hz,1h),3.41(dd,j=11.8,5.4hz,1h),3.17(t,j=8.8hz,1h),3.12
–
2.99(m,3h),2.36(dd,j=13.9,6.6hz,2h),2.18(ddq,j=22.5,15.0,7.5hz,2h),1.93
–
1.72(m,2h).esi
‑
ms(m/z):573.5[m
‑
h]
‑
。
[0066]
实施例10:n1‑
(3
‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a10)
[0067]
实施例10的化合物制备方法同实施例9,只是使用了间氨基苯甲酸替代了对氨基苯甲酸,得白色固体40.3mg,收率10.0%。
[0068]1h nmr(600mhz,dmso
‑
d6)δ13.48(s,1h),10.12(s,1h),8.35(d,j=2.0hz,2h),8.19(s,2h),7.83(d,j=7.9hz,2h),7.45(t,j=7.9hz,1h),4.96(d,j=4.1hz,1h),4.91
–
4.81(m,2h),4.72(t,j=9.1hz,1h),4.49(t,j=5.1hz,1h),3.64(dd,j=11.0,3.9hz,1h),3.44
–
3.38(m,1h),3.17(td,j=8.7,3.5hz,1h),3.11
–
3.01(m,3h),2.37(t,j=7.4hz,2h),2.27
–
2.07(m,2h),1.88
–
1.78(m,2h).esi
‑
ms(m/z):573.0[m
‑
h]
‑
。
[0069]
实施例11:n1‑
(2
‑
氟
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a11)
[0070]
实施例11的化合物制备方法同实施例9,只是使用了3
‑
氟
‑4‑
氨基苯甲酸替代了对氨基苯甲酸,得白色固体40.1mg,收率9.7%。
[0071]1h nmr(600mhz,dmso
‑
d6)δ9.77(s,1h),8.36(d,j=9.1hz,1h),8.25(s,1h),8.05
–
7.97(m,1h),7.92(d,j=8.4hz,1h),7.86(d,j=12.1hz,1h),7.70(s,2h),4.71(dt,j=13.4,9.1hz,2h),3.63(d,j=14.1hz,2h),3.44
–
3.37(m,2h),3.22
–
3.13(m,2h),3.12
–
3.00(m,4h),2.44(t,j=7.1hz,2h),2.24
–
2.16(m,2h),1.82(dt,j=14.7,7.3hz,2h).esi
‑
ms(m/z):591.3[m
‑
h]
‑
。
[0072]
实施例12:n1‑
(2
‑
氯
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a12)
[0073]
实施例12的化合物制备方法同实施例9,只是使用了3
‑
氯
‑4‑
氨基苯甲酸替代了对氨基苯甲酸,得白色固体33.7mg,收率7.9%。
[0074]1h nmr(600mhz,dmso
‑
d6)δ12.58(s,1h),8.23(d,j=9.1hz,1h),8.10(s,1h),7.85(dd,j=8.6,1.8hz,1h),6.84(d,j=8.6hz,1h),6.29(s,2h),4.88(d,j=41.0hz,3h),4.70(t,j=9.1hz,1h),4.54(s,1h),3.62(d,j=11.7hz,1h),3.40(d,j=11.4hz,3h),3.16(t,j=8.7hz,1h),3.11
–
2.99(m,4h),2.07(dq,j=14.6,7.4hz,2h),2.00(t,j=7.3hz,2h),1.63(p,j=7.3hz,2h).esi
‑
ms(m/z):607.5[m
‑
h]
‑
。
[0075]
实施例13:n1‑
(2
‑
溴
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a13)
[0076]
实施例13的化合物制备方法同实施例9,只是使用了3
‑
溴
‑4‑
氨基苯甲酸替代了对
氨基苯甲酸,得白色固体24.1mg,收率5.3%。
[0077]1h
‑
nmr(600mhz,dmso
‑
d6)δ13.23(s,1h),8.35(d,j=8.9hz,1h),8.26(d,j=1.8hz,1h),7.92(dd,j=8.2,1.8hz,1h),6.79(d,j=8.2hz,1h),6.35(s,2h),4.65(t,j=8.5hz,1h),3.53(d,j=9.1hz,1h),3.32(dd,j=11.0,4.4hz,2h),3.18(dd,j=13.5,6.1hz,1h),3.10
–
2.95(m,3h),2.17
–
1.95(m,4h),1.68(d,j=35.5hz,2h).esi
‑
ms(m/z):651.0[m
‑
h]
‑
。
[0078]
实施例14:n1‑
(2
‑
甲基
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a14)
[0079]
实施例14的化合物制备方法同实施例9,只是使用了3
‑
甲基
‑4‑
氨基苯甲酸替代了对氨基苯甲酸,得白色固体45.8mg,收率11.1%。
[0080]1h
‑
nmr(600mhz,dmso
‑
d6)δ13.21(s,1h),9.37(s,1h),8.35(d,j=9.1hz,1h),8.15(s,2h),8.03(d,j=1.3hz,1h),7.96(dd,j=8.4,1.6hz,1h),7.70(dd,j=23.7,8.3hz,1h),4.97(d,j=0.5hz,1h),4.87(dd,j=11.1,4.8hz,2h),4.73(t,j=9.1hz,1h),4.49(t,j=5.1hz,1h),3.64(dd,j=11.5,2.4hz,1h),3.45
–
3.38(m,1h),3.18(t,j=8.4hz,1h),3.13
–
2.98(m,3h),2.43(t,j=7.1hz,2h),2.30(s,3h),2.27
–
2.11(m,2h),1.84(p,j=7.3hz,2h).esi
‑
ms(m/z):588.7[m
‑
h]
‑
。
[0081]
实施例15:n1‑
(2
‑
甲氧基
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a15)
[0082]
实施例15的化合物制备方法同实施例9,只是使用了3
‑
甲氧基
‑4‑
氨基苯甲酸替代了对氨基苯甲酸,得白色固体40.4mg,收率9.6%。
[0083]1h nmr(600mhz,dmso
‑
d6)δ13.44(s,1h),9.38(s,1h),8.36(s,2h),8.34(d,j=9.1hz,1h),8.30(d,j=8.4hz,1h),7.85(d,j=1.8hz,1h),7.78(dd,j=8.5,1.8hz,1h),4.90(s,1h),4.72(t,j=9.1hz,1h),3.97(s,3h),3.64(dd,j=11.7,1.7hz,1h),3.41(dd,j=11.8,5.4hz,1h),3.18(t,j=8.8hz,1h),3.14
–
2.95(m,3h),2.54
–
2.51(m,2h),2.29
–
2.01(m,2h),1.91
–
1.71(m,2h).esi
‑
ms(m/z):603.1[m
‑
h]
‑
。
[0084]
实施例16:n1‑
(2
‑
硝基
‑4‑
((5
‑
氨磺酰
‑
1,3,4
‑
噻二唑
‑2‑
基)氨甲酰基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(a16)
[0085]
实施例15的化合物制备方法同实施例9,只是使用了3
‑
硝基
‑4‑
氨基苯甲酸替代了对氨基苯甲酸,得白色固体24.6mg,收率5.7%。
[0086]1h nmr(600mhz,dmso
‑
d6)δ13.55(d,j=81.3hz,1h),8.99(dd,j=6.6,2.1hz,1h),8.42
–
8.29(m,2h),8.10(d,j=9.0hz,3h),7.14(d,j=9.0hz,1h),4.87(s,1h),4.67(t,j=9.0hz,1h),3.65
–
3.57(m,1h),3.40(dd,j=11.8,4.9hz,2h),3.16(t,j=8.6hz,1h),3.11
–
2.99(m,2h),2.35(t,j=7.1hz,2h),2.10(ddt,j=30.3,15.2,7.5hz,2h),1.76
–
1.60(m,2h).esi
‑
ms(m/z):619.0[m
‑
h]
‑
。
[0087]
实施例17:n1‑
(4
‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b1)
[0088]
将对氨基苯磺酰胺(1.0g,5.8mmol)分散于适量水中,冰浴条件下加入浓盐酸(2ml),搅拌至全部溶解后加入亚硝酸钠(0.5g,7.2mmol),室温搅拌2h,制备中间体15。不经分离,溶液中加入叠氮化钠(0.8g,12.3mmol),继续反应0.5h后,加入二氯甲烷(50ml),依次
用水、饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤有机层,无水硫酸钠干燥过夜,过滤,减压除去溶剂得粗品中间体16。
[0089]
将对溴苯胺(1.0g,5.8mmol)溶解在乙酸(10ml)中,加入乙酸酐(0.7ml,7.5mmol),室温反应1.5h后,加入二氯甲烷(30ml),依次用水、饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤有机层,无水硫酸钠干燥过夜,过滤,减压除去溶剂得1.2g中间体18,收率97.1%。
[0090]
将中间体18(1.2g,5.6mmol)、二(三苯基膦)二氯化钯(0.2g,0.3mmol)和碘化亚铜(0.1g,0.5mmol)溶于适量n,n
‑
二甲基甲酰胺后,加入三乙胺(7.2ml,51.6mmol)和三甲基乙炔基硅(1.2ml,8.7mmol),氩气保护下50℃反应12h,加入乙酸乙酯(50ml),依次用水和饱和氯化钠溶液萃取有机层,无水硫酸钠干燥过夜,过滤,减压除去溶剂,柱层析(石油醚:乙酸乙酯=5:1)得1.0g中间体19,收率77.3%。
[0091]
将中间体19(1.0g,4.3mmol)溶解在适量n,n
‑
二甲基甲酰胺中,加入1n四丁基氟化铵溶液2.0ml,室温反应3h后,加入乙酸乙酯(30ml),依次用水和饱和氯化钠溶液萃取有机层,无水硫酸钠干燥过夜,过滤,减压除去溶剂,得0.5g中间体20,收率75.2%。
[0092]
将中间体16(0.6g,3.1mmol)和20(0.5g,3.1mmol)溶解在叔丁醇
‑
水(20ml,1:1)混合溶液中,加入五水硫酸铜(75.0mg,0.3mmol)和抗坏血酸钠(59.4mg,0.3mmol),50℃反应3h后,冷却至室温,浓缩反应液,得中间体21。
[0093]
将上述中间体21粗品分布在20ml氢氧化钠水溶液(2n)中,回流反应5h后,冷却至室温,抽滤,滤饼溶解后柱层析(二氯甲烷:甲醇=25:1)得0.5g中间体22,两步收率51.2%。
[0094]
将中间体5(0.5g,0.7mmol)、中间体22(0.3g,1.0mmol)和edci(0.2g,1.0mmol)溶于15ml吡啶中,60℃反应48h,冷却至室温,浓缩反应液,得到中间体23。
[0095]
将中间体23溶于丙酮中,冰浴下加入1n的甲醇钠的甲醇溶液0.5ml,室温反应2h。加入阳离子交换树脂调节ph至中性,过滤,浓缩滤液,柱层析(二氯甲烷:甲醇=9:1),得到白色固体45.0mg,两步收率11.2%。
[0096]1h nmr(600mhz,dmso
‑
d6)δ10.16(s,1h),9.33(s,1h),8.51(d,j=9.0hz,1h),8.17(d,j=8.7hz,2h),8.06(d,j=8.7hz,2h),7.88(d,j=8.6hz,2h),7.73(d,j=8.6hz,2h),7.54(s,2h),5.10
–
4.90(m,2h),4.71(t,j=9.0hz,1h),4.53(s,1h),3.64(d,j=10.7hz,1h),3.45
–
3.40(m,1h),3.18(dd,j=11.5,5.5hz,1h),3.12
–
3.01(m,3h),2.63
–
2.56(m,2h),2.47(dd,j=15.9,7.7hz,1h).esi
‑
ms(m/z):575.6[m
‑
h]
‑
[0097]
实施例18:n1‑
(3
‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b2)
[0098]
实施例18的化合物制备方法同实施例17,只是使用了间溴苯胺替代了对溴苯胺,得白色固体40.1mg,收率9.9%。
[0099]1h nmr(600mhz,dmso
‑
d6)δ10.14(s,1h),9.37(s,1h),8.49(d,j=8.9hz,1h),8.32(s,1h),8.21(d,j=8.7hz,2h),8.05(d,j=8.7hz,2h),7.56(dd,j=11.0,9.7hz,4h),7.42(t,j=7.9hz,1h),4.95(d,j=22.5hz,3h),4.72(t,j=9.0hz,1h),4.50(s,1h),3.64(d,j=11.5hz,1h),3.42(d,j=10.3hz,1h),3.22
–
3.14(m,1h),3.07(q,j=9.4hz,3h),2.69
–
2.56(m,2h).esi
‑
ms(m/z):575.4[m
‑
h]
‑
。
[0100]
实施例19:n1‑
(2
‑
氟
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b3)
[0101]
实施例19的化合物制备方法同实施例17,只是使用了2
‑
氟
‑
4溴苯胺替代了对溴苯胺,得白色固体37.2mg,收率8.9%。
[0102]1h nmr(600mhz,dmso
‑
d6)δ9.93(s,1h),9.44(s,1h),8.54(d,j=8.9hz,1h),8.16(d,j=8.6hz,2h),8.07(d,j=8.6hz,3h),7.79(d,j=11.8hz,1h),7.74(d,j=8.4hz,1h),7.56(s,2h),5.07(s,2h),4.98(s,1h),4.71(t,j=9.0hz,1h),4.54(s,1h),3.63(d,j=11.2hz,1h),3.42(d,j=10.8hz,1h),3.18(t,j=8.5hz,1h),3.13
–
3.01(m,3h),2.72
–
2.58(m,2h),2.49
–
2.40(m,2h).esi
‑
ms(m/z):594.3[m
‑
h]
‑
。
[0103]
实施例20:n1‑
(2
‑
氯
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b4)
[0104]
实施例20的化合物制备方法同实施例17,只是使用了2
‑
氯
‑
4溴苯胺替代了对溴苯胺,得白色固体30.0mg,收率7.0%。
[0105]1h nmr(600mhz,dmso
‑
d6)δ12.29(s,1h),9.26(s,1h),8.36(d,j=9.1hz,1h),8.15(dd,j=24.2,8.8hz,4h),7.77(d,j=1.8hz,1h),7.62(dd,j=8.3,1.8hz,1h),6.90(d,j=8.4hz,1h),5.64(s,2h),4.95(d,j=4.3hz,1h),4.84(dd,j=19.3,5.1hz,2h),4.65(t,j=9.1hz,1h),4.49(t,j=5.6hz,1h),3.60(dd,j=11.7,4.0hz,1h),3.42
–
3.36(m,1h),3.14(td,j=8.7,4.0hz,1h),3.08
–
2.96(m,3h),2.47
–
2.39(m,2h),2.37
–
2.23(m,2h).esi
‑
ms(m/z):609.1[m
‑
h]
‑
。
[0106]
实施例21:n1‑
(2,6
‑
二氟
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b5)
[0107]
实施例21的化合物制备方法同实施例17,只是使用了2,6
‑
二氟
‑
4溴苯胺替代了对溴苯胺,得白色固体20.2mg,收率4.7%。
[0108]1h nmr(600mhz,dmso
‑
d6)δ9.25(d,j=43.4hz),8.39
–
8.17(m),8.02(ddd,j=36.2,32.2,8.6hz),7.54(s),7.48(d,j=7.4hz),5.49(d,j=17.4hz),4.96(s),4.85(s),4.72
–
4.61(m),4.52(s),3.67
–
3.56(m),3.43
–
3.37(m),3.16(dd,j=17.5,8.7hz),3.05(dd,j=16.8,7.4hz),2.45
–
2.17(m).esi
‑
ms(m/z):611.3[m
‑
h]
‑
。
[0109]
实施例22:n1‑
(2
‑
甲基
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b6)
[0110]
实施例22的化合物制备方法同实施例17,只是使用了2
‑
甲基
‑
4溴苯胺替代了对溴苯胺,得白色固体29.6mg,收率7.2%。
[0111]1h nmr(600mhz,dmso
‑
d6)δ9.39(d,j=18.3hz,2h),8.51(d,j=9.0hz,1h),8.18(d,j=8.7hz,2h),8.06(d,j=8.7hz,2h),7.80(s,1h),7.73(d,j=9.3hz,1h),7.61(d,j=8.2hz,1h),7.55(s,3h),4.74(s,1h),3.64(d,j=10.6hz,1h),3.42(dd,j=11.8,5.2hz,2h),3.19(t,j=8.7hz,1h),3.14
–
2.99(m,3h),2.67
–
2.57(m,2h),2.30(s,4h).esi
‑
ms(m/z):589.4[m
‑
h]
‑
。
[0112]
实施例23:n1‑
(2
‑
甲氧基
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n4‑
β
‑
d
‑
吡喃葡萄糖丁二酰胺(b7)
[0113]
实施例23的化合物制备方法同实施例17,只是使用了2
‑
甲氧基
‑
4溴苯胺替代了对溴苯胺,得白色固体37.8mg,收率8.9%。
[0114]1h nmr(600mhz,dmso
‑
d6)δ9.41(s,1h),9.29(s,1h),8.59(d,j=8.8hz,1h),8.17
(d,j=8.6hz,2h),8.14(d,j=8.2hz,1h),8.07(d,j=8.6hz,2h),7.60(s,1h),7.56(s,2h),7.50(d,j=9.5hz,1h),5.18(s,2h),5.04(s,1h),4.70(t,j=9.0hz,1h),4.56(s,1h),3.95(s,3h),3.63(d,j=11.0hz,1h),3.42(d,j=11.5hz,1h),3.18(t,j=8.4hz,1h),3.10
–
3.01(m,3h),2.66(dd,j=25.0,17.2hz,2h),2.46(dd,j=16.1,8.2hz,2h).esi
‑
ms(m/z):605.5[m
‑
h]
‑
。
[0115]
实施例24:n1‑
(4
‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b8)
[0116]
实施例24的化合物制备方法同实施例17,只是使用了戊二酸酐替代了丁二酸酐,得白色固体23.9mg,收率5.8%。
[0117]1h nmr(600mhz,dmso
‑
d6)δ10.13(s),9.36(s),8.18(d,j=8.2hz),8.06(d,j=8.3hz),7.88(d,j=7.9hz),7.75(d,j=7.6hz),7.55(s),5.01(s),4.90(dd,j=12.8,4.3hz),4.72(t,j=8.5hz),4.51(s),3.64(dd,j=10.6,4.3hz),3.42(d,j=6.1hz),3.18(s),3.07(dd,j=9.7,4.7hz),3.03
–
2.93(m),2.64
–
2.53(m),2.41
–
2.33(m),2.20(ddd,j=27.9,14.0,6.9hz),1.89
–
1.78(m).esi
‑
ms(m/z):589.4[m
‑
h]
‑
。
[0118]
实施例25:n1‑
(3
‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b9)
[0119]
实施例25的化合物制备方法同实施例24,只是使用了间溴苯胺替代了对溴苯胺,得白色固体29.0mg,收率7.0%。
[0120]1h nmr(600mhz,dmso
‑
d6)δ10.06(s,1h),9.38(s,1h),8.50
–
8.25(m,2h),8.21(d,j=8.5hz,2h),8.06(d,j=8.5hz,2h),7.58(dd,j=18.9,11.5hz,4h),7.43(t,j=7.8hz,1h),4.98(s,1h),4.88(s,2h),4.73(t,j=9.0hz,1h),4.48(s,1h),3.64(d,j=8.6hz,1h),3.48
–
3.38(m,1h),3.19(t,j=8.4hz,1h),3.13
–
2.97(m,3h),2.38(t,j=7.1hz,2h),2.20(dd,j=14.2,7.1hz,2h),1.96
–
1.74(m,2h).esi
‑
ms(m/z):589.0[m
‑
h]
‑
。
[0121]
实施例26:n1‑
(2
‑
氟
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b10)
[0122]
实施例26的化合物制备方法同实施例24,只是使用了2
‑
氟
‑
4溴苯胺替代了对溴苯胺,得白色固体32.0mg,收率7.5%。
[0123]1h nmr(600mhz,dmso
‑
d6)δ9.87(d,j=51.7hz),9.44(s),8.16(d,j=8.7hz),8.07(d,j=8.6hz),7.79(d,j=13.2hz),7.75(d,j=8.2hz),7.55(s),4.98(d,j=3.9hz),4.91
–
4.83(m),4.73(td,j=9.1,5.4hz),4.50(dt,j=11.3,5.8hz),3.64(dd,j=11.4,5.4hz),3.48
–
3.39(m),3.18(td,j=8.7,4.3hz),3.14
–
3.01(m),2.71
–
2.59(m),2.44(t,j=7.3hz),2.19(ddt,j=22.5,15.1,7.5hz),1.89
–
1.77(m).esi
‑
ms(m/z):607.8[m
‑
h]
‑
。
[0124]
实施例27:n1‑
(2
‑
氯
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b11)
[0125]
实施例27的化合物制备方法同实施例24,只是使用了2
‑
氯
‑
4溴苯胺替代了对溴苯胺,得白色固体29.1mg,收率6.7%。
[0126]1h nmr(600mhz,dmso
‑
d6)δ12.21(s,1h),9.25(s,1h),8.26(d,j=9.1hz,1h),8.16(q,j=8.9hz,4h),7.77(d,j=1.8hz,1h),7.62(dd,j=8.4,1.8hz,1h),6.90(d,j=8.4hz,1h),5.62(s,2h),4.92(s,1h),4.81(d,j=15.1hz,2h),4.68(t,j=9.0hz,1h),4.44(s,
1h),3.62(d,j=11.3hz,1h),3.40(dd,j=11.5,4.2hz,1h),3.23
–
3.12(m,2h),3.05(dt,j=17.8,9.2hz,3h),2.28(t,j=7.3hz,2h),2.07(d,j=8.0hz,2h),1.73
–
1.53(m,2h).esi
‑
ms(m/z):623.1[m
‑
h]
‑
。
[0127]
实施例28:n1‑
(2,6
‑
二氟
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b12)
[0128]
实施例28的化合物制备方法同实施例24,只是使用了2,6
‑
二氟
‑
4溴苯胺替代了对溴苯胺,得白色固体20.9mg,收率4.8%。
[0129]1h nmr(600mhz,dmso
‑
d6)δ12.25(s),9.31(s),8.28(d,j=9.1hz),8.21
–
8.03(m),7.49(dd,j=7.4,2.1hz),5.51(s),4.95(d,j=4.4hz),4.86(d,j=5.2hz),4.82(d,j=5.0hz),4.68(t,j=9.1hz),4.47(t,j=5.4hz),3.62(dd,j=11.4,3.2hz),3.45
–
3.36(m),3.15(td,j=8.7,4.1hz),3.11
–
3.05(m),3.02(td,j=9.1,5.1hz),2.27(t,j=7.4hz),2.16
–
1.97(m),1.63(p,j=7.4hz).esi
‑
ms(m/z):624.9[m
‑
h]
‑
。
[0130]
实施例29:n1‑
(2
‑
甲基
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b13)
[0131]
实施例29的化合物制备方法同实施例24,只是使用了2
‑
甲基
‑
4溴苯胺替代了对溴苯胺,得白色固体39.9mg,收率9.4%。
[0132]1h
‑
nmr(400mhz,dmso
‑
d6)δ9.31(s),8.17(d,j=8.7hz),8.07(d,j=8.7hz),7.81(s),7.74(d,j=9.6hz),7.58(d,j=8.2hz),4.74(d,j=9.0hz),3.65(d,j=11.5hz),3.42(dd,j=11.8,5.5hz),3.21(t,j=8.8hz),3.14(dd,j=8.3,6.6hz),3.07(dd,j=19.1,10.1hz),2.41(t,j=7.0hz),2.30(s),2.23(dd,j=12.3,7.2hz),1.92
–
1.80(m).esi
‑
ms(m/z):603.5[m
‑
h]
‑
。
[0133]
实施例30:n1‑
(2
‑
甲氧基
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b14)
[0134]
实施例30的化合物制备方法同实施例24,只是使用了2
‑
甲氧基
‑
4溴苯胺替代了对溴苯胺,得白色固体47.1mg,收率10.8%。
[0135]1h nmr(600mhz,dmso
‑
d6)δ9.41(s,1h),9.18(s,1h),8.37(t,j=24.4hz,1h),8.17(d,j=8.8hz,2h),8.13(d,j=8.2hz,1h),8.07(d,j=8.8hz,2h),7.60(d,j=1.7hz,1h),7.55(s,2h),7.51(dd,j=8.2,1.7hz,1h),4.98(d,j=4.4hz,1h),4.88(dd,j=10.1,5.4hz,2h),4.73(t,j=9.1hz,1h),4.50(t,j=5.8hz,1h),3.95(s,3h),3.68
–
3.60(m,1h),3.41(dt,j=11.5,5.7hz,1h),3.18(td,j=8.7,3.8hz,1h),3.14
–
2.99(m,3h),2.44(t,j=7.1hz,2h),2.26
–
2.08(m,2h),1.82(p,j=7.5hz,2h).esi
‑
ms(m/z):619.6[m
‑
h]
‑
。
[0136]
实施例31:n1‑
(2
‑
硝基
‑4‑
(1
‑
(4
‑
氨磺酰苯基)
‑
1h
‑
1,2,3
‑
三唑
‑4‑
基)苯基)
‑
n5‑
β
‑
d
‑
吡喃葡萄糖戊二酰胺(b14)
[0137]
实施例31的化合物制备方法同实施例24,只是使用了2
‑
硝基
‑
4溴苯胺替代了对溴苯胺,得白色固体19.9mg,收率4.5%。
[0138]1h
‑
nmr(400mhz,dmso
‑
d6)δ12.32(s,1h),9.38(s,1h),8.55(d,j=1.7hz,1h),8.24(d,j=9.0hz,1h),8.08(q,j=8.6hz,4h),7.98(dd,j=8.8,1.7hz,1h),7.64(s,2h),7.17(d,j=8.8hz,1h),4.92(d,j=3.1hz,1h),4.83(d,j=3.8hz,2h),4.68(t,j=9.0hz,1h),4.46(s,1h),3.62(d,j=11.4hz,1h),3.39(dd,j=12.2,3.5hz,2h),3.15(d,j=12.8hz,
2h),3.10
–
2.93(m,4h),2.16(s,2h),2.06(dd,j=13.1,7.1hz,2h),1.70
–
1.51(m,2h).esi
‑
ms(m/z):634.2[m
‑
h]
‑
。
[0139]
本发明产物的药理研究
[0140]
(1)采用酶水解法测定各化合物a1
‑
16及b1
‑
15对人源碳酸酐酶xi和xii(hca ix和xii)的抑制作用。用分析缓冲液将底物4
‑
硝基苯乙酸酯稀释到2mm,用配制的分析缓冲液(125mmtris,75mmnacl)将酶稀释到20ng/μl,将50μl的20ng/μl酶加入到96孔板中,加入上述制备的各化合物作为抑制剂,室温下孵育15分钟,加入25μl的2mm底物起始反应,10分钟后酶标仪读取405nm吸光度值。测试8个不同浓度的抑制率得到ic
50
值,抑制率计算公式如下:
[0141]
%inhibition=(1
‑
sample activity/total activity)x 100所得结果如下表:
[0142][0143]
n.t.not test.
[0144]
(2)采用mtt法测定优选化合物a7、a9、a10、a14、b1、b2和b6对人结肠癌细胞ht
‑
29的细胞活力抑制作用。取对数生长期的上述细胞,将细胞密度调整为2x104/孔埋入96孔板中,37℃培养24小时后,除阴性对照组外,每组设三个平行孔,加入相应药物,继续于37℃培养24小时后每孔加入mtt(0.5mg/ml)溶液培养3小时,弃去上清液,以pbs清洗残留药物后,每孔加入100μldmso,于微量振荡器中振荡10分钟至结晶完全溶解,随后用emax microplate reader(molecular devices,sunnyvale,ca,usa)测定各孔在540nm处的吸光值,根据阴性对照组计算细胞活力抑制率:
[0145]
inhibitory ratio(%)=(a
540,control
‑
a
540,experiment
)/(a
540,control
‑
a
540,blank
)x100所得测试结果如下表:
[0146][0147]
综上药理研究表明,本发明化合物在体外酶水平药理测试中,均表现出对肿瘤相关蛋白ca ix明显的抑制活性,对部分化合物进行的另一肿瘤相关蛋白ca xii活性抑制实验所得半数抑制浓度为41
‑
256nm;之后对酶水平测试优选化合物进行的肿瘤细胞活力抑制实验表明,化合物对人结肠癌细胞ht
‑
29的抑制率为22.2
‑
43.1%。
[0148]
综上所述,本发明根据肿瘤相关蛋白ca ix和ca xii的药效团特征和亚细胞分布特点,通过多步反应制备端基叠氮糖,之后通过“一锅法”将叠氮基还原并发生开环反应进行糖给体的合成,完成n
‑
芳基磺胺
‑
n
‑
β
‑
d
‑
吡喃葡萄糖二酰胺类化合物的制备;酶水平药理活性测试表明本发明所设计的吡喃葡萄糖二酰胺类化合物具有良好的ca ix及xii抑制活性,其中linker为酰胺结构的化合物较三氮唑衍生物表现出更好的抑制活性,而卤素取代会导致活性下降,细胞实验结果表明本发明设计化合物对人结肠癌细胞ht
‑
29表现出一定的抑制效果,具有潜在的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1