一种催化靛蓝生物合成的p450突变酶
技术领域
1.本发明属于生物催化技术领域,具体涉及一种催化靛蓝生物合成的p450突变酶。
背景技术:
2.靛蓝(indigo,cas no.482-89-3)是一种蓝色粉末状物质,其分子式为c
16h10
n2o2,结构式如下:
[0003][0004]
其溶解性较差,微溶于水和乙醇,易溶于二甲基亚砜(dmso)。
[0005]
靛蓝用途广泛,广泛用于食品、医药和印染工业。在印染工业方面,靛蓝用作染料已有几千年历史,可以染制丝、毛、棉、麻等纺织品,是古代应用最广泛和最重要的染料,被誉为“染料之王”。在食品工业方面,天然靛蓝及其磺酸钠盐或铝化的形式可用作食用色素,我国称之为亮蓝(gb7655.1-1996)和亮蓝铝淀(gb7655.2-1996)。在医药工业方面,靛蓝及其同分异构体靛玉红是传统中药板蓝根、大青叶及青黛的主要活性成分,能有效应对流行性感冒。另外,靛蓝还具有抗菌、抗炎、抑制肿瘤细胞增殖等作用。
[0006]
起初,靛蓝是从植物(木蓝和菘蓝等)提取制成,但提取方法工艺繁琐,产量低,而且受时间、地域限制。随着对靛蓝需求不断增长,化学合成工艺日渐兴起,工业过程取代了以植物为基础的靛蓝生产。目前大规模生产过程通常依赖苯胺作为廉价的化学原料合成靛蓝,但化学合成法生成有毒副产物、危害健康,污染环境,目前对于工业化生物合成靛蓝困难,所以开发高效靛蓝生物合成的酶具有重要价值。
[0007]
细胞色素p450单加氧酶(cytochromes p450 monooxygenase,p450或cyp)是以半胱氨酸为轴向配体、以亚铁血红素作为活性中心的含铁氧化酶超级家族。天然p450酶能在温和条件下高选择性的催化包括羟化、环氧化、杂原子氧化等多种类型的反应,但其催化应用却一直受到昂贵的辅因子nad(p)h及其复杂的电子传递体系的限制,这种限制在一定程度上制约了p450酶的工业应用尤其是体外催化应用。
[0008]
中国专利文献cn110128364a(申请号:201810126862.7)一种激活酶催化反应的双功能小分子化合物及其应用,公开了双功能小分子能够激活p450酶利用h2o2对底物进行催化反应的应用,反应过程中不需要额外添加辅因子nad(p)h及还原伴侣蛋白就能实现催化氧化。
[0009]
中国专利文献cn102747053a(申请号:201210257003.4)公开了一种细胞色素p450bm-3突变酶及其编码基因和用途,该发明通过定点突变,在细胞色素p450bm-3(f87v/a74g/l188q)突变酶的基础上引入了三个突变位点,即168位点由天冬氨酸(d)突变为亮氨酸(l),435位点由谷氨酸(e)突变为苏氨酸(t),445位点由缬氨酸(v)突变为丙氨酸(a),该突变体命名为p450bm-3(d168l/e435t/v445a),该专利文献发明人还申请了其他细胞色素p450bm-3突变体酶,但是所涉及的突变体与本发明涉及的p450突变酶的突变位点不同。
[0010]
中国专利文献cn109423482a(申请号:201710731112.8)公开了一种催化cyperenoic acid羟基化的细胞色素p450 bm3突变酶,该发明涉及的细胞色素p450bm3突变酶选择性催化cyperenoic acid,生产7β-hydroxy-cyperenoic acid和9α-hydroxy-cyperenoic acid,该专利文献涉及的突变酶与本发明涉及的p450突变酶的突变位点不同。
技术实现要素:
[0011]
针对现有技术的不足,本发明提供了一种催化靛蓝生物合成的p450突变酶。
[0012]
本发明采用双功能小分子驱动体系研究p450突变酶生物合成靛蓝。
[0013]
本发明的技术方案如下:
[0014]
双功能小分子im-c6-phe利用p450突变酶在生物合成靛蓝中的应用,所述双功能小分子im-c6-phe结构式如下:
[0015][0016]
根据本发明优选的,所述p450突变酶包括p450 bmp-f87g-t268v突变酶,以p450bmp-f87g-t268v突变酶为父本,在如下4个位点至少突变一个位点叠加的p450突变酶,所述4个位点为f77i即第77位的苯丙氨酸突变为异亮氨酸、e140d即第140位的谷氨酸突变为天冬氨酸、r190q即第190位的精氨酸突变为谷氨酰胺、l277m即第277位的亮氨酸突变为甲硫氨酸;所述p450 bmp-f87g-t268v突变酶的氨基酸序列如seq id no.39所示。
[0017]
进一步优选的,所述p450 bmp-f87g-t268v突变酶的编码核苷酸序列如seq id no.40所示。
[0018]
进一步优选的,所述p450突变酶为:p450 bmp-f87g-t268v-f77i突变酶、p450 bmp-f87g-t268v-e140d突变酶、p450 bmp-f87g-t268v-r190q突变酶、p450 bmp-f87g-t268v-l277m突变酶、p450 bmp-f87g-t268v-f77i-e140d突变酶、p450 bmp-f87g-t268v-f77i-r190q突变酶、p450 bmp-f87g-t268v-e140d-r190q突变酶、p450 bmp-f87g-t268v-f77i-l277m突变酶、p450 bmp-f87g-t268v-e140d-l277m突变酶、p450 bmp-f87g-t268v-r190q-l277m突变酶、p450 bmp-f87g-t268v-f77i-e140d-r190q突变酶、p450 bmp-f87g-t268v-f77i-e140d-l277m突变酶、p450 bmp-f87g-t268v-f77i-r190q-l277m突变酶、p450 bmp-f87g-t268v-e140d-r190q-l277m突变酶或p450 bmp-f87g-t268v-f77i-e140d-r190q-l277m突变酶。
[0019]
进一步优选的,所述p450突变酶为:p450 bmp-f87g-t268v-f77i突变酶、p450 bm p-f87g-t268v-e140d突变酶、p450 bmp-f87g-t268v-r190q突变酶、p450 bmp-f87g-t268v-l277m突变酶、p450 bmp-f87g-t268v-f77i-e140d突变酶、p450 bmp-f87g-t268v-f77i-r190q突变酶、p450 bmp-f87g-t268v-f77i-e140d-r190q突变酶或p450 bmp-f87g-t268v-f77i-e140d-l277m突变酶。
[0020]
更优选的,所述p450突变酶为p450 bmp-f87g-t268v-f77i-e140d突变酶,该突变酶的氨基酸序列如seq id no.2。
[0021]
更优选的,所述p450突变酶为p450 bmp-f87g-t268v-f77i-e140d突变酶,该突变酶的编码核苷酸序列如seq id no.1。
[0022]
所述突变酶以下简称为:
[0023]
f87g-t268v;f87g-t268v-f77i;f87g-t268v-e140d;f87g-t268v-r190q;f87g-t268v-l277m;f87g-t268v-f77i-e140d;f87g-t268v-f77i-r190q;f87g-t268v-e140d-r190q;f87g-t268v-f77i-l277m;f87g-t268v-e140d-l277m;f87g-t268v-r190q-l277m;f87g-t268v-f77i-e140d-r190q;f87g-t268v-f77i-e140d-l277m;f87g-t268v-f77i-r190q-l277m;f87g-t268v-e140d-r190q-l277m;f87g-t268v-f77i-e140d-r190q-l277m。
[0024]
一种催化靛蓝生物合成的p450突变酶包括:以p450 bmp-f87g-t268v突变酶为父本,在如下4个位点至少突变一个位点叠加的p450突变酶,所述4个位点为f77i即第77位的苯丙氨酸突变为异亮氨酸、e140d即第140位的谷氨酸突变为天冬氨酸、r190q即第190位的精氨酸突变为谷氨酰胺、l277m即第277位的亮氨酸突变为甲硫氨酸;所述父本酶p450 bmp-f87g-t268v突变酶的氨基酸序列如seq id no.39所示。
[0025]
根据本发明优选的,所述p450 bmp-f87g-t268v突变酶的编码核苷酸序列如seq id no.40所示;
[0026]
根据本发明优选的,所述p450突变酶为:p450 bmp-f87g-t268v-f77i突变酶、p450bmp-f87g-t268v-e140d突变酶、p450 bmp-f87g-t268v-r190q突变酶、p450 bmp-f87g-t268v-l277m突变酶、p450 bmp-f87g-t268v-f77i-e140d突变酶、p450 bmp-f87g-t268v-f77i-r190q突变酶、p450 bmp-f87g-t268v-e140d-r190q突变酶、p450 bmp-f87g-t268v-f77i-l277m突变酶、p450 bmp-f87g-t268v-e140d-l277m突变酶、p450 bmp-f87g-t268v-r190q-l277m突变酶、p450 bmp-f87g-t268v-f77i-e140d-r190q突变酶、p450bmp-f87g-t268v-f77i-e140d-l277m突变酶、p450 bmp-f87g-t268v-f77i-r190q-l277m突变酶、p450 bmp-f87g-t268v-e140d-r190q-l277m突变酶或p450 bmp-f87g-t268v-f77i-e140d-r190q-l277m突变酶。
[0027]
进一步优选的,所述p450突变酶为:p450 bmp-f87g-t268v-f77i突变酶、p450 bmp-f87g-t268v-e140d突变酶、p450 bmp-f87g-t268v-r190q突变酶、p450 bmp-f87g-t268v-l277m突变酶、p450 bmp-f87g-t268v-f77i-e140d突变酶、p450 bmp-f87g-t268v-f77i-r190q突变酶、p450 bmp-f87g-t268v-f77i-e140d-r190q突变酶或p450 bmp-f87g-t268v-f77i-e140d-l277m突变酶。
[0028]
更优选的,所述p450突变酶为p450 bmp-f87g-t268v-f77i-e140d突变酶,该突变酶的氨基酸序列如seq id no.2。
[0029]
更优选的,所述p450突变酶为p450 bmp-f87g-t268v-f77i-e140d突变酶,该突变酶的编码核苷酸序列如seq id no.1。
[0030]
一种重组表达载体包含上述突变酶的编码基因。
[0031]
一种重组菌株包含上述突变酶的编码基因。
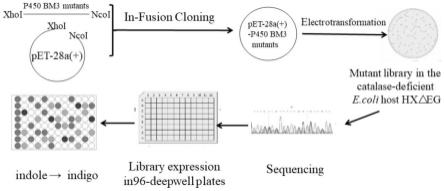
[0032]
上述突变酶的编码基因、重组表达载体或重组表达菌株在制备上述p450突变酶的应用。
[0033]
上述p450突变酶的制备方法,包括如下步骤:
[0034]
将含有p450突变酶的重组菌培养至od
600
=0.6-0.8时,加入fecl3和5
’‑
ala培养15-30min,然后加入iptg进行诱导表达,诱导培养15-20h后,收集菌体,用缓冲液重悬,进行超声波破碎、纯化制备p450突变酶。
[0035]
根据本发明优选的,所述制备方法,包括如下步骤:
[0036]
将p450突变酶转化至大肠杆菌bl21(de3)表达宿主,涂布至含有终浓度为50μg/mlka na的lb平板中,37℃过夜培养,挑取单克隆于50ml含有终浓度为50μg/mlkana的lb培养基过夜活化,取10ml菌液至500ml含有终浓度为50μg/ml kana的lb培养基,37℃、200rpm培养2小时,待od
600
=0.6-0.8时,加入终浓度为0.5mm的fecl3和5
’‑
ala,30℃培养20min,加入终浓度为1mm的iptg进行诱导表达,置于摇床中30℃、200rpm诱导18小时,离心收集菌体,用缓冲液重悬,超声破碎、纯化制备p450突变酶。
[0037]
上述p450突变酶在制备靛蓝中的应用。
[0038]
根据本发明优选的,所述应用中,p450突变酶利用吲哚制备靛蓝的方法涉及如下步骤:将p450突变酶、吲哚溶液、h2o2、双功能小分子im-c6-phe加入tris-hcl缓冲溶液中反应,获得靛蓝。
[0039]
进一步优选的,上述方法的反应体系包括:p450突变酶的终浓度为0.08-0.15μm,吲哚的终浓度为3-5mm,dmso的体积分数为1.5-2.5%(作为吲哚助溶剂),h2o2的终浓度为18-22mm,双功能小分子im-c6-phe的终浓度为1.5-2.5mm。
[0040]
进一步优选的,tris-hcl缓冲溶液为ph8.2的tris-hcl缓冲溶液。
[0041]
本发明的有益效果
[0042]
本发明涉及的定向进化属于非理性设计,通过易错pcr等诱变技术改造酶的基因,根据特定改造目的,筛选有价值的天然酶。本发明通过对p450bm3定向进化,利用随机突变,高通量筛选获取催化靛蓝生物合成的优势突变体,通过对优势突变位点的半理性设计,构建“小而精”的突变体文库,提高了筛选效率,在双功能小分子协同的p450过加氧酶体系下,获得到高产量的靛蓝优势突变酶,其中p450 bmp-f87g-t268v-f77i-e140d突变酶的作用效果最显著。
附图说明
[0043]
图1为定向进化构建p450bm3靛蓝突变文库流程图。
[0044]
图2为初筛靛蓝突变文库结果示意图。
[0045]
图3为复筛靛蓝突变文库结果示意图。
[0046]
图4为反应ph对产物靛蓝的影响。
[0047]
图5为底物浓度对产物靛蓝的影响。
[0048]
图6为h2o2浓度对产物靛蓝的影响。
[0049]
图7为im-c6-phe浓度对产物靛蓝的影响。
具体实施方式
[0050]
下面结合实施例对本发明做进一步阐述,但本发明所保护的范围不限于此。
[0051]
实施例中未详加说明的内容均按本领域现有技术。
[0052]
材料来源
[0053]
大肠杆菌dh10b、蛋白表达纯化所用宿主大肠杆菌bl21(de3)均为普通市售产品;(thermofisher公司、上海生工生物工程有限公司)
[0054]
敲除过氧化氢酶基因(kate和katg)的大肠杆菌bl21(de3)表达宿主为常规实验技
术获得。
[0055]
in-fusion cloning试剂盒购自南京诺唯赞生物科技股份有限公司。
[0056]
吲哚标品购自阿拉丁公司;
[0057]
靛蓝标品购自麦克林公司;
[0058]
双功能小分子(im-c6-phe)为实验室人员自主合成,该双功能小分子为申请号为201810126862.7、发明名称为“一种激活酶催化反应的双功能小分子化合物及其应用”的中国专利申请中公开的化合物;
[0059]
所用常规溶剂、试剂为分析纯,购自上海国药有限公司。
[0060]
实施例1
[0061]
利用易错pcr获得催化靛蓝生物合成的优势突变株
[0062]
以p450bm3的血红素结构域bmp-f87g-t268v为父本酶进行易错pcr,获得易错pcr产物,利用普通pcr获得ncoi、xhoi为末端的pet-28a(+)开环质粒,对pcr产物进行dpni酶切消化,将普通pcr产物和易错pcr产物两者进行琼脂糖电泳以及胶回收。
[0063]
通过无缝克隆技术将易错pcr产物与开环质粒连接起来,利用乙醇沉淀法纯化连接体系,电转化至敲除过氧化氢酶基因(kate和katg)的大肠杆菌bl21(de3)表达宿主(宿主简称hxδeg),涂布到含50μg/ml kana的lb平板上,37℃过夜培养,构建p450突变文库。挑取单菌落至96深孔板进行诱导表达,通过吲哚反应观察颜色变化获得靛蓝优势突变株,实验流程图见图1。
[0064]
实施例2
[0065]
易错pcr反应体系的优化
[0066]
本实验易错pcr反应体系中,通过优化mn
2+
的浓度(0.025mm、0.03mm、0.04mm、0.05mm、0.06mm、0.07mm、0.1mm、0.125mm)筛选合适的突变频率,从而使得碱基在一定程度上被随机错误地引入并以此创造出具有序列多样性特征的突变文库,包括如下步骤:
[0067]
(1)在双功能小分子协同的p450过加氧酶体系下,野生型p450bmp对吲哚反应不生成产物靛蓝。所述野生型p450 bmp的氨基酸序列如seq id no.41所示。所述野生型p450bmp的编码核苷酸序列如seq id no.42所示。
[0068]
通过筛选本实验室前期构建的p450突变体,发现在f87g基础上增加t268v的双突变酶催化吲哚反应生物合成靛蓝的产量较f87g单突变酶提高了5倍,所以选择f87g-t268v作为父本酶进行易错pcr。
[0069]
易错pcr的引物见表1:
[0070]
表1
[0071][0072]
不同易错pcr反应体系组分见表2:
[0073]
表2
[0074][0075][0076]
易错pcr反应条件见表3:
[0077]
表3
[0078]
步骤温度(℃)时间1943min29810s35630s4721min30s5步骤2-430循环67210min
[0079]
(2)对pet-28a(+)进行pcr,pet-28a(+)引物见表4:
[0080]
表4
[0081]
entryprimersequence(5
’‑3’
)1fctcgagcaccaccacc seq id no.52rccatggtatatctccttcttaaag seq id no.6
[0082]
pcr反应体系见表5:
[0083]
表5
[0084]
名称体积(μl)primestar mix25正向引物(f)1反向引物(r)1pet-28a(+)1ddh2o22总体积50
[0085]
pcr反应条件见表6:
[0086]
表6
[0087]
步骤温度(℃)时间1943min29810s35630s
4721min30s5步骤2-430循环67210min
[0088]
(3)dpni消除模板闭环pet-28a(+)质粒
[0089]
反应条件见表7,37℃反应1h。
[0090]
表7
[0091][0092][0093]
(4)将易错pcr产物与开环pet-28a(+)进行0.8%琼脂糖凝胶电泳,电泳后在紫外灯下分别切下目的条带,利用胶回收试剂盒回收目的片段。
[0094]
(5)通过无缝克隆将易错pcr产物与开环pet-28a(+)进行连接
[0095]
连接体系见表8,37℃反应30min。
[0096]
表8
[0097][0098]
(6)利用乙醇沉淀法纯化连接体系
[0099]
将连接体系加入两倍无水乙醇,充分混匀,加入总体积1/10的5m nacl,再次充分混匀,放于-20℃30min。离心弃上清,加入700μl 75%乙醇,离心弃上清,烘干,加入超纯水保存。
[0100]
(7)将纯化后的连接体系电转化至缺陷型hxδeg菌体中,取部分菌液涂布到含50μg/ml kana的lb平板上,37℃过夜培养。
[0101]
待平板上长出单菌落,随机选取15个单菌落测定分析基因序列,查看其突变频率,见表9,结果发现mn
2+
浓度0.03mm时,1-4个氨基酸突变频率为85%,所以选用0.03mm进行易错pcr反应。
[0102]
表9
[0103][0104]
实施例3
[0105]
初筛实施例2的突变文库
[0106]
利用转化后的缺陷型hxδeg菌株进行全细胞反应初筛突变文库,提高筛选效率,舍弃大部分的错义突变,通过反应产物颜色初步筛选生物合成靛蓝的优势突变株。
[0107]
1、突变体菌种的保存与诱导表达
[0108]
1)利用灭菌牙签将单克隆挑取至含有300μl tb培养基(含有终浓度为50μg/ml kana)的96孔深孔板中过夜培养,37℃、600rpm过夜活化培养,转接后加入等量体积分数为40%甘油,置于-80℃保存。
[0109]
2)菌种的诱导表达:取10μl菌液于含有400μl tb培养基(含有终浓度为50μg/ml kana)的96深孔板中,37℃、600rpm培养2小时,od
600
=1.0,加入1mm的iptg进行诱导表达,于高速震荡摇床中30℃、600rpm诱导18小时,离心收集菌体。
[0110]
2、全细胞催化突变文库
[0111]
利用96μl的ph8.2 tris-hcl重悬96深孔板中的菌体,每孔取16μl至96微孔板进行吲哚羟化反应。反应体系组成包括:16μl菌液,终浓度4mm的吲哚,体积分数2%的dmso(作为吲哚助溶剂),终浓度0.5mm的双功能小分子im-c6-phe(该双功能小分子为申请号为201810126862.7、发明名称为“一种激活酶催化反应的双功能小分子化合物及其应用”的中国专利申请中公开的化合物),终浓度20mm的h2o2,ph8.2 100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为200μl;对照体系为pet-28a(+)-f87g-t268v的全细胞反应;25℃反应30min。共计筛选约4300个突变酶,通过吲哚羟化反应后的颜色观察,结果发现优于父本酶以及和父本酶颜色相近的突变体共计921个突变酶,结果如图2所示。
[0112]
实施例4
[0113]
复筛实施例3的优势突变酶文库
[0114]
将初筛得到的优势菌种重新诱导表达,每孔添加400μl裂解液(终浓度为1mg/ml溶菌酶、终浓度为2.5u/ml dnasei、终浓度为0.1%tritonx-100),对菌种裂解制备粗酶液,将存有58μl粗酶液的96微孔板置于多功能酶标仪中检测粗酶液在420nm和490nm处的吸光值,使用a
420-a
490
估算各突变体间相对酶浓度。反应体系组成包括:58μl粗酶液,终浓度4mm的吲哚,体积分数2%的dmso(作为吲哚助溶剂),终浓度0.5mm的双功能小分子im-c6-phe,终浓度20mm的h2o2,ph8.2 100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为100μl;对照体系为pet-28a(+)-f87g-t268v的粗酶液反应;25℃反应30min。靛蓝通过多功能酶标仪检测670nm的吸光值。通过a
670
/a
420-490
评估单位酶浓度下靛蓝生成量,以pet-28a(+)-f87g-t268v为对照,相比pet-28a(+)-f87g-t268v,a
670
/a
420-490
越高,代表突变体催化吲哚活性越高,生成靛蓝量越多。从初筛921个突变酶中进行复筛,共计筛选出高于父本酶的156个p450突变酶,见图3。
[0115]
实施例5
[0116]
扩大体积培养进一步筛选p450靛蓝优势突变酶
[0117]
为提高筛选准确性,将获得的156个优势突变酶进一步扩大至50ml tb培养基中进行培养筛选。
[0118]
从-80℃取出优势突变体的甘油菌液,使用接种环蘸取少量菌液后在lb平板(含终浓度为50μg/ml kana)上划线,并放置于37℃培养箱中过夜培养。挑取单菌落,接种到含有5ml lb液体培养基(含终浓度为50μg/ml kana)的无菌试管中,37℃,200rpm活化培养12h。
[0119]
转接1ml菌液于50ml的tb液体培养基(含终浓度为50μg/ml kana)中,待od
600
为0.6
100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为1ml;对照体系为pet-28a(+)-f87g-t268v的纯酶反应;25℃反应30min。反应液加入dmso溶解产物靛蓝,通过紫外分光光度计检测620nm的吸光值。如表11所示,f87g-t268v-f77i、f87g-t268v-e140d、f87g-t268v-r190q、f87g-t268v-l277m的ton(酶的转化数)优于父本酶1.4倍以上。
[0128]
表11
[0129][0130]
实施例6
[0131]
对上述优势突变体f87g-t268v-f77i、f87g-t268v-e140d、f87g-t268v-r190q、f87g-t268v-l277m的优势位点f77、e140、r190、l277进行定点改造。
[0132]
在pet28a(+)-f87g-t268v的基础上,构建f77、e140、r190、l277位的三突变体。其反向引物不变(f77-r、e140-r、r190-r、l277-r),通过更换正向引物(f77-f、e140-f、r190-f、l277-f)获得f87g-t268v的三突变体,具体引物如下,见表12:
[0133]
表12
[0134][0135][0136]
(1)pcr反应体系见表13:
[0137]
表13
[0138]
名称体积(μl)primestar mix25正向引物(f)1反向引物(r)1模板1ddh2o22总体积50
[0139]
(2)pcr反应条件见表14:
[0140]
表14
[0141]
步骤温度(℃)时间1945min29415s3575s4721min5步骤2-42循环69415s7555s8721min9步骤6-823循环107210min
[0142]
(3)pcr后进行琼脂糖凝胶电泳,电泳完后在紫外灯下分别切下目的条带,然后利用胶回收试剂盒回收目的片段。
[0143]
(4)将胶回收的不同突变体的序列末端进行磷酸化处理,磷酸化体系如下,见表15,37℃1h:
[0144]
表15
[0145]
名称体积(μl)磷酸酶1buffer2pcr回收片段17总体积20
[0146]
(5)将磷酸化后的不同突变体的序列进行连接,连接体系如下,
[0147]
见表16,16℃过夜连接:
[0148]
表16
[0149]
名称体积(μl)磷酸化体系20t4dna连接酶1总体积21
[0150]
(6)将10μl连接体系转入大肠杆菌dh10b感受态细胞中,轻轻混匀,冰浴30min;42℃热激90s,冰浴5min;加入600μl新鲜lb液体培养基,37℃、200rpm震荡培养1h;取200μl菌液涂布到含50μg/ml kana的lb平板上,37℃过夜培养。
[0151]
(7)待平板上长出单菌落,测定分析基因序列。测序成功的质粒即是不同的p450 bm3突变体。
[0152]
(8)将p450bm3突变体转化至大肠杆菌bl21(de3)表达宿主,涂布至含有终浓度为50μg/mlkana的lb平板中,37℃过夜培养,挑取单克隆于5ml含有终浓度为50μg/mlkana的lb培养基过夜活化,取1 ml菌液至50ml含有终浓度为50μg/ml kana的tb培养基,37℃、200 rpm培养2小时,待od600=0.6-0.8时,加入终浓度为0.5 mm的fecl3和5
’‑
ala,30℃培养20 min,加入终浓度为1 mm的iptg进行诱导表达,置于摇床中30℃、200 rpm诱导18小时,离心收集菌体,用缓冲液重悬,超声破碎,利用血红素吡啶法测定粗酶液浓度,进吲哚羟化反应,结果发现:相比定向进化得到的突变体,定点突变得到的突变酶靛蓝产量没有进一步提高,见表17。
[0153]
表17
[0154][0155]
[0156]
对上述粗酶液反应中每个突变位点最优突变体f87g-t268v-f77v、f87g-t268v-e140r、f87g-t268v-l277a进行纯酶验证,f87g-t268v-r190的粗酶液反应都低于父本酶f87g-t268v,将其舍弃。纯酶反应发现其靛蓝产量与父本酶相近,见表18。
[0157]
表18
[0158][0159]
实施例7
[0160]
综上所述,最终选取f77i、e140d、r190q、l277m进行叠加突变,具体引物如下,见表19:
[0161]
表19
[0162]
entryprimersequence(5
’‑3’
)1f77i-fattgtacgtgattttgcaggagacg seq id no.312f77-rtttaagcgcttgacttaagtttttatcaaag seq id no.323e140d-fgatgtaccggaagacatgacacg seq id no.334e140-raatatgctcatctgcatttagacgc seq id no.345r190q-fcaggcaaatccagacgaccc seq id no.356r190-rctgcagcttgttcattgcttcatc seq id no.367l277m-fcgatgtatttcctggtgaaaaatccac seq id no.378l277-rcaaatgataaaagaccacttgttgtttcgtg seq id no.38
[0163]
突变体的构建方法同上,将组合突变体进行诱导表达,超声破碎,采用ni-nta his trap hp柱亲和层析进行蛋白纯化,通过血红素吡啶法测定纯酶浓度,进一步验证吲哚反应。
[0164]
生物合成靛蓝的反应体系组成包括:终浓度0.1μm的纯酶,终浓度4mm的吲哚,体积分数2%的dmso(作为吲哚助溶剂),终浓度0.5mm的双功能小分子im-c6-phe,终浓度的20mm h2o2,ph8.2 100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为1ml;对照体系为pet-28a(+)-f87g-t268v的纯酶反应;25℃反应30min。反应液加入9ml的dmso,通过紫外分光光度计检测620nm的吸光值,见表20。
[0165]
结果发现f77i与e140d的叠加,反应活性是父本酶的1.74倍,为最优突变体。
[0166]
表20
[0167][0168]
实施例8
[0169]
利用最优突变体p450 bmp-f87g-t268v-f77i-e140d纯酶(以下简称f87g-t268v-f77i-e140d)对反应ph、底物吲哚、h2o2、im-c6-phe进行优化。
[0170]
首先对反应体系的ph进行优化见图4,反应体系组成包括:终浓度0.1μm的f87g-t268v-f77i-e140d,终浓度4mm的吲哚,体积分数2%的dmso(作为吲哚助溶剂),终浓度0.5mm的双功能小分子im-c6-phe,终浓度20mm的h2o2,终体积为1ml,ph分别为7.2、8.2、9,100mm的tris-hcl缓冲溶液作为反应体系的溶剂;25℃反应30min。反应液加入9ml的dmso,通过紫外分光光度计检测620nm的吸光值。结果发现在8.2tris-hcl,反应活性最高。
[0171]
对底物吲哚浓度进行优化见图5,反应体系组成包括:终浓度为0.1μm的f87g-t268v-f77i-e140d,终浓度20mm的h2o2,终浓度0.5mm的双功能小分子im-c6-phe,反应体系中吲哚的终浓度分别为2、4、6、8、10mm,体积分数2%的dmso(作为吲哚助溶剂),ph8.2 100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为1ml;25℃反应30min。反应液加入9ml的dmso,通过紫外分光光度计检测620nm的吸光值。结果发现在终浓度为4mm吲哚时,反应活性最高。
[0172]
对h2o2浓度进行优化见图6,反应体系组成包括:终浓度为0.1μm的f87g-t268v-f77i-e140d,终浓度4mm的吲哚,体积分数2%的dmso(作为吲哚助溶剂),终浓度0.5mm的双功能小分子im-c6-phe,反应体系中h2o2的终浓度分别为20、40、60、80mm,ph8.2 100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为1ml;25℃反应30min。反应液加入9ml的dmso,通过紫外分光光度计检测620nm的吸光值。结果发现在终浓度为20mm h2o2时,反应活性最高。
[0173]
对双功能小分子im-c6-phe浓度进行优化见图7,反应体系组成包括:终浓度为0.1μm的f87g-t268v-f77i-e140d,终浓度4mm的吲哚,体积分数2%的dmso(作为吲哚助溶剂),反应体系中双功能小分子im-c6-phe的终浓度分别为0.25、0.5、1、2、4mm,ph8.2 100mm的tris-hcl缓冲溶液作为反应体系的溶剂,终体积为1ml;25℃反应30min。反应液加入9ml的
dmso,通过紫外分光光度计检测620nm的吸光值。结果发现在终浓度为2mm im-c6-phe时,反应活性最高。
[0174]
靛蓝浓度的测定:利用1ml ph8.2 100mm tris-hcl与9ml dmso配制不同浓度(0.01mm、0.02mm、0.03mm、0.04mm、0.05mm)的靛蓝标品,通过紫外分光光度计检测a620nm的吸收峰,标准曲线为y=17.178x,r2=0.99。
[0175]
综上所述,生物合成靛蓝的最优条件为:ph8.2 tris-hcl条件下,终浓度为0.1μm的f87g-t268v-f77i-e140d与终浓度为4mm吲哚(indole)、体积分数2%的dmso(作为吲哚助溶剂)、终浓度为2mm双功能小分子im-c6-phe、终浓度为20mm h2o2反应,25℃反应30min,反应液加入9ml的dmso,通过紫外分光光度计检测620nm的吸光值为0.792,通过标准曲线获得产物靛蓝浓度为461μm,ton为4611;本发明涉及的p450突变酶生物合成靛蓝的反应活性明显提高,其中本发明涉及的突变酶p450 bmp-f87g-t268v-f77i-e140d生物合成靛蓝的反应活性是父本酶f87g-t268v的1.74倍,效果最显著;本发明涉及的突变酶利用双功能小分子生物合成靛蓝,克服了p450酶催化应用一直受到昂贵的辅因子nad(p)h及其复杂的电子传递体系的限制,对于工业化微生物合成靛蓝,开发高效靛蓝生物合成的酶具有重要价值。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:丛志奇 孔繁慧 陈杰 刘传飞
- 技术所有人:中国科学院青岛生物能源与过程研究所
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....