一种天冬氨酸激酶基因表达调控序列及其应用
1.本发明属于分子生物学和生物工程领域,具体涉及用于调控天冬氨酸激酶基因转录表达的多核苷酸序列,以及利用该多核苷酸序列转录表达天冬氨酸激酶进而生产l
‑
赖氨酸的方法。
背景技术:
2.l
‑
赖氨酸,简称赖氨酸,为碱性氨基酸,是人类和动物营养中最重要的必需氨基酸,由于谷物食品中的赖氨酸含量甚低,且在加工过程中易被破坏而缺乏,故称为第一限制性氨基酸,被广泛应用于医药、健康、食品、动物饲料等行业中。赖氨酸主要采用微生物发酵法来生产,目前,主要的生产菌株包括大肠杆菌、谷氨酸棒杆菌等的微生物。
3.l
‑
赖氨酸的合成途径在许多微生物中都是从天冬氨酸起始的,包括两步和甲硫氨酸和苏氨酸共用的步骤,经过九步的酶催化过程,最终产生l
‑
赖氨酸。其中,天冬氨酸激酶(aspartate kinase,ask或ak,编码基因lysc)是l
‑
赖氨酸合成途径中天冬氨酸起始的第一个酶,它的活力决定着代谢流流向l
‑
赖氨酸合成途径的比例,是赖氨酸生产的限速步骤。天冬氨酸激酶的活力在微生物体内受复杂的调控。在许多l
‑
赖氨酸的生产菌中,天冬氨酸激酶的活力受到终产物l
‑
赖氨酸的负反馈抑制。目前已报道了大量的解除反馈抑制的天冬氨酸激酶突变体,如ep2374873a1。而如何进一步提高解除了反馈抑制的天冬氨酸激酶的表达,是微生物高产赖氨酸的必需途径。
技术实现要素:
4.本发明的目的之一在于解决现有技术中存在的问题,提供增强lysc基因表达调控的多核苷酸序列。本发明的发明人经过大量的工作发现,通过对人工合成的表达调控序列(其核苷酸序列如seq id no:1所示)的核糖体结合位点(ribosomebinding site,以下简称rbs)和起始密码子之间的间隔区部分序列ttactcta(即seq id no:1所示多核苷酸序列的第366位至373位)进行改造,将该序列与起始密码子gtg或ttg连接后形成的多核苷酸序列具有转录表达调控活性,这些具有转录表达调控活性的多核苷酸序列能够增加天冬氨酸激酶编码基因lysc的表达,从而实现l
‑
赖氨酸的大量积累,在此基础上完成了本发明。
5.本发明的另一目的是提供含有多核苷酸序列的载体,该多核苷酸序列显示改进的启动子活性。
6.本发明另一个目的是提供含有lysc基因表达调控序列的宿主细胞。
7.本发明还另一个目的是提供通过发酵宿主细胞产生l
‑
赖氨酸的方法。
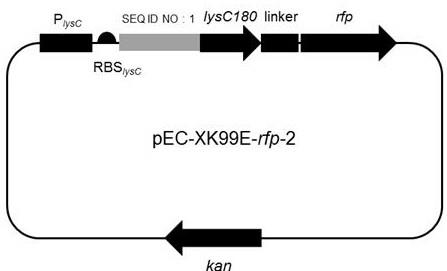
8.为了实现上述目的,本发明采用如下技术方案:在第一方面,本发明提供一种用于基因表达调控的多核苷酸序列,所述多核苷酸序列为:(1)在seq id no:1所示序列的第366位至373位进行一个或多个位置的核苷酸的取代和/或缺失,将所示经核苷酸取代和/或缺失后所得的序列与起始密码子gtg连接后形
成的多核苷酸序列;或者,(2)在seq id no:1所示序列的第366位至373位进行一个或多个位置的核苷酸的取代和/或缺失,将所示经核苷酸取代和/或缺失后所得的序列与起始密码子ttg连接形成的多核苷酸序列。
9.与未改造的seq id no:1相比,所述多核苷酸序列具有增强lysc基因表达的活性。
10.优选地,所述多核苷酸序列的核苷酸序列如seq id no:2、seq id no:3或seq id no:4所示。
11.在第二方面,本发明提供一种包含上述多核苷酸序列的载体。
12.优选地,所述载体是以pk18mobsacb为骨架,所述pk18mobsacb的genbank登记号为fj437239.1。
13.在第三方面,本发明提供一种用于lysc基因表达调控的表达盒,所述表达盒为将上述多核苷酸序列与无起始密码子的lysc基因可操作地连接形成的多核苷酸序列。
14.优选地,所述多核苷酸序列如seq id no:2、seq id no:3或seq id no:4所示。
15.在第四方面,本发明提供一种包含上述多核苷酸序列,或上述表达盒的宿主细胞。
16.优选地,所述多核苷酸序列如seq id no:2、seq id no:3或seq id no:4所示。
17.任选地,所述宿主细胞来源于棒状杆菌属、短杆菌属、节杆菌属、微杆菌属或埃希氏菌属;优选地,所述宿主细胞为谷氨酸棒杆菌或大肠杆菌;更优选地,所述宿主细胞为谷氨酸棒杆菌atcc 13032、谷氨酸棒杆菌atcc 13869或谷氨酸棒杆菌atcc 14067。
18.在第五方面,本发明提供一种增强天冬氨酸激酶编码基因lysc表达的方法,所述方法为将上述多核苷酸序列与无起始密码子的lysc基因可操作地连接。
19.优选地,所述多核苷酸序列如seq id no:2、seq id no:3或seq id no:4所示。
20.优选地,所述可操作地连接为将含有上述多核苷酸序列的载体导入宿主细胞中,通过同源重组整合到宿主细胞的基因组中。
21.进一步优选地,所述宿主细胞来源于棒状杆菌属、短杆菌属、节杆菌属、微杆菌属或埃希氏菌属;优选地,所述宿主细胞为谷氨酸棒杆菌或大肠杆菌;更优选地,所述宿主细胞为谷氨酸棒杆菌atcc 13032、谷氨酸棒杆菌atcc 13869或谷氨酸棒杆菌atcc 14067。
22.更进一步优选地,所述宿主细胞是经过如下改良的谷氨酸棒杆菌:1)谷氨酸棒杆菌atcc13032中的天冬氨酸激酶编码基因lysc引入了t311i突变编码序列;2)谷氨酸棒杆菌中丙酮酸羧化酶基因pyc启动子的第279位至第317位的核心区为cgggccttgattgtaagataagacatttagtataattag;3)谷氨酸棒杆菌中二氨基庚二酸脱氢酶基因ddh启动子的第279位至第317位的核苷酸由野生型atgcatctc突变为ccttgttat。
23.第六方面,本发明提供第一方面的多核苷酸序列、第二方面的载体、第三方面的表达盒、第四方面的宿主细胞在制备l
‑
赖氨酸中的应用。
24.第七方面,本发明提供了一种生产l
‑
赖氨酸的方法,所述方法包括培养第四方面的宿主细胞,使之生产l
‑
赖氨酸的步骤。
25.任选地,包括从发酵液中分离l
‑
赖氨酸的步骤。
26.第八方面,本发明提供第一方面的多核苷酸序列、第二方面的载体、第三方面的表达盒、第四方面的宿主细胞在制备天冬氨酸家族氨基酸及其衍生物中的应用,所述天冬氨
酸家族氨基酸及其衍生物包括l
‑
苏氨酸、l
‑
异亮氨酸、l
‑
高丝氨酸、l
‑
甲硫氨酸和l
‑
赖氨酸下游产物如戊二胺、5
‑
氨基戊酸、戊二酸。
27.本发明的有益效果本发明提供了具有增强lysc基因表达活性的多核苷酸,将其与目标基因lysc可操作地连接,可以显著提高lysc的表达强度,进而稳定、高效的生产下游产物。
28.本发明提供了生产l
‑
赖氨酸的方法,利用上述具有基因转录表达调控活性的多核苷酸,能够提高天冬氨酸激酶的表达,进而稳定、高效的生产l
‑
赖氨酸,l
‑
赖氨酸产量可达到起始菌株的1.9倍。
29.附图说明
30.图1示出了pec
‑
xk99e
‑
rfp
‑
1质粒图谱;图2示出了pec
‑
xk99e
‑
rfp
‑
2质粒图谱。
具体实施方式
31.下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
32.除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york: cold spring harbor laboratory press, 1989)中所述的条件,或按照制造厂商所建议的条件。
33.定义与说明:本发明所用的术语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
34.本发明所用的“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
35.本发明所用的“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
36.本发明所用的选择/可选/优选的“数值范围”既包括范围两端的数值端点,也包括相对于前述数值端点而言,所述数值端点中间所覆盖的所有自然数。
37.本发明中的术语“多核苷酸”指由核苷酸组成的聚合物。多核苷酸可以是单独片段的形式,也可以是更大的核苷酸序列结构的一个组成部分,其是从至少在数量或浓度上分离一次的核苷酸序列衍生而来的,能够通过标准分子生物学方法(例如,使用克隆载体)识别、操纵以及恢复序列及其组分核苷酸序列。当一个核苷酸序列通过一个dna序列(即a、t、g、c)表示时,这也包括一个rna序列(即a、u、g、c),其中“u”取代“t”。换句话说,“多核苷酸”指从其他核苷酸(单独的片段或整个片段)中去除的核苷酸聚合物,或者可以是一个较大核苷酸结构的组成部分或成分,如表达载体或多顺反子序列。多核苷酸包括dna、rna和cdna序列。
38.本发明中的术语“突变”是指在多核苷酸的一个或多个(例如,若干个)位置处包含突变的核苷酸,并且保持多核苷酸的启动子活性。其中,本发明中的突变(包含,取代、插入和/或缺失)特指其中的取代和缺失,取代是指用不同的核苷酸置换占用一个位置的核苷酸。缺失是指去除占据某一位置的核苷酸。
39.在一些具体的实施方案中,本发明的“突变”包含在seq id no:1所示序列的rbs间隔区的部分序列ttactcta(即seq id no:1所示序列的第366位至373位)进行一个或多个位置的核苷酸的取代和/或缺失,将该序列与起始密码子gtg或ttg连接后形成的多核苷酸序列,与未改造的seq id no:1相比,具有增强lysc表达的活性。
40.示例性地,本发明的“突变”包含在seq id no:1所示序列的第366位至373位进行1个、2个、3个、4个、5个、6个、7个、8个位置的取代和/或缺失。本发明的“突变”包含在seq id no:1所示序列的第363位至373位进行6个核苷酸的缺失,和/或对缺失后的序列进行0
‑
2个核苷酸的取代,并与起始密码子gtg或ttg连接。上述突变后形成的seq id no:2、seq id no:3或seq id no:4,与未被取代的seq id no:1相比,具有更高的基因转录表达调控活性。
41.本发明中的术语“启动子”是指一种核酸分子,通常位于目的基因编码序列的上游,为rna聚合酶提供识别位点,并位于mrna转录起始位点的 5’方向的上游。它是不被翻译的核酸序列,rna聚合酶与这一核酸序列结合后启动目的基因的转录。在核糖核酸(rna)的合成中,启动子可以和调控基因转录的转录因子产生相互作用,控制基因表达(转录)的起始时间和表达的程度,包含核心启动子区域和调控区域,就像“开关”,决定基因的活动,继而控制细胞开始生产哪一种蛋白质。
42.本发明中的术语“rbs间隔区”是指位于原核生物启动子区的一段核酸序列,是rbs与起始密码子之间的一段核苷酸序列。
43.本发明中的术语“起始密码子”具有本领域技术人员公知的定义,是指蛋白质合成起始位点的密码子,通常包括atg、gtg、ttg和ata。示例性的,本发明seq id no:2和seq id no:3中包含的起始密码子为gtg, seq id no:4包含的起始密码子为ttg。
44.本发明中的术语“表达”包括涉及rna产生及蛋白产生的任何步骤,包括但不限于:转录、转录后修饰、翻译、翻译后修饰和分泌。
45.本发明中的术语“转录表达盒”指的包含转录调控元件与目标基因,利用转录调控元件对目标基因的表达进行调控的一类表达元件。在本发明中,转录调控元件包含启动子,在此基础上,还可以包含增强子、沉默子、绝缘子等元件。在本发明中,目标基因具体为蛋白编码基因。
46.目标基因与多核苷酸“可操作地连接”,是指将具有启动子活性的多核苷酸与目标基因功能性连接,以启动和介导目标基因的转录,所述可操作地连接的方式可以采用本领域技术人员所述的任何方式。示例性的,本发明的目标基因与多核苷酸可操作地连接为将seq id no:2、seq id no:3、seq id no:4与lysc基因可操作连接后的多核苷酸序列。
47.本发明中的“lysc基因”指的是谷氨酸棒杆菌来源的天冬氨酸激酶(ec:2.7.2.4)的编码基因,包括但不限于天然存在的谷氨酸棒杆菌来源的lysc基因、解除了赖氨酸反馈抑制的lysc基因突变体(如t311i、d274a、q298g、n299l、n374a、e382a、r384l等),以及谷氨酸棒杆菌来源的经过人工改造的仍然具有天冬氨酸激酶活性的lysc基因突变体。示例性的,本发明的lysc基因是谷氨酸棒杆菌atcc13032的天冬氨酸激酶编码基因,基因编号为
ncgl0247或cgl0251,ncbi数据库gene id: 1021294,所编码的蛋白protein id: np_599504或wp_003855724.1。
48.本发明的“无起始密码子的lysc基因”是指缺失了起始密码子gtg的天冬氨酸激酶(ec:2.7.2.4)的编码基因。
49.本发明中的术语“载体”指的是dna构建体,其含有与合适的控制序列可操作地连接的dna序列,从而在合适的宿主中表达目的基因。“重组表达载体”指用于表达例如编码所需多肽的多核苷酸的dna结构。重组表达载体可包括,例如包含 i)对基因表达具有调控作用的遗传元素的集合,例如启动子和增强子;ii)转录成mrna并翻译成蛋白质的结构或编码序列;以及iii)适当的转录和翻译起始和终止序列的转录亚单位。重组表达载体以任何合适的方式构建。载体的性质并不重要,并可以使用任何载体,包括质粒、病毒、噬菌体和转座子。用于本发明的可能载体包括但不限于染色体、非染色体和合成dna序列,例如细菌质粒、噬菌体dna、酵母质粒以及从质粒和噬菌体dna的组合中衍生的载体,来自如牛痘、腺病毒、鸡痘、杆状病毒、sv40和伪狂犬病等病毒的dna。
50.示例性的,本发明涉及的载体为基于pec
‑
xk99e
‑
rfp质粒构建的具有表达调控序列的表征质粒pec
‑
xk99e
‑
rfp
‑
1和pec
‑
xk99e
‑
rfp
‑
2,pec
‑
xk99e
‑
rfp
‑
1和pec
‑
xk99e
‑
rfp
‑
2质粒图谱分别如图1和2所示。图1中p
lysc
表示为lysc基因的野生型启动子;lysc180表示野生型天冬氨酸激酶lysc编码基因n端的180 bp编码区;linker表示为位于lysc基因与rfp蛋白之间的连接肽;rfp表示为红色荧光蛋白(red fluorescent protein,rfp);kan表示为卡那霉素抗性(kanamycin resistant)。图2中seq id no:1表示为seq id no:1所示的启动子;lysc180表示野生型天冬氨酸激酶lysc编码基因n端的180 bp编码区;linker表示为位于lysc基因与rfp蛋白之间的连接肽;rfp表示为红色荧光蛋白(red fluorescent protein,rfp);kan表示为卡那霉素抗性(kanamycin resistant)。pec
‑
xk99e
‑
rfp
‑
1和pec
‑
xk99e
‑
rfp
‑
2转化入合适的宿主之后,可以复制并独立于宿主基因组发挥功能,或者在某些情况下整合入基因组本身。
51.本发明中的术语“宿主细胞”意指易于用包含本发明的多核苷酸的转录起始元件或表达载体转化、转染、转导等的任何细胞类型。术语“重组宿主细胞”涵盖导入转录起始元件或重组表达载体后不同于亲本细胞的宿主细胞,重组宿主细胞具体通过转化来实现。
52.本发明中的术语“转化”具有本领域技术人员普遍理解的意思,即将外源性的dna导入宿主的过程。所述转化的方法包括任何将核酸导入细胞的方法,这些方法包括但不限于电穿孔法、磷酸钙(capo4)沉淀法、氯化钙(cacl2)沉淀法、微注射法、聚乙二醇(peg)法、deae
‑
葡聚糖法、阳离子脂质体法以及乙酸锂
‑
dmso法。
53.本发明的宿主细胞是原核细胞,只要是能够导入本发明的具有转录表达调控活性的多核苷酸的细胞即可。在一个实施方案中,宿主细胞指来源于适合发酵生产氨基酸的微生物,例如棒状杆菌属、短杆菌属、节杆菌属、微杆菌属或埃希氏菌属。作为优选地,宿主细胞是来源于棒状杆菌属的谷氨酸棒杆菌。其中,谷氨酸棒杆菌可以是谷氨酸棒杆菌atcc 13032、谷氨酸棒杆菌atcc 13869或谷氨酸棒杆菌atcc 14067等。
54.本发明的宿主细胞的培养可以根据本领域的常规方法进行,包括但不限于孔板培养、摇瓶培养、批次培养、连续培养和分批补料培养等,并可以根据实际情况适当地调整各种培养条件如温度、时间和培养基的ph值等。
55.除非另外定义或由背景清楚指示,否则在本发明中的全部技术与科学术语具有如本发明所属领域的普通技术人员通常理解的相同含义。
56.具有增强lysc基因的表达活性的多核苷酸本发明通过对pec
‑
xk99e
‑
rfp
‑
2质粒中的ttactctagtg(下划线为seq id no:1的第366位至373位序列,是rbs间隔区的部分序列;粗体为lysc基因的起始密码子)进行改造,改造为序列“aggtg”、“tcgtg”、“ttttg”,并将含有以上突变的序列与pec
‑
xk99e质粒骨架片段通过诺唯赞的一步重组试剂盒克隆连接,分别获得pec
‑
xk99e
‑
rfp
‑
3、pec
‑
xk99e
‑
rfp
‑
4和pec
‑
xk99e
‑
rfp
‑
5表征载体。将以上质粒转化谷氨酸棒杆菌atcc13032,获得atcc13032(pec
‑
xk99e
‑
rfp
‑
3)、atcc13032(pec
‑
xk99e
‑
rfp
‑
4)和atcc13032(pec
‑
xk99e
‑
rfp
‑
5)菌株。与对照菌株atcc13032(pec
‑
xk99e
‑
rfp
‑
2)相比,具有更高的lysc基因转录表达调控活性。
57.赖氨酸的生产过程(1)本发明中将具有增强lysc基因表达活性的多核苷酸,与参与合成氨基酸的酶的编码基因可操作的连接,得到能够合成参与合成氨基酸的酶的重组表达载体,利用重组表达载体转化宿主细胞,获得重组宿主细胞。
58.(2)对重组宿主细胞进行发酵培养,从重组宿主细胞或重组宿主细胞的培养液中收集赖氨酸,完成赖氨酸的生产过程。
59.在一些实施方案中,宿主细胞为谷氨酸棒杆菌(corynebacterium glutamicum)。在一些具体的实施方案中,重组宿主细胞是经过如下改良的谷氨酸棒杆菌:1)谷氨酸棒杆菌atcc13032中的天冬氨酸激酶编码基因lysc引入了t311i突变编码序列;2)谷氨酸棒杆菌中丙酮酸羧化酶基因pyc启动子的第279位至第317位的核心区为cgggccttgattgtaagataagacatttagtataattag;3)谷氨酸棒杆菌中二氨基庚二酸脱氢酶基因ddh启动子的第279位至第317位的核苷酸由野生型atgcatctc突变为ccttgttat;4)将含有具有转录表达调控活性的多核苷酸seq id no:2、seq id no:3、seq id no:4的重组载体pk18
‑
1、pk18
‑
2、pk18
‑
3或pk18
‑
4转化上述谷氨酸棒杆菌,获得重组的谷氨酸棒杆菌。以上述方法改造的谷氨酸棒杆菌,是l
‑
赖氨酸的高产菌株。
60.与野生型相比,根据本发明所述的宿主细胞在天冬氨酸激酶基因表达上有所改良。因为天冬氨酸激酶是赖氨酸生物合成途径中最重要的酶,所以宿主细胞的发酵引起赖氨酸较高产率的产生。在本发明中,可利用公知方法进行转化体的发酵,并可适当地控制发酵条件,包括温度、时间、ph 等。以下文件提供了发酵的详细描述[chmiel ;bioprozesstechnik 1.einfuhrung in die bioverfahrenstechnik(gustav fischer verlag,stuttgart,1991), 以及storhas ;bioreaktoren undperiphere einrichtungen(vieweg verlag,braunschweig /wiesbaden,1994)]。发酵可通过分批培养、连续培养或补料分批培养实现。
[0061]
用于发酵,培养基必须满足所用菌株的需要。适用于培养各种微生物的培养基是本领域公知的(如,来自american society forbacteriology(washington d.c.,usa,1981) 的“manual of methods forgeneral bacteriology”)。培养基可包含如碳源糖(saccharides) 和碳水化合物(carbohydrates)(如葡萄糖、蔗糖、乳糖、果糖、麦芽糖、糖蜜、淀粉和纤维素),脂质和脂肪(如豆油、葵花籽油、花生油和椰子油),脂肪酸(如
棕榈酸、硬脂酸、蓖麻酸(rinoleic acid)),醇(如甘油和乙醇) 和有机酸(如醋酸)。这些物质可分别使用或组合使用。作为氮源,含氮有机化合物(如蛋白胨、酵母提取物、肉汤、麦芽汁、玉米浆、豆粕和尿素) 或含氮无机化合物(如硫酸铵、氯化铵、磷酸铵、碳酸铵和硝酸铵)可分别使用或组合使用。用于培养基的磷源的实例包括磷酸氢二钾、磷酸二氢钾和相应的钠盐。
[0062]
另外,培养基可包含细胞生长必需的金属盐(如硫酸镁或硫酸铁),并可补充必需营养物如氨基酸和维生素以刺激生长。此外,可向培养基添加适当的前体。可一次一起或在发酵过程中分别添加营养物和添加剂。
[0063]
培养基的ph 可用碱性化合物(如氢氧化钠、氢氧化钾或氨水) 或酸性化合物(如磷酸或硫酸) 调节。培养基中泡沫的生成可用消泡剂如聚乙二醇脂肪酸酯抑制。可通过在其中引入氧气或含氧气体混合物将培养基保持在有氧条件下。对于培养温度,通常在20℃到45℃之间,优选地在25℃到40℃之间。发酵连续进行直到产生l
‑
赖氨酸的最大量。在这方面,可在10 到160 小时内完成。l
‑
赖氨酸产生后,l
‑
赖氨酸可输出至培养基或可保持在细胞内。
[0064]
在一些具体的实施方案中,重组宿主细胞的培养条件为:首先将菌株接种到tsb液体培养基中培养8 h,培养物作为种子接种到每孔含有800 μl发酵培养基的24孔板中,初始od
600
控制约为0.1,30℃培养19 h,孔板摇床转速为800 rpm。
[0065]
对于tsb液体培养基,成分为:葡萄糖,5 g/l;酵母粉,5 g/l;大豆蛋白胨,9 g/l;尿素,3 g/l;丁二酸,0.5 g/l;k2hpo4•
3h2o,1 g/l;mgso4•
7h2o,0.1 g/l;生物素,0.01 mg/l;维生素b1,0.1 mg/l ;mops,20 g/l。
[0066]
对于发酵培养基,成份为:葡萄糖,80 g/l;酵母粉,1 g/l;大豆蛋白胨,1 g/l;nacl,1 g/l;硫酸铵,1 g/l;尿素,8 g/l; k2hpo4•
3h2o,1 g/l;mgso4•
7h2o,0.45 g/l;feso4•
7h2o,0.05 g/l;生物素,0.4 mg/l;维生素b1,0.1 mg/l ;mops,40 g/l;初始ph7.2。
[0067]
在一些具体的实施方案中,对于重组宿主细胞或重组细胞的培养液回收氨基酸,可通过本领域常用方法,包括但不限于:过滤、阴离子交换色谱、结晶和hplc。
[0068]
实施例1. 人工合成表达调控序列增强谷氨酸棒杆菌lysc基因的表达在细菌中,基因的表达调控序列及n端编码区是影响基因表达的关键区域。本发明采用基因的表达调控区、基因n端的180 bp编码区、一个柔性linker和一个红色荧光蛋白基因rfp顺序连接的方法,基于荧光强度对lysc基因的表达调控序列进行表达强度表征。
[0069]
本实施例首先构建1个表征谷氨酸棒杆菌lysc基因自身表达调控序列表达的表达强度的载体。具体构建如下:在pec
‑
xk99e质粒骨架基础上,由lysc基因自身启动子和rbs表达lysc基因n端60个氨基酸、一个连接肽和红色荧光蛋白基因。根据已公开的谷氨酸棒杆菌atcc13032基因组序列(gene id: 2830649)及lysc基因注释信息,设计引物lysc
‑
f/r,以atcc13032基因组为模板,通过pcr扩增获得lysc基因启动子、rbs 和n端180 bp的dna片段。以文献报道的pec
‑
xk99e
‑
rfp(王迎春等,基于时间序列转录组筛选谷氨酸棒杆菌内源高效组成型启动子[j]. 生物工程学报,2018,34(11):1760~1771 )质粒为模板,以pec
‑
1/2引物,扩增pec
‑
xk99e质粒骨架、连接肽(dna序列为:ggcggtggctctggaggtggtgggtccggcggtggctct)和红色荧光蛋白基因的dna片段。以上两个片段通过诺唯赞的一步重组试剂盒克隆连接,获得pec
‑
xk99e
‑
rfp
‑
1表征载体,质粒图谱如图1 所示。
[0070]
为了增强lysc基因的表达强度,本实施例人工合成了seq id no:1所示的表达调控序列,并将其插入lysc基因上游。为表征插入人工合成表达调控序列增强表达强度的效果,在pec
‑
xk99e
‑
rfp
‑
1表征载体基础上进一步构建表征载体。具体构建如下:以dna合成公司合成的核苷酸序列如seq id no:1所示的表达调控序列为模板,以pyc
‑
f/r为引物扩增带有20 bp同源臂的人工序列。以pec
‑
xk99e
‑
rfp
‑
1质粒为模板,以pec
‑
3/4引物,扩增质粒骨架。以上两个片段通过诺唯赞的一步重组试剂盒克隆连接,获得pec
‑
xk99e
‑
rfp
‑
2表征载体,质粒图谱如图2所示。本实施例所用引物序列如表1所示。
[0071]
表1为表征插入人工合成表达调控序列(seq id no:1)增强表达的强度,将构建的pec
‑
xk99e
‑
rfp
‑
1和pec
‑
xk99e
‑
rfp
‑
2分别转化至谷氨酸棒杆菌atcc13032,获得atcc13032(pec
‑
xk99e
‑
rfp
‑
1)和 atcc13032(pec
‑
xk99e
‑
rfp
‑
2)菌株。采用96孔板培养表征人工合成表达调控序列(seq id no:1)表达lysc的强度。tsb液体培养基成份为(g/l):葡萄糖,5 g/l;酵母粉,5 g/l;大豆蛋白胨,9 g/l;尿素,3 g/l;丁二酸,0.5 g/l;k2hpo4·
3h2o,1 g/l;mgso4·
7h2o,0.1 g/l;生物素,0.01 mg/l;维生素b1,0.1 mg/l ;mops,20 g/l。tsb固体培养基再补充15 g/l琼脂粉。将tsb平板获得的菌株用牙签接种至每孔含有200 μl tsb液体培养基的96孔板中,每个菌株3个平行,孔板摇床转速为800 rpm,30℃培养24 h后采用酶标仪检测菌株的荧光强度(激发波长:560 nm,发射波长:607 nm)。测定结果如表2所示,插入人工合成表达调控序列(seq id no:1)荧光强度提高了4.8倍,说明插入以上人工表达调控序列可以增强lysc基因的表达强度。
[0072]
表2实施例2. 人工合成表达调控序列及lysc基因起始密码子改造进一步增强lysc基因的表达强度rbs间隔区碱基序列和起始密码子的改造可用于进一步增强表达强度,本实施例
对pec
‑
xk99e
‑
rfp
‑
2质粒中的ttactctagtg(下划线为seq id no:1的第366位至373位序列,是rbs间隔区的部分序列;粗体为lysc基因的起始密码子)进行改造,改造为序列“aggtg”、“tcgtg”、“ttttg”,改造后获得的具有表达调控活性的多核苷酸序列分别如序列seq id no:2、seq id no:3、和seq id no:4所示。具体构建如下:以pec
‑
xk99e
‑
rfp
‑
2质粒为模板,以rbs1/ pec
‑
5、rbs2/ pec
‑
5、rbs3/ pec
‑
5为引物,分别扩增包括3种改造区的3个片段。以pec
‑
xk99e
‑
rfp
‑
2质粒为模板,以pec
‑
6/7为引物,扩增质粒骨架。以上3个包括改造区的片段分别与质粒骨架片段通过诺唯赞的一步重组试剂盒克隆连接,分别获得pec
‑
xk99e
‑
rfp
‑
3、pec
‑
xk99e
‑
rfp
‑
4和pec
‑
xk99e
‑
rfp
‑
5表征载体。本实施例所用引物序列如表3所示。
[0073]
表3为表征seq id no:2、seq id no:3、和seq id no:4增强表达的强度,将pec
‑
xk99e
‑
rfp
‑
3、pec
‑
xk99e
‑
rfp
‑
4和pec
‑
xk99e
‑
rfp
‑
5质粒分别转化至谷氨酸棒杆菌atcc13032,获得atcc13032(pec
‑
xk99e
‑
rfp
‑
3)、atcc13032(pec
‑
xk99e
‑
rfp
‑
4)和atcc13032(pec
‑
xk99e
‑
rfp
‑
5)菌株。以上菌株及对照菌株atcc13032(pec
‑
xk99e
‑
rfp
‑
2)再次采用实施例1相同策略测定荧光强度。结果如表4所示,atcc13032(pec
‑
xk99e
‑
rfp
‑
3)、atcc13032(pec
‑
xk99e
‑
rfp
‑
4)和atcc13032(pec
‑
xk99e
‑
rfp
‑
5)菌株的荧光强度分别比对照提高了1.3倍、2.7倍、5.0倍,表明起始密码子及上游rbs间隔区序列改造可以进一步增强lysc基因的表达。
[0074]
表4实施例3. 改造后的表达调控序列应用于l
‑
赖氨酸生产(1)谷氨酸棒杆菌lysc基因表达调控序列改造的重组载体构建根据实施例1和2表征的表达强度,分别将seq id no:2、seq id no:3、和seq id no:4按照前面相同方式插入谷氨酸棒杆菌atcc13032基因组上lysc基因上游,以增强lysc
基因的表达。根据已报道的谷氨酸棒杆菌atcc13032基因组序列,分别以atcc13032基因组为模板,以lysc
‑
uf / lysc
‑
ur为引物,pcr扩增部分上游同源臂;分别以pec
‑
xk99e
‑
rfp
‑
3、pec
‑
xk99e
‑
rfp
‑
4和pec
‑
xk99e
‑
rfp
‑
5质粒为模板,以pyc
‑
rbs1/pyc
‑
rbs2为引物,分别扩增对应的表达调控序列和部分上下游同源臂;以lysc
‑
df / lysc
‑
dr为引物,pcr扩增另一部分下游同源臂;以pk18
‑
1f/ pk18
‑
2r为引物扩增pk18mobsacb(genbank: fj437239.1)的骨架。上述4种pcr片段回收后,通过诺唯赞的一步重组试剂盒克隆连接,分别获得lysc基因表达调控序列改造的重组载体pk18
‑
2、pk18
‑
3和pk18
‑
4。以上所用引物序列如表5所示。
[0075]
表5(2)将lysc基因表达调控序列改造的重组载体引入谷氨酸棒杆菌赖氨酸生产菌为了验证lysc基因表达序列改造对l
‑
赖氨酸生产的影响,本发明首先构建一个可以生产l
‑
赖氨酸的基础菌株scgl40。谷氨酸棒杆菌l
‑
赖氨酸生产菌scgl40的遗传改造包括:将谷氨酸棒杆菌atcc13032天冬氨酸激酶基因lysc引入了t311i(碱基由acc突变为atc)氨基酸突变,丙酮酸羧化酶基因pyc启动子的第279位至第317位的核苷酸由野生型cgatgtttgattgggggaatcgggggttacgatactagg突变为cgggccttgattgtaagataagacatttagtataattag,二氨基庚二酸脱氢酶基因ddh启动子的第279位至第317位的核苷酸由野生型atgcatctc突变为ccttgttat。为了进一步引入lysc基因表达调控序列改造,将上述(1)构建的重组载体pk18
‑
2、pk18
‑
3和pk18
‑
4分别转化谷氨酸棒杆菌赖氨酸生产菌scgl40,涂布含有5 g/l葡萄糖和25 μg/ml卡那霉素的lbhis固体培养基上,30℃培养获得第一次重组的转化子。正确的一次重组转化子分别接种含有5 g/l葡萄糖的lb培养基,过夜培养,分别稀释涂布添加100 g/l蔗糖的lb固体培养基平板,通过抗性平板和无抗性平板同时点板培养对获得的克隆进行卡那霉素敏感性筛选。对卡那霉素敏感的克隆分别采用引物lysc
‑
c1(序列:cccagttcaagatgagtccc)和lysc
‑
c2(序列:ccgggatcattactataagacg)进行pcr扩增及测序,测序正确的克隆即为获得的lysc基因表达序列改造后的菌株scgl42、scgl43和scgl44。
[0076]
(3)谷氨酸棒杆菌赖氨酸生产菌lysc基因表达元件改造突变体的l
‑
赖氨酸生产能力评价为了测试谷氨酸棒杆菌中lysc基因表达元件改造对菌株产l
‑
赖氨酸的影响,分别对scgl40、scgl42、scgl43和scgl44菌株进行发酵测试,发酵培养基成份为:葡萄糖,80 g/
l;酵母粉,1 g/l;大豆蛋白胨,1 g/l;nacl,1 g/l;硫酸铵,1 g/l;尿素,8 g/l; k2hpo4·
3h2o,1 g/l;mgso4·
7h2o,0.45 g/l;feso4
·
7h2o,0.05 g/l;生物素,0.4 mg/l;维生素b1,0.1 mg/l ;mops,40 g/l;初始ph7.2。首先将菌株接种到tsb液体培养基中培养8 h,培养物作为种子接种到每孔含有800 μl发酵培养基的24孔板中,初始od
600
控制约为0.1,30℃培养19 h,孔板摇床转速为800 rpm,每个菌株3个平行,发酵结束后检测l
‑
赖氨酸产量和葡萄糖消耗量,并计算从葡萄糖到l
‑
赖氨酸的糖酸转化率。结果如表6所示,lysc基因表达元件改造后菌株的赖氨酸产量和糖酸转化率均有提高,scgl42菌株产量提高达89%。以上结果表明增强lysc基因表达强度的表达序列可应用于l
‑
赖氨酸生产。
[0077]
表6菌株od
600
l
‑
赖氨酸产量(g/l)转化率(%)scgl4015.7
±
0.43.7
±
0.36.9
±
0.5scgl4215.9
±
0.77.0
±
1.014.0
±
2.0scgl4317.3
±
0.35.0
±
0.08.9
±
0.2scgl4410.9
±
0.34.7
±
0.614.1
±
1.0由于天冬氨酸下游产物的合成均依赖于天冬氨酸激酶lysc催化的反应步骤,通过本发明公开的lysc基因表达增强的方法也可以用于提高依赖lysc催化反应的下游产物的产量。因此,本发明提供的技术方案也可用于l
‑
苏氨酸、l
‑
异亮氨酸、l
‑
高丝氨酸、l
‑
甲硫氨酸和l
‑
赖氨酸下游产物如戊二胺、5
‑
氨基戊酸、戊二酸等的生产。
[0078]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1