一种重组a-L-艾杜糖醛酸普酶及其制备方法与流程
一种重组a-l-艾杜糖醛酸普酶及其制备方法
技术领域
1.本发明涉及分子生物学领域,特别涉及一种重组a-l-艾杜糖醛酸普酶及其制备方法。
背景技术:
2.黏多糖贮积症(mps),是一种罕见病,其主要是因为溶酶体中降解黏多糖所需要的水解酶的缺陷,导致组织内大量的黏多糖贮积。黏多糖病ⅰ型(mps i),是由于a-l-艾杜糖醛酸普酶(alpha-l-iduronidase)缺乏导致的代谢紊乱综合征,其症状最重的亚型又称hurler综合征,常在10岁左右死亡,临床可见智能低下、面容丑陋、肝脾肿大、骨骼病变、心血管病变、角膜混浊和耳聋等多种表现。目前除了对症处理外,还有骨髓移植和基因治疗,但治疗过程复杂,风险性高,治疗效果不确切。临床上的重组酶替代疗法,是目前唯一疗效确实的药物疗法,通过静脉注射,风险小,但需要终身治疗,且费用高昂。
3.aldurazyme是genzyme和biomarin公司共同研制的重组的alpha-l-iduronidase,用于mps-i的酶替代治疗,也是目前唯一一种市售的治疗mps i的特异性药物。
4.a-l-艾杜糖醛酸普酶存在于哺乳细胞胞浆中的溶酶体,正常人血清中检测不到。其氨基酸序列中有一段不典型的信号肽序列(1-27:mrplrpraallallasll aappvapae)[uniprot https://www.uniprot.org/uniprot/p35475],然而,信号肽预测软件[signalp]分析显示,其信号肽的切割位置至少有三处[图10],而且信号肽切割位置并不在27-28位氨基酸处。因此,a-l-艾杜糖醛酸普酶的信号肽引导的分泌过程,并不是经典的蛋白质翻译后从内质网到细胞外的分泌过程,可能主要是引导翻译后的蛋白质从内质网到溶酶体的过程。从20世纪90年代起,人们就试图从不同组织中提取天然的酶,发现不同组织来源的酶的氨基端有很大差别[clements et al.,1989]。这一发现也间接证实了a-l-艾杜糖醛酸普酶的所谓的
‘
分泌性信号肽’并不是典型的分泌性蛋白的信号肽。尽管如此,1968年neufeld发现a-l-艾杜糖醛酸普酶仍然可以从细胞中分泌出来并被周围基因缺陷的细胞摄取,缓解胞浆内黏多糖贮积的表型[fratantoni et al.,1968],这一发现成为后来推动利用基因工程生产a-l-艾杜糖醛酸普酶,并用于临床治疗的奠基性发现。
[0005]
进一步的研究显示,a-l-艾杜糖醛酸普酶上有多种翻译后的修饰,除了常见的n-糖基化外,还有两处甘露糖糖基的磷酸化(bisphsophorylated oligomannosidic glycan)。其中347位氨基酸的糖基化是底物识别所必须的[maita et al.,2013],311和390位氨基酸的甘露糖糖基磷酸化是结合6-磷酸-甘露糖受体(mannose-6-phosphate receptor,m6pr),并实现细胞内化的关键修饰,通过m6pr跨越细胞膜,从细胞外进入细胞浆,然后再通过m6pr进入溶酶体。因此翻译后的修饰被认为是a-l-艾杜糖醛酸普酶发挥正常活性不可或缺的。由于这些特殊的翻译后修饰(n-糖基化磷酸化)形成的过程仍然不清楚,猜测可能是在分泌过程中形成的。
[0006]
基于a-l-艾杜糖醛酸普酶复杂的翻译后修饰(n-糖基化磷酸化),第一代重组酶(aldurazyme)谨慎地利用了其自身天然的信号肽,并通过dna重组技术,在cho细胞中,10%
fbs的培养基条件下进行生产,从培养上清中获取得到。但其产量低,约为20-40μg/天/10e7细胞。低表达量给后续的纯化带来很多挑战;尤其是如果利用a-l-艾杜糖醛酸普酶的天然信号肽,可能会导致不一致的氨基端,极大地限制了重组酶的纯度和均一性。
[0007]
因此,本领域的技术人员致力于开发一种能提高a-l-艾杜糖醛酸普酶表达量的重组a-l-艾杜糖醛酸普酶及其制备方法。
技术实现要素:
[0008]
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是提供一种能提高a-l-艾杜糖醛酸普酶表达量的重组a-l-艾杜糖醛酸普酶及其制备方法。
[0009]
为实现上述目的,本发明的一个方面提供了一种分离的核苷酸序列,包括信号肽序列和编码a-l-艾杜糖醛酸普酶核苷酸序列,其中,信号肽序列不是a-l-艾杜糖醛酸普酶的天然信号肽序列。
[0010]
进一步地,信号肽选自如seq id no:1、seq id no:2、seq id no:3或seq id no:4所示的序列。
[0011]
进一步地,编码a-l-艾杜糖醛酸普酶核苷酸序列如seq id no:9所示。
[0012]
可选地,所述分离的核苷酸序列,选自下列序列:
[0013]
1)seq id no:5、seq id no:6、seq id no:7或seq id no:8;
[0014]
2)与seq id no:5、seq id no:6、seq id no:7或seq id no:8具有至少80%以上同源性的核苷酸序列;
[0015]
3)编码多肽的密码子与1)或2)中的核苷酸序列的编码部分简并、且编码的是a-l-艾杜糖醛酸普酶的核苷酸序列。
[0016]
本发明的第二个方面提供了一种重组a-l-艾杜糖醛酸普酶,其包括a-l-艾杜糖醛酸普酶和异源信号肽,异源信号肽能在单一位点被切割。
[0017]
可选地,其氨基酸序列选自下列序列:
[0018]
1)seq id no:10、seq id no:11、seq id no:12或seq id no:13;
[0019]
2)与seq id no:10、seq id no:11、seq id no:12或seq id no:13具有至少95%以上同源性的氨基酸序列。
[0020]
进一步地,重组a-l-艾杜糖醛酸普酶在第311位、390位和426位具有糖基化修饰。
[0021]
进一步地,糖基化修饰为glcnac(2)man(7)p(2)。
[0022]
进一步地,重组a-l-艾杜糖醛酸普酶的细胞内化是由m6pr介导的。
[0023]
本发明的第三个方面提供了一种a-l-艾杜糖醛酸普酶的制备方法,使用如上所述的分离的核苷酸序列进行真核表达。
[0024]
可选地,在分离的核苷酸序列前加上kozark序列,构建至真核表达载体上,然后转入真核表达系统中进行表达。
[0025]
可选地,kozark序列为gccgccaccatgc。
[0026]
可选地,真核表达为在哺乳动物细胞中进行表达。
[0027]
可选地,哺乳动物细胞为chok1sv gs-ko。
[0028]
进一步地,制备方法包括:构建含有所述分离的核苷酸序列的重组真核表达载体;将所述重组真核表达质粒转入真核表达系统中,进行真核表达;收集上清,进行纯化后获得
所述a-l-艾杜糖醛酸普酶。
[0029]
进一步地,纯化包括亲和层析、疏水相互作用层析以及离子交换层析中的一种或多种。
[0030]
可选地,纯化为包括亲和层析、疏水相互作用层析以及离子交换层析在内的三步纯化。
[0031]
可选地,亲和层析为使用琼脂糖凝胶进行线性梯度洗脱,获得含有目的蛋白的洗脱液。其中,洗脱缓冲液为缓冲液b,20mm pb,2m nacl,ph5.3。
[0032]
可选地,疏水相互作用层析采用疏水层析柱,用于去除杂蛋白、多聚体;样品上样前加4m nacl到2m终浓度并用1m naoh调节ph至5~6,目的蛋白用洗脱缓冲液等度洗脱。其中,所述洗脱缓冲液为:20mm pb 0.15m nacl ph 5.5。
[0033]
可选地,离子交换层析使用耐盐阳离子柱,样品上样及平衡后,用洗脱缓冲液按照0-70%线性梯度洗脱目标蛋白。其中,洗过缓冲液为20mm pb 1m nacl ph5.5。
[0034]
可选地,经纯化后的溶液用30kda的膜超滤浓缩换液至含有0.0001%tween 80ph 5.5的磷酸缓冲液中。
[0035]
使用了本发明中的异源信号肽,不仅提高了重组a-l-艾杜糖醛酸普酶的表达量,还能产生切点单一,且翻译后修饰(n-糖基化磷酸化)正确的蛋白,能跨越细胞膜,在细胞内发挥酶活性的特点。
[0036]
以下将结合附图对本发明的构思、具体步骤及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
[0037]
图1是本发明实施例2中5种不同信号肽的a-l-艾杜糖醛酸普酶进行哺乳细胞表达的细胞上清蛋白电泳图;
[0038]
图2是商品化aldurazyme的n端序列分析的一级lc-ms图谱;
[0039]
图3是本发明实施例3中制备的asp-1-laronidase的n端序列分析的一级lc-ms图谱;
[0040]
图4(a)是商品化aldurazyme的n-糖基化磷酸化分析的二级lc-ms/ms图谱;(b)是此二级lc-ms/ms图谱中匹配到的(质量偏差小于20ppm)的多肽碎片离子的理论分子量;
[0041]
图5(a)是本发明实施例3中制备的asp-1-laronidase的n-糖基化磷酸化分析的二级lc-ms/ms图谱;(b)是此二级lc-ms/ms图谱中匹配到的(质量偏差小于20ppm)的多肽碎片离子的理论分子量;
[0042]
图6是a-l-艾杜糖醛酸普酶分解底物alpha-l四羟基环氧戊酸-4-甲基伞形酯产生有荧光信号的产物4-甲基伞形酮(4-methylumbelliferone)的示意图;
[0043]
图7是本发明实施例4的asp-1-laronidase与商品化aldurazyme的酶活性实验结果图;
[0044]
图8是m6p存在和缺失条件下,asp-1-laronidase与商品化aldurazyme进入hek293效率的western blotting鉴定图;hek293细胞在含0μg/ml asp-1-laronidase和aldurazyme(泳道1),10μg/ml asp-1-laronidase(泳道2),10μg/ml aldurazyme(泳道4),10μg/ml asp-1-laronidase+10mm/l m6p(泳道3),10μg/ml aldurazyme+10mm/l m6p(泳道
5)的培养基中培养3天,然后收集裂解并取50ng总蛋白进行western blotting检测。st:(asp-1-laronidase);
[0045]
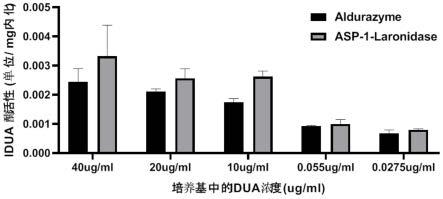
图9是本发明实施例6的asp-1-laronidase与商品化aldurazyme的细胞内化实验比较图;
[0046]
图10是使用信号肽预测软件[signalp]分析a-l-艾杜糖醛酸普酶的氨基酸序列中的不典型信号肽序列的切割位置。
具体实施方式
[0047]
以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
[0048]
下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。所采用的试剂,若无特殊说明,均为市售或公开渠道可以获得的试剂。
[0049]
在本发明中,可选用本领域已知的各种载体,如市售的载体,包括质粒等。
[0050]
根据本发明的一个具体实施方式,在a-l-艾杜糖醛酸普酶的编码核苷酸序列前添加人工信号肽序列形成重组核苷酸序列,利用所述重组核苷酸序列进行真核表达获得重组a-l-艾杜糖醛酸普酶。在本发明的一个具体实施方式中,使用的4中人工信号肽(seq id no:1、seq id no:2、seq id no:3或seq id no:4所示的序列)能够很好的提高a-l-艾杜糖醛酸普酶的表达量,且能获得切点单一、翻译后修饰(n-糖基化磷酸化)正确的a-l-艾杜糖醛酸普酶。
[0051]
实施例1合成5个质粒用于表达5种不同信号肽的a-l-艾杜糖醛酸普酶
[0052]
由金唯智公司合成带有4种不同信号肽(asp-1,seq id no:1;asp-2,seq id no:2;asp-3,seq id no:3;asp-4,seq id no:4)的laronidase质粒及含天然信号肽(nsp)的laronidase质粒,其中带人工信号肽的酶的核苷酸序列如seq id no:5(带asp-1),seq id no:6(带asp-2),seq id no:7(带asp-3),seq id no:8(带asp-4)所示;带天然信号肽的酶的核苷酸序列如seq id no:14所示,氨基酸序列如seq id no:15所示。使用的载体为pzd,其核苷酸序列如seq id no:16所示。
[0053]
实施例2 5种不同信号肽的a-l-艾杜糖醛酸普酶的哺乳细胞表达和培养上清定量
[0054]
2.1哺乳动物细胞表达5种不同信号肽的a-l-艾杜糖醛酸普酶
[0055]
将asp-1-laronidase-pzd,asp-2-laronidase-pzd,asp-3-laronidase-pzd,asp-4-laronidase-pzd,nsp-laronidase-pzd提取质粒,按照质粒与pei 1:5的比例预混,转染至hek293细胞中。5天后收集上清,去细胞碎片,用1m的磷酸将上清调节ph为5.5。每种表达上清取25ul,加入5ul蛋白上样缓冲液,95度煮样5分钟。跑12%的sds-蛋白电泳。
[0056]
蛋白电泳结果参见图1,从5种不同信号肽表达laronidase的细胞上清电泳结果可以直观看出,采用四种异源信号肽的laronidase表达量比采用天然信号肽nsp的表达量有所提升。
[0057]
2.2上清定量
pb 0.15m nacl ph 5.5等度洗脱,收集含有目标蛋白的洗脱液。
[0068]
用耐盐阳离子柱(如sulfate-650f(东曹),poros xs(thermo scientific),eshmuno-cps(merck)等填料)进一步精纯asp-1-laronidase。来自疏水层析收集液上样到用20mm pb 0.15m nacl ph 5.5平衡的耐盐阳离子柱上,上样后用平衡液洗脱至基线稳定,最后用20mm pb 1m nacl ph5.5按照0-70%线性梯度洗脱目标蛋白。收集洗脱液。最终样品用30kda的膜超滤浓缩换液至含有0.0001%tween 80ph 5.5磷酸缓冲液中。
[0069]
3.3将asp-1-laronidase和商品化aldurazyme送到正大康健公司,使用lc-ms/ms进行蛋白质n端分析。结果见表3,图2,图3,图4,图5。
[0070]
表3.商品化aldurazyme及asp-1-laronidase使用胰蛋白酶酶解产生n端多肽lc-ms/ms
[0071][0072]
由表3、图2-图5可知,经lc-ms/ms结果表明,使用的asp-1信号肽在蛋白在胞内加工后信号肽断裂的位置和商品化aldulazyme一致。
[0073]
其中,本实施例选择表达laronidase的idua基因时,所选择基因如seq id no:9所示,这个基因表达的蛋白和商品化aldurazyme在氨基酸序列第8位(不含信号肽)有区别,本实施例中的laronidase为8q,商品化aldurazyme为8h。这是基于idua基因的多态性考虑,在人群种前者占比约为85%。
[0074]
3.4将高纯度蛋白送到正大康健公司进行n-糖基化磷酸化分析,结果见表4。
[0075]
表4.样品使用糜蛋白酶水解糖肽lc-ms/ms定量结果
[0076][0077]
由表4可知,商品化aldurazyme和asp-1-laronidase的糖基化修饰基本相同。
[0078]
其中,修饰位点第311位、第390位、第426位为不含信号肽的laronidase的第311位、第390位、第426位。
[0079]
实施例4 asp-1-laronidase与商品化aldurazyme的酶活鉴定
[0080]
4.1配制ph3.5的醋酸钠溶液作为反应缓冲液。
[0081]
4.2配制ph10.7的甘氨酸溶液,作为终止液。
[0082]
4.3用dmso配制4mg/ml的底物(alpha-l四羟基环氧戊酸-4-甲基伞形酯)母液,-20℃冻存。
[0083]
4.4用反应缓冲液将底物母液稀释到800μm备用。
[0084]
4.5将asp-1-laronidase与商品化aldurazyme在0.9%氯化钠溶液中稀释到2μm,
梯度10倍稀释到0.0002μm,并添加空白对照(即不含酶的0.9%氯化钠溶液)。
[0085]
4.6取25μl底物与25μl 4.5中稀释为不同浓度的酶和氯化钠溶液在96孔荧光检测板混匀,在37℃保温20分钟后,加入200μl终止液终止反应。
[0086]
4.7将96孔荧光检测板放入酶标仪进行检测,设置酶标仪参数如下:激发360/40nm,发射460/40nm。
[0087]
asp-1-laronidase与商品化aldurazyme可以分解底物alpha-l四羟基环氧戊酸-4-甲基伞形酯产生有荧光信号的产物4-甲基伞形酮(4-methylumbelliferone),如图6所示。
[0088]
用相同摩尔浓度和体积的asp-1-laronidase和商品化aldurazyme,与相同体系、体积和浓度的底物进行反应,对产生的产物进行荧光值检测,荧光信号值的大小直接呈现酶活高低。检测结果如图7所示,结果说明相同摩尔浓度和体积的asp-1-laronidase和商品化aldurazyme酶活相当。
[0089]
实施例5 asp-1-laronidase与商品化aldurazyme的内化都是由m6pr介导的
[0090]
5.1 day 0
[0091]
5.1.1用500ul的胰酶消化t25瓶中的hek293细胞,1-2min;
[0092]
5.1.2加入5ml的dmem(10%fbs+25ug/ml的g418),将细胞吹开,混匀;
[0093]
5.1.3进行细胞计数,然后将细胞传成0.2
×
106/ml,5ml/t25瓶,共5瓶;
[0094]
5.1.4 3-4h后,取5.1.3中的4瓶细胞,分别加入10ug/ml的asp-1-laronidase(无m6p)、aldurazyme(无m6p)、asp-1-laronidase(含10mm/l m6p)、aldurazyme(含10mm/l m6p)。
[0095]
5.2 day 3
[0096]
5.2.1用胰酶消化上述处理后培养3天的hek293细胞,每t25瓶加500ul的胰酶消化1-2min;
[0097]
5.2.2加入3ml的dmem(10%fbs+25ug/ml的g418),将细胞吹开,混匀,并计数;
[0098]
5.2.3根据计数,计算3*106个细胞的体积。取对应体积进行细胞离心,弃去培养基,加入pbs清洗2次;
[0099]
5.2.4用超声破碎的方式进行裂解,用bca试剂盒测总蛋白浓度;
[0100]
5.2.5再取50ug的超声破碎的蛋白进行western blotting检测。以上蛋白样品先通过sds-page分离,然后通过半干法转到pvdf膜(roche),封闭后,依次加一抗(sheep anti-laronidase抗体)、二抗(过氧化物酶anti-sheep igg)温浴,最后加显色液,进行显色和拍照,结果如图8所示。
[0101]
如图8所示,在m6p存在条件下,hek293细胞在含asp-1-laronidase或商品化aldurazyme的培养基培养3天后,hek293细胞裂解液中没有检测到asp-1-laronidase或商品化aldurazyme。说明两者的细胞内化都是m6pr介导的。
[0102]
实施例6 asp-1-laronidase与商品化aldurazyme在hek293细胞中的细胞内化效率鉴定
[0103]
6.1将hek293细胞按照0.2
×
106/ml的密度接种到6孔板中,每孔体积为2ml。
[0104]
6.2将asp-1-laronidase与商品化aldurazyme分别按照40μg/ml,20μg/ml,10μg/ml,0.055μg/ml,0.0275μg/ml的量加入上述hek293培养液中,在摇床孵育培养。
[0105]
6.3孵育2.5h后,各取约2ml细胞到新的离心管中,200g离心5分钟,用pbs重悬细胞,重复清洗3次。至此,asp-1-laronidase与商品化aldurazyme的内化过程被终止。将清洗后的细胞加入300μl的细胞裂解液(thermo/#78501)进行裂解,得到的细胞裂解物可视为asp-1-laronidase或aldurazyme的粗酶溶液。
[0106]
6.4用bca试剂盒定量上述粗酶溶液中总蛋白的浓度。
[0107]
6.5配制ph3.5的醋酸钠溶液作为反应缓冲液。
[0108]
6.6用反应缓冲液将4.3中所述底物(alpha-l四羟基环氧戊酸-4-甲基伞形酯)母液稀释到360μm备用。
[0109]
6.7制备未处理的(即培养液中从未添加酶)hek293细胞的细胞裂解物。取15ml密度为0.2
×
106/ml的hek293细胞到新的离心管中,200g离心5分钟,用pbs重悬细胞,重复清洗3次后,加入7ml的细胞裂解液进行裂解。
[0110]
6.8将产物(4-甲基伞形酮)用混合液(50%6.7中所述未处理的hek293细胞裂解物+50%反应缓冲液)稀释成1.6μg/ml,0.8μg/ml,0.4μg/ml,0.2μg/ml,0.1μg/ml,0.05μg/ml,0.025μg/ml,并设置空白对照。
[0111]
6.9取50μl 6.3中粗酶溶液和50μl的360μm的底物加入96孔荧光检测板,同时取100μl 6.8中所述的产物稀释液加入同一96孔荧光检测板。
[0112]
6.10将96孔荧光检测板放入酶标仪检测荧光产物的生成量,动力学检测1.5小时,每分钟检测一次。(设置酶标仪参数如下:37℃,激发360/40nm,发射460/40nm。)
[0113]
6.11最终3-16分钟的读值被选择用于酶活单位计算。反应前期荧光产物的生成量与时间成正比,兼顾误差最小原则,选取3-16分钟的读值用于最终结果计算。
[0114]
上述过程简单来说,就是将已知相同浓度的asp-1-laronidase和商品化aldurazyme,加入到相同数量的hek293中进行孵育,2.5小时后,部分蛋白会内化到hek293细胞内。此时将细胞进行离心洗涤3次,去掉没有内化进入细胞内的酶。用相同体积的细胞裂解液分别裂解细胞,得到细胞裂解物(即asp-1-laronidase或aldurazyme的粗酶溶液)。由于其它条件设置相同,粗酶溶液的酶活和内化到细胞内的酶的含量呈现正相关。因此比较粗酶溶液的酶活就可以体现细胞内化的情况。计算过程中扣除了不加酶的本底对照。
[0115]
如图9所示,asp-1-laronidase的细胞内化率与商品化aldurazyme无明显差别。
[0116]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1