一种测定难以观察组织细胞感染与否的病毒的含量的方法与流程
本发明涉及生物领域,具体涉及一种测定难以观察组织细胞感染与否的病毒的含量的方法。
背景技术:
一些病原微生物感染细胞没有病变或者有病变但不明显,且暂时缺乏用于检测的特异性标记物,因此,在测定病原微生物的tcid50等方面,原有技术只能观察贴壁细胞病变噬斑或结合对病变不明显的样品的培养物抽提核酸进行pcr,看是否出现特异性条带来判定是否存在病原微生物感染。
这种技术存在以下几个缺点:1.利用细胞培养的病原微生物,会出现没有细胞病变或者细胞病变不易观察的情况;2.普通pcr无法区分特异性条带来自起始感染阶段的活病毒还是死病原微生物核酸,导致结果假阳性。3.某些情况下因为培养物模板原因,pcr过程中引物出现非特异扩增,或杂带干扰判断。
技术实现要素:
本发明的目的是提供一种测定难以观察组织细胞感染与否的病毒的含量的方法,该方法的优势在于:可相对准确的计算病原微生物的tcid50,不受外界干扰,避免假阳性。
本发明的具体方案如下:一种测定难以观察组织细胞感染与否的病毒的含量的方法,包括如下步骤:
步骤1:根据需检测病原微生物设计对应的荧光pcr引物和探针,并构建阳性重组质粒样品;
步骤2:利用步骤1的引物、探针和重组阳性质粒,构建该病原微生物的荧光定量标准曲线;
步骤3:培养健康细胞,以合适的密度传代到细胞培养板、细胞培养皿或者细胞培养瓶等适宜的细胞培养器材中;
步骤4:取适量待测定tcid50的病毒原液,用适宜的细胞维持液按照设定倍比稀释得到不同稀释度的接种病毒液,取一定定量的接种病毒液留样作为对照组,再取一定剂量的接种病毒液分别将其接种到步骤3准备好的细胞中作为接毒组,按照对应细胞的适宜条件进行培养;
步骤5:接毒组细胞培养适宜天数后,收取细胞悬液并进行冻融,以冻融后的接毒组细胞悬液和步骤4中收取作为对照组的接种病毒液为模板采用步骤1的荧光pcr引物和探针进行荧光定量pgr并根据ct值,按照步骤2得出的标准曲线,计算样本中的病原微生物拷贝数浓度,与相同稀释度的对照组病原微生物拷贝数浓度做比较,接毒组的病原微生物浓度拷贝数浓度比对照组病原微生物浓度拷贝数浓度高10倍,即为阳性;反之,则为阴性。
步骤6:根据步骤5统计的阳性和阴性结果,计算tcid50。
在上述方法中,所述病原微生物为禽腺病毒、禽自血病中的一种。
需要说明的是,本发明的病原微生物一般指的是病毒,其不限于上述两种病毒,本发明的方法特别适用于以下几种应用情况:
利用细胞培养的病原微生物,但是细胞没有出现病变或者细胞病变不易观察;2、利用鸡胚培养的病原微生物,但是鸡胚没有出现病变或者鸡胚病变不易观察3.无对应的免疫荧光抗体;4、暂无其他检测手段或判断标准的新发疫病病原。
在上述方法中,所述步骤4中,每个稀释度的病毒液均至少接种4个细胞样本。
在上述方法中,所述荧光定量pgr引物、探针以及pgr酶分别为对应病原微生物的荧光定量pgr引物和taqman探针;pcr酶为南京诺唯赞acequniversalu+probemastermixv2;
每20μl中上下游pcr引物各0.4μl,taqman探针0.2μl,pgr酶10μl。
在上述方法中,与相同稀释度的对照组病原微生物拷贝数浓度做比较,接毒组的病原微生物浓度拷贝数浓度比对照组病原微生物浓度拷贝数浓度高10倍,即为阳性;反之,则为阴性。
在上述方法中,步骤6中计算病原微生物的tcid50的方法为reed-muench两氏法。
在上述方法中,传代的培养方法为贴壁培养或悬浮培养。
在上述方法中,所述步骤5中培养天数为3-8天。
本发明相对于现有技术具有如下的优点及效果:
本发明特别适用于如下检测缺陷的病原微生物:1.利用细胞培养的病原微生物,但是细胞没有出现病变或者细胞病变不易观察;2、利用鸡胚培养的病原微生物,但是鸡胚没有出现病变或者鸡胚病变不易观察3.无对应的免疫荧光抗体;4、暂无其他检测手段或判断标准的新发疫病病原。
当然本发明并不排斥采用该方法对以上情况之外的其他病毒进行检测。
该方法的优势在于:可相对准确的计算病原微生物的tcid50,不受外界干扰,避免假阳性。
附图说明
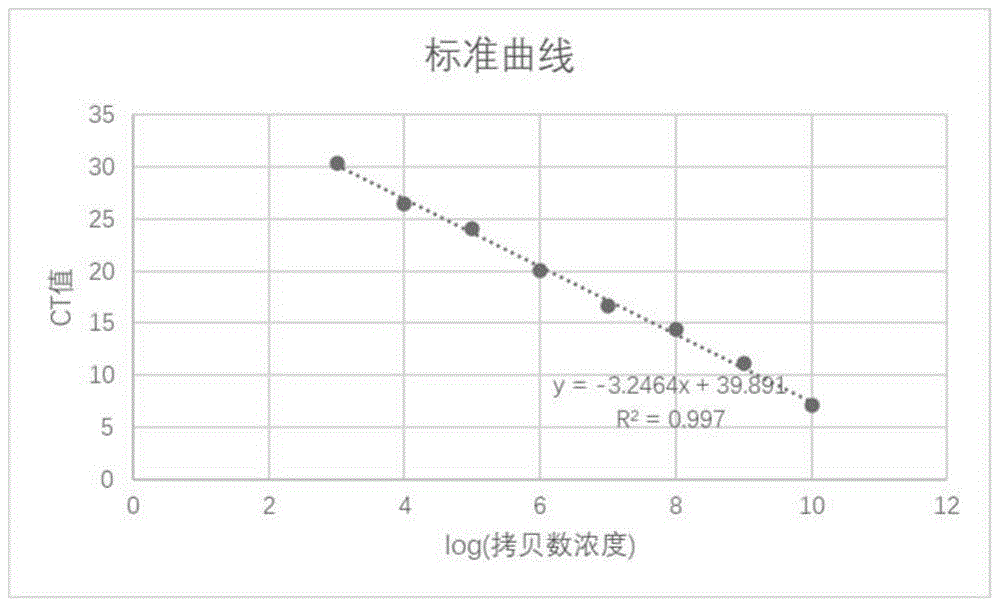
图1是本发明的实施例1的病原微生物的荧光定量标准曲线;
图2是本发明的实施例2的病原微生物的荧光定量标准曲线。
具体实施方式
下面结合实施例,对本发明作进一步的描述,但不构成对本发明的任何限制,任何在本发明权利要求范围所做的有限次的修改,仍在本发明的权利要求范围内。
实施例1
利用荧光定量pcr方法在贴壁细胞上测定禽腺病毒ticd50:
1、根据ncbi上已经登记禽腺病毒序列设计了一对特异性引物和一条taqman探针;以禽腺病毒dna为模板,用合成的引物进行pcr扩增,利用pcr产物构建阳性质粒,引物、探针和阳性质粒均由生工生物工程(上海)股份有限公司合成。
2、将阳性质粒标准品经核酸蛋白检测仪测定其浓度后,利用公式:(6.02×1014copies/mol)×(浓度ng/μl)/(dna长度×660)=copies/μl,计算出其拷贝数浓度,依次做10倍梯度稀释,以103~1010copies/μl的质粒为模板,进行荧光定量pcr,记录各标准品拷贝数录对应的ct值,数据见表1,以各标准品拷贝数浓度的对数为x轴,ct值为y轴构建标准曲线(见图1)。
表1不同拷贝数的标准品对应的ct值
3、将对数生长期的lmh细胞以4×105/2ml/孔的细胞密度接到12孔细胞培养板中,置于培养箱中培养,使其细胞贴壁良好并长至汇合度60%~80%。
4、根据经验以及已有数据等,估算待测的禽腺病毒的病毒含量为108tcid50/2ml左右,将需检测的腺病毒原液以pbs缓冲液做10倍梯度稀释(10-6~10-10),每个稀释度留300μl作为起始样本,将不同稀释度的病毒样品分别接种到步骤3准备好的12孔细胞培养板中,每个稀释度接6个孔,每个孔接种2ml,将接种后的12孔细胞培养板置于培养箱中孵育30min,吸去病毒液,向每孔加入2ml细胞维持培养液,置于细胞培养箱中培养。
5、接种病毒培养6天后将细胞培养板置于-20℃冻融,收取细胞悬液,以细胞悬液和步骤4收取的起始样本为模板采用步骤1的荧光pcr引物和探针进行荧光定量pcr并根据ct值,按照步骤2得出的标准曲线计算样本中的病原微生物拷贝数浓度,与起始样本的病原微生物拷贝数浓度做比较,接毒细胞的病原微生物浓度拷贝数浓度比同稀释度起始样本病原微生物浓度拷贝数浓度高10倍即提示病原细胞已经感染细胞,记为细胞病毒感染阳性;反之,则为细胞病毒感染阴性。样本拷贝数浓度及病毒感染细胞阳性判定见表2,统计结果见表3。
表3接种不同稀释度病毒培养6天后细胞病毒感染阳性数量统计情况
6、根据表3的统计结果,按照中华人民共和国兽药典(2015版三部)第207页《半数致死(感染)量(ld50、eld50、id50、eid50、tcid50)测定法》的要求,用reed-muench两氏法计算tcid50=107.6,即所测定的禽腺病毒的病毒含量为107.6tcid50/2ml。
实施例2
利用荧光定量pcr方法在悬浮细胞上测定禽腺病毒ticd50:
1、根据ncbi上已经登记禽腺病毒序列设计了一对特异性引物和一条taqman探针;以禽腺病毒dna为模板,用合成的引物进行pgr扩增,利用pcr产物构建阳性质粒,引物、探针和阳性质粒均由生工生物工程(上海)股份有限公司合成。
2、将阳性质粒标准品经核酸蛋白检测仪测定其浓度后,利用公式:(6.02×1014copies/mol)×(浓度ng/μl)/(dna长度×660)=copies/μl,计算出其拷贝数浓度,依次做10倍梯度稀释,以103~1010copies/μl的质粒为模板,进行荧光定量pcr,记录各标准品拷贝数录对应的ct值,数据见表4,以各标准品拷贝数浓度的对数为x轴,ct值为y轴构建标准曲线(见图2)。
表4不同拷贝数的标准品对应的ct值
3、将悬浮培养的lmh细胞以2×106/ml/瓶的细胞密度接到细胞培养瓶中,每瓶18ml。
4、根据经验以及已有数据等,估算待测的禽腺病毒的病毒含量为108tcid50/2ml左右,将需检测的腺病毒原液以细胞维持培养液做10倍梯度稀释(10-6~10-10),将不同稀释度的病毒样品分别接种到步骤3准备好的悬浮细胞中,每个稀释度接种6瓶细胞,每瓶接种2ml,将接种后的细胞置于细胞摇床上5min摇匀,每个稀释度取1ml样品作为起始样本,然后将细胞置于细胞摇床上培养。
5、接种病毒培养3天后将细胞培养瓶置于-20℃冻融,收取细胞悬液,以细胞悬液和步骤4收取的起始样本为模板采用步骤1的荧光pgr引物和探针进行荧光定量pcr并根据ct值,按照步骤2得出的标准曲线计算样本中的病原微生物拷贝数浓度,与起始样本的病原微生物拷贝数浓度做比较,接毒细胞的病原微生物浓度拷贝数浓度比同稀释度起始样本病原微生物浓度拷贝数浓度高10倍即提示病原细胞已经感染细胞,记为细胞病毒感染阳性;反之,则为细胞病毒感染阴性。样本拷贝数浓度及病毒感染细胞阳性判定见表5,统计结果见表6。
6、根据表6的统计结果,按照中华人民共和国兽药典(2015版三部)第207页《半数致死(感染)量(ld50、eld50、id50、eid50、tcid50)测定法》的要求,用reed-muench两氏法计算tcid50=107.6,即所测定的禽腺病毒的病毒含量为107.7tcid50/2ml。
表6接种不同稀释度病毒培养6天后细胞病毒感染阳性数量统计情况
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!