一株香蕉枯萎病生防拮抗菌株及其应用
1.本发明涉及生物肥料技术领域,特别涉及一株香蕉枯萎病生防拮抗菌株及其应用。
背景技术:
2.香蕉(musa spp.)是全球重要的热带和亚热带作物,不仅是世界第二大、贸易量第一大的水果作物,同时也是继水稻、小麦和玉米后的第四大粮食作物。我国是香蕉种植大国,主要种植于海南、广东、广西、福建、云南等省(区),香蕉产业的规模巨大。由尖孢镰刀菌古巴专化型(fusarium oxysporum f.sp. cubense,foc)的1号(race 1),2号(race 2)和4号(race 4)生理小种,尤其是 4号生理小种热带型(tropical race 4:tr4)引起的香蕉枯萎病是我国香蕉产区发生最为严重的一种毁灭性病害。目前还没有对香蕉枯萎病完全免疫的高抗商业香蕉品种,也没有理想的化学农药可防治香蕉枯萎病。因此,开展香蕉枯萎病生物防治、筛选对香蕉枯萎病具有抑制效果的生防菌株,开发相应的生防菌剂研究具有重要意义。
技术实现要素:
3.本发明的目的在于克服现有技术之不足,本发明的目的是提供一株抑菌率高的香蕉枯萎病生防拮抗菌株及其应用。
4.本发明的技术方案如下:本发明提供了如下技术方案:本发明的一株香蕉枯萎病生防拮抗菌株,该菌株为香蕉枯萎病生防拮抗菌株;保藏名称为贝莱斯芽孢杆菌bacillus velezensis;保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号;保藏日期:2020年11月16日;保藏编号:cgmcc no.21190。
5.进一步地,所述的贝莱斯芽孢杆菌bacillus velezensis菌株为香蕉枯萎病生防拮抗菌株。
6.进一步地,该菌株在将分离的菌株在na固体培养基上划线培养,37℃培养24h,在na平板上菌落呈圆形,不透明,中间稍凸起;正面呈乳白色,表面不光滑有皱褶,背面呈乳白色,较光滑湿润;革兰氏染色反应阳性,电镜观察细菌形态呈杆状,长度约1
‑
2μm。
7.本发明所述的香蕉枯萎病生防拮抗菌株制备的香蕉枯萎病生防拮抗菌菌剂。
8.本发明所述的香蕉枯萎病生防拮抗菌菌剂,其活性成分为如下(a)(b)(c) 中的至少一种:
9.(a)所述的香蕉枯萎病生防拮抗菌的发酵培养物;
10.(b)所述的香蕉枯萎病生防拮抗菌细胞的超声裂解上清;
11.(c)所述的香蕉枯萎病生防拮抗菌细胞的超声裂解沉淀。
12.本发明所述的香蕉枯萎病生防拮抗菌菌剂的制备方法,包括如下步骤:将拮抗菌株接种于200ml lb液体培养基,35
‑
37℃、180
‑
220r/min振荡培养16
‑
18 h,取菌液12000r/min离心5
‑
10min,收集菌体,用灭菌水洗涤1
‑
2次后,用200 ml的灭菌水重新悬浮菌体,制得
香蕉枯萎病生防拮抗菌菌剂。
13.本发明所述的香蕉枯萎病生防拮抗菌菌株在制备香蕉枯萎病制剂中的应用。
14.有益效果:本发明在香蕉组培苗中分离到两株香蕉共生细菌,平板对峙实验表明其中一株对香蕉枯萎病菌(tr4)具有显著抑制效果,抑制率高达79.63%,经鉴定该菌为一株贝莱斯芽孢杆菌,命名为yn1282
‑
2。盆栽实验也表明该菌对香蕉具有显著的促生以及枯萎病防治效果。
附图说明
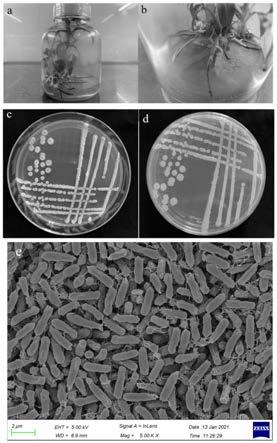
图1为本发明的分离菌株平板形态图.a
‑
b,组培瓶内菌株生长情况;c
‑
d,na 平板菌株生长情况;e,扫描电镜形态观察;图2为本发明的tr4单独培养对照图;细菌对tr4有明显的抑制作用(图,并且能使病原菌菌丝裂解,膨大变畸(图2c,d),而没有被yn1282
‑
2 拮抗的对照菌丝则无此变化(图2e)。图3为本发明的yn1282
‑
2系统发育树构建图。图4为本发明的测序序列用ncbi blast比对结果为yn1282
‑
2为一株贝莱斯 芽孢杆菌bacillus velezensis图。图5为本发明的dhbc、sboa为扩增到目的条带的示意图;图6为本发明yn1282
‑
2对云蕉1号(t27)香蕉枯萎病盆栽防治效果图。图7为本发明的yn1282
‑
2对巴西蕉(brazilian)香蕉枯萎病盆栽防治效果。
具体实施方式
15.下面将通过附图和具体实施例对本发明做进一步的具体描述,但不能理解为是对本发明保护范围的限定。
16.实施例1
17.本发明的一株香蕉枯萎病生防拮抗菌株,该菌株为香蕉枯萎病生防拮抗菌株;保藏名称为贝莱斯芽孢杆菌bacillus velezensis;保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是北京市朝阳区北辰西路1号院3号;保藏日期:2020年11月16日;保藏编号:cgmcc no.21190。
18.所述的贝莱斯芽孢杆菌bacillus velezensis菌株为香蕉枯萎病生防拮抗菌株。
19.该菌株在将分离的菌株在na固体培养基上划线培养,37℃培养24h,在 na平板上菌落呈圆形,不透明,中间稍凸起;正面呈乳白色,表面不光滑有皱褶,背面呈乳白色,较光滑湿润;革兰氏染色反应阳性,电镜观察细菌形态呈杆状,长度约1.5μm。
20.本发明所述的香蕉枯萎病生防拮抗菌株制备的香蕉枯萎病生防拮抗菌菌剂。
21.本发明所述的香蕉枯萎病生防拮抗菌菌剂,其活性成分为如下(a)(b)(c) 中的至少一种:
22.(a)所述的香蕉枯萎病生防拮抗菌的发酵培养物;
23.(b)所述的香蕉枯萎病生防拮抗菌细胞的超声裂解上清;
24.(c)所述的香蕉枯萎病生防拮抗菌细胞的超声裂解沉淀。
25.本发明所述的香蕉枯萎病生防拮抗菌菌剂的制备方法,包括如下步骤:将拮抗菌
株接种于200ml lb液体培养基,37℃、200r/min振荡培养18h,取菌液12000r/min离心5min,收集菌体,用灭菌水洗涤3次后,用200ml的灭菌水重新悬浮菌体,制得香蕉枯萎病生防拮抗菌菌剂。
26.本发明所述的香蕉枯萎病生防拮抗菌菌株在制备香蕉枯萎病制剂中的应用。
27.实施例2
28.实施例2与实施例1的区别在于:该菌株在将分离的菌株在na固体培养基上划线培养,37℃培养24h,在na平板上菌落呈圆形,不透明,中间稍凸起;正面呈乳白色,表面不光滑有皱褶,背面呈乳白色,较光滑湿润;革兰氏染色反应阳性,电镜观察细菌形态呈杆状,长度约1μm。
29.本发明所述的香蕉枯萎病生防拮抗菌菌剂的制备方法,包括如下步骤:将拮抗菌株接种于200ml lb液体培养基,35℃、180r/min振荡培养16h,取菌液12000r/min离心10min,收集菌体,用灭菌水洗涤1次后,用200ml的灭菌水重新悬浮菌体,制得香蕉枯萎病生防拮抗菌菌剂。
30.实施例3
31.实施例3与实施例1的区别在于:该菌株在将分离的菌株在na固体培养基上划线培养,37℃培养24h,在na平板上菌落呈圆形,不透明,中间稍凸起;正面呈乳白色,表面不光滑有皱褶,背面呈乳白色,较光滑湿润;革兰氏染色反应阳性,电镜观察细菌形态呈杆状,长度约2μm。
32.本发明所述的香蕉枯萎病生防拮抗菌菌剂的制备方法,包括如下步骤:将拮抗菌株接种于200ml lb液体培养基,36℃、220r/min振荡培养17h,取菌液12000r/min离心8min,收集菌体,用灭菌水洗涤2次后,用200ml的灭菌水重新悬浮菌体,制得香蕉枯萎病生防拮抗菌菌剂。
33.试验例1
34.下面结合实施例对本发明作进一步的详述。实施例中的微生物肥料,按微生物发酵常规方法及微生物肥料制备常规方法制成。
35.1实验材料
36.1.1菌株
37.(1)芽孢杆菌yn1282
‑
2菌株:为本实验室分离获得的一株香蕉内生菌,于
‑
80℃冰箱中甘油保藏备用。
38.(2)香蕉枯萎病菌:tr4(4号生理小种热带型)(fusarium oxysporum f.sp. cubense,foc)菌株15
‑
1,为本实验室2015年于西双版纳橄榄坝香蕉病株上分离保存。
39.1.2培养基
40.(1)lb液体培养基:胰蛋白胨10g,酵母提取物5g,nacl 10g溶解后用 5mol/lnaoh调ph至7.0,用去离子水定容至1l。
41.(2)na固体培养基:蛋白胨10g,牛肉膏3g,nacl 5g,琼脂15
‑
20g,定容至1l。
42.(3)pda培养基:马铃薯200g,葡萄糖20g,琼脂15
‑
20g,定容至1l,自然ph,不加琼脂的即为pdb液体培养基。
43.2实验方法
44.2.1菌株yn1282
‑
2的形态鉴定
45.将分离的菌株在na固体培养基上划线培养,37℃培养24h,观察记录菌落形态、透明度及菌落颜色等菌落特征,并在光学显微镜下观察细菌形态。冷冻电镜扫描观察:挑菌株单菌落接种至lb试管中,37℃,180rpm振荡培养16 h,取出后12000rpm离心收集菌体,用无菌蒸馏水清洗干净后重新悬浮菌体,吸取2
‑
3μl放在喷金板上后迅速置于液氮冷冻液,放入冷冻室升华喷金后在扫描电镜下观察细菌的形状及形态。
46.2.2菌株yn1282
‑
2的拮抗活性测定
47.使用点接种方法,测定分离菌株在pda平板上对tr4的抑制能力。具体步骤将目标病原菌丝体(tr4)(直径5毫米)放在pda平板的中央。在四个对称点接种分离的细菌。距板中心的距离为25mm。五次重复。只接种病原菌的平板用作对照。在28℃下培养5
‑
7天后通过十字交叉法测量病原菌直径。根据公式分别计算抑制区和真菌生长抑制百分比(gi):抑制生长百分比=[(c
–ꢀ
t)/c]
×
100%,其中c和t分别是对照和处理平板中真菌菌丝生长的直径。同时,将经过yn1282
‑
2拮抗后的tr4菌丝置于冷冻电镜扫描观察,轻轻挑取菌丝放在喷金板上后迅速置于液氮冷冻液,放入冷冻室升华喷金后在扫描电镜下观察真菌tr4的形状及形态。
[0048]
2.3菌株yn1282
‑
2的解磷功能测定
[0049]
将贝莱斯芽孢杆菌yn1282
‑
2采用划线法接种于na固体培养基进行活化,37℃培养24h。用高压灭菌过的牙签挑取活化后的贝莱斯芽孢杆菌yn1282
‑
2单菌落接种于有机磷培养基平板上,每个平板接种3个菌落,设置3组平行试验。接种后的平板置于37℃培养7天,用十字交叉法检测测量透明圈的大小。选择有解磷圈出现的菌落测量该菌落直径d和解磷圈直径d,计算d/d比值,确定解磷能力强度。
[0050]
2.4菌株yn1282
‑
2的生理生化鉴定
[0051]
细菌的生理生化测定采用biolog微孔板法,依照biolog genⅲ微孔板操作手册进行。具体操作为将纯培养的菌种接种至bug琼脂培养基,33℃培养;然后使用inoculatorz棉签从平板中沾取菌落,然后将棉签的末端深入装有接种液的接种管底端,来回上下晃动细菌释放到接种液中,搅动均匀后得到细胞悬液,用浊度仪测定并调至所需浓度;然后将菌悬液加入鉴定板盖上盖子,分别在24h 和48h之后,放入biolog读数仪测定。
[0052]
2.5菌株yn1282
‑
2的分子鉴定
[0053]
将拮抗菌株接种于na液体培养基,37℃、180r/min振荡培养18h,取1ml 菌液12000r/min离心1min,收集菌体,使用ezup柱式细菌基因组dna抽提试剂盒(生工生物工程股份有限公司)对拮抗细菌的dna进行提取。pcr扩增引物为27f/1429r(5’agagtttgatcctggctcag3’/5
’ꢀ
ctacggctaccttgttacga3’),its1/its4(5’tccgtaggtgaacctgcgc3
’ꢀ
/5’tcctccgcttattgatatgc3’)。扩增条件为95℃5min,95℃30s,58℃30s, 72℃1min30s,72℃7min,35cycles。反应完成后,取3ul pcr产物进行1%琼脂糖凝胶电泳检测,确认pcr扩增片段。pcr产物用axyprep dna凝胶回收试剂盒回收,具体操作按试剂盒说明书进行。取各个菌种纯化后的pcr产物,使用测序仪abi3730
‑
xl进行dna测序。用ncbi blast程序将拼接后的序列文件与ncbi 16s数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息,使用mega6.0进行构建系统发育树,即为鉴定结果。
[0054]
2.6菌株yn1282
‑
2的生防基因检测
[0055]
取出斜面保藏的菌株贝莱斯芽孢杆菌yn1282
‑
2于na培养基平板活化,用灭菌的牙
签挑取单菌落于50μl的lysis buffer中混匀,然后置于80℃水浴裂解 15分钟,低速离心1min,取上清液作为dna模板。使用表1中的9对引物分别对yn1282
‑
2进行pcr扩增,扩增体系(25μl):mix酶22μl,模板1μl,上游引物1μl,下游引物1μl.扩增条件为98℃2min;98℃10s;54℃15s(引物147f/147r、fedf1/fndr1、bamc2f/bamc2r)或57℃15s(引物110f/110r) 或51℃15s(引物itucf1/itucr3)或56℃15s(引物itud2f/itud2r)或58℃ 15s(引物dhbcf/dhbcr、sbo1f/sbo1r)或55℃15s(引物ysnef/ysner);35 个循环;72℃10s;72℃5min.最后使用1%的琼脂糖凝胶电泳检测扩增产物。
[0056]
表1 pcr扩增的引物基因序列
[0057][0058][0059]
2.7菌株yn1282
‑
2的防治效果盆栽实验
[0060]
为进一步探讨贝莱斯芽孢杆菌yn1282
‑
2对香蕉枯萎病的防控效应及作用机理,为香蕉枯萎病的生物防治提供理论支撑。具体操作为将拮抗菌株接种于 200ml lb液体培养基,37℃、220r/min振荡培养发酵48h,取菌液12000r/min 离心10min,收集发酵液,制得香蕉枯萎病生防拮抗菌菌剂,取20ml发酵原液加入180ml灭菌水即得到200ml发酵10倍稀释液。每盆接种40ml发酵液,接种同体积的空白培养基为空白对照。
[0061]
将tr4挑取菌丝接种到pdb培养基中,28℃、180r/min振荡培养发酵72h,取菌液12000r/min离心10min,收集菌体,用200ml的灭菌水重新悬浮菌体 (1
×
108spore/ml),再将菌液稀释100倍即为获得香蕉枯萎病菌接种液(1
×
10
6 spore/ml)。每盆接种40ml菌悬液,接种同体积的灭菌水为空白对照。
[0062]
本研究通过设置不同接种处理(表2)进行盆栽试验,探究yn1282
‑
2对抗性品种云蕉1号及感病品种巴西蕉的香蕉枯萎病防控效果,yn1282
‑
2盆栽试验处理如表2所示:
[0063]
表2 yn1282
‑
2盆栽试验处理
[0064][0065][0066]
3实验结果
[0067]
3.1菌株yn1282
‑
2的分离及形态鉴定
[0068]
在香蕉组培苗发现一株香蕉共生菌,分离至平板后命名为yn1282
‑
2,在na平板上菌落呈圆形,不透明,中间稍凸起;正面呈乳白色,表面不光滑有皱褶,背面呈乳白色,较光滑湿润;革兰氏染色反应阳性,电镜观察细菌形态呈杆状,长度约1
‑
2μm。
[0069]
图1.分离菌株平板形态图.a
‑
b,组培瓶内菌株生长情况;c
‑
d,na平板菌株生长情况;e,扫描电镜形态观察.figure1.platemorphologyofisolatedstrain.a
‑
b,thegrowthofisolatedstraininthetissueculturebottle;c
‑
d,thegrowthofisolatedstraininnaplate.e,morphologyunderscanningelectronmicroscope.
[0070]
3.2菌株yn1282
‑
2的拮抗活性测定
[0071]
我们将分离的细菌做了tr4对峙实验,同时接种了细菌和病原菌tr4,培养7天后观察病原菌的生长情况,结果可知,该细菌对tr4有明显的抑制作用(图2a,b),并且能使病原菌菌丝裂解,膨大变畸(图2c,d),而没有被yn1282
‑
2拮抗的对照菌丝则无此变化(图e)。抑菌率高达79.63%(表3)。并且能使分离菌株拮抗tr4对峙平板图.a,yn1282
‑
2与tr4对峙平板图;b,tr4单独培养对照如图2所示,菌株yn1282
‑
2平板抑制率如表3所示:
[0072]
表3yn1282
‑
2的平板对峙抑菌效果
[0073][0074]
3.3菌株yn1282
‑
2的解磷功能测定
[0075]
yn1282
‑
2在有机磷培养基上培养后使用经测量,3组平行试验中,解磷圈直径d
(cm)分别为:1.55、1.40、1.43,其中的菌落直径d(cm)分别为:1.08、0.90、0.90。经计算,d/d比值分别为:1.43、1.56、1.59(图3)。
[0076]
3.4yn1282
‑
2的分子鉴定
[0077]
将yn1282
‑
2提取dna后进行pcr扩增测序,测序获得菌株(yn1282
‑
2)的16srrna基因片段序列长度为1420bp(genbank登录号:mw663765)。测序序列用ncbiblast比对结果为yn1282
‑
2为一株贝莱斯芽孢杆菌(bacillusvelezensis)(图4)。yn1282
‑
2系统发育树构建如图3所示:
[0078]
3.5yn1282
‑
2的生理生化测定
[0079]
使用biologgenⅲ微孔板进行了yn1282
‑
2测定,结果表明yn1282
‑
2是革兰氏阳性菌,其他的生化测定如表4所示:
[0080]
表4yn1282
‑
2biologgenⅲ测定
[0081][0082]
3.6yn1282
‑
2的生防基因鉴定
[0083]
对菌株yn1282
‑
2进行生防/促生基因检测,通过pcr检测的9个生防基因的pcr检测结果表明,在菌株yn1282
‑
2中,扩增到srfab、yndj、fend、ituc、itud、bamc、ysne7个基因的目的条带,dhbc、sboa为扩增到目的条带,阴性对照无条带(图5)。其中,扩增到的基因有srfab、yndj、fend、ituc、itud、bamc6个基因具有抑菌拮抗功能,ysne基因具有促生功能,表明该菌株具有良好的生防潜力。
[0084]
3.7yn1282
‑
2对香蕉枯萎病的防治效果
[0085]
3.7.1yn1282
‑
2对云蕉1号香蕉枯萎病的防治效果
[0086]
为了进一步探究贝莱斯芽孢杆菌yn1282
‑
2是否对香蕉枯萎病有良好的防控效果以及是否对香蕉有促生作用,我们进行了温室盆栽试验。结果表明:云蕉1号(t27)在接种tr4后30天,接种yn1282
‑
2发酵原液的香蕉植株的株高显著高于接种yn1282
‑
2稀释10倍发酵液的处理,高于不接生防菌的对照但差异不显著(图6a,f);而接种yn1282
‑
2发酵原液的香蕉植株的假茎粗度显著高于稀释10倍的处理及对照(图6b);叶片数上无显著变化(图6c);病情指数调查情况可以看出,接种生防菌处理的香蕉植株病情指数均低于对照,并且yn1282
‑
2发酵原液的香蕉植株的病情指数低于10倍稀释液的处理;yn1282
‑
2发酵原液的防治效果为69.23%,yn1282
‑
2稀释10倍发酵液的处理的防治效果为46.15%(图6d,e.表
5)。在不接种tr4的处理中,接种生防菌处理的株高显著高于不接种生防菌的对照(图6a,e,f);接种yn1282
‑
2发酵原液的香蕉植株的假茎粗度显著高于稀释10倍的处理及对照(图6b);叶片数生长同样没有显著差异(图6c)。由此可以看出,贝莱斯芽孢杆菌yn1282
‑
2不仅可以有效抑制云蕉1号枯萎病的发生,并且对云蕉1号植株有一定的促生作用。
[0087]
图6为本发明yn1282
‑
2对云蕉1号(t27)香蕉枯萎病盆栽防治效果。a. 各处理的植株高度生长情况;b.各处理的假茎围度生长情况;c.各处理的叶片生长情况;d.叶片病情指数;e.接种tr4的三个处理的植株生长情况;f.不接中tr4的三个处理的植株生长情况n=12.
[0088]
3.7.2yn1282
‑
2对巴西蕉香蕉枯萎病的防治效果
[0089]
同样对巴西蕉进行了盆栽试验,结果发现巴西蕉(brazilian)在接种tr4 后30天,接种yn1282
‑
2发酵原液的香蕉植株的株高显著高于不接生防菌的对照,与接种yn1282
‑
2稀释10倍发酵液的处理无显著差异(图7a,e);而香蕉植株的假茎粗度和叶片数无显著差异(图7b,c);病情指数调查情况可以看出,接种生防菌处理的香蕉植株病情指数均显著低于对照,并且yn1282
‑
2发酵原液的香蕉植株的病情指数显著低于10倍稀释液的处理;yn1282
‑
2发酵原液的防治效果高达80.95%,yn1282
‑
2稀释10倍发酵液的防治效果为61.90%(图7d,e.表 6)。在不接种tr4的处理中,接种yn1282
‑
2发酵原液的香蕉植株的株高显著高于接种yn1282
‑
2稀释10倍发酵液的处理,与不接种生防菌的对照无显著差异(图7a,e,f);而假茎粗度和叶片数生长均无显著差异(图7b,c)。可以看出,贝莱斯芽孢杆菌yn1282
‑
2可以有效抑制巴西蕉枯萎病的发生,也有一定的促生作用。
[0090]
图7为本发明的yn1282
‑
2对巴西蕉(brazilian)香蕉枯萎病盆栽防治效果。 a.各处理的植株高度生长情况;b.各处理的假茎围度生长情况;c.各处理的叶片生长情况;d.叶片病情指数;e.接种tr4的三个处理的植株生长及剖根情况; f.不接中tr4的三个处理的植株生长及剖根情况;n=12.
[0091]
4.讨论
[0092]
香蕉枯萎病生物防治的研究报道较多,利用拮抗细菌防治香蕉枯萎病是目前采取的主要对策之一,但很多生防菌易受周围环境条件影响,不易在病原物存在的环境中定殖,从而严重影响其防效。本研究在香蕉组培苗中分离到两株香蕉共生细菌,平板对峙实验表明其中一株对香蕉枯萎病菌(tr4)具有显著抑制效果,经后续鉴定该菌为一株贝莱斯芽孢杆菌(bacillus velezensis)。盆栽实验表明该菌对香蕉枯萎病有良好的防治效果,并且对香蕉也有明显的促生作用。这与很多对香蕉枯萎病拮抗细菌的研究报道一致。
[0093]
本实验设置了两个生防菌接种浓度,结果表明稀释后的菌液对香蕉枯萎病的防治效果以及促生效果都没有发酵原液的效果好,这可能表明生防菌进入土壤中需要达到一定的浓度才会大量定殖并且发挥作用,低浓度的菌液可能使生防菌无法与本土微生物形成竞争从而抵抗香蕉枯萎病,但是从结果可以看出低浓度的菌液效果还是明显好于对照,说明只要土壤中存在一定数量的生防菌也会在一定程度上抑制病原菌的生长和侵染。
[0094]
本实验香蕉植株整体发病不是非常严重,可能是因为病原菌接种方式为灌根接种,并未伤根,病原菌的侵染很难通过伤口进入。不过接种和未接种的处理植株发病情况对比明显,因此可能延长接种后的侵染时间效果更加明显。
[0095]
5.结论
[0096]
本研究从香蕉组培苗中分离到一株香蕉共生细菌,平板对峙实验表明其中一株对香蕉枯萎病菌(tr4)具有显著抑制效果,经后续鉴定该菌为一株贝莱斯芽孢杆菌(bacillus velezensis)。盆栽实验表明该菌对香蕉枯萎病有良好的防治效果,并且对香蕉也有明显的促生作用。
[0097]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1