一种多个水稻性状控制基因变异检测功能标记方法
1.本发明涉及涉及基因组学、分子生物学、分子遗传学、生物信息学和分子植物育种领域,特别涉及一种多个水稻性状控制基因变异检测功能标记方法。
背景技术:
2.水稻是我国最主要的粮食作物之一,对保障国家粮食安全起到举足轻重的作用,粮食生产的关键在于优良品种的选育,而传统的品种选育依赖于过程复杂、鉴定周期长、受环境影响大的表型鉴定,一个优良品种的培育往往需要花费多至十几年的时间周期,为了提高选择效率,育种家在实践中不断探索运用分子标记技术来进行分子标记辅助育种选择。分子标记技术是分子标记辅助育种中的核心工具,常用分子标记技术如rflp(限制性片段长度多态性)和ssr(简单序列重复)技术,snp(单核苷酸多态性)标记检测技术,在功能基因组研究及分子标记辅助育种中发挥着重要作用。但是传统的分子标记技术存在许多局限性,如通量低、数量少、操作过程繁琐,不能满足大规模商业化育种的需求,为了对目标基因进行精确控制,对遗传背景进行有效选择,对育种品种进行准确分析和鉴定,需要开发和利用高通量分子标记技术。目前高通量分子标记技术平台主要包括:第二代测序技术和基因芯片技术,但上述这些分子标记检测方法,大都是作为随机标记在应用,并没有考虑变异和基因功能及控制性状间的联系,一方面,水稻已经克隆了大量重要农艺性状控制基因,其中一些控制重要农艺性状的变异已经通过实验证实;另一方面,育种材料中重要农艺性状控制基因的变异是未知的,所以,通过功能标记对育种材料中已知重要农艺性状控制基因的变异进行检测有重要的育种应用价值。
3.市面上对个别基因进行功能标记开发的研究及相关专利比较多,但系统的开发多个重要农艺性状基因的功能标记的研究还未见报道,个别基因的功能标记只能对育种材料作出是否含有某个育种有利等位基因的判断,多个功能标记则可以对育种材料中的多个性状的多个育种有利等位基因的存在作出综合性的片段,在此基础上可以开展有效的设计育种。此外,功能标记组可以应用到对品种资源进行分子标记指纹分析、对杂交群体后代进行基因型鉴定、对品种真实性进行鉴定、对育种材料遗传背景进行分析和筛选、对农艺性状进行关联分析等研究,具有广阔的应用前景。
4.现有技术中也可利用基于pcr的分子标记技术,如kasp、indel和casp等分子标记方法,逐个基因的变异位点开发功能标记进行检测,但是在检测时需要逐个标记进行检测,过程复杂,效率低,耗时较长;也可利用全基因组二代测序的方法进行检测,但是成本比较高,需要复杂的生物信息学方法进行数据处理,适合对少量材料进行分析,不适合进行大量育种材料的分析及分子标记辅助育种;若利用包含目标功能变异的高密度snp芯片进行检测,则需要重新设计包含已知功能位点的芯片,使用成本非常高,不适合进行大量育种材料的分析及分子标记辅助育种。
技术实现要素:
5.本发明的目的在于提供一种多个水稻性状控制基因变异检测功能标记方法,具有的能够通过一次实验同步获得多个重要目标基因变异的基因型数据,可以很方便地对大量育种材料进行多个重要基因变异进行扫描,能够有效克服传统分子标记技术低效率的问题,检测成本比基于常规的二代测序及高密度芯片的检测方法大大降低的优点,以解决上述背景技术中提出的检测过程复杂,效率低,耗时较长,成本比较高,需要复杂的生物信息学方法进行数据处理,适合对少量材料进行分析,不适合进行大量育种材料的分析及分子标记辅助育种的问题。
6.为实现上述目的,本发明提供如下技术方案:一种多个水稻性状控制基因变异检测功能标记方法,包括以下步骤:
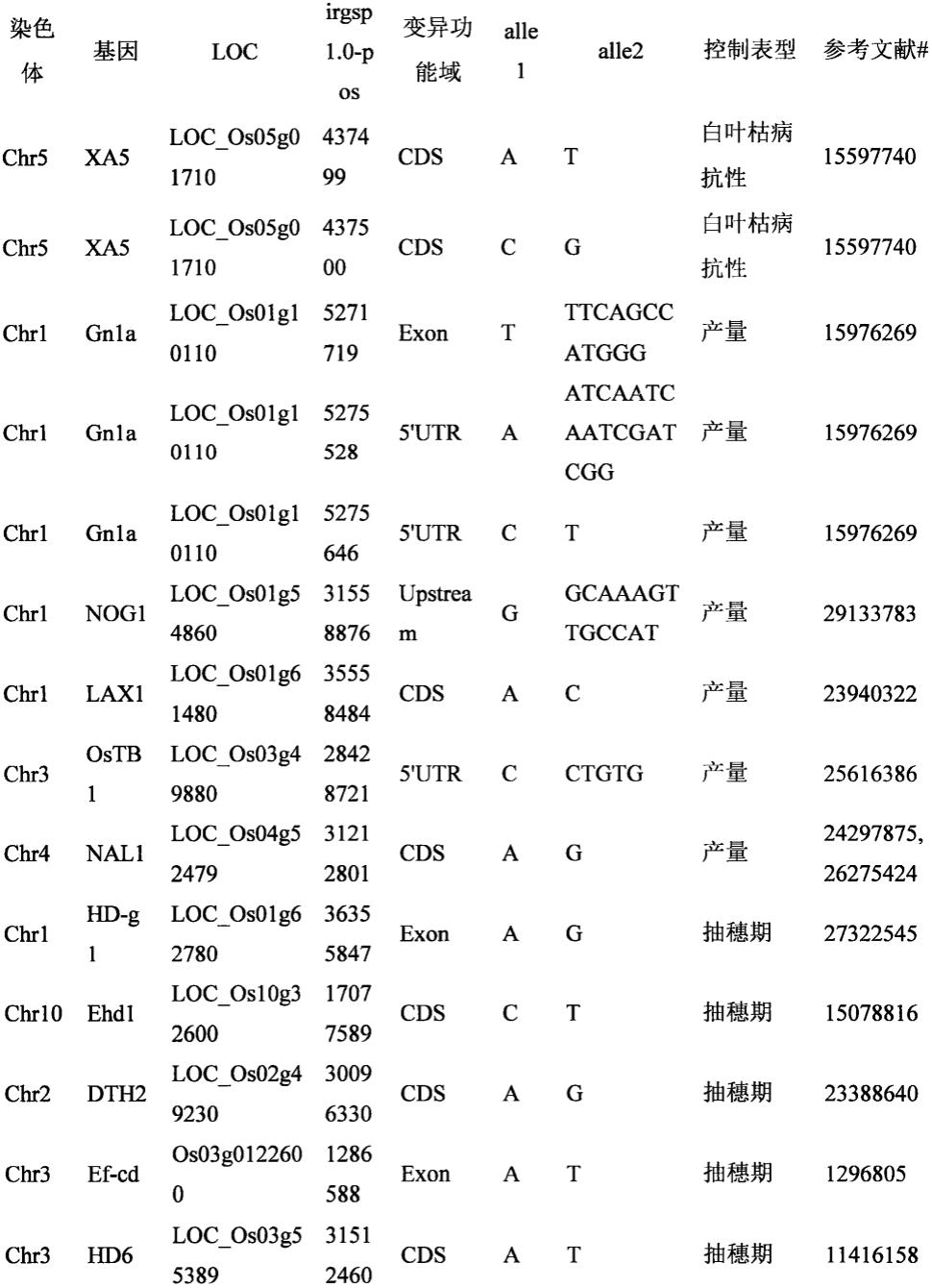
7.步骤一、目标变异的选择:本发明涉及的目标变异位点见图1;
8.步骤二、pcr引物设计及筛选:在图1中变异位点的基础上,根据变异位点在水稻日本晴参考基因组(基因组版本irgsp1.0),提取变异位点上下游200bp的序列,按下列引物设计原则进行引物设计:引物长度18-36bp;tm值59-64℃;gc含量15%-70%;
9.在设计出的引物中进一步进行如下评估选择:针对设计出来的引物进行非特异性评估,然后挑出非特异性的引物;引物之间进行二聚体评估,避免二聚体的产生;针对上述两步筛选的引物,再次进行两两非特异性评估;选出最终符合要求的引物,符合要求的引物等量混合构成用于检测多个水稻目标基因的功能标记引物组,该引物组命名为rfmp1;
10.步骤三、变异位点的pcr扩增及产物回收:包括dna提取及基因组定量过程、靶区域扩增过程、pcr产物纯化过程和第二轮pcr及pcr产物回收过程;
11.步骤四、高通量测序及数据分析:对上步骤中得到的纯化后的pcr产物进行高通量测序和数据分析,获得靶区域的基因型鉴定结果。
12.进一步的,所述dna提取及基因组定量过程为用ctab方法进行dna提取,提取后利用试剂盒或荧光定量pcr方法对基因组进行精确定量。
13.进一步的,所述靶区域扩增过程为利用0.2ml pcr管/96孔pcr板进行pcr扩增,反应体系如下:rfmp18μl,模板dna(≥50ng),3
×
t master mix10μl,用超纯水补齐 30μl,在95℃条件下热启动3min,在95℃环境下循环30s,在60℃环境下循环4min,95℃和60℃交替循环15次后,再在72℃环境下延伸4min。
14.进一步的,所述pcr产物纯化过程为利用纯化试剂盒对pcr产物进行纯化的过程,具体包括如下步骤:
15.s1、向pcr反应液/酶促反应液加入0.4倍体积dna clean beads(30μl体系加12μl),涡旋震荡后使扩增产物与dna clean beads充分混匀,室温静置5分钟后瞬离;
16.s2、用强力磁铁或磁力架吸附磁珠,室温静置2min,此时溶液为澄清状态;
17.s3、用移液器吸取全部上清至新的ep管子/96孔板中(保留上清),避免吸到磁珠,该步骤被吸附的磁珠可抛弃;
18.s4、向新的上清液中加入0.6倍原始pcr体积dna clean beads(30μl体系加18μl),涡旋震荡后使扩增产物与dna clean beads充分混匀,室温静置5分钟后瞬离;
19.s5、用强力磁铁或磁力架吸附磁珠,室温静置2min,此时溶液为澄清状态,用移液器吸取上清后抛弃上清,留磁珠;
20.s6、加入等pcr体积的bw10 buffer,涡旋震荡后重悬磁珠,室温静置5分钟后瞬离,再用磁力架吸附磁珠,直至溶液澄清为止,用移液器吸取上清后弃上清,留磁珠;
21.s7、保持pcr管处于磁力架中,加入100μl 80%的乙醇,室温静置1min,此时溶液为澄清状态,用移液器去除上清,避免吸到磁珠;
22.s8、室温放置,直至乙醇挥发干净,本步骤磁珠亦可放于烘箱中50℃烘干5分钟左右,快速蒸干乙醇。
23.进一步的,所述pcr产物回收过程具体为对回收产物进行pcr扩增,引入与测序相应接头与barcode,在带有磁珠的tube管中加入pcr体系,并扩增体系如下:i5 barcode (10um)-mgi 1μ,i7 barcode(2um)-mgi 5μl,3
×
t master mix 10μl,超纯水14μl, pcr扩增程序为:在95℃条件下热启动3min,在95℃环境下循环15s,在58℃环境下循环15s,在72℃环境下循环30s,再95℃、58℃和72℃交替循环7次后,在72℃环境下延伸4min,利用纯化试剂盒对pcr产物进行纯化,再对纯化产物进行dna浓度测定,产物可直接用于上机测序或置于-20℃保存。
24.进一步的,检测的目标变异位点为图1所列的94个变异位点。
25.进一步的,通过pcr扩增、高通量测序的方法同步进行多个变异位点的检测。
26.进一步的,pcr扩增引物设计序列为图1中irgsp1.0-pos列所示94个变异位点(以水稻品种日本晴为参考基因组)上、下游200bp。
27.进一步的,根据图1所列的94个变异位点,提取参考基因组上、下游序列进行引物设计,可以使用的水稻参考基因组不限于水稻品种日本晴的基因组。其它水稻品种基因组相应的位置可以由图1中94个变异位点及日本晴基因组中上、下游200bp序列,通过blast 的方法获得。
28.进一步的,可以同时检测图1所列的94个变异位点,对94个变异位点,或其中5个以上的位点进行同步检测在本发明的权利要求内。
29.与现有技术相比,本发明的有益效果是:
30.本多个水稻性状控制基因变异检测功能标记方法,利用本发明开发出来的功能标记检测组rfmp1,可以对66个水稻重要农艺性状控制基因的94个变异位点进行准确的基因型鉴定,涉及抽穗期、产量、稻瘟病抗性等重要农艺性状,可以很方便地对大量育种材料进行多个重要基因变异进行扫描,有效地克服了传统分子标记技术的低效率的问题,同时检测成本比基于常规的二代测序及高密度芯片的检测方法大大降低。
附图说明
31.图1是本发明提出的一种多个水稻性状控制基因变异检测功能标记方法的步骤一中的目标变异位点选择表;
32.图2是本发明提出的一种多个水稻性状控制基因变异检测功能标记方法的利用功能标记组rfmp1检测11个水稻亲本94个位点的基因型的实施例展示表。
具体实施方式
33.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚;完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,基于
本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
34.一种多个水稻性状控制基因变异检测功能标记方法,包括以下步骤:
35.步骤一、目标变异的选择:本发明涉及的目标变异位点见图1,检测的目标变异位点为图1所列的94个变异位点,通过pcr扩增、高通量测序的方法同步进行多个变异位点的检测,pcr扩增引物设计序列为图1中irgsp1.0-pos列所示94个变异位点(以水稻品种日本晴为参考基因组)上、下游200bp,根据图1所列的94个变异位点,提取参考基因组上、下游序列进行引物设计,可以使用的水稻参考基因组不限于水稻品种日本晴的基因组。其它水稻品种基因组相应的位置可以由图1中94个变异位点及日本晴基因组中上、下游 200bp序列,通过blast的方法获得,可以同时检测图1所列的94个变异位点,对94个变异位点,或其中5个以上的位点进行同步检测在本发明的权利要求内。
36.步骤二、pcr引物设计及筛选:在图1中变异位点的基础上,根据变异位点在水稻日本晴参考基因组(基因组版本irgsp1.0),提取变异位点上下游200bp的序列,按下列引物设计原则进行引物设计:引物长度18-36bp;tm值59-64℃;gc含量15%-70%。
37.在设计出的引物中进一步进行如下评估选择:针对设计出来的引物进行非特异性评估,然后挑出非特异性的引物;引物之间进行二聚体评估,避免二聚体的产生;针对上述两步筛选的引物,再次进行两两非特异性评估;选出最终符合要求的引物,符合要求的引物等量混合构成用于检测多个水稻目标基因的功能标记引物组,该引物组命名为rfmp1。
38.步骤三、变异位点的pcr扩增及产物回收:包括dna提取及基因组定量过程、靶区域扩增过程、pcr产物纯化过程和第二轮pcr及pcr产物回收过程,dna提取及基因组定量过程为用ctab方法进行dna提取,提取后利用试剂盒或荧光定量pcr方法对基因组进行精确定量;靶区域扩增过程为利用0.2ml pcr管/96孔pcr板进行pcr扩增,反应体系如下:rfmp18μl,模板dna(≥50ng),3
×
t master mix10μl,用超纯水补齐30 μl,在95℃条件下热启动3min,在95℃环境下循环30s,在60℃环境下循环4min,95℃和60℃交替循环15次后,再在72℃环境下延伸4min;pcr产物纯化过程为利用纯化试剂盒对pcr产物进行纯化的过程,具体包括如下步骤:
39.s1、向pcr反应液/酶促反应液加入0.4倍体积dna clean beads(30μl体系加12μl),涡旋震荡后使扩增产物与dna clean beads充分混匀,室温静置5分钟后瞬离;
40.s2、用强力磁铁或磁力架吸附磁珠,室温静置2min,此时溶液为澄清状态;
41.s3、用移液器吸取全部上清至新的ep管子/96孔板中(保留上清),避免吸到磁珠,该步骤被吸附的磁珠可抛弃;
42.s4、向新的上清液中加入0.6倍原始pcr体积dna clean beads(30μl体系加18μl),涡旋震荡后使扩增产物与dna clean beads充分混匀,室温静置5分钟后瞬离;
43.s5、用强力磁铁或磁力架吸附磁珠,室温静置2min,此时溶液为澄清状态,用移液器吸取上清后抛弃上清,留磁珠;
44.s6、加入等pcr体积的bw10 buffer,涡旋震荡后重悬磁珠,室温静置5分钟后瞬离,再用磁力架吸附磁珠,直至溶液澄清为止,用移液器吸取上清后弃上清,留磁珠;
45.s7、保持pcr管处于磁力架中,加入100μl 80%的乙醇,室温静置1min,此时溶液为澄清状态,用移液器去除上清,避免吸到磁珠;
46.s8、室温放置,直至乙醇挥发干净,本步骤磁珠亦可放于烘箱中50℃烘干5分钟左右,快速蒸干乙醇。
47.pcr产物回收过程具体为对回收产物进行pcr扩增,引入与测序相应接头与barcode,在带有磁珠的tube管中加入pcr体系,并扩增体系如下:i5 barcode(10um)-mgi 1μ, i7 barcode(2um)-mgi 5μl,3
×
t master mix 10μl,超纯水14μl,pcr扩增程序为:在95℃条件下热启动3min,在95℃环境下循环15s,在58℃环境下循环15s,在72℃环境下循环30s,再95℃、58℃和72℃交替循环7次后,在72℃环境下延伸4min,利用纯化试剂盒对pcr产物进行纯化,再对纯化产物进行dna浓度测定,产物可直接用于上机测序或置于-20℃保存。
48.步骤四、高通量测序及数据分析:对上步骤中得到的纯化后的pcr产物进行高通量测序和数据分析,获得靶区域的基因型鉴定结果。
49.综上所述,本多个水稻性状控制基因变异检测功能标记方法,利用本发明开发出来的功能标记检测组rfmp1,可以对66个水稻重要农艺性状控制基因的94个变异位点进行准确的基因型鉴定,涉及抽穗期、产量、稻瘟病抗性等重要农艺性状,可以很方便地对大量育种材料进行多个重要基因变异进行扫描,有效地克服了传统分子标记技术的低效率的问题,同时,检测成本比基于常规的二代测序及高密度芯片的检测方法大大降低。
50.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1