一种利用miRNA检测诊断胰腺癌的方法及应用与流程
本发明涉及生物医药领域、基因诊断领域;具体的涉及mirna-21分子在制备用于胰腺癌早期诊断和/或伴随诊断的用途。
背景技术:
据最新研究数据显示,胰腺癌发病率居于全球肿瘤的第9位,死亡率居于全球肿瘤的第4位,且患者术后5年的生存率低于5%[37]。而我国每年胰腺癌新发病例已超过9万例,其中死亡病例接近90%[38]。目前,针对胰腺癌的治疗策略包括手术、化疗、放射治疗以及靶向治疗都没有显著的治疗效果,不能显著延长胰腺癌术后生存率。因此,寻找胰腺癌早期特异性基因及分子标记物,实现对胰腺癌早期诊断、治疗及判断预后已成为当前研究的热点。此外,mirna是一类具有调控作用的内源性非编码rna,通过复杂的基因网络调控影响肿瘤的发生和进展,与肿瘤的发生、进展、诊断和预后密切相关[39-40]。随着分子生物学技术的蓬勃发展,越来越多的证据显示mirna在胰腺癌发生进展的过程中起着重要的调控作用[41-42]。因此,对mirna的功能和作用机制的研究越来越引起科研工作者的重视。在过去的几十年中,mirna作为与人类和其他生物体中基因表达调控相关的重要分子而出现,从而扩大了可用于诊断和处理多种疾病的策略。到目前为止,mirna约占人类基因组的3%[7],在生理条件下,mirna在控制组织动态平衡和细胞信号传导中起关键作用,是基因表达的转录后机制。这些分子的协调功能与其他机制相关,可避免异常细胞增殖的发生,调节细胞分化并响应检测到的内分泌激素和其他刺激(例如细胞因子,趋化因子,感染性或应激性条件)而对mrna进行精细调节,并控制人类中>60%的蛋白质编码基因的表达[8]。自从在慢性淋巴细胞性白血病中报道了mir-15和mir-16的异常表达以来,越来越多的证据表明mirna突变或错表达与多种人类癌症有关,并表明mirna可以充当肿瘤抑制因子或致癌基因[9]。它们充当基因表达的调节剂,从而在调节广泛的细胞过程(包括生长,分化,增殖和凋亡)中发挥关键作用。
技术实现要素:
本发明在于利用mirna-21-5p基因作为胰腺癌早期诊断和/或伴随诊断的标志物的方法。
本发明还在于利用mirna-21-5p作为胰腺癌诊断的标志物,通过5例胰腺癌患者组织样本与正常组织样本的高通量测序数据分析后挖掘出的新的调控胰腺癌的mirna。
本发明还发现了mirna-21-5p在临床样本测序数据中的差异性,包括在肿瘤组织中mirna-21-5p的表达量比正常组织中高30-100倍。
本发明还公开了mirna-21-5p的模拟物序列如seqidno:2,mirna-21-5p的抑制剂序列如seqidno:4
本发明还发现了mirna-21-5p在细胞水平的功能,包括mirna-21-5p模拟物转染进入细胞后,细胞的增殖速率加快,凋亡速率减慢,促进了细胞分裂;还包括mirna-21-5p抑制剂转染进入细胞后,细胞的增殖速率减慢,凋亡速率加快,抑制了细胞分裂。
本发明还涉及了mirna-21-5p在制备应用于胰腺癌早期诊断和或/伴随诊断的试剂盒中的应用。胰腺癌诊断试剂盒中包括mirna-21-5p的检测引物对、内参基因u6的检测引物对、缓冲试剂、逆转录cdna引物。试剂盒检测mirna-21-5p的方法包括rna提取步骤、cdna反转录合成、pcr扩增、扩增产物结果计算判断等。其中mirna-21-5p引物对序列如seqidno:9和seqidno:10,内参u6基因引物对序列如seqidno:6和seqidno:7。
附图说明:
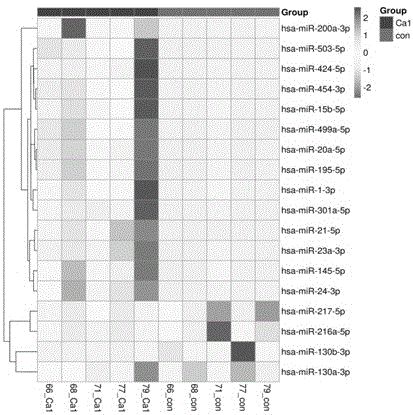
图1为肿瘤样本高通量测序筛选出mirna-21-5p为重要的诊断标志物;
图2为mirna-21-5p对cfpac-1细胞增殖能力的影响;
图3-图7为mirna-21-5p对cfpac-1细胞周期分裂的影响;
图8-图12为mirna-21-5p对cfpac-1细胞凋亡的影响;
图13为mirna-21-5p的edu荧光分析对cfpac-1细胞增殖的影响。
具体实施方式:
实施例1:胰腺癌检早期诊断和/或伴随诊断测标志物mirna-21-5p的发现
收集胰腺癌选择5例病人肿瘤组织和正常组织,进行高通量测序,共筛选到171个mirna发生上调,188个mirna发生下调。其中mirna-21-5p的表达量,肿瘤中比正常组织高30-100倍。
本实施方式中所采用以下实验方法和内容:
1、组织总rna提取与质检。利用trizol法进行总rna提取,总rna提取完成后用agilent2100和nanodrop对rna纯度进行,rna是否有降解及杂峰进行检测。总rna完成后要先使用qubit2.0和nanodrop进行初步定量,随后使用1%琼脂糖凝胶电泳对提取的rna完整性进行检测,再使用agilent2100对rna进行精准检测(rin/rqs>7),符合要求后,用以保证rna质量。rna质量达到要求后,再进行文库构建。
2、测序文库构建。使用nebnext®multiplexsmallrnalibraryprepsetforillumina®(neb,usa)试剂盒构建mirna文库使用dna高灵敏度芯片在agilent2100评估文库质量。采用illuminahiseq测序平台,对mirna采用se50测序策略进行测序。
3、高通量测序。使用truseqpeclusterkitv3-cbot-hs(illumina),根据试剂盒说明方法,在cbot群集生成系统上对index编码的样本进行了拆分。产生簇后,将文库在illuminahiseq3000平台上测序,产生50bp的单末端读数。每个样品的mirna的读取数分别为14658590-18771808。每个样品的mirna的干净碱基分别为5-62mreads。每个样品的mirna的错误率分别为<0.01%。
4、生物信息学分析。通过去掉reads两端的接头、去掉低质量reads、去污染等过程完成数据初步过滤,将干净的读数筛选出长度为18-25nt的mirna,并定位至参考序列。利用fastqc对rawreads进行质控分析。与mirevo软件和mirdeep2软件结合使用,以分析新mirna的功能。采用负二项式分布的deseq2分析mirna的差异表达。所有测序程序均由novogenecompany执行。随后对已知mirna进行差异表达分析,筛选出mirna-21-5p为重要的诊断标志物(图1)。
实施例2:胰腺癌早期诊断和/或伴随诊断标志物mirna-21-5p的验证
本实施方式中公开了以下实验方法和实验结论。
1、仪器和重点试剂。人胰腺癌细胞系cfpac-1:购买于国家实验细胞资源共享平台(北京协和细胞库)。sw-cj-1d生物洁净工作台苏州净化有限公司;mco-18acco2细胞培养箱(日本panasonic公司);xz-10倒置显微镜(广州明美光电技术有限公司);smr60047酶标检测仪(武汉优尔生生命科学装备有限公司);80-2离心机(常州峥嵘仪器有限公司);bs110电子天平(美国sartorius公司);milli-q超纯水系统(美国millpore公司);mdf-u32v低温冰箱(日本sanyo公司);吉尔森gilso移液器(法国gilson公司);ldzx-40b型立式自动蒸汽灭菌器(德国systec公司);k20金属浴(杭州蓝焰科技有限公司);phs-10aph计(杭州万达仪器仪表厂);定量移液器(美国thermo公司);一次性用针头式滤器(美国palllifesciences公司);mf53倒置荧光显微镜(广州明美光电技术有限公司);电热恒温鼓风干燥箱(常州普天仪器制造有限公司);nanodrop™2000c分光光度计(瑞士roche公司);流式细胞仪(flowcytometry)(美国bd公司);pcr扩增仪(瑞士roche公司);pp-1105电泳仪(北京凯元信瑞仪器有限公司);mp-8120转移电泳仪槽(北京凯元信瑞仪器有限公司);mp-3030垂直电泳槽(北京凯元信瑞仪器有限公司);tgl-16c冷冻离心机(上海安亭科学仪器厂);ims-20制冰机(常熟市雪科电器有限公司);wd-9405a脱色摇床(北京市六一仪器厂);annexin-v-fitc凋亡检测试剂盒(南京凯基生物技术有限公司);细胞周期检测试剂盒(南京凯基生物技术有限公司);基因引物(上海生工生物工程有限公司);反转录试剂盒(日本takara公司);trizol溶液(北京solarbio公司);sds-page凝胶制备试剂盒(武汉百仟度生物科技有限公司);ripa总蛋白裂解液(武汉百仟度生物科技有限公司);bca蛋白质浓度测定试剂盒(武汉百仟度生物科技有限公司);ecl化学发光检测试剂盒(武汉百仟度生物科技有限公司);proteaseinhibitorcocktail(瑞士roche公司)。
2、实验方法
细胞转染实验:(1)转染前一天,取1×106个/ml的cfpac-1细胞接种在6孔板上,加入2ml含血清的imdm培养基。置于co2浓度为5%的培养箱中于37℃培养至细胞汇合达到70-80%。
(2)在100μl的opti-mem无血清培养基加入mirna-21-5p的模拟物mimics和抑制剂inhibitor,柔和混匀。另取10μllipofectamin试剂,加到100μl无血清的opti-mem中,轻轻混匀,室温放置5min。
(3)将dna和lipofectamin2000溶液混合,轻柔混匀,室温放置20min,以便mirna与lipofectamin形成复合物。将200μldna/lipofectamin复合物加到含有细胞和1.8ml无血清培养基的培养板的孔中,来回轻柔摇晃细胞培养板。
(4)将细胞在co2培养箱中37℃温育6h后,更换新鲜含血清培养基,摇晃培养板混匀。继续孵育48h后,收集细胞用于后续实验。
细胞增殖实验:收集对数期的cfpac-1细胞种植于96孔板孵育中,每孔中加入100μl含细胞数6000细胞/孔的细胞密度,培养至细胞融合度为80%。根据转染试剂步骤,将mirna加入到opti-mem无血清培养基中柔和混匀,并与适量的lipofectamin2000混合,室温静置20min,以便形成mirna与lipofectamin形成复合物。将mirna与lipofectamin复合物加到含有细胞和100μl培养液的96孔板内,6h后更换成新鲜的完全培养基后继续培养至48小时。培养结束时,用移液枪向96孔板中的每个孔加入10μl的cck8溶液(避免气泡产生),将培养板在培养箱中继续孵育2小时。在酶标仪测值前之前,将96孔板放于轨道振动器上轻轻震动混合5分钟,以确保颜色均匀分布。使用酶标仪测量450nm波长处每孔的吸光度,每组3个孔重复。根据标准曲线,计算各组细胞增殖情况。
细胞凋亡实验:收集对数期的cfpac-1细胞种植于6孔板孵育中,每孔中加入2ml含细胞数为1×106的cfpac-1细胞,培养至细胞融合度为80%。将mirna/sirna加入到opti-mem无血清培养基中柔和混匀,并与适量的lipofectamin2000混合,室温静置20min,以便形成mirna与lipofectamin形成复合物。将mirna与lipofectamin复合物加到含有2ml培养液的6孔板内,6h后更换成新鲜的完全培养基后继续培养至48小时。培养结束后,消化并收集cfpac-1细胞悬液于2ml的离心管中,置于1500rpm的条件下离心5min,弃上清留沉淀。用1ml预冷的pbs洗涤,于1500rpm条件下离心5min后去除悬液内的细胞碎片,重复2次。用移液枪吸取300µl的bindingbuffer重悬沉淀。再吸取5µl的annexinv-fitc和5µl的propidiumiodide染色液分别加入到混悬液中,再次轻轻混匀。将混悬好的细胞液于室温条件下孵育5-15min,随后置于冰浴中以供检测。将制好的样本依次通过流式细胞仪进行凋亡检测,并用flomax软件对结果进行分析。
细胞周期分析:收集对数期的cfpac-1细胞种植于6孔板孵育中,每孔中加入2ml含细胞数为1×106的cfpac-1细胞,培养至细胞融合度为80%。将mirna加入到opti-mem无血清培养基中柔和混匀,并与适量的lipofectamin2000混合,室温静置20min,以便形成mirna与lipofectamin形成复合物。将mirna与lipofectamin复合物加到含有2ml培养液的6孔板内,6h后更换成新鲜的完全培养基后继续培养48小时。培养结束后,收集原培养液、洗后的pbs和消化后的cfpac-1细胞悬液于2ml的离心管中,在1500rpm的条件下离心5min,弃上清留沉淀。用1ml预冷的pbs洗涤,于1500rpm条件下离心5min后去除悬液内的细胞碎片,重复2次。加入适量的75%的乙醇,于4℃条件下固定2h后,在1500rpm条件下离心5min,弃上清留沉淀,并用预冷的pbs洗涤2次去除残留的无水乙醇。依次在细胞沉淀中加入400ul的溴化乙锭(pi,50ug/ml)和100μl的rnasea(100ug/ml),于4℃避光孵育30min。随后置于冰浴中以供检测,在流式细胞仪下用标准程序进行检测,并用软件modfit进行周期分析。
edu荧光分析:收集对数期的cfpac-1细胞种植于96孔板孵育中,每孔中加入100μl含细胞数103-104的细胞,培养至细胞融合度为80%。将mirna加入到opti-mem无血清培养基中柔和混匀,并与适量的lipofectamin2000混合,室温静置20min,以便形成mirna与lipofectamin形成复合物。将mirna与lipofectamin复合物加到含有培养液的细胞中,6h后更换成新鲜的完全培养基后继续培养48小时。用细胞培养液按照1000:1的比例稀释edu试剂,配制成含50μm的edu培养液,并在每孔加入100μl含50μm的edu培养液,于37℃条件下孵育2h。孵育结束后,弃培养液并用预冷的pbs洗涤细胞2次,5min/次。每孔加入100μl的1×apollo®染色反应液,在避光、室温、脱色摇床条件下孵育30min后,弃反应液。再加入100μl含0.5%tritonx-100的渗透剂,脱色摇床清洗2-3次,10min/次。再依次每孔加入100μl的甲醇清洗2次,5min/次,每孔加入预冷的pbs清洗细胞2次,5min/次。荧光显微镜下进行观察并成像处理。
3、实验结果
(1)mirna-21-5p高表达可以促进细胞增殖,低表达抑制细胞增殖。mirna-21-5p模拟物mimic促进mirna-21-5p基因的表达,进而提高了cfpac-1细胞的增殖能力。然而当mirna-21-5p的基因表达被抑制时,cfpac-1细胞的增殖能力明显被抑制。以上结果证实了mirna-21-5p可调控胰腺癌细胞cfpac-1的增殖能力,且cfpac-1细胞的增殖活力与mirna-21-5p的表达成正相关(图2)。
(2)mirna-21-5p高表达可以促进细胞分裂,低表达可以抑制细胞分裂相比mimicnc组,mirna-21-5pmimic可明显增加g0/g1期的细胞比例,促进了cfpac-1细胞分裂。相反的是,相比较inhibitornc组,mirna-21-5p可有效降低g0/g1期的细胞比例,并使cfpac-1细胞周期阻滞在s期,进而抑制了细胞的增殖。以上结果揭示了mirna-21-5p可调控cfpac-1细胞的周期分裂,其高表达可促进细胞分裂;低表达可引起细胞周期阻滞(图3-图7)。
(3)mirna-21-5p高表达可以降低细胞凋亡,低表达可以促进细胞凋亡。相比mimicnc组,高表达的mirna-21-5p可降低cfpac-1的细胞凋亡比例。反之,当mirna-21-5p的表达被抑制时,可显著促进cfpac-1细胞发生凋亡。综上所述,mirna-21-5p呈负相关调节性调控cfpac-1细胞的凋亡,并佐证了mirna-21-5p对cfpac-1细胞增殖和周期分裂的调控作用(图8-图12)。
(4)mirna-21-5p高表达可以促进细胞增殖,低表达可以抑制细胞增殖。相比较mimicnc组,mirna-21-5pmimic显著激活了cfpac-1细胞的增殖活力;反之,相比较inhibitornc组,mirna-21-5pinhibitor有效的降低了cfpac-1细胞的增殖活力。以上结果从分子层面证实了mirna-21-5p可增强cfpac-1的增殖活力(图13)。
序列表
<110>武汉博越致和生物科技有限公司
<120>一种利用mirna检测诊断胰腺癌的方法及应用
<160>10
<170>siposequencelisting1.0
<210>1
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>1
uagcuuaucagacugauguuga22
<210>2
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>2
uagcuuaucagacugauguuga22
<210>3
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>3
uuuguacuacacaaaaguacug22
<210>4
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>4
ucaacaucagucugauaagcua22
<210>5
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>5
caguacuuuuguguaguacaaa22
<210>6
<211>20
<212>dna/rna
<213>人工序列(artificialsequence)
<400>6
cgcttcggcagcacatatac20
<210>7
<211>20
<212>dna/rna
<213>人工序列(artificialsequence)
<400>7
aaatatggaacgcttcacga20
<210>8
<211>50
<212>dna/rna
<213>人工序列(artificialsequence)
<400>8
gtcgtatccagtgcagggtccgaggtattcgcactggatacgacgccaaa50
<210>9
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>9
tagcttatcagactgatgttga22
<210>10
<211>22
<212>dna/rna
<213>人工序列(artificialsequence)
<400>10
ccagtgcagggtccgaggtatt22
- 还没有人留言评论。精彩留言会获得点赞!