靶向HBV核心启动子的药物筛选细胞模型、Triciribine及结构类似物新应用
靶向hbv核心启动子的药物筛选细胞模型、triciribine及结构类似物新应用
技术领域
1.本发明涉及分子生物学和生物医药技术领域,具体涉及一种靶向hbv核心启动子的药物筛选细胞模型、triciribine及其结构类似物的新应用。
背景技术:
2.目前,全球乙肝病毒携带者约有3.5亿患者,我国6
‑
7%的人群(约8000万)处于病毒携带状态。病毒携带者可发展为慢性乙型肝炎,慢乙肝患者与普通人群相比,发生肝硬化、肝癌的风险更高,全球每年约100万人死于hbv感染相关的肝脏疾病。因此,治疗慢性hbv感染,阻止其致死性后果是事关公共健康的重要问题。
3.目前,用于乙肝治疗的药物包括α干扰素(ifn
‑
α,peg
‑
ifnα)和6种核苷(酸)类似物(拉米夫定、阿德福韦、恩替卡韦、替比夫定、替诺福韦、替诺福韦阿拉酚胺)。长效干扰素治疗48周后,仅少数患者可获得持续应答,且副作用明显。核苷(酸)类似物在大多数患者中均表现出较强的病毒抑制效果,它们可在一定时期内降低多数患者的血清hbv载量,改善转氨酶水平及肝脏组织学表现。然而,核苷(酸)类药物治疗也存在停药后反弹,长期用药可能筛选耐药突变株的问题。总之,现有治疗药物还远不足以彻底解决乙肝问题。正因为如此,开发新型抗hbv药物十分必要。
4.对hbv而言,有效的药物靶点应该针对病毒生活周期的关键环节。众所周知,共价闭合环状dna(covalently closed circular dna,cccdna)是hbv生命周期的一个关键分子。病毒感染细胞后,其松弛环状dna(relaxed circular dna,rcdna)基因组转运入核,转变成游离于染色体的cccdna。cccdna是所有hbv病毒mrna的转录模板,它的持续存在,也是现有抗病毒治疗后病毒持续存在或反弹的主要原因。阻断并清除细胞内cccdna库,可以完全清除hbv,已成为领域内的普遍共识。然而,目前各种抗病毒治疗方案中,缺少以cccdna为靶点的药物。
5.靶向cccdna的药物,最终可以通过两种途径发挥作用:降低cccdna的数量或者抑制其功能。cccdna的主要功能,是作为所有hbv mrna的转录模板,这些mrna中很重要的是pgrna,因其是子代病毒dna合成的模板,同时也是核心蛋白和聚合酶的翻译模板。控制pgrna转录的,是核心启动子。因此,抑制核心启动子的转录活性,即是在很大程度上抑制了cccdna的功能。然而,目前为止,尚无能有效抑制核心启动子转录活性的药物上市。
技术实现要素:
6.本发明的发明人在研究过程中,构建了一种靶向hbv核心启动子转录的抗hbv药物筛选细胞模型,然后利用该模型,进行了化合物筛选,筛选到了能抑制hbv核心启动子转录和hbv复制的化合物,这些药物具有进一步发展为乙肝治疗候选药物的潜力。基于此,本发明要求保护如下技术方案:
7.一种质粒pcore
‑
hu
‑
smar,其骨架载体是质粒pcmv
‑
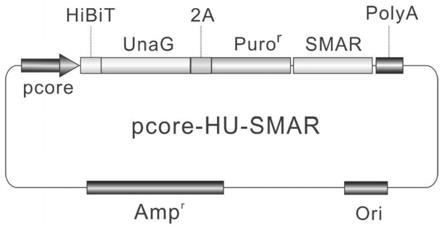
gluc,在所述骨架载体中插入
有:由hbv核心启动子驱动表达的hibit
‑
unag融合基因,所述hibit
‑
unag融合基因通过t2a序列与嘌呤霉素抗性基因相连,在嘌呤霉素抗性基因和polya序列之间插入smar序列,所述hibit
‑
unag融合基因是荧光素酶标签hibit和荧光蛋白报告基因unag的融合基因,所述smar序列是位于人ifnβ基因上游的序列。
8.上述技术方案中,所述荧光素酶标签hibit和荧光蛋白报告基因unag通过g4s接头序列连接,所述hbv核心启动子、hibit、g4s接头序列、unag、t2a序列、嘌呤霉素抗性基因、smar序列和骨架载体的核苷酸序列依次如seq id no.1~8所示;
9.所述质粒pcore
‑
hu
‑
smar的核苷酸序列为seq id no.1~8所示的序列依次连接得到的序列。
10.上述的质粒pcore
‑
hu
‑
smar的构建方法,包括以下步骤:
11.1)构建质粒puro
‑
smar:以质粒pch9
‑
puro为模板,用引物r puro和f sv40gg2扩增载体片段frag1;扩增得到smar序列frag2,将frag1和frag2连接起来得到质粒puro
‑
smar;
12.2)构建质粒pcore
‑
unag:以质粒pch9/3091为模板,用引物f1070gg及r1901gg扩增包含增强子i、增强子ii和基本核心启动子的区域,将扩增产物回收片段命名为frag3;扩增unag基因片段frag4;以质粒pcmv
‑
gluc为模板,用引物f sv40和r cmv扩增载体片段frag5,将所述frag3、frag4、frag5连接起来得到质粒pcore
‑
unag;
13.3)构建质粒pcore
‑
hibit
‑
unag:以质粒pcore
‑
unag为模板,用引物f unag2和r 1901h扩增载体片段frag6;以质粒47g4s
‑
hbc为模板,用引物f h
‑
gs和r gs gg扩增包含甘氨酸
‑
丝氨酸接头序列的片段frag7,将所述frag6、frag7接起来得到质粒pcore
‑
hibit
‑
unag;
14.4)构建质粒pcore
‑
hu
‑
smar:以质粒pcore
‑
hibit
‑
unag为模板,用引物r unag
‑
2a和f sv40gg扩增dna片段frag8;以质粒puro
‑
smar为模板,用引物f puro
‑
2a和r smar 2扩增dna片段frag9,将frag8、frag9连接起来得到质粒pcore
‑
hu
‑
smar。
15.一种靶向hbv核心启动子的药物筛选细胞模型,是将上述的质粒pcore
‑
hu
‑
smar转染小鼠肝细胞系aml12,通过嘌呤霉素筛选和连续传代,获得pcore
‑
aml12细胞。
16.所述传代培养的传代间隔为3天,总共至少可传30代。
17.上述的靶向hbv核心启动子的药物筛选细胞模型的构建方法,采取前述的方法制备质粒pcore
‑
hu
‑
smar,将质粒pcore
‑
hu
‑
smar转染小鼠肝细胞系aml12获得pcore
‑
aml12细胞,将pcore
‑
aml12细胞在嘌呤霉素筛选下进行连续传代培养得到的稳定传代细胞。
18.本发明还请求保护:前述的质粒pcore
‑
hu
‑
smar,或者前述的靶向hbv核心启动子的药物筛选细胞模型,在筛选能抑制hbv核心启动子转录和/或hbv复制的化合物中的应用。
19.本发明还请求保护:triciribine及其结构类似物,在制备抑制hbv核心启动子转录和/或hbv复制的药物中的应用,或在制备治疗乙型肝炎的药物中的应用。
20.所述triciribine的结构类似物为5
‑
iodotubercidin或tubercidin。
21.所述triciribine的结构类似物为5
‑
iodotubercidin。
22.本发明的有益效果是:本发明构建的靶向hbv核心启动子转录的抗hbv药物筛选细胞模型,能够专用于筛选抑制核心启动子转录活性的药物,利用该药物筛选模型,筛选到能有效抑制核心启动子转录活性的化合物triciribine,及其结构类似物5
‑
iodotubercidin和tubercidin,从而提供了新的靶向hbv cccdna的化合物,有望成为乙肝治疗新型药物。
附图说明
23.图1是pcore
‑
hu
‑
smar质粒结构示意图。
24.图2是pcore
‑
aml12细胞的构建流程(图a)与鉴定结果(图b)。
25.图3是化合物筛选流程(图a)及3种化合物的抑制效应(图b)。
26.图4是3种化合物的进一步鉴定结果(图a、c)和triciribine的结构式(图b)。
27.图5是triciribine药理作用实验southern blot检测结果。
28.图6是5种triciribine的结构类似物的结构式(图a)与筛选结果(图b)。
29.图7是5
‑
iodotubercidin抑制hbv转基因小鼠体内hbv复制实验中细胞内core dna的southern blot检测、细胞内hbv rna northern blot进行检测的结果。
30.图8是triciribine和5
‑
iodotubercidin抑制hbv复制的动物实验,其中,图a是实验流程示意图,图b是血清hbv dna检测结果,图c是血清hbv rna检测结果,图d是血清hbsag检测结果,图e是血清hbeag检测结果。
具体实施方式
31.下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
32.下述实施例中的实验方法,如无特别说明,均为常规方法。
33.本申请实施例所用主要试剂和材料来源:
34.质粒模板pch9/3091由德国弗莱堡大学michael nassal构建;
35.质粒模板pcmv
‑
gluc:new england biolabs公司,美国;
36.unag基因:由上海生工生物工程公司合成;
37.hepg2
‑
ntcp细胞(厦门大学夏宁绍实验室赠送);
[0038]2×
primestar hs mix:takara公司,日本;
[0039]
胶回收试剂盒、基因组dna提取试剂盒:qiagen公司,德国;
[0040]
大肠杆菌jm109、nanoglo hibit lytic detection system:promega公司,美国;
[0041]
bsmb i、tango buffer、dtt、puromycin:thermo scientific公司,美国;
[0042]
化合物库(包含本发明实施例中用到的senoside c
‑
k,triciribine、cycloheximide、adenosine,reversine,sch58261,5
‑
iodotubercidin和tubercidin等672种化合物):mce公司,美国;
[0043]
atp、t7 dna ligase、质粒pcmv
‑
gluc:new england biolabs公司,美国;
[0044]
southern blot、northern blot检测试剂盒、逆转录试剂盒、qpcr试剂盒:roche公司,德国;
[0045]
hbv表面抗原、e抗原检测试剂盒:上海科华生物工程公司,中国;
[0046]
aml12细胞:美国模式菌种收集中心;
[0047]
其余试剂如未特殊表明,均为本领域常规试剂,均可商购获得。
[0048]
本发明实施例中所用扩增引物序列如下表1所示:
[0049]
表1.本发明实施例中所用引物序列
[0050][0051]
实施例一、靶向hbv核心启动子的药物筛选细胞模型构建
[0052]
1、设计思路与工作原理
[0053]
hbv核心启动子发挥作用是在cccdna上,而cccdna以独立于细胞染色体的微染色体的形式存在于细胞中。在这一点上,所有基于转基因(整合于细胞染色体)的细胞模型都与实际情况存在差距。为了更好地模拟cccdna转录事件,最好将核心启动子置于染色体之外。
[0054]
基于质粒载体(或类质粒)转染的cccdna模拟系统,如mchbv
‑
gluc cccdna模型,以及基于fluc的整合缺陷的慢病毒载体系统(integration
‑
deficient lentiviral vector of fluc)等,的确是位于染色外的,但其显著缺陷,是cccdna模拟分子不能复制,而是随着细胞的分裂而逐渐丢失,无法稳定存在。这导致每次实验均需转染或者感染步骤,继而造成实验系统更不稳定,同时成本更高。
[0055]
针对这些问题,我们基于smar序列(nucleic acids res,1999,27(2):426
‑
428.)设计构建了一种可复制的微染色体系统。smar是位于人ifnβ基因上游的一段长度约2k的序列,当smar序列插入质粒的表达基因与polya序列之间时,所转染的质粒能在细胞中长期稳
定存在(数量为2
‑
10拷贝/细胞,与cccdna类似),且不整合到染色体中。我们构建的微染色体模拟分子主要结构包括:由hbv核心启动子驱动表达的荧光素酶标签hibit和荧光蛋白报告基因unag(cell.2013,153(7),1602
‑
1611.),嘌呤霉素抗性基因,以及位于polya序列之前的smar序列。该质粒转染后,将能长期稳定地以独立于染色体的形态存在于细胞中,同时,该质粒将表达由hbv核心启动子驱动的报告基因,能方便地用于高通量药物筛选。
[0056]
2、pcore
‑
hu
‑
smar微染色体模拟分子构建
[0057]
分三步构建质粒pcore
‑
hu
‑
smar,该质粒包含由hbv核心启动子驱动表达的hibit
‑
unag融合基因,该基因通过t2a序列与嘌呤霉素抗性基因相连,同时,在嘌呤霉素抗性基因和polya序列之间,还包含smar序列(结构如图1所示),以支持该质粒在细胞中的复制。具体构建过程如下:
[0058]
(1)质粒puro
‑
smar构建
[0059]
以质粒pch9
‑
puro(见文献antimicrob agents chemother.2018,62(12)nov 26;62(12):e01302
‑
18.)为模板,用引物r puro+f sv40gg2扩增载体片段,反应体系为:质粒pch9
‑
puro 10ng,引物rpuro(10μm)及f sv40gg2(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,58℃ 15s,72℃ 1m30s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag1。以hepg2细胞基因组dna为模板,用引物f smar+r smar扩增smar序列。反应体系为:基因组dna 1μg,引物f smar(10μm)及r smar(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性5min;94℃ 20s,56℃ 15s,72℃ 45s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag2。
[0060]
将以上得到的两个片段frag1、frag2做golden gate连接反应,反应体系为:
[0061][0062][0063]
反应条件:37℃ 5min,20℃ 5min,循环25次。80℃ 20min灭活反应。
[0064]
golden gate产物转化jm109感受态细菌,涂板,克隆初筛,测序鉴定,正确的克隆命名为质粒puro
‑
smar。
[0065]
(2)质粒pcore
‑
unag构建
[0066]
以质粒pch9/3091(j virol.1992,66:4107
‑
16.)为模板,扩增包含增强子i,增强子ii(curs)和基本核心启动子(bcp)的区域。反应体系为:质粒pch9/3091 10ng,引物f1070gg(10μm)及r1901gg(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积
至50μl。反应条件:95℃预变性3min;94℃ 15s,58℃ 15s,72℃ 30s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag3。
[0067]
以合成的unag基因(上海生工生物工程公司合成)为模板,用引物f unag+r unag扩增unag基因片段。反应体系为:含unag基因的质粒10ng,引物f unag(10μm)及r unag(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,55℃ 15s,72℃ 15s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag4。
[0068]
以质粒pcmv
‑
gluc为模板,用引物f sv40+r cmv扩增载体片段。反应体系为:质粒pcmv
‑
gluc 10ng,引物f sv40(10μm)及r cmv(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,58℃ 15s,72℃ 1m,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag5。
[0069]
将以上得到的三个片段frag3、frag4、frag5做golden gate连接反应,反应体系为:
[0070][0071][0072]
反应条件:37℃ 5min,20℃ 5min,循环25次。80℃ 20min灭活反应。
[0073]
golden gate产物转化jm109感受态细菌,涂板,克隆初筛,测序鉴定,正确的克隆命名为质粒pcore
‑
unag。
[0074]
(3)质粒pcore
‑
hibit
‑
unag构建
[0075]
以质粒pcore
‑
unag为模板,用引物f unag2+r 1901h扩增载体片段。反应体系为:质粒pcore
‑
unag 10ng,引物f unag2(10μm)及r 1901h(10μm)各1μl,2
×
primestarhs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,58℃ 15s,72℃ 30s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag6。
[0076]
以质粒rfp
‑
47g4s
‑
hbc(即为中国专利zl 201510075723.2中的质粒rfp
‑
47g4s
‑
hbc)为模板,用引物f h
‑
gs+r gs gg扩增包含甘氨酸
‑
丝氨酸接头序列的片段。反应体系为:质粒rfp
‑
47g4s
‑
hbc 10ng,引物f h
‑
gs(10μm)及r gs gg(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,58℃ 15s,72℃ 30s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag7。
[0077]
将以上得到的两个片段frag6、frag7做golden gate连接反应,反应体系为:
[0078]
h2o2μlbsmb i酶0.75μltango buffer1μldtt1μlt7 dna ligase0.25μlatp1μlfrag62μl(50ng)frag72μl(20ng)总体积10μl
[0079]
反应条件:37℃ 5min,20℃ 5min,循环25次。80℃ 20min灭活反应。
[0080]
golden gate产物转化jm109感受态细菌,涂板,克隆初筛,测序鉴定,正确的克隆命名为质粒pcore
‑
hibit
‑
unag。
[0081]
(4)质粒pcore
‑
hu
‑
smar构建
[0082]
以质粒pcore
‑
hibit
‑
unag为模板,用引物r unag
‑
2a+f sv40gg扩增dna片段。反应体系为:质粒pcore
‑
unag 10ng,引物r unag
‑
2a(10μm)及f sv40gg(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,58℃ 15s,72℃ 1m30s,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag8。
[0083]
以质粒puro
‑
smar为模板,用引物f puro
‑
2a+r smar 2扩增dna片段。反应体系为:质粒puro
‑
smar 10ng,引物f puro
‑
2a(10μm)及r smar 2(10μm)各1μl,2
×
primestar hs mix 25μl,灭菌超纯水补齐体积至50μl。反应条件:95℃预变性3min;94℃ 15s,56℃ 15s,72℃ 1m,35个循环。用胶回收试剂盒回收扩增片段,将该回收片段命名为frag9。
[0084]
将以上得到的两个片段frag8、frag9做golden gate连接反应,反应体系为:
[0085]
h2o3μlbsmb i酶0.75μltango buffer1μldtt1μlt7 dna ligase0.25μlatp1μlfrag81μl(50ng)frag92μl(30ng)总体积10μl
[0086]
反应条件:37℃ 5min,20℃ 5min,循环25次。80℃ 20min灭活反应。
[0087]
golden gate产物转化jm109感受态细菌,涂板,克隆初筛,测序鉴定,正确的克隆命名为质粒pcore
‑
hu
‑
smar。
[0088]
3、pcore
‑
hu
‑
smar稳定传代细胞构建与鉴定
[0089]
将构建好的质粒pcore
‑
hu
‑
smar分别转染人肝癌细胞系hepg2和永生化小鼠肝细胞系aml12,转染后48小时,开始用0.4μg/ml嘌呤霉素进行筛选(流程见图2a)。筛选约2周后,具有抗性的aml12细胞增殖较好,而hepg2细胞尽管存在具有抗性的细胞,但几乎不再增
殖。我们将获得的aml12细胞命名为pcore
‑
aml12,并对其作进一步鉴定。
[0090]
将pcore
‑
aml12细胞进行连续传代培养,传代间隔为3天,总共传40代,每传代5次后,在荧光显微镜下观察细胞中荧光蛋白unag表达情况,同时,取数量约为105的细胞,检测其hibit标签融合蛋白表达情况。结果显示,在30代以内,无论是unag还是hibit都得到了稳定表达(结果如图2b),提示稳定传代细胞构建成功。
[0091]
实施例二、靶向hbv转录的化合物筛选
[0092]
1、化合物初筛
[0093]
在获得稳定传代细胞pcore
‑
aml12后,即将其用于化合物筛选。筛选流程如下:复苏pcore
‑
aml12细胞,用含10%胎牛血清的dmem培养基培养于10cm培养皿中(采用常规方法培养)。细胞传代3次后,生长状态较佳时,将细胞消化并接种到96孔板。细胞接种后第二天,将待测化合物分别加入96孔板中,终浓度为5μm,每种化合物做2个复孔。加药后约48小时,吸去培养基,每孔加入细胞裂解液,室温摇动孵育20min,然后取裂解液用hibit检测试剂进行检测(流程如图3a所示)。
[0094]
我们首先对672种化合物进行初筛,发现能使hibit活性降低2倍或以上,且表现出剂量依赖性的化合物共有3种,分别是:senoside c
‑
k,triciribine(曲西瑞宾)和cycloheximide(环己酰亚胺)。这三种化合物抑制荧光素酶活性的ec50(图3b)分别为17.1
±
5.1μm,2.1
±
1.2μm和9.9
±
0.75μm。为进一步鉴定,将这三种化合物分别用不同浓度处理hepg2.2.15细胞,处理5天后,提取细胞内核心颗粒hbv dna(core dna),并用southern blot检测。结果(图4a)显示,这三种化合物中,triciribine(结构式如图4b)表现出较好的抑制hbv dna复制的趋势,且该效应与细胞毒性能明显区分开,cc50=55.9μm(图4c)。
[0095]
2、triciribine药理作用的进一步鉴定
[0096]
为了进一步确认triciribine作用环节,首先用不同浓度药物处理hepg2.2.15细胞,处理5天后,提取细胞内core dna,并用southern blot方法进行检测;同时,提取细胞内总rna,并用northern blot方法进行检测。结果显示,随着triciribine浓度增加,细胞内core dna逐渐降低(图5a),同时细胞内hbv rna水平也逐渐降低(图5c)。接下来,我们在hbv感染后的hepg2
‑
ntcp细胞(厦门大学夏宁绍实验室赠送)中进行类似实验,同样发现triciribine能剂量依赖性地降低细胞内core dna水平(图5b),同时也能降低细胞内hbv rna水平和培养上清中的hbeag水平(图5d)。这些结果提示,triciribine在细胞模型的确能抑制hbv dna复制,且可能通过抑制hbv rna来发挥作用。
[0097]
3、triciribine的结构类似物5
‑
iodotubercidin能抑制pcore转录活性
[0098]
为了获得活性更高的化合物,我们对5种triciribine的结构类似物进行了测试,这几种化合物分别是adenosine,reversine,sch58261,5
‑
iodotubercidin和tubercidin(图6a)。测试过程如下:将质粒pcmv
‑
hibit
‑
gfp和pcore
‑
3xflag
‑
hbc共转染hepg2细胞,转染后第二天开始,用不同浓度药物处理细胞,3天后,收集和裂解细胞,然后用western blot检测裂解液中的3xflag
‑
hbc(见文献antimicrob agents chemother.2018,62(12)nov26;62(12):e01302
‑
18.),同时用hibit
‑
gfp(见文献antimicrob agents chemother.2018,62(12)nov 26;62(12):e01302
‑
18.)作为参照。结果显示,在这几种药物中,5
‑
iodotubercidin和tubercidin能较特异性地降低由pcore(核心启动子)驱动的3xflag
‑
hbc的表达,而不显著影响由pcmv驱动的hibit
‑
gfp的表达。二者中,以5
‑
iodotubercidin的活
性更强(图6b)。
[0099]
4、5
‑
iodotubercidin通过抑制hbv rna来抑制hbv dna复制
[0100]
为了进一步评价5
‑
iodotubercidin的作用,首先用不同浓度药物处理hepg2.2.15细胞,处理5天后,提取细胞内core dna,并用southern blot进行检测;同时,提取细胞内总rna,并用northern blot进行检测。结果显示,随着5
‑
iodotubercidin浓度增加,细胞内core dna逐渐降低(图7a),同时细胞内hbv rna水平也逐渐降低(图7b)。在hbv感染后的hepg2
‑
ntcp细胞中进行类似实验,同样发现5
‑
iodotubercidin能剂量依赖性地降低细胞内core dna水平,同时也能降低细胞内hbv rna水平和培养上清中的hbeag水平(图7c、7d)。这些结果提示,5
‑
iodotubercidin通过抑制hbv rna来发挥抑制hbv dna复制的作用。
[0101]
5、triciribine和5
‑
iodotubercidin抑制hbv转基因小鼠体内hbv复制
[0102]
我们进一步在hbv转基因小鼠中评价了triciribine和5
‑
iodotubercidin对hbv复制的影响。将20只c57/hbv1.2转基因小鼠(厦门大学夏宁绍实验室赠送)随机分为4组,分别3种药物和对照处理:恩替卡韦(每日灌胃给药0.05mg/kg)、triciribine(每日腹腔注射给药2mg/kg)、5
‑
iodotubercidin(每日腹腔注射给药2mg/kg)、dmso(等体积每日腹腔注射)。总共处理15天,期间每隔5天采血,测量血清hbsag和hbeag的变化情况,最后一次血清样本检测hbv dna和hbv rna(流程见图8a)。结果(图8b)显示,处理15天后,与对照组相比,恩替卡韦,triciribine和5
‑
iodotubercidin处理组,hbv dna均显著降低,降低幅度恩替卡韦>5
‑
iodotubercidin>triciribine。恩替卡韦不能显著降低血清hbv rna水平,但triciribine和5
‑
iodotubercidin均能减少hbv rna(图8c)。此外,与阴性对照和恩替卡韦相比,triciribine和5
‑
iodotubercidin还能显著降低血清hbsag和hbeag水平(图8d、8e)。这些结果提示,triciribine和5
‑
iodotubercidin能抑制hbv转基因小鼠模型中hbv的复制,且与核苷类似物相比,还能降低血清hbv rna、hbsag和hbeag,因而具有较好的潜在应用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1