水稻OsATL17基因在调控水稻抗性中的应用
水稻osatl17基因在调控水稻抗性中的应用
技术领域
1.本发明植物基因工程技术领域,具体涉及水稻osatl17基因在调控水稻抗性中的应用。
背景技术:
2.水稻是世界上重要的粮食作物,也是研究单子叶植物功能基因组学的模式植物。在自然生长条件下水稻经常会受到非生物逆境(干旱、低温)和生物逆境(稻瘟菌、白叶枯菌)的危害。
3.中国由于地形复杂,如四川等地区,造成了灌溉困难。广东、广西、海南地区由于处在单一气团的控制下,很容易造成春旱,而长江中下游、福建、江西等地,由于受到太平洋副热带气团的控制,易造成伏旱现象,而西北地区,由于地处大陆腹地受夏季风影响甚微,伏旱、秋旱多较为严重。旱灾容易造成水稻生长受到抑制,尤其是水稻孕穗期,如果遭遇干旱,很容易造成空粒,造成严重的减产。因而,选育一些耐干旱的品种就显得尤为重要。
技术实现要素:
4.本发明的目的在于为改良水稻抗性提供一种新选择。
5.本发明的技术方案是水稻osatl17基因在调控水稻抗性中的应用。
6.具体的,所述水稻osatl17基因的核苷酸序列如seq id no.17所示。
7.其中,所述调控为正调控。
8.进一步,所述抗性为抗旱性。
9.具体的,所述调控为调控水稻脯氨酸含量、可溶性糖含量或/和干旱相关基因的表达水平。
10.优选的,干旱相关基因osap37、oszip23、ospp2c68、osrab21和oserd1。
11.本发明的有益效果:本发明通过实验验证了水稻osatl17基因的功能。实验证实本发明的基因osatl17的沉默植株对干旱的耐性显著降低,预示本发明的基因osatl17的实施将能创造新型耐干旱植物,可用于后续的作物品种改良,对我国农业生产具有重大意义。这表明了osatl17正向调控了水稻对干旱逆境的耐性。并进一步研究发现,该调控是通过调节脯氨酸含量、可溶性糖含量和干旱相关基因的表达水平。
附图说明
12.图1、干旱处理后,osatl17的表达模式,ck为对照,drought为干旱。
13.图2、bmv:osatl17植株,对干旱的耐性降低。(a)遭受干旱和复水后,bmv:osatl17沉默植株和对照植株的表型;bmv:00就是指对照植株,也就是该基因没有沉默的植株;bmv:osatl9指的是该基因沉默的植株;左图是bmv:osatl17沉默植株和对照植株在没有遭受干旱逆境时,无任何明显差异;右图表示在遭受干旱且复水后,bmv:osatl17沉默植株与对照植株相比,恢复率下降;即多数植株都死亡了;(b)bmv:osatl17沉默植株中,osatl17基因的
沉默效率;(c)干旱逆境下,bmv:osatl17沉默植株和对照植株的失水率;(d)干旱逆境下,bmv:osatl17沉默植株和对照植株的存活率。
14.图3、bmv:osatl17沉默植株通过调控脯氨酸含量和可溶性糖的含量降低对干旱的耐性。(a)正常(normal)和干旱(drought)逆境下,bmv:osatl17沉默植株和对照植株中脯氨酸的含量;(b)正常和干旱逆境下,bmv:osatl17沉默植株和对照植株中可溶性糖的含量。
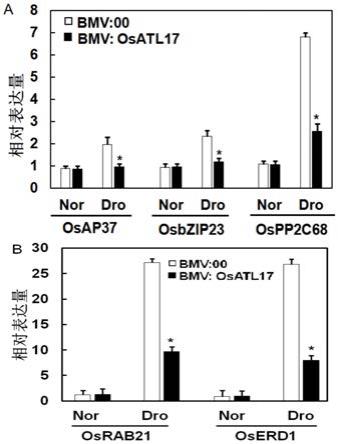
15.图4、正常(nor)和干旱(dro)逆境条件下,bmv:osatl17和对照植株中,干旱相关基因的表达情况
具体实施方式
16.下述实施例中用到的主要实验材料与方法:
17.1、植物材料
18.所采用的水稻品种为原丰早和ir64,“原丰早”用于干旱逆境处理的表达分析;ir64用于病毒诱导的基因沉默(vigs)。
19.2、主要实验试剂
20.trizol试剂购买于thermofisher,实时荧光定量pcr(qrt
‑
pcr)相关的试剂购买于takara公司。其他常规的试剂购买于北京鼎国生物技术有限责任公司。
21.3、植物种植方法
22.水稻(oryza sativa)品种原丰早经过催芽后种植在塑料营养钵(直径8cm,高10cm,每盆播种10株),置于培养箱中培养。幼苗的生长条件是:28℃,16h光照/8h黑暗。一周龄的水稻幼苗用干旱处理。
23.水稻品种ir64将水稻种子播种于塑料营养钵中,每钵播种5株,生长温度控制在22~24℃,光周期为14h/10h。待植株生长10~14天时,用于vigs侵染实验。
24.4、实施例中用到的引物见表1。
25.表1实施例中用到的引物
26.[0027][0028]
实施例1基因的表达模式分析
[0029]
干旱胁迫采用三周龄左右的“原丰早”水稻放于空气中自然干燥,干旱处理后0、0.5、1和2h取样,液氮速冻后于
‑
80℃保存备用。
[0030]
总rna的提取采用trizol的方法,具体操作如下:取叶片在液氮中充分研(研磨要迅速,最好不要超过1分钟);然后将研磨号的粉末装入离心管中;每使用1ml trizol加0.2ml氯仿,盖好管盖,剧烈振荡15秒,室温放置3分钟;4℃,10000rpm离心10~15分钟;把水相转移到新管中并加入等体积异丙醇,混匀,室温放置20~30分钟;4℃,10000rpm离心10分钟,去上清;加入1ml 75%乙醇洗涤沉淀(每使用1ml至少用1ml 75%乙醇对沉淀进行洗涤);4℃,5000rpm离心3分钟,倒出液体;室温放置晾干,根据实验需要,加入30~100μl无rnase水,溶解rna。按照takara反转录试剂盒说明先去除rna中dna的污染。然后按照试剂盒说明书进行反转录,获得相应的cdna。qrt
‑
pcr反应采用sybr green i作为反应荧光染料。反应在cfx96tm real
‑
time system(bio
‑
rad,hercules,ca,usa)仪器中进行。以水稻actin基因作为内参基因,检测osatl17基因的表达量。扩增actin基因的引物为表1中seq id no.1和seq id no.2,扩增osatl17基因的引物为表1中seq id no.3和seq id no.4。扩增体系:fast essential dna green master(2
×
)12.5μl,引物1(10μm)0.5μl,引物2(10μm)0.5μl,cdna模板0.5μl,ddh2o(双蒸水)补足至25μl。扩增程序:反应程序为95℃10min;95℃20s,60℃20s,72℃延伸20s,进行40个循环。
[0031]
osatl17基因的表达受到了干旱逆境的诱导:干旱逆境下,osatl17基因的表达受到了强烈的诱导。干旱0.5h后,osatl17基因的表达量显著增加,在干旱1h后达到了最大值,随后稍微有所下降(图1)。
[0032]
实施例2基因沉默vigs载体的构建
[0033]
水稻osatl17基因的系统座位标识码为os06g34390(http://rice.plantbiology.msu.edu/)。该基因的核苷酸序列如seq id no.17所示,其编码蛋白的氨基酸序列seq id no.18所示。基因沉默表达载体bmv载体由浙江大学农业与生物技术学院宋凤鸣课题组提供。
[0034]
采用表1中seq id no.15和seq id no.16为引物,以水稻基因组dna为模板,扩增osatl17基因,并将其连接到t/a克隆载体pmd19上。经测序验证正确后,以pmd19
‑
osatl17质
粒为模板,用特异性引物seq id no.15和seq id no.16进行pcr扩增。pcr产物经l%琼脂糖胶电泳后,采用dna gel purification kit(sangon,shanghai,china)回收目标条带,用ncoi和avrⅱ(购于neb公司)双酶切目标片段和沉默载体bmv,在37℃温浴4h,酶切的体系为:4μl buffer,1.5μl ncoi,1.5μl avrⅱ,10μl bmv载体质粒或者目标片段,添加水补充至40μl。酶切后回收bmv载体质粒或者目标片段,16度t4(takara)连接酶过夜连接,连接体系为:1μl连接缓冲液,1μl t4连接酶,2μl酶切后回收的bmv载体质粒,6μl酶切后回收的目标片段。42℃热击转化大肠杆菌jm109(含50mg/l的卡那霉素的lb平板筛选),挑取单菌落进行菌落pcr鉴定进行初筛,最终提取质粒进行测序验证,并命名为bmv:osatl17。经电击法将所述沉默表达载体bmv:osatl17转入农杆菌。挑取单菌落进行菌落pcr鉴定,选取阳性菌斑,在液体培养基中培养,获得农杆菌菌液,
‑
80℃保存备用。
[0035]
实施例3vigs沉默植株的获得
[0036]
取实施例2获得载体于
‑
80℃保存的菌株,在含有50mg/l kan的yep固体养基上28℃划线培养2~3d;挑取单克隆于含抗生素的50ml yep培养基中,250rpm,28℃培养,使菌液浓度达到od
595
为1.0,将分别含有bmv:osatl17和病毒粒子p1300m/rna1+2(该病毒粒子可帮助携带基因的病毒载体在植物体内的移动,由浙江大学农业与生物技术学院宋凤鸣课题组提供)农杆菌液等体积混合。对照组使用分别含bmv和p1300m/rna1+2的农杆菌混合液。混合后农杆菌菌液4000rpm离心10min,去上清,并用等体积的诱导缓冲液重悬,28℃培养3h后,添加100μm乙酰丁香酮(as),0.4g/l l
‑
半胱氨酸,0.15g/l二巯基苏糖醇(dtt),0.75mg/l硝酸银。诱导缓冲液配方:10mm 2
‑
吗啉乙磺酸(mes),10mm mgcl2,200μm乙酰丁香酮(as)。
[0037]
将生长两周的幼苗倒置于农杆菌浸入缓冲液中,进行抽真空处理。真空压力为
‑
4000pa,侵染时间为7min。侵染完后,将缓冲液叶面喷施于幼苗,将幼苗置于24/22℃(白天/黑夜),14h光照/10h黑暗的培养箱内培养。
[0038]
参照实施例1中的方法提取总rna样品。按照takara反转录试剂盒说明先去除rna中dna的污染。然后按照试剂盒说明书进行反转录,获得相应的cdna。qrt
‑
pcr反应采用sybr green i作为反应荧光染料。反应在cfx96tm real
‑
time system(bio
‑
rad,hercules,ca,usa)仪器中进行。用qrt
‑
pcr检测基因的沉默效率。以水稻actin基因作为内参基因,检测osatl17基因的表达量。扩增actin基因的引物为表1中seq id no.1和seq id no.2,扩增osatl17基因的引物为表1中seq id no.3和seq id no.4。扩增体系:fast essential dna green master(2
×
)12.5μl,引物1(10μm)0.5μl,引物2(10μm)0.5μl,cdna模板0.5μl,ddh2o(双蒸水)补足至25μl。扩增程序:反应程序为95℃10min;95℃20s,60℃20s,72℃延伸20s,进行40个循环。
[0039]
结果见图2b。从图中可以看出osatl17基因在bmv:osatl17沉默植株中的沉默效率约为62%。
[0040]
实施例4水稻osatl17基因在调控水稻抗性中应用
[0041]
将30天苗龄的沉默植株和对照植株同时转移到同一个容器,容器的一侧种上沉默植株,另一侧则种上对照植株,每侧至少有10个植株,设3次重复。恢复生长10天后停止浇水,10天后复水,复水后12天统计植株的存活率,生物量,脯氨酸含量和可溶性糖含量等指标。
[0042]
失水率测定:将三个月大的水稻植株充分吸水过夜,每个株系取三株水稻,每株取
5张叶片,失水前称量每张叶片的质量,然后在室温条件下放置2h、4h、7h、10h后分别称重记录,最后将所有叶片在80℃烘箱中过夜烘干;失水率为失水质量占鲜重的百分比。
[0043]
可溶性糖的测定:水稻叶片可溶性糖选用蒽酮法进行测定。取水稻叶片0.5g,经液氮研磨充分,放于加有10ml无菌水的试管中,沸水浴煮沸20min,静置冷却后离心10min(4000rpm),取1ml上清液加入含有5ml蒽酮试剂的洁净试管中,沸水浴煮沸10min,静置冷却,取上清在620nm波长处测定吸光值,并根据标准曲线算得可溶性糖数值(x)。水稻中可溶性糖含量(%)=x
×
提取液体积(ml)
×
稀释倍数/[测定用样品液的体积(ml)
×
样品重量(g)
×
106]
×
100。
[0044]
脯氨酸含量的测定:称取水稻叶片组织0.5g,用液氮研磨至粉末状,然后将其转移到含5ml 3%的磺基水杨酸溶液向试管中,在沸水浴中煮沸10min(提取过程中注意要经常摇动试管),冷却后离心10min(4000rpm),取滤液于干净试管中,滤液即为脯氨酸的提取液。吸取2ml提取液于另一干净试管中,向其中加入2ml冰醋酸和2ml 2.5%酸性茚三酮溶液,放入沸水中煮沸30min,溶液逐渐呈现红色。冷却后向其中加入4ml甲苯,摇荡30秒钟,静置10min,取上层溶液与洁净试管中,离心5min(4000rpm)。用吸管轻轻吸取上层脯氨酸红色甲苯溶液于比色杯中,以甲苯溶液为空白对照,在520nm波长处测定吸光度值。根据吸光度值从标准曲线中查的脯氨酸数值(x),根据公式x
×
提取液总体积(ml)/样品鲜重(g)
×
测定时所用提取液体积(ml)算得水稻叶片中脯氨酸含量(μg
·
g
-1
fw)。
[0045]
bmv:osatl17沉默植株,与对照植株相比,对干旱的抗性降低:沉默植株和对照植株同时转移到同一个容器,容器的一侧种上沉默植株,另一侧则种上对照植株。恢复生长10天后停止浇水,10天后复水,观察现象。osatl17确实沉默的植株,与对照植株相比,对干旱的抗性降低。与对照植株相比,bmv:osatl17沉默植株的失水率增加,存活率下降(图2),这些都表明osatl17正向调控对干旱的耐性。
[0046]
osatl17沉默调控了脯氨酸和可溶性糖的含量:干旱逆境下,检测bmv:osatl17沉默植株和对照植株体内的脯氨酸含量和可溶性糖含量。结果显示,干旱条件下,bmv:osatl17沉默植株体内的脯氨酸含量(图3a)和可溶性糖含量(图3b)比对照植株显著降低。这表明了osatl17沉默会降低植株体内脯氨酸含量和可溶性糖含量。
[0047]
参照实施例1中的方法提取总rna样品。按照takara反转录试剂盒说明先去除rna中dna的污染。然后按照试剂盒说明书进行反转录,获得相应的cdna。qrt
‑
pcr反应采用sybr green i作为反应荧光染料。反应在cfx96tm real
‑
time system(bio
‑
rad,hercules,ca,usa)仪器中进行。
[0048]
以水稻actin基因作为内参基因,对已报道的跟植物干旱耐受有关基因osap37、oszip23、ospp2c68、osrab21和oserd1的表达量进行检测。扩增actin的引物为表1中seq id no.1和seq id no.2,扩增osap37、oszip23、ospp2c68、osrab21和oserd1的引物为表1中seq id no.5~14。扩增体系:fast essential dna green master(2
×
)12.5μl,引物1(10μm)0.5μl,引物2(10μm)0.5μl,cdna模板0.5μl,ddh2o(双蒸水)补足至25μl。扩增程序:反应程序为95℃10min;95℃20s,60℃20s,72℃延伸20s,进行40个循环。
[0049]
如图4所示,干旱逆境条件下,bmv:osatl17沉默植株,与对照植株相比,抑制了干旱相关基因的表达情况。这些都表明了osatl17沉默降低对干旱逆境的耐性,可能是通过对干旱相关基因表达的调控来实现的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1