一种非绿色组织高效表达顺式元件及其应用的制作方法
1.本发明涉及植物基因工程技术领域,具体涉及一种非绿色组织高效表达顺式元件及应用。
背景技术:
2.质体转化技术利用同源重组,可以实现外源基因的定点整合,拥有高效、安全等优势,作为一种重要的植物基因工程手段,在双子叶植物中得到了广泛的运用。但是在单子叶植物水稻中却进展缓慢,一方面由于水稻自身对质体转化中常用筛选剂如壮观霉素不敏感,另一方面质体转化常用表达元件prrn在非绿色组织中的转录水平较低。因此针对水稻质体转化中使用的愈伤受体,不仅需要利用高效的筛选标记,还需要寻找有效的表达调控元件提高筛选效率。
3.尽管植物中的质体转化已取得重大进展,但是对于非绿色组织的质体转化的研究少之又少,在非绿色组织中缺乏有效的表达调控元件。番茄果实的有色体(kahlau and bock,2008)和马铃薯块茎中淀粉体转录和翻译的全基因组分析(valkov et al.,2009)显示质体基因组在非绿色组织中有明显的下调表达,这种下调表达在转录和转录后水平都存在。在某些情况下,来自其他植物的异源调控序列可能比内源序列驱动外源基因表达更加高效。zhang等发现来自玉米叶绿体基因组中的异源表达元件在烟草根部组织中能够获得比内源表达元件更高水平的表达(zhang et al.,2012)。
[0004]5’
非翻译区(5’utr)在叶绿体基因表达中起着重要作用。许多大肠杆菌和质体转录本的5’utr包含一个shine
‑
dalgarno(sd)序列(ggagg),位于翻译起始密码子上游约10nt,可以与16s核糖体rna碱基配对(shine and dalgarno,1974;kozak,1999)。实验表明,细菌sd为某些mrna有效翻译合成蛋白质所必需。t7g10是一种对质体中的产生高水平外源蛋白特别有效的5’utr(staub et al.,2000;kuroda and maliga,2001),来源于编码t7噬菌体外壳蛋白的基因(基因10),通常用于在大肠杆菌中表达外源蛋白。t7g10 5’utr包含一个共有的sd序列,对于在质体中的翻译起始可能是重要的。t7g10 5’utr调节了质体中许多最高积累的外源蛋白,证明了该噬菌体5’utr在驱动外源蛋白积累方面的实用性。
技术实现要素:
[0005]
本发明通过克隆一个水稻质体基因clpp启动子pclpp的dna片段,并将水稻中分离克隆的启动子pclpp与t7g10 5’utr组合后构成pclpp:g10顺式调控元件,探索利用这个调控元件提高目的基因在非绿色组织中的表达,从而改良水稻质体转化体系。
[0006]
本发明的技术方案如下:
[0007]
本发明提供一种能在植物非绿色组织内高效表达目的基因的顺式元件,其核苷酸序列如序列表seq id no:1所示。该顺式元件由启动子pclpp与t7g10 5’utr组合后构成。
[0008]
其中,水稻质体基因clpp是根据发明人所在作物遗传改良国家重点实验室水稻全生育期质体基因表达芯片数据及水稻品种日本晴和明恢63全生育期质体基因表达谱芯片
数据筛选得到。其在愈伤组织中表达强度不低于叶片中的质体基因,可能含有在愈伤组织中高效表达的启动子或其他元件。该基因的第一个起始密码子为atg,针对其上游2kb左右的区间设计引物,并在反向引物5’端加上t7g10 5’utr接头,选择烟草品种petit havana的基因组作为模板,克隆该顺式元件片段并命名为p
clpp
:g10。
[0009]
本发明的上述顺式元件能够提高外源基因在植物非绿色组织中表达。
[0010]
本发明还提供了一种提高外源基因在植物非绿色组织中表达水平的方法,利用所述seq id no:1所示的顺式元件,与外源基因构建植物质体转化载体,通过遗传转化方法将所构建的转化载体导入植物受体中,在植物非绿色组织中,该外源基因表达量将显著上升。
[0011]
其中,本发明中的外源基因可选的为抗除草剂基因,也可以为其他有特殊性能的目的外源基因。
[0012]
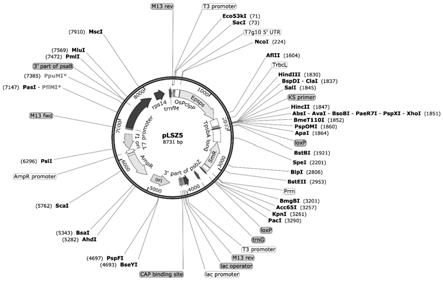
作为一种可实施的方式,本发明中的转化载体优选的为plsz3。将p
clpp
:g10构建到烟草质体转化载体plsz3(图1)上,形成终载体plsz5(图2)。
[0013]
本发明中的遗传转化法可以为本领域中出现的已知质体遗传转化方法,在本发明具体实施例中,采用基因枪介导法将所构建的转化载体导入植物受体中。
[0014]
作为一种可实施的方式,本发明在具体实施例中的植物受体采用烟草,也可以为其他能够实现叶绿体遗传转化的植物,例如西红柿、土豆、生菜等。通过基因枪介导法将plsz5导入植物受体,对获得的转基因阳性植株进行转录水平、蛋白水平检测,并检测其草甘膦抗性水平,确定p
clpp
:g10的表达模式。分子生物学实验表明,转基因阳性植株根部组织中草甘膦抗性基因在转录水平和蛋白水平均得到高效表达。
[0015]
本发明的有益效果:
[0016]
本发明筛选得到一个在愈伤组织中表达强度不低于在叶片中的质体基因clpp,将水稻中分离克隆的启动子p
clpp
与t7g10 5’utr组合后构成p
clpp
:g10顺式调控元件。将含有该顺式调控元件与抗草甘膦基因构建植物质体转化载体,通过遗传转化方法将所构建的转化载体导入烟草受体中,分子生物学实验表明,转基因阳性植株根部组织中草甘膦抗性基因在转录水平和蛋白水平均得到高效表达,确定p
clpp
:g10顺式调控元件能在植物非绿色组织内高效表达目的基因,该特征在在水稻质体转化工程中具有较好应用前景。
附图说明
[0017]
图1:是本发明应用的质体转化载体plsz3结构示意图。
[0018]
图2:是本发明制备的重组表达载体plsz5结构示意图。
[0019]
图3:载体pesi
‑
blunt vector结构示意图。
[0020]
图4:烟草质体转化阳性植株southern检测。
[0021]
图5:烟草质体转化阳性植株northern检测。
[0022]
图6:烟草质体转化阳性植株western检测。
[0023]
图7:草甘膦抗性下烟草质体转化阳性植株根的生长。
[0024]
图8:草甘膦抗性下烟草质体转化阳性植株根部组织的分化。
具体实施方式
[0025]
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进
行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0026]
以下实施例进一步定义本发明,并描述了本发明在上述前期研究工作结果的基础上验证p
clpp
:g10顺式元件(clpp启动子与t7g10 5’utr组合)功能的方法和结果。根据以下的描述和这些实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,对本发明做出各种修改,以使其适用各种用途和条件。
[0027]
下述实施例中的实验方法,如无特殊说明,均为常规方法。
[0028]
实施例1:顺式元件p
clpp
:g10的功能区分析
[0029]
1.分离p
clpp
:g10顺式元件
[0030]
用clpp基因启动子特异性的pcr引物ospclpp
‑
f和ospclpp
‑
10
‑
r(引物序列见表1)扩增5’端带有t7g105’utr的clpp基因启动子的完整dna片段p
clpp
:g10,序列长度为161个碱基,核苷酸序列如下:
[0031]
gagctctctacgtacttaatagaatctatagtattcatatagaataagaaaaaaacgtgaaaacaataaactgcggattctttctttctcttccattcttacgtttccatattaaagtgtagttttcttacttaaatttaaagaaggagatatacccatgg。
[0032]
pcr引物ospclpp
‑
f含有限制性内切酶sac i位点,引物ospclpp
‑
10
‑
r含有限制性内切酶nco i位点。以粳稻品种zh11基因组为模版pcr扩增获得的dna片段克隆到pesi
‑
blunt vector载体(yeasen公司,图3)。采用m13f通用引物(见表1)(武汉昆泰锐生物技术有限公司)对顺式元件片段的克隆进行测序验证。
[0033]
表1本发明中所涉及的引物
[0034][0035]
2.烟草质体转化载体的构建
[0036]
烟草质体转化所使用的载体plsz3(图1),由本实验室路史展硕士构建。plsz3携带由驱动的抗除草剂基因epsps(5
‑
enolpyruvylshikimate
‑3‑
phosphate synthase,5
‑
烯醇式丙酮酰莽草酸
‑3‑
磷酸合酶)及筛选标记基因aada(aminoglycoside 3
’‑
adenylyltransferase,氨基糖苷
‑3’‑
腺苷酸转移酶)。转化载体的构建采用常规酶切连接的方法(sambrook and russell,2001)。主要步骤是:用限制性内切酶sac i和nco i酶切上述p
clpp
:g10顺式元件片段和质体转化载体plsz3,将酶切产物电泳后,分别切下顺式元件片段和载体片段,然后使用dna纯化回收试剂盒回收目的片段。用回收的顺式元件片段和plsz3载体片段做连接反应,使其置于抗除草剂基因epsps的上游(图2)。通过菌液pcr筛选阳性克隆。将获得的重组质粒命名为plsz5,将该重组质粒电转化导入大肠杆菌dh5α,使用plasmid midi kit(qiagen)提取质粒,并调整浓度为2μg/μl。
[0037]
实施例2:烟草的叶绿体转化
[0038]
采用基因枪介导的质体转化方法将plsz5质粒dna导入到烟草质体中,具体的基因枪介导的质体转化步骤如下:
[0039]
1烟草转化材料准备
[0040]
1)将野生型烟草种子在无菌工作台上进行消毒处理,步骤如下:600μl75%酒精加1滴tween20清洗1分钟,再加入600μl 6%naclo溶液清洗3分钟,再用灭菌水洗涤数次清除残留naclo。
[0041]
2)将消毒处理好的种子移至rm培养基上进行发芽,两周后将幼苗转移至装有50毫升rm培养基的方形培养盒中生长3周。
[0042]
3)取烟草植株幼嫩叶片,将其背面朝上置于rm培养基平皿中央待用。
[0043]
2金粉处理
[0044]
1)称取1.5毫克直径0.6微米的金粉于1.5毫升离心管中,加入600微升无水乙醇,使用超声波震荡5分钟,4℃离心至5000转/分后停止。
[0045]
2)吸去上清,加入600微升无菌双蒸水,震荡30秒,4℃离心至5000转/分后停止。
[0046]
3)吸去上清,加入175微升无菌双蒸水,震荡混匀。
[0047]
3质粒包裹
[0048]
1)取1.5毫升离心管提前冰浴,并加入172微升处理好的金粉溶液。
[0049]
2)加入20微克质粒(约10微升),震荡混匀。
[0050]
3)加入175微升2.5m cacl2溶液,震荡混匀。
[0051]
4)加入35微升0.1m亚精胺溶液,震荡混匀。
[0052]
5)每分钟震荡混匀10秒,持续10分钟。
[0053]
6)4℃离心至3500转/分后停止。
[0054]
7)吸去上清,加入600微升无水乙醇,使用200微升枪头反复吹吸,直至金粉完全打散。
[0055]
8)4℃离心至5000转/分后停止。
[0056]
9)重复7)、8)步。
[0057]
10)吸取上清(尽量吸干净),加入50微升无水乙醇,并吹吸混匀。
[0058]
4基因枪轰击(在超净工作台中进行)
[0059]
1)1100磅/平方英寸可裂膜在无水乙醇中浸泡清洗2分钟,载体膜、阻止网、载体膜盘架在无水乙醇中浸泡清洗5分钟,放置在干净无菌平皿上吹干。使用无水乙醇擦拭可裂膜保持盖、微粒送出组装装置、靶板及轰击室内壁并晾干。
[0060]
2)打开基因枪、真空泵电源,打开氦气罐开关,并设置气压为1300磅/平方英寸。
[0061]
3)将载体膜放置在载体膜盘架上,在载体膜中央滴加7微升包裹好的金粉溶液,等待无水乙醇挥发完全。
[0062]
4)将可裂膜放置在可裂膜保持盖中,旋紧安装至气体加速管末端,使用扭力扳手锁紧。
[0063]
5)将阻止网、载体膜盘架依次安装到微粒送出组装装置上,置于轰击室内。
[0064]
6)将带有叶片的rm平皿放在靶板中央,置于轰击室内,位于微粒送出组装装置下方9厘米。
[0065]
7)基因枪按钮按到vac档位抽真空,待真空度达到28英寸汞柱后转为hold档位,一
直按下fire按钮直至可裂膜破裂,调整至vent档位放气完全后打开室门将样品拿出,暗培养16小时。
[0066]
5筛选
[0067]
1)将无菌滤纸放置在无抗rmop培养基平皿上,在滤纸上将转化后烟草叶片切成5厘米
×
5厘米大小,背面朝下放置在含有500毫克/升壮观霉素的rmop培养基平皿上,光照下培养30
‑
40天,温度25℃。
[0068]
2)取筛选后再生幼芽叶片,重复步骤1)
[0069]
3)重复步骤2)
[0070]
6生根
[0071]
将筛选后再生幼芽从愈伤上切下,插入到装有rm培养基的培养盒中,光照下培养2
‑
3周,温度25℃。
[0072]
7移土栽培
[0073]
1)洗掉根上的残留培养基,将具有良好根系的幼苗转入育苗基质中培养,同时在最初的几天保持水分湿润。
[0074]
2)转化烟草品种petit havana,得到质体转化t 0代植株。
[0075]
共获得阳性独立转化植株2株。取8μg阳性转化烟草植株基因组dna,使用bglⅱ将基因组消化完全,以dig
‑
11
‑
dutp标记的dig
‑
psab为特异性探针,进行southern blotting检测(图4)。和预期结果相同,野生型烟草显示条带为3.5kb,阳性烟草转化植株显示条带为6.8kb,且未显示出野生型条带,故可以判断烟草转化植株均已达到同质化。
[0076]
实施例3:利用转基因植株检测顺式元件p
clpp
:g10的表达模式
[0077]
1.转化植株的同质化检测
[0078]
将供试的质体转化烟草t0代阳性植株的种子,在含有500mg/l壮观霉素的rm培养基上发芽以检测阳性植株是否达到同质化。具体筛选过程如下:
[0079]
1)配制rm培养基并添加壮观霉素,使壮观霉素的终浓度为500mg/l。
[0080]
2)将需要鉴定的烟草种子在无菌工作台上进行消毒处理,步骤如下:600μl 75%酒精加1滴tween20清洗1分钟,再加入600μl 6%naclo溶液清洗3分钟,再用灭菌水洗涤数次清除残留naclo。
[0081]
3)将消毒处理好的种子移至含有壮观霉素的rm培养基上进行发芽,两周后观察,如果全部发芽正常为同质化,有部分白化苗的为非同质化。
[0082]
2.幼苗期抗草甘膦基因分子生物学检测
[0083]
取壮观霉素发芽阳性植株转移至生根盒中,待烟草植株长到八叶期分别取叶片和根部组织进行总rna和总蛋白提取。
[0084]
烟草样品总rna的抽提采用trizol法,具体步骤如下:
[0085]
1)取烟草组织于液氮中研磨成粉,然后转移至含有1ml trizol(购自invitroge公司)试剂的1.5ml离心管中,用手轻摇匀,静置10min使样品与trizol试剂充分反应;
[0086]
2)加入200μl氯仿并轻轻上下颠倒摇匀后静置10min,使其充分反应;
[0087]
3)4℃,12000rpm,冷冻离心15min;
[0088]
4)吸取450μl上清至另一个新的1.5ml离心管;
[0089]
5)加入450μl异丙醇,轻轻混匀,室温静置10min;
[0090]
6)在4℃,12000rpm,冷冻离心15min后,弃上清;
[0091]
7)加入75%乙醇700μl并轻轻上下颠倒数次;
[0092]
8)4℃,7500rpm冷冻离心5min,弃上清并吸干残余乙醇后,静置5min左右;
[0093]
9)加入灭菌depc水20μl,然后置于55℃水浴锅中10min,使rna充分溶解,后立即置于冰上5min,最后保存在
‑
70℃备用。
[0094]
为了检测抗除草剂基因在转录水平上的表达情况,通过甲醛变性胶分离烟草转化植株总rna,转膜后以dig
‑
11
‑
dutp标记的dig
‑
aroai.va*为特异性探针进行northern blotting检测(图5)。
[0095]
取烟草转化植株总蛋白进行sds
‑
page电泳分离,半干转膜后使用anti
‑
i.variabilis
‑
epsps多克隆抗体进行western blotting检测(图6)。
[0096]
northern blot实验和western blot实验分析结果表明,p
clpp
:g10顺式元件能够高效驱动草甘膦抗性基因在根部组织的表达,相比于质体转化常用顺式元件ntprrn:g10,p
clpp
:g10顺式元件阳性转化植株在转录水平和蛋白水平均有较高的累积。
[0097]
3.草甘膦抗性种子萌发实验
[0098]
将供试的质体转化烟草t0代阳性植株的种子,在含有50mg/l草甘膦的rm培养基上发芽。具体实验过程如下:
[0099]
1)配制rm培养基并添加草甘膦,使草甘膦的终浓度为50mg/l。
[0100]
2)将需要质体转化烟草种子在无菌工作台上进行消毒处理,步骤如下:600μl 75%酒精加1滴tween20清洗1分钟,再加入600μl 6%naclo溶液清洗3分钟,再用灭菌水洗涤数次清除残留naclo。
[0101]
3)将消毒处理好的种子移至含有草甘膦的rm培养基上进行发芽,两周后观察,拍照并测量幼苗根的生长长度(图7)。
[0102]
实验结果显示,在草甘膦抗性下,野生型无法正常生长,相比于ntprrn:g10顺式元件,ospclpp:g10顺式元件阳性转化植株根发育状况更好。
[0103]
4.草甘膦抗性再生实验
[0104]
取草甘膦发芽阳性植株转移至生根盒中,待烟草植株长到八叶期分别取叶片和根部组织放置在含有50mg/l草甘膦的rmop培养基上再生。具体实验过程如下:
[0105]
1)配制rmop培养基并添加草甘膦,使草甘膦的终浓度为50mg/l。
[0106]
2)取阳性烟草植株无菌苗根部组织,在无菌工作台上切成长度1cm的小段,并平铺到含有50mg/l草甘膦的rmop培养基上再生,一个月后观察阳性植株再生情况。结果显示,野生型未能分化出愈伤,ospclpp:g10阳性转化植株能够分化出愈伤并形成再生植株。
[0107]
综合以上研究结果,顺式元件p
clpp
:g10是一个能够在非绿色组织中高效表达目的基因的调控元件,预期可以在水稻质体转化工程中具有较好应用前景。
[0108]
本发明涉及的烟草质体转化过程、培养基及相关试剂配制方法如下:
[0109]
1.试剂和溶液缩写
[0110]
本发明中培养基所用到的试剂的缩写表示如下:
[0111]6‑
ba(6
‑
benzylaminopurine,6
‑
苄基氨基嘌呤);
[0112]
naa(naphthalene acetic acid,萘乙酸);
[0113]
vb1(vitamin b1,维生素b1);
[0114]
fenaedta(ethylenediaminetetraacetate ferric sodium,乙二胺四乙酸铁钠);
[0115]
msmax(ms大量元素成分溶液);
[0116]
msmin(ms微量元素成分溶液);
[0117]
spec(spectinomycin,壮观霉素);
[0118]
strep(streptomycin,链霉素)。
[0119]
2.溶液配方
[0120]
1)ms培养基大量元素母液(msmax母液)(按照10
×
浓缩液配制)
[0121][0122]
将上述试剂在20
‑
25℃温度下溶解,并用蒸馏水定容至1000毫升。
[0123]
2)ms培养基微量元素母液(msmin母液)(按照100
×
浓缩液配制)
[0124]
将上述试剂在20
‑
25℃温度下溶解,并用蒸馏水定容至1000毫升。
[0125][0126]
3)6
‑
ba贮存液(1毫克/毫升)的配制:
[0127]
称取6
‑
ba100毫克,用1毫升1n氢氧化钾溶解5分钟,然后加10毫升蒸馏水溶解完全后定容至100毫升,20
‑
25℃温度保存。
[0128]
4)萘乙酸(naa)贮存液(1毫克/毫升)的配制:
[0129]
称取naa 100毫克,用1毫升1n氢氧化钾溶解5分钟,然后加10毫升蒸馏水溶解完全后定容至100毫升,4℃保存备用。
[0130]
5)维生素b1(vb1)贮存液(1毫克/毫升)的配制:
[0131]
称取vb1 100毫克,加入10毫升蒸馏水溶解完全后定容至100毫升,4℃保存备用。
[0132]
6)乙二胺四乙酸铁钠(fenaedta)贮存液(10毫克/毫升)的配制:
[0133]
称取fenaedta 1克,加入10毫升蒸馏水溶解完全后定容至100毫升,4℃保存备用。
[0134]
7)1n氢氧化钾贮存液
[0135]
称取氢氧化钾5.6克,用蒸馏水溶解定容至100毫升,20
‑
25℃温度保存备用。
[0136]
8)2.5m氯化钙贮存液
[0137]
称取2.775克无水氯化钙溶于10毫升双蒸水中,使用0.22微米过滤灭菌器灭菌后分装到0.5毫升离心管中,负20℃保存备用。
[0138]
9)0.1m亚精胺贮存液
[0139]
称取72.6毫克亚精胺粉末溶于5毫升双蒸水中,使用0.22微米过滤灭菌器灭菌后分装到0.2毫升离心管中,负20℃保存备用。
[0140]
3.用于烟草质体转化的培养基配方
[0141]
1)rm培养基
[0142][0143]
加蒸馏水至900毫升,1n氢氧化钾调节ph值到5.8,定容至1000毫升,分装到500毫升三角瓶(500毫升/瓶),封口后按常规方法灭菌(121℃下灭菌25分钟,下述的培养基灭菌方法与本培养基的灭菌方法相同)。
[0144]
2)rmop培养基
[0145]
加蒸馏水至900毫升,1n氢氧化钾调节ph值到5.8,定容至1000
[0146][0147]
毫升,分装到500毫升三角瓶(500毫升/瓶),封口后按常规方法灭菌(121℃下灭菌25分钟,下述的培养基灭菌方法与本培养基的灭菌方法相同)。
[0148]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1