一种鸡PEBP1基因多克隆抗体、制备方法及应用
本发明涉及生物技术领域,涉及一种鸡pebp1基因多克隆抗体、制备方法及应用,特别涉及一种与肉鸡肺动脉高压和腹水类疾病发生发展相关的鸡pebp1基因多克隆抗体、制备方法及应用。
背景技术:
肉鸡腹水综合征(ascitessyndrome,as)曾叫做禽类水肿、充血性心衰和肺动脉高压综合征等,是一种比较常见的代谢紊乱、非传染性疾病。该病最早发现于高海拔、寒冷的地区,其主要特征是心脏负荷增强、低氧血症、右心肥大等,病理剖检后可见腹腔中积聚大量淡黄色透明液体、心包积液、肾脏和肝脏充血肿大乃至坏死。研究表明,此类疾病主要发生于2-6周龄且体型较大的肉鸡,并由营养、疾病、环境及饲养管理等多种因素共同作用导致。这是因为在肉鸡生长的关键时期,肉仔鸡的心肺发育尚未成熟,使其扩张受到限制,但生长速率过快会导致机体耗氧量达到心肺供氧的临界点,当血流量增加时,受到肺脏的限制,其毛细血管过度充盈,肺血管阻力增强,进而导致肺动脉高压形成腹水。此外,这类肺动脉高压和腹水类疾病的发生会给养禽业带来重大的经济损失,该病一年四季皆可发生,寒冷的冬春季节较为多见,且病程较短,一般5-7天死亡,死亡率高达15%-30%。近年来,该病在肉鸡饲养过程中经常发生,甚至会对全球养禽业的经济效益造成严重损害。
磷脂酰乙醇胺结合蛋白1(pebp1),又称为raf激酶抑制剂蛋白(rkip),是一种具有高度保守性且与其他蛋白家族没有显著同源性的特殊调控因子。它广泛存在于机体的多个组织或器官中,参与调节机体的各种生理活动。研究表明,pebp1的表达与损伤细胞的侵袭以及血管形成程负相关。pebp1本身可以与raf-1相结合,并起到抑制raf-1下游信号通路的作用,进而削弱损伤细胞的增殖扩散,降低动脉血管的过度形变和异常增生。防止因血管内皮细胞的损伤造成动脉血管的极度扩张和扭曲,进而降低肺动脉高压和腹水类疾病的发生发展。此外,当机体处于一系列病理条件下时,pebp1的磷酸化会抑制pebp1与raf-1之间的相互作用,反而和磷脂酰胆碱特异性磷脂酶c(pc-plc)发生相互结合,从而正向调控其活性。而pc-plc参与了血管内皮细胞凋亡的信号通路,引起血管内皮细胞功能障碍,导致血管壁对细胞因子和脂质的渗透性增强,动脉压强和阻力增大,加剧了动脉壁内皮细胞的损伤,最终导致腹水综合征的形成。综上可知,pebp1与肉鸡肺动脉高压和腹水类疾病存在着密切的联系。
同时,发明人在前期肉鸡腹水综合征的肺动脉组织转录组测序试验结果中发现pebp1基因水平呈显著低表达。可见,pebp1基因可以成为肉鸡腹水综合征疾病中检测及治疗靶点的潜在指标。目前对鸡的pebp1基因相关抗体的研究还是空白。因此,通过制备pebp1基因多克隆抗体,将为肉鸡腹水综合征疾病等相关疾病的检测及治疗的研究提供了条件。
技术实现要素:
本发明的目的是提供一种鸡pebp1基因多克隆抗体、制备方法及应用,以解决上述现有技术存在的问题,该多克隆抗体的制备简便,成本低,灵敏度高,作用范围广,为后期pebp1蛋白的检测和腹水类疾病病理机制的研究提供了数据支持。
为实现上述目的,本发明提供了如下方案:
本发明提供了一种鸡pebp1基因多克隆抗体的制备方法,包括以pebp1重组蛋白作为抗原免疫新西兰大白兔,获取多克隆抗体的步骤。
优选的是,所述pebp1重组蛋白的制备包括以下步骤:
步骤1:获取鸡源pebp1基因的核苷酸序列;
步骤2:利用步骤1所得的核苷酸序列构建pebp1重组质粒,转化大肠杆菌,培养,诱导,纯化,得到pebp1重组蛋白。
优选的是,步骤1中所述的核苷酸序列如seqidno:1所示,由seqidno:1所示序列编码的氨基酸序列如seqidno:2所示。
优选的是,pebp1重组蛋白包含如seqidno:2所示的氨基酸序列。
本发明还提供一种所述的鸡pebp1基因多克隆抗体的制备方法制备的鸡pebp1基因多克隆抗体。
本发明还提供一种鸡pebp1蛋白的间接免疫荧光检测试剂盒,包含一抗、荧光标记的二抗、固定液、洗涤液、抗体稀释液、检测抗体;所述检测抗体为权利要求5所述的鸡pebp1基因多克隆抗体。
本发明还提供所述的鸡pebp1基因多克隆抗体在制备肉鸡肺动脉高压和腹水类疾病药物中的应用。
本发明还提供所述的鸡pebp1基因多克隆抗体在制备检测肉鸡肺动脉高压和腹水类疾病的检测试剂中的应用。
本发明公开了以下技术效果:
本发明采用克隆、亚克隆技术构建出pet32a-pebp1表达载体,经由异丙基-β-d-硫代半乳糖苷(iptg)诱导表达的重组pebp1蛋白纯化后作为抗原免疫兔子,从而制备高质量的多克隆抗体。利用酶联免疫吸附试验、蛋白免疫印记和间接免疫荧光技术等检测方法对pebp1基因表达进行检测以验证该多克隆抗体的灵敏度和特异性,结果显示免疫新西兰大白兔的抗pebp1的血清效价高达1:204,800,并且该多克隆抗体能特异性结合动物组织中的pebp1蛋白,且pebp1蛋白的表达主要集中于动物各种器官的细胞质部分,并具有明显的物种特异性,充分证实了该抗体具有灵敏度好、特异性强、应用范围广等方面的优点,这为后期pebp1蛋白的检测和腹水类疾病病理机制的研究提供了物质支撑。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
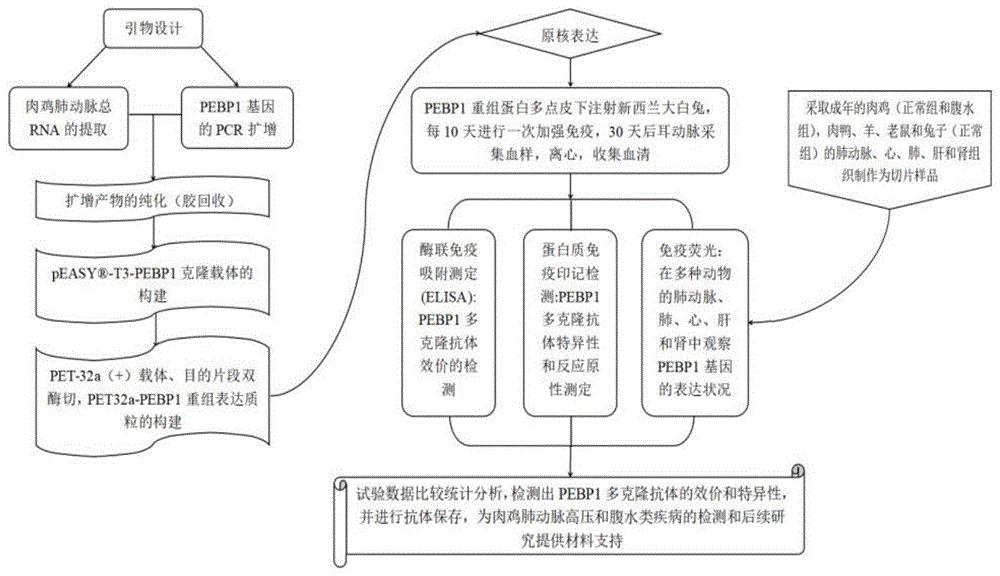
图1为本发明pebp1基因多克隆抗体研制方法的技术路线图;
图2为本发明克隆和表达重组质粒的构建的结果;a:pebp1基因的聚合酶链式反应扩增产物(561bp),泳道1:阴性对照;泳道2:pebp1基因蛋白的pcr扩增产物;b:克隆重组质粒的菌液pcr结果图,泳道1:
图3为本发明pet32a-pebp1重组质粒的核苷酸和氨基酸序列测定结果(包含his标签、hindiii和xhoi内切酶部分),黑色下划线为插入pet-32a载体的pebp1基因片段dna和氨基酸序列,没有下划线的部分为pet-32a(+)的部分载体;
图4为本发明重组pebp1蛋白的诱导表达和纯化结果;a:iptg诱导的重组pebp1蛋白表达,泳道1、2:pet32a-pebp1的诱导总蛋白;泳道3:未诱导的pet32a-pebp1总蛋白;b:重组pebp1蛋白表达形式的鉴定,泳道1:pet32a-pebp1蛋白的上清液;泳道2:pet32a-pebp1蛋白的沉淀;泳道3:未诱导的pet32a-pebp1总蛋白;c:重组蛋白纯化洗脱缓冲液的最适咪唑浓度检测,泳道1-3:不同咪唑浓度(500mm、300mm、100mm)的洗脱缓冲液洗脱目的蛋白,泳道4:洗脱缓冲液;d:镍柱纯化后的目标蛋白;泳道1-3:纯化后的重组pebp1总蛋白(28kda),泳道4:洗脱缓冲液;上图中白色箭头全指示目的蛋白条带;泳道m:标准蛋白marker(10kda-180kda);
图5为本发明间接酶联免疫吸附试验测定制备的抗血清的效价;x轴表示抗pebp1血清的稀释梯度;y轴表示多克隆抗体在450nm波长处的吸光度值;抗血清1-抗血清3分别表示3只不同新西兰大白兔产生的抗pebp1血清,对照为免疫前血清在相同稀释梯度下的吸光值;
图6为本发明免疫印记法检测白羽肉鸡pebp1蛋白;a:肉鸡pebp1蛋白在五种相关组织中的表达水平;b:pebp1蛋白的表达水平柱状图,x轴代表肺动脉、心、肺、肝和肾五种不同的组织,y轴表示pebp1相较于β-actin的表达水平;c:蛋白质印记法检测原核表达中pebp1蛋白特异性,上层泳道1-3:肉鸡肺动脉pebp1总蛋白(28kda),目标蛋白用黑色箭头指出,下层泳道1-3:免疫前血清的阴性对照;
图7为本发明肉鸡、肉鸭、山羊、小鼠和兔子相关组织(肺动脉、心、肺、肝和肾)pebp1蛋白表达免疫荧光检测;a-f:分别代表正常肉鸡,腹水肉鸡,正常肉鸭,正常小鼠,正常兔子和正常山羊中相关组织切片与pbs缓冲液(空白对照)、免疫前血清(阴性对照)和抗pebp1血清孵育后的免疫荧光结果图;蓝色荧光:细胞核染色,红色荧光:蛋白质染色;g:肉鸡肺动脉、心、肺、肝和肾组织pebp1蛋白平均荧光强度柱状图,x轴:相关组织,y轴:pebp1蛋白的平均荧光强度;h:不同物种pebp1基因同源性比较结果图;i:不同动物相关组织pebp1蛋白平均荧光强度柱状图,x轴:肺动脉、心、肺、肝和肾,y轴:pebp1蛋白的平均荧光强度。
具体实施方式
现以实施例方式对本发明技术方案进行具体说明,但其不应该被认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1肉鸡pebp1基因多克隆抗体的制备方法
1、pet32a-pebp1重组表达载体的构建
1.1根据genbank中报道的鸡源pebp1基因核苷酸序列通过生物信息学分析筛选出优质的核苷酸编码序列再设计并合成特异性引物,与模板进行相应的结合从而扩增pebp1基因,pebp1基因pcr反应总体系为20μl,见表1。
表1pcr反应总体系
pcr反应程序:94℃预变性5min,94℃变性30s,56℃退火35s,72℃延伸40s,35个循环,最后再72℃延伸10min。
由图2a易知,基于genbank上公布的鸡pebp1基因序列,设计了一对具有较强特异性的引物来扩增pebp1基因的编码序列,在分子量约为561bp的位置可见清晰单一的特异性条带,引物见表2。
表2pcr反应引物
1.2采用ta克隆技术将上述扩增的目的片段插入到
由图2b易知,经由菌液pcr结果证实成功将纯化后的目的序列插入到
1.3对上述重组克隆载体和pet-32a(+)表达载体进行双酶切消化,将获得的目的片段与pet-32a(+)表达载体进行连接,构建出pet32a-pebp1重组表达载体。
由图2c-d易知,经由菌液pcr、重组质粒的双酶切鉴定分析证实在原有的扩增条件下,可以利用已知引物扩增出重组质粒中的目的片段,且双酶切重组质粒后,在相应大小的位置出现明显的目的条带,并结合图3的重组表达载体图谱,由此表明成功构建出了pet32a-pebp1表达载体。
2、抗pebp1蛋白的获取
2.1将上述成功构建的pet32a-pebp1表达载体转入大肠杆菌dh5α感受态细胞,并用终浓度为1mm的iptg,于37℃,220rpm/min的摇床上摇4h,诱导培养大肠杆菌表达重组蛋白。将获得的重组蛋白进行15%的sds-page电泳,鉴定是否为所需目的蛋白。
由图4a可知,在该条件下重组pebp1蛋白大量表达,且用白色箭头表示。并且主要是在大肠杆菌培养液的上清液中出现大量的pebp1活性蛋白,见图4b所示。
2.2将表达的pebp1重组蛋白进行镍亲和柱纯化,分别用500mm、300mm、100mm咪唑浓度的洗脱缓冲液进行洗脱条件优化,经15%的sds-page电泳确定最佳洗脱浓度为500mm咪唑,保存纯化后的重组蛋白备用于后期兔子免疫。
由图4c-d所知,其不同的咪唑洗脱浓度其洗脱效果区别较小,所以我们选用最大咪唑浓度的洗脱缓冲液(500mm)来洗脱蛋白,pebp1重组蛋白过镍亲和柱纯化后得到分子量为28kda的蛋白,这与预期大小相符合。
2.3将纯化的pebp1重组蛋白与弗氏完全佐剂等比例(1:1)混合,对新西兰大白兔进行皮下多点注射,每隔10天加强免疫一次(加强免疫要求pebp1蛋白与弗氏不完全佐剂混合),免疫30天后取耳动脉血,离心获得免疫血清。
3、pebp1基因多克隆抗体的质量验证方法
3.1酶联免疫吸附试验
将纯化的pebp1重组蛋白作为抗原稀释至2.5μg/ml,涂在96孔板上(150μl/孔)在37℃中孵化6h。用pbs-t洗涤3次,在每孔中加入200μl的5%的脱脂奶粉封闭液,37℃孵化2h,清洗后分别加入倍比稀释(1:100-1:204800)的抗pebp1血清和具有相同稀释梯度的免疫前血清(100μl/孔),37℃孵育1h清洗过后,加入按照1:3000稀释的辣根过氧化物酶标记的山羊抗兔igg(120μl/孔)孵化1h,最后用pbs-t彻底清洗后加入可溶型单组分tmb底物溶液避光反应20min,用浓硫酸终止反应,在酶标仪中取450nm的吸光度值进行测量,进而计算pebp1多克隆抗体的实际效价。
由图5易知,前期实验表明,选用了2.5μg/ml的抗原包被浓度可以获得最佳的抗体效价,根据od阳性/od阴性≥2.1的计算公式可知,从不同的3只新西兰大白兔中提取的抗pebp1的血清效价都高达1:204,800。
3.2westernblot检测
提取正常组和腹水组肉鸡五种相关组织(肺动脉、肺、心、肝和肾)总蛋白后,经由bca法测定蛋白浓度后,将30μg的蛋白进行15%的sds聚丙烯酰胺凝胶电泳,并以稳定表达的基因β-actin为内参照,通过湿转将电泳条带转移到聚偏二氟乙烯膜(pvdf)上,在5%脱脂奶粉中室温封闭2h,然后用抗pebp1血清(1:3000稀释)于摇床上4℃孵育过夜,用tbs-t洗涤3次(每次洗涤10min),将膜与辣根过氧化物酶标记的山羊抗兔igg(1:1000稀释)在室温下孵育1h,最后清洗3次,用高敏型ecl化学发光检测试剂盒进行蛋白条带显色,进而检测组织中该基因的蛋白水平。
由图6a-b易知,抗pebp1阳性血清作为一抗可以与肉鸡五种组织(肺动脉、肝、肾、心和肺)中提取的总蛋白进行特异性结合。并运用统计学的方法分析可知在这五种组织中腹水组pebp1蛋白表达水平都呈现明显下降趋势,且腹水鸡肺动脉、心和肺中pebp1蛋白的表达量以极显著的差异低于对照组(p<0.01)。
同时,利用抗pebp1阳性血清和免疫前血清作为一抗对原核表达的pebp1蛋白进行特异性检测。如图6c所示,结果表明免疫前血清无法与原核表达的pebp1蛋白结合,而抗pebp1阳性血清孵育的pvdf膜则出现明显的蛋白表达,说明该多克隆抗体对pebp1蛋白具有明显的反应原性。
3.3间接免疫荧光检测
将肉鸡、肉鸭、小鼠、兔子和山羊的五种相关组织(肺动脉、心、肺、肝和肾)进行样品采集,并将其储存在4%多聚甲醛溶液中,方便后期进行相应的切片制备。抗原修复后,将5μm左右厚的脱蜡载玻片在山羊血清中封闭30min。将载玻片分别与抗pebp1蛋白抗体(1:200稀释)和免疫前血清(1:200稀释)在4℃孵育过夜,用pbs-t洗涤3次(每次5min),将载玻片与1:300稀释的cy3conjugatedgoatanti-rabbitigg(h+l)孵育液(boster,wuhan,china)室温避光孵育50min。用pbs-t清洗3次(每次5min),滴加4',6-diamidino-2-phenylindole(dapi;1:400稀释)后避光孵育10min,最后清洗3次后,用抗荧光淬灭封片剂封片,置于尼康倒置荧光显微镜下进行镜检定位。
如图7a-f所示,将pbs缓冲液、免疫前血清和抗pebp1血清作为一抗与肉鸡、肉鸭、小鼠、兔子和山羊的相关组织(肺动脉、心、肺、肝和肾)进行孵育,可知与两种对照组相比,肉鸡和肉鸭的实验组表现出明亮的荧光信号,具有强阳性,而其他动物的实验组则荧光信号较弱;说明该多克隆抗体可以特异性结合动物组织中的pebp1蛋白,且pebp1蛋白的表达主要集中于动物各种器官的细胞质部分。
如图7g所示,对肉鸡正常组和腹水组的荧光强度进行统计分析,表明在肉鸡的相关组织中pebp1蛋白在正常组中的表达量以极显著的差异高于腹水组(p<0.01)。
如图7h、i所示,肉鸡pebp1基因与原鸡、肉鸭pebp1基因的同源性比对都达到85%以上,与小鼠、兔子和山羊的同源性差异较大(处于65%左右),且肉鸡各种组织中pebp1基因的表达量明显高于小鼠、兔子和山羊(p<0.01),证明所制备的抗pebp1蛋白多克隆抗体具有物种特异性,可用于研究肉鸡肺、心、肺动脉、肝和肾pebp1蛋白表达的定位。
以上实验数据应用spss25.0软件进行处理,计量方式以均数±标准差(m±sd)表示,方差分析进行组间比较,p<0.05表示差异显著性,p<0.01表示差异极显著。
实施例2鸡pebp1蛋白的间接免疫荧光检测试剂盒的建立
制备抗原:将肉鸡、肉鸭、小鼠、兔子和山羊的五种相关组织(肺动脉、心、肺、肝和肾)进行样品采集,并将其储存在4%多聚甲醛溶液中,方便后期进行相应的切片制备。
封闭:抗原修复后,将5μm左右厚的脱蜡载玻片在山羊血清中封闭30min。
待检样品与检测抗体:将载玻片分别与实施例1制备的抗pebp1蛋白抗体(1:200稀释)和免疫前血清(1:200稀释)在4℃孵育过夜;
洗涤:用pbs-t洗涤3次(每次5min);
一抗、二抗:将载玻片与1:300稀释的cy3conjugatedgoatanti-rabbitigg(h+l)孵育液(boster,wuhan,china)室温避光孵育50min。用pbs-t清洗3次(每次5min),滴加4',6-diamidino-2-phenylindole(dapi;1:400稀释)后避光孵育10min;
清洗、封片:最后清洗3次后,用抗荧光淬灭封片剂封片;
观察:置于尼康倒置荧光显微镜下进行镜检定位。
结果同实施例13.3间接免疫荧光检测结果,再次证明该多克隆抗体可以特异性结合动物组织中的pebp1蛋白。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110>江西农业大学
<120>一种鸡pebp1基因多克隆抗体、制备方法及应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>561
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgccggtggagctggggctgtgggacgggccgctgagcctgagcgaggtggagcagaaa60
cccgcgcacccgctgcgcgtcaagtatggctccgtggagatagacgagctgggcaaggtg120
ctcacgcctacgcaggtgcagcaccgacccaccagcatcgagtgggacggctgcgacccc180
cagaagctctacacgctggtgctcaccgaccccgacgcgcccagtaggaaggatccgaag240
ttcagagaatggcatcacttcctggtgaccaacatgaaaggtaacgatgtggggagcggg300
accgtgctgtcagactacgtgggctcggggccccctaaaggaacagggctgcaccgctac360
gtgtggctggtgtacgagcagccaaagcagctgacctgcaatgagcccatcctgtccaat420
cgctctggtgacaaacgagggaagttcaaggtagcagctttccgcagcaagtatgggctg480
ggggtgccggtggctggcacttgctaccaggcagagtgggatgactatgtgccgaaactc540
tatgagcagctgtctgggaag561
<210>2
<211>187
<212>prt
<213>人工序列(artificialsequence)
<400>2
metprovalgluleuglyleutrpaspglyproleuserleuserglu
151015
valgluglnlysproalahisproleuargvallystyrglyserval
202530
gluileaspgluleuglylysvalleuthrprothrglnvalglnhis
354045
argprothrserileglutrpaspglycysaspproglnlysleutyr
505560
thrleuvalleuthraspproaspalaproserarglysaspprolys
65707580
pheargglutrphishispheleuvalthrasnmetlysglyasnasp
859095
valglyserglythrvalleuserasptyrvalglyserglypropro
100105110
lysglythrglyleuhisargtyrvaltrpleuvaltyrgluglnpro
115120125
lysglnleuthrcysasngluproileleuserasnargserglyasp
130135140
lysargglylysphelysvalalaalapheargserlystyrglyleu
145150155160
glyvalprovalalaglythrcystyrglnalaglutrpaspasptyr
165170175
valprolysleutyrgluglnleuserglylys
180185
- 还没有人留言评论。精彩留言会获得点赞!