IDH1R132H基因突变实时荧光定量PCR检测试剂及方法与流程
本发明涉及分子生物学
技术领域:
,具体涉及idh1r132h基因突变实时荧光定量pcr检测试剂及方法。
背景技术:
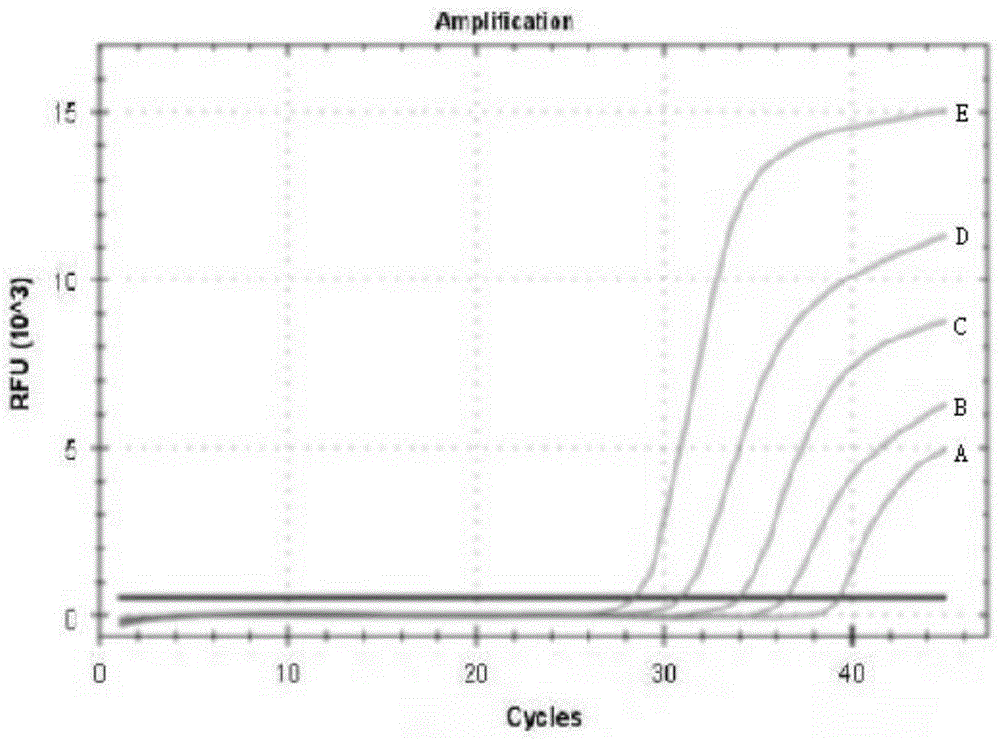
:idh(isocitratedehydrogenase,异柠檬酸脱氢酶)是三羧酸循环中关键限速酶,其作用是促进异柠檬酸转化为α-酮戊二酸(α-kg)及co2,为细胞新陈代谢提供能量及生物合成的前体物质。idh基因突变多见于中枢神经系统肿瘤且多存在于低级别胶质瘤,亦见于继发性胶母细胞瘤,其中80%以上的idh基因突变发生在idh1基因132位密码子中精氨酸和组氨酸的转换(cgt>cat),idh1r132h基因突变不仅减少了idh1蛋白酶的分泌,同时降低了该酶的活性,使得胞内细胞低氧诱导因子-1α含量增加,α-kg合成减少,最终促进肿瘤的生长及增殖。目前,idh1r132h突变常用的检测方法包括免疫组织化学(ihc)法及sanger测序法。其中,ihc法是根据抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂来定性或定量地确定组织细胞内抗原的方法。但ihc法主观性强,不同医生的判读结果可能不一致,可能出现一些弱阳性或非特异性着色而导致无法判读。sanger测序法的原理是在作为扩增原料的四种脱氧核苷酸(dntp)中混入限量的缺少延伸所需3’-oh基团的双脱氧核苷酸(ddntp)作为链终止剂,使延长的寡聚核苷酸选择性地在g、a、t或c处结束,然后对所得的一系列核苷酸进行电泳检测,从而获得可见的dna碱基序列。但sanger测序法对组织要求高,操作复杂,敏感性仅为10~20%,容易检测失败或造成污染。聚合酶链式反应(pcr)是一种体外扩增dna或rna的分子生物学技术,具有扩增速度快等优点。pcr技术的基本原理类似于dna的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。pcr步骤通常包括:双链模板dna解离呈单链,单链与引物配对结合,在dna聚合酶的作用下,以dntp为反应原料,按碱基互补配对和半保留复制原理,合成新的与模板dna链互补的半保留复制链,如此重复循环能够将基因扩增放大几百万倍目前也存在利用pcr进行基因突变检测的方法,但大多检测敏感性不高,现有技术中一些文献公开了采用巢式pcr来提高检测敏感性,但巢式pcr操作复杂,且容易放大污染,对检测样本要求高。技术实现要素:针对现有技术的不足,本发明的目的是提供idh1r132h基因突变实时荧光定量pcr检测方法,能够实现idh1r132h基因突变的实时荧光定量pcr检测,检测速度快,判断方便,检测敏感性好,对检测样本要求低,成本低。为实现本发明的目的,本发明提供了idh1r132h基因突变实时荧光定量pcr检测试剂,其包括引物和探针;引物包括序列如seqidno.1所示的正向引物和序列如seqidno.2所示的反向引物;探针包括序列如seqidno.3所示的野生型探针和序列如seqidno.4所示的突变型探针;野生型探针的5’端标记有vic荧光基团,野生型探针的3’端标记有mgb淬灭基团;突变型探针的5’端标记有fam荧光基团,野生型探针的3’端标记有mgb淬灭基团。其中,seqidno.1为5’-cggcttgtgagtggatgg-3’;seqidno.2为5’-acgacctgatccccataagc-3’;seqidno.3为5’-catcataggtcgtcatg-3’;seqidno.4为5’-catcataggtcatcatg-3’。进一步的技术方案是,idh1r132h基因突变实时荧光定量pcr检测试剂还包括dntp、dna聚合酶、pcr反应缓冲液和ddh2o,pcr反应缓冲液包含mg2+离子。为实现本发明的目的,本发明还提供了idh1r132h基因突变实时荧光定量pcr检测方法,其包括以下步骤:步骤1:在上述任一方案所述的idh1r132h基因突变实时荧光定量pcr检测试剂中加入待检测的dna,进行扩增反应和实时荧光检测;步骤2:根据扩增曲线判读突变情况。进一步的技术方案是,在步骤2中,根据扩增曲线获得ct值,根据ct值判断突变情况。与现有技术相比,本发明能够取得以下有益效果:本发明的idh1r132h基因突变实时荧光定量pcr检测试剂及由其实现的idh1r132h基因突变实时荧光定量pcr检测方法,能够提高检测速度,判断方便,改善检测敏感性,对检测样本要求低,同时检测可以在全封闭状态下进行,无污染风险。具体地,本发明根据idh1r132h的野生基因及突变基因设计了1对引物及2条探针,用于对提取的组织dna进行扩增,根据扩增曲线获得ct值即可判断突变情况,操作简单,成本低。本发明的idh1r132h基因突变实时荧光定量pcr检测试剂和方法适用于疾病诊断目的和非疾病诊断目的idh1r132h基因突变检测。附图说明图1是本发明实施例敏感性测试的扩增曲线图。图中a为突变型质粒含量分别为1%的待测样品的扩增曲线,b为突变型质粒含量分别为2%的待测样品的扩增曲线,c为突变型质粒含量分别为5%的待测样品的扩增曲线,d为突变型质粒含量分别为10%的待测样品的扩增曲线,e为突变型质粒含量分别为15%的待测样品的扩增曲线。以下结合附图以及具体实施方式对本发明作进一步详细的说明。具体实施方式本实施例为了实现idh1r132h基因突变的实时荧光定量pcr检测方法,根据idh1基因的野生型及突变型设计了idh1r132h基因突变的实时荧光定量pcr检测试剂。idh1基因的野生型质粒序列如seqidno.5所示,idh1基因的r132h突变型质粒序列如seqidno.6所示。seqidno.5为agctatgatttaggcatagagaatcgtgatgccaccaacgaccaagtcaccaaggatgctgcagaagctataaagaagcataatgttggcgtcaaatgtgccactatcactcctgatgagaagagggttgaggagttcaagttgaaacaaatgtggaaatcaccaaatggcaccatacgaaatattctgggtggcacggtcttcagagaagccattatctgcaaaaatatcccccggcttgtgagtggatgggtaaaacctatcatcataggtcgtcatgcttatggggatcaggtcgt;seqidno.6为agctatgatttaggcatagagaatcgtgatgccaccaacgaccaagtcaccaaggatgctgcagaagctataaagaagcataatgttggcgtcaaatgtgccactatcactcctgatgagaagagggttgaggagttcaagttgaaacaaatgtggaaatcaccaaatggcaccatacgaaatattctgggtggcacggtcttcagagaagccattatctgcaaaaatatcccccggcttgtgagtggatgggtaaaacctatcatcataggtcatcatgcttatggggatcaggtcgt。idh1基因的r132h突变位点如上述seqidno.5和seqidno.6中带下划线的碱基位置,碱基由g突变为a。本实施例根据idh1基因以及r132h突变位点,设计了一对引物和两条探针,试剂中还可以包括dntp、dna聚合酶(例如taqdna聚合酶)、pcr反应缓冲液(含mg2+)和ddh2o,构成idh1r132h基因突变实时荧光定量pcr检测的试剂体系。检测时将提取的组织dna与试剂混合后进行pcr反应,通过检测系统对pcr反应容器内样品的荧光信号进行实时检测,得到扩增曲线,即可进行判断。具体地,本实施例的idh1r132h基因突变实时荧光定量pcr检测方法所设计的引物和探针如下表1所示。表1idh1r132h基因突变实时荧光定量pcr检测试剂的引物和探针引物/探针对应序列编号序列(按5’端到3’端)正向引物seqidno.15’-cggcttgtgagtggatgg-3’反向引物seqidno.25’-acgacctgatccccataagc-3’野生型探针seqidno.3vic-catcataggtcgtcatg-mgb突变型探针seqidno.4fam-catcataggtcatcatg-mgb其中,正向引物和反向引物与idh1基因配合紧密,引物长度适中,正向引物和反向引物不会与idh1基因的非目标位点结合而导致错配,且引物分子稳定,易于合成。正向引物自身、反向引物自身、正向引物与反向引物之间以及各引物与各探针之间不会形成稳固的发夹结构或二聚体而影响引物与待测基因的结合,从而使得扩增反应具有较高的扩增效率。2条探针与野生型和突变型的突变位点处对应的序列段完全互补。探针中突变位点对应的碱基位于探针的中间略靠近3’端的位置,使得从引物延伸的复制链即使未完全延伸到snp位点仍可激发荧光信号,提高了检测灵敏度。探针的两端分别标记一个荧光基团和一个淬灭基团,当pcr扩增时,dna聚合酶将探针酶切降解,使荧光基团与淬灭基团分离,荧光基团能够发射出荧光信号,荧光信号的强度与扩增反应产物的量同步,从而实现定性定量分析。本实施例通过选择合适的探针的长度,探针的特异性强、准确性高,且易于合成。mgb淬灭基团本身不带颜色,不影响荧光信号检测。且mgb淬灭基团能够结合到dna的小沟部位,与普通的淬灭基团相比探针与靶序列结合更加稳定,tm值也更高,使得探针的tm值高于引物的tm值,探针在退火时能够更好地优先于引物与靶序列结合,提高了荧光定量分析的精确度。vic和fam分别标记野生型和突变型的5’端,fam和vic波长稳定,不会相互覆盖,有利于检测。通过上述引物与探针的配合,获得了特异性好、灵敏性高、扩增效率高的idh1r132h基因突变实时荧光定量pcr检测试剂,其用于idh1r132h基因突变实时荧光定量pcr检测时,与待检测的dna混合即可进行实时荧光定量pcr检测,具有操作简单等优点。在idh1r132h基因突变实时荧光定量pcr检测试剂中,正向引物和反向引物的浓度分别在0.05~1μmol/l的范围内,野生型探针和突变型探针的浓度分别在0.1~0.6μmol/l的范围内,dntp的浓度在20~200μmol/l的范围内,mg离子的浓度在0.5~2mmol/l的范围内,dna聚合酶的浓度在2.5~5u,ddh2o的用量根据实际所需的试剂体积补充添加。该试剂与待检测dna的用量关系为20~25μl试剂:5~20ngdna。idh1r132h基因突变实时荧光定量pcr检测方法需要约2个小时,具体包括以下步骤:步骤1:在反应容器中加入idh1r132h基因突变实时荧光定量pcr检测试剂和提取的组织dna,然后进行扩增反应和实时荧光检测,将荧光信号值的实时变化显示为扩增曲线。其中dna与各物料的添加顺序可以根据需要进行调整,例如加入dna后,最后再滴加ddh2o调整体系的液体体积实时荧光检测可以对fam和vic两种荧光信号进行检测,fam荧光信号的扩增曲线可以用于判断突变情况,vic荧光信号的扩增曲线可以作为参考和对比。作为一个具体的实施例,包含待检测的dna的反应物的溶液总体积为25μl。其中dna的加入量为2μl,浓度是10ng/μl。在包含dna的总反应物体系中,正向引物和反向引物的浓度分别为0.3μmol/l,野生型探针和突变型探针的浓度分别为0.2μmol/l。具体地,扩增反应的步骤包括:步骤1.1:dna的预变性:加热至95℃维持5min,使dna完全解链。步骤1.2:重复循环以下步骤1.2.1至1.2.3进行扩增,进行约40个循环例如40~45个循环:步骤1.2.1:dna的变性:加热至94℃维持30s,使待检测的dna双链或经pcr扩增形成的双链dna解离,形成单链。步骤1.2.2:dna与引物的退火:温度降至58℃,维持30s,使得引物与dna单链的互补序列配对结合。步骤1.2.3:引物的延伸:温度升至72℃,在dna聚合酶的作用下,dntp为原料,dna的靶序列为模板,合成dna半保留复制链,延伸时间约30s。步骤2:根据扩增曲线判断突变情况。例如对于不存在突变的dna样品,扩增曲线没有ct值或ct值过高。例如对于存在突变的dna样品,可以根据扩增曲线获得ct值,根据所述ct值判断突变情况,ct值高则突变数量少,ct值低则突变数量大,可以通过比较所测样品的ct值与预设ct值,判断是否存在突变以及突变程度。ct值是指每个反应管内的荧光信号到达设置阈值时所经历的循环数。上述idh1r132h基因突变实时荧光定量pcr检测方法的检测通量可以根据实际需要进行调整,例如可以在同一时间段内检测一个或多个样品,检测通量可以从单例到90例。对以上检测方法进行验证:(1)敏感性验证:将含有野生idh1基因的野生型质粒与含有idh1r132h突变基因的突变型质粒混合,形成突变型质粒在质粒混合物中质量含量分别为1%、2%、5%、10%及15%的待测样品,按照上述方法进行实时荧光定量pcr检测。检测结果的fam荧光信号的扩增曲线如图1所示,突变型质粒含量为5%的待测样品可见明确s型扩增曲线,ct值为34。突变型质粒含量为10%和15%的待测样品也有明显的s型扩增曲线,ct值比突变型质粒含量为5%的待测样品更低,且突变型质粒含量越高,ct值越低。突突变型质粒含量为1%和2%的待测样品也有s型扩增曲线,ct值比突变型质粒含量为5%的待测样品更高。在对实际提取的组织dna的检测过程中,ct值高于35则难以判断是由样品本身突变还是污染导致的ct值,即ct值高于35后将难以判断检测的基因是否突变。采用本实施例的idh1r132h基因突变实时荧光定量pcr检测的试剂和方法检测提取检测时,将ct值高于35的样品判断为阴性(即判断为idh1基因没有突变),将ct值低于35的样品判断为阳性(即判断为idh1r132h基因突变)。可见,本实施例的检测敏感性可达5%。(2)准确性验证:选取采用ihc法检测的脑胶质瘤组织316例,提取组织dna,按上述方法进行实时荧光定量pcr检测,并通过sanger测序法进行验证,分析实时荧光定量pcr检测法与ihc法、过sanger测序法的检查结果。先比较ihc法和实时荧光定量pcr检测法。在检测的316例标本中,18例ihc结果可疑,其余的标本中14例实时荧光定量pcr结果失败,共有284例标本同时完成ihc及实时荧光定量pcr检测。其中,94.72%(269/284)检测结果一致,仅有5.28%(15/284)两种方法检测结果存在差异,结果参见表2。表2ihc法和实时荧光定量pcr法检测结果分析在ihc法和实时荧光定量pcr法检测结果不一致的15例标本中,6例ihc检测为阳性而实时荧光定量pcr检测为阴性,9例ihc检测为阴性而实时荧光定量pcr检测为阳性。对该15例样本进行sanger测序验证,结果发现,6例ihc检测为阳性、实时荧光定量pcr检测为阴性的标本中,sanger测序结果为5例阳性,1例阴性;9例原本是qpcr测序阳性、ihc阴性的标本,sanger测序结果全部为阳性,结果参见表3。表3sanger测序法验证ihc和实时荧光定量pcr不一致标本的结果由上可见,本实施例的实时荧光定量pcr检测方法与ihc法检测结果一致性高,且对于ihc法和实时荧光定量pcr法检测结果不一致的标本,由更准确的sanger测序法验证结果可知,实时荧光定量pcr检测法的检出率更高。(3)特异性验证:挑选30例正常人外周血白细胞,提取基因组dna,按上述方法进行实时荧光定量pcr检测。检测结果是,在正常人外周血白细胞dna中未见任何非特异性扩增。这表明了本实施例的idh1r132h基因突变实时荧光定量pcr检测试剂和方法具有良好的特异性。(4)重复性验证:挑选接近于阳性阈值的ct值=30的dna标本3例,每一例重复10次按上述方法进行实时荧光定量pcr检测,观察每次的ct值。检测结果是,ct值在30处的dna标本ct值检测结果重叠性良好。(5)抗干扰性验证:将pcr反应缓冲液、引物及探针等试剂原料分别放置于4℃及-20℃冰箱15天,然后按上述方法进行实时荧光定量pcr检测,观察其pcr扩增效能。检测结果是,放置于4℃及-20℃环境的引物、探针及pcr反应缓冲液等均可正常使用。可见,本实施例的idh1r132h基因突变实时荧光定量pcr检测试剂及方法有良好的抗干扰性,试剂能够存放,使用方便。最后需要强调的是,以上所述仅为本发明的优选实施例,并不用于限制本发明。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。sequencelisting<110>中山市博爱医院<120>idh1r132h基因突变实时荧光定量pcr检测试剂及方法<130><160>6<170>patentinversion3.3<210>1<211>18<212>dna<213>人工序列<400>1cggcttgtgagtggatgg18<210>2<211>20<212>dna<213>人工序列<400>2acgacctgatccccataagc20<210>3<211>17<212>dna<213>人工序列<400>3catcataggtcgtcatg17<210>4<211>17<212>dna<213>人工序列<400>4catcataggtcatcatg17<210>5<211>299<212>dna<213>人工序列<400>5agctatgatttaggcatagagaatcgtgatgccaccaacgaccaagtcaccaaggatgct60gcagaagctataaagaagcataatgttggcgtcaaatgtgccactatcactcctgatgag120aagagggttgaggagttcaagttgaaacaaatgtggaaatcaccaaatggcaccatacga180aatattctgggtggcacggtcttcagagaagccattatctgcaaaaatatcccccggctt240gtgagtggatgggtaaaacctatcatcataggtcgtcatgcttatggggatcaggtcgt299<210>6<211>299<212>dna<213>人工序列<400>6agctatgatttaggcatagagaatcgtgatgccaccaacgaccaagtcaccaaggatgct60gcagaagctataaagaagcataatgttggcgtcaaatgtgccactatcactcctgatgag120aagagggttgaggagttcaagttgaaacaaatgtggaaatcaccaaatggcaccatacga180aatattctgggtggcacggtcttcagagaagccattatctgcaaaaatatcccccggctt240gtgagtggatgggtaaaacctatcatcataggtcatcatgcttatggggatcaggtcgt299当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1