一组与小麦白粉病抗性显著关联的SNP位点及其在遗传育种中的应用
一组与小麦白粉病抗性显著关联的snp位点及其在遗传育种中的应用
技术领域
1.本发明涉及植物分子标记技术领域,具体涉及一组与小麦抗白粉病基因位点显著关联的snp及其在白粉病抗性的遗传及分子育种中的应用。
背景技术:
2.小麦白粉病是由禾本科布氏白粉菌(blumeria graminis f. sp. tritici)引起的一种气传真菌性病害,是一种世界性病害,在各主要产麦国均有分布。近年来,随着耕作制度的调整和气候的不断变化,该病在我国东北、华北、黄淮和西南等几大主要麦区,均有日趋严重之势。该病主要发生在苗期和成株期,以侵害叶片和叶鞘为主,发病严重时颖壳和麦芒也可受害。小麦白粉病一般在流行年份,可造成产量损失5%
‑
45%,发病严重的田块可高达50%,甚至绝产。因此,挖掘小麦抗白粉病基因并将其应用于小麦育种对小麦白粉病的防治及改善小麦品质、保证小麦高产稳产具有重要意义。
3.化学防治和选育抗病品种是抵御白粉病危害的有效手段。但长期使用药剂防治会导致病原菌产生抗药性、环境受到污染等一系列问题;鉴定利用抗白粉病基因,选育抗病品种,不仅能解决环境污染问题,还能改善小麦的遗传组成,提高小麦产量,是防治小麦白粉病最经济、安全、有效的措施。
4.对小麦白粉病抗性进行遗传研究,对了解白粉病抗性的遗传结构、抗病基因作图与克隆,以及在育种中进行有目的的进行抗病基因的选择,对于提高育成品种的白粉病抗性具有非常重要的作用。分子标记技术是进行小麦有关性状的遗传、基因作图、标记辅助育种、基因组选择育种等育种研究中最常用的技术。常用的dna分子标记有rflp(限制性长度片段多态性),ssr(简单重复序列)和snp(单核苷酸多态性)等。传统的rflp和ssr等分子标记存在通量低、数量少、操作过程繁琐等局限,不能满足遗传与育种研究的需要。而snp标记在基因组中分布及其丰富,具有二态性,且易于高通量自动化检测,是在遗传研究与育种中最有应用前途的分子标记技术。
5.目前,常用的snp的高通量检测技术主要包括测序和dna芯片技术。利用测序技术对样品材料进行dna重测序可以获得高密度的snp标记,但重测序的成本很高。而简化基因组测序genotyping
‑
by
‑
sequencing (gbs)则先对基因组dna进行酶切等方法处理以减小基因组的复杂性,构建复杂性低的基因组dna文库,再利用二代测序技术进行深度测序,一定程度上降低了测序的成本。小麦中利用两种限制性内切酶处理基因组dna构建dna文库并通过测序鉴定snp的技术已经成熟。但是对于相对于小麦庞大的基因组(16g)要进行深度测序成本依然很高,而且gbs数据的处理、序列比对、基因分型等过程对数据分析的要求较高,需要有专业生物信息学背景的人员才能完成,一般育种家难以掌握和利用。
技术实现要素:
6.控制小麦重要数量性状位点(qtl)的作图、基因克隆以及分子标记辅助选择育种
过程中需要开发分子标记。传统的ssr标记通量低、数量少,而基于snp位点转化而成kasp (kompetitive allele specific pcr)标记,即竞争性等位基因特异性 pcr 技术,能够在广泛的基因组dna样品中,对snps和特定位点上的indels进行精准的双等位基因判断。以其高度稳定性、准确性和低成本、高通量的特点,可广泛应用于基因定位、基因的精细作图、克隆,大规模育种材料的高通量筛选,在遗传研究和分子标记辅助育种、基因组选择育种中具有重要利用价值。
7.针对现有技术存在的不足,本发明利用gbs技术,对768份来自中国小麦主产区的小麦品种(系)进行简化基因组测序,获得了遍布全基因组高密度的snp位点,通过田间抗病性鉴定及全基因组关联分析鉴定出了与白粉病抗性显著关联的snp位点,可广泛应用于kasp标记的开发、抗白粉病基因定位、作图、标记辅助选择及全基因组选择,为小麦抗白粉病基因的遗传研究及分子育种奠定了重要基础。
8.本发明提供了一套与小麦白粉病抗性显著关联的snp,可用于开发kasp标记和snp芯片,广泛应用于小麦抗白粉病基因的作图、精细作图与克隆、育种中的单个、多个抗病qtl的标记辅助选择及全基因组选择。
9.本发明所采用的技术方案是:本发明提供了一组(58个)与小麦白粉病抗病性显著关联的单核苷酸多态性位点(snp),包括snp侧翼序列、snp位点信息及碱基突变信息,这些snp位于普通小麦17条染色体上。
10.本发明提供的一组与小麦白粉病抗性显著关联的snp位点,包括58个snp位点,编号分别为snp01~snp58,它们的信息如下:
ꢀ
ꢀ
ꢀ
表中物理位置以中国春基因组iwgsc reference genome v1.1 (iwgsc, 2018)为参考序列;表中所列序列见序列表seq id no.1~seq id no.116。
11.本发明提供的一组与小麦白粉病抗性显著关联的snp位点可以在小麦白粉病抗性鉴定中应用。
12.本发明提供的一组与小麦白粉病抗性显著关联的snp位点可以在制备小麦白粉病抗性鉴定试剂盒中应用。
13.本发明提供的一组与小麦白粉病抗性显著关联的snp位点可以在制备单个可检测的snp标记或基因芯片中应用。
14.本发明提供的一组与小麦白粉病抗性显著关联的snp位点可以在制备与抗白粉病基因位点qpm6a.3共分离的kasp标记k6a86486中应用。
15.本发明提供的一组与小麦白粉病抗性显著关联的snp位点可以在小麦白粉病抗性鉴定检测方法中应用。
16.检测方法的应用中,我们可以根据snp位点设计kasp引物,根据包含snp位点上下游各50bp的dna短序列设计kasp引物。具体利用网站polymarker (http://www.polymarker.info/)进行引物设计,采用网站默认的参数设置。引物前加接头,fam序列为“gaaggtgaccaagttcatgct”,hex序列为“gaaggtcggagtcaacggatt”。
17.引物设计合成后,可以利用分离群体或者自然群体进行有效性检测,验证通过gwas鉴定到的qtl是否存在,其使用方法分别如下:(1)以小麦dna为pcr扩增模板,以设计合成的kasp引物,进行pcr扩增,反应体系为6μl。上述反应体系具体包括:20
‑
50ng/μl的dna 3μl,2
×
kaspmaster mix 3μl,kaspassaymix(上下游引物混合液)0.0825μl。置于384孔pcr仪扩增。
18.(2)pcr扩增程序为:94℃预变性15min;94℃变性20s,65
‑
57℃复性60s(每循环降低0.8℃),10个循环;94℃变性20s,57℃复性60s,30个循环;10℃保存;(3)pcr结束后,置于omega snp分型仪检测pcr分型结果;(4)分析鉴定,根据分型结果分析基因型。
19.本发明的有益效果是:(1)本发明鉴定了一组(58个)与小麦白粉病抗性显著关联的snp。基本涵盖了目前在中国小麦种质中含有的大部分抗白粉病基因位点。
20.(2)这些snp可进一步转化为kasp标记,用于抗白粉病病基因的精细作图、克隆及大规模应用于育种材料的分子标记辅助选择、基因聚合,提高分子育种的效率。
21.(3)这些snp也可制作成基因芯片,应用于对育种材料进行白粉病抗病性的全基因组选择,进一步提高分子育种的效率准确性。
22.(4) 开发了与抗白粉病基因位点qpm6a.3共分离的kasp标记k6a86486,不但证明我们鉴定到的snp是非常有效的,也为qpm6a.3的标记辅助选择提供了良好的高通量鉴定标记。
附图说明
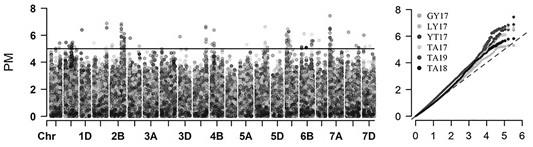
23.图1是白粉病抗性全基因组关联分析的曼哈顿图(左)和qq图(右)。
具体实施方式
24.实施例1 通过简化基因组测序鉴定snp1.1 测序材料选取了768份小麦品种(系)进行简化基因组测序,鉴定snp。这些小麦品种(系)主要是来自我国小麦主产区包括黄淮麦区、北方冬麦区、长江中下游麦区和西南麦区。
25.研究方法1.2.1 小麦基因组dna提取利用幼苗叶片提供基因组dna。dna提取采用改进的ctab法。具体操作:取小麦幼嫩叶片于2ml离心管中,利用液氮冷冻并于组织粉碎器上磨成粉末;(b)加入800μl ctab于2ml管中后,置于65℃水浴90min,水浴期间轻晃5
‑
8次,使dna充分裂解;(c)加入800μl氯仿异戊醇(体积比24:1)轻晃10min;(d)12000rpm条件下离心10min后取600μl上清液置于新的2ml管中(注意对应序号);(e)加入60μl 3m醋酸钠(ph=5.2)和600μl异丙醇(提前
‑
20℃冷冻),轻晃混匀,即可看到白色dna絮状物产生,放于
‑
20℃冰箱1h以增加dna产量。(f)12000rpm离心10min后倒掉上清液,将沉淀用70%乙醇(提前放入
‑
20℃冰箱冷冻)清洗2
‑
3次,通风橱中静置风干;(g)加入200μl ddh2o溶解dna。
26.样品质量检测用质量分数为1%的琼脂糖凝胶电泳检测,用凝胶成像系统查看电泳结果,保证基因组dna的完整性。基因组dna a260/280比值应在1.8
ꢀ–ꢀ
2.0之间,a260/230比值应在1.8
‑
2.2之间。将dna稀释到工作浓度20 ng/ul。
‑
20℃保存备用。
27.文库构建和gbs测序参照poland et al. (2012b)进行gbs dna文库的构建。基因组dna利用两个限制性内切酶psti和mspi(new england biolabs, inc., ipswich, ma, united states)进行消化。利用t4(new england biolabs, inc., ipswich, ma, united states)连接酶将条码序列连接到消化好的dna片段上。将每个平板的所有产物混合并使用qiaq快速pcr纯化试剂盒(qiagen, inc., valencia, ca, united states)进行纯化。利用与条码序列互补的引物进行pcr扩增。pcr产物再次使用qiaquick pcr纯化试剂盒进行纯化,并利用qubit
™
双链dna高灵敏度荧光定量试剂盒 (life technologies, inc., grand island, ny, united states)测定浓度。利用琼脂糖凝胶电泳(life technologies, inc., grand island, ny, united states)筛选200
‑
300大小的dna片段,qubit 2.0 荧光剂和qubit
™
双链dna高灵敏度荧光定量试剂盒估计每个dna文库的浓度。使用ion chef instrument (ion pi hi
‑
q chef kit)将经片段大小筛选过的dna文库利用加载到p1v3芯片上并利用ion proton sequencer (life technologies, inc., grand island, ny, united states, software version 5.10.1)进行序列测定。这个ion torrent系统可以产生各种读长的序列。
28.位点鉴定对测序产生的序列,在其3’端加上80个poly
‑
a碱基,然后利用tassel 5.0进行序列分析,这样trait analysis by association, evolution and linkage (tassel) pipeline 5.0(tassel 5.0)(bradbury et al., 2007)就可以处理短于64碱基的序列而不仅仅是丢弃这些短序列。以中国春基因组iwgsc reference genome v1.1 (iwgsc, 2018)
为参考序列,利用tassel 5.0 (bradbury et al., 2007)进行序列比对鉴定snp位点。所有的参数都采用tassel 5.0的默认设置。共获得432,588个snp位点,覆盖全基因组约14gb,标记之间的平均距离为34.0 kb。其中a基因组上150784个位点,平均间距32.9kb;b基因组182192个位点,平均间距28.9kb;d基因组99612个位点,平均间距40.3kb。各染色体上snp标记的数目10177到31149,标记间距变异范围是 26.1
ꢀ–ꢀ
50.1 kb。这些snp主要位于基因之间的区域,有364203个,占84.1,其次是cds区,39901个(9.2%)、内含子区22215个(5.1%)、5’utr区3543个(0.8%)和3’utr区3300个(0.8%)。
29.表1. gbs鉴定的snp位点在小麦基因组中的分布实施例2 抗白粉病基因位点的全基因组鉴定2.1材料768份来自我国小麦主产区包括黄淮麦区、北方冬麦区、长江中下游麦区和西南麦区的小麦品种(系),同实施例1。
30.2.2方法2.2.1 白粉病抗性的鉴定为鉴定材料对白粉病的抗性,将这768份小麦品种(系)于2017
‑
2018 (ta17),2018
‑
2019 (ta18),和2019
‑
2020 (ta19)年度种植于泰安山东农业大学实验站病害鉴定圃,进行白粉病抗性人工接种鉴定鉴定。同时,在2017
‑
2018年度在烟台(yt)、洛阳(ly)、贵阳(gy)三地也种植了这批材料,并利用大田自然发病条件对白粉病抗性进行了鉴定。在所有的试验条件下,利用辉县红和明显169作为感病对照材料。每个材料种植1行,行长3米,行
距25厘米。
31.白粉病抗性人工接种鉴定鉴定是在春季小麦起身后,接种我国北方流行的小麦白粉病菌生理小种“e09”。接种方式是通过将感病对照材料上的白粉病菌孢子直接抖落在植株上的方式接种白粉病菌。
32.在5月中下旬,当感病材料充分发病时对768材料进行抗病性的鉴定。利用0
ꢀ–ꢀ
4级法进行抗性鉴定,0 = 无明显症状或坏死斑点;1 =孢子堆很少且很小;2 = 孢子堆小或中等,较分散;3 = 孢子堆中等大小至很大,数量较多;4 = 普遍出现大孢子堆。
33.2.2.2全基因组关联分析对所有鉴定到的432588个snp位点,进一步筛选最小等位基因频率(maf)大于0.01,缺失率小于80%的snp位点,得到的327609个snp。对白粉病抗性进行全基因组关联分析。采用gapit v.3程序包进行,它使用emma,压缩的混合线性模型(compressed mixed linear model,cmlm)和population parameters previously determined (p3d)提高gwas运行的效率。利用emma算法分析kinship,使用前3个主成分控制群体结构。显著性阈值设定为1.0
×
10
‑5。
34.2.3结果2.3.1抗病基因的全基因组关联分析通过对多个环境下测定白粉病的抗性反应进行gwas,共鉴定到158个关联位点(marker trait association,mta),根据ld合并为53个抗白粉病qtl。其中有26个qtl被定位在1.0mb区间内,各含有不到10个注释基因。说明利用我们鉴定到的高密度snp标记进行gwas能够将抗白粉病qtl定位在较小的物理区间内,极大的方便了后续qtl的精细定位、基因克隆以及分子标记辅助育种。参见图1。
35.对通过gwas鉴定到的抗白粉病qtl区间,每一个区间选取各环境下最显著关联的一个snp,共得到抗白粉病snp位点58个,见表2。表中“qtl”一列,表明snp连锁的抗白粉病qtl名称;表中“snp所在染色体及物理位置”一列,表明snp染色体所在的染色体和物理位置,物理位置参照以中国春基因组iwgsc reference genome v1.1 (iwgsc, 2018)为参考序列;表中“序列与snp变异位点”一列,“[ ]”中碱基表明变异的位点,有的位点仅有一个碱基,表示变异后缺失此碱基。
[0036]
表2 与小麦白粉病抗性显著关联的snp位点信息
ꢀ
实施例3 小麦抗白粉病基因qpm6a.3的验证与作图3.1材料研究材料包括利用抗白粉病的亲本2013bp24、感病亲本徐麦32及二者杂交构建的f6重组近交系群体,共126个重组近交系。以辉县红和铭贤169为感病对照。
[0037]
3.2方法3.2.1 抗病性的表型鉴定同实施例1,白粉病抗性的鉴定方法3.2.2 dna提取同实施例1。
[0038]
3.2.3 kasp引物设计、稀释:根据gwas分析结果,将与抗白粉病qtl位点qpm6a.3显著关联的snp(6a_86486561)根据snp位点信息设计了一组(共三条)kasp引物k6a86486。将这组引物三条引物用超纯水稀释到100μm后按照体积比正向引物
‑
fam
‑
r:正向引物
‑
hex
‑
s:反向引物:超纯水=6:6:15:23的比例进行混合后,保存至
‑
20℃备用。
[0039]
3.2.4 kasp pcr扩增体系和程序如下:kasp反应体系采用6μl 体系:依下表在冰上配制体系,模板dna 3μl(20ng/μl左右),2
×
master mix 3μl(lgc group uk), kasp化验引物0.0825μl(上海生工生物公司合成)。
[0040]
pcr程序如下:1.94℃预变性5min;2.94℃变性20s;3.65℃退火30s(每个循环降低0.8℃),步骤2
‑
3循环10次。
[0041]
4.94℃变性20s;5.57℃退火30s,步骤4
‑
5循环35次。
[0042]
6.10℃保存。信号检测。
[0043]
3.3 结果3.3.1 ril群体中白粉病抗性的分离gwas分析结果表明,qpm6a.3是一个控制小麦白粉病抗性的qtl,位于6as上63.9
‑
107.7 mb的区间内。为进一步验证这个qtl并开发与其连锁的kasp标记,利用2013bp24与徐麦32杂交构建了f6重组近交系群体。
[0044]
对该群体进行白粉病抗性鉴定表明,f6代白粉病抗性出现明显的抗、感分离。其中抗病的ril有64个,感病的ril有62个,卡方检验符合抗:感=1:1的比例(p≤0.001)。
[0045]
4.3.2 ril群体中基因型与抗病性的关系将与该qtl关联最显著的一个gbs
‑
snp(6a_86486561)转换成kasp(k6a86486)标记后,对该群体进行基因分型,结果表明,这个kasp标记能将该ril群体进行分型。将基因型与抗病性表现进行分析表明这个标记与抗病性完全对应,与抗病亲本基因型相同的ril表现抗病,与感病亲本基因型相同的ril表现感病。该区间与已克隆的抗白粉病基因pm21是重叠的,利用前人发现的一个与pm21共分离的ssr标记6vs
‑
09b在这个群体中也进行了基因分型,分型结果与k6a5846的分型结果是完全一致的,与白粉病的抗性都表现共分离,表明qpm6a.3可能就是pm21,在育种中具有重要利用价值。
[0046]
以上所述仅是本专利的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本专利技术原理的前提下,还可以做出若干改进和替换,这些改进和替换也应视为本专利的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1