GSDME抑制剂及其在肿瘤化疗诱导的消化道损伤防治中的用途
本发明涉及一种gsdme抑制剂及其在肿瘤化疗诱导的消化道损伤防治中的用途,属于生物医药技术领域。
背景技术:
肿瘤综合治疗的方法日新月异,但对于大部分肿瘤尤其是晚期肿瘤患者,化疗仍是治疗恶性肿瘤的主要方法之一,其在肿瘤综合治疗中占据着重要的地位。反复多次化疗后会导致化疗药物不良反应加重、甚至造成组织不可逆性损伤。其中化疗诱导的消化道粘膜损伤发生率为40%,尤其是应用顺铂、紫杉醇、5-氟尿嘧啶、阿糖胞苷等化疗药时,消化道损伤的发生率高达90%(bensingerw,et.jnatlcomprcancnetw.2008,6(1):s1.21)。而化疗诱导的消化道损伤会导致或加重营养不良,加重患者病情使其不能坚持化疗,增加患者的身心痛苦,降低患者生活质量,延长住院时间,加重经济负担,甚至导致死亡。目前临床上针对肿瘤化疗后消化道损伤副反应的治疗方式仍以止吐、静脉营养、抑制消化道炎症、抗氧化以及益生菌等对症支持治疗为主,但这些治疗方法是治标不治本。既往采用gsdme敲除小鼠的研究发现,化疗药物干预过程中,caspase-3活化后剪切gsdme,而活化的gsdme介导细胞焦亡不仅在化疗诱导的肿瘤细胞死亡中发挥了重要作用,还介导了单纯顺铂或5-氟尿嘧啶化疗诱导的小鼠消化道绒毛组织损伤和体重降低。这表明gsdme既是化疗药物介导细胞焦亡达到抗肿瘤效果的关键分子,也是化疗药物诱导的消化道损伤导致营养不良的关键分子。
生理条件下,gsdme高表达于耳蜗、胎盘,同时在消化道、肝、胰腺、心、脑、肺、骨骼肌、肾等各组织中均有表达。2017年nature上发表的文章中检测了美国国家肿瘤研究所60种肿瘤细胞系中gsdme蛋白表达水平,发现卵巢癌、消化道等肿瘤细胞系无明显gsdme表达,而肿瘤细胞与正常细胞中gsdme的表达差异,正是化疗药物导致组织损伤不良反应的关键。这也可能作为治疗靶点来改善化疗消化道损伤等副反应,且不影响化疗的抗肿瘤效果。
所以综上所述,细胞焦亡在肿瘤化疗诱导的消化道组织损伤中发挥了重要作用,而gsdme是介导化疗药物诱导细胞焦亡的关键分子。针对gsdme的多肽抑制剂可作为肿瘤化疗诱导的消化道损伤防治的潜在药物成为本领域技术人员亟需研究的问题。
技术实现要素:
本发明的目的是为解决利用针对gsdme的多肽抑制剂作为肿瘤化疗诱导的消化道损伤防治的潜在药物的技术问题。
为达到解决上述问题的目的,本发明所采取的技术方案是提供一种gsdmde抑制剂;包括鼠源性多肽抑制剂z-dmld-fmk和人源性多肽抑制剂z-dmpd-fmk,z-dmld-fmk化学结构如式(i)所示;
优选地,所述gsdmde抑制剂竞争性抑制caspase3对于gsdmde的剪切作用。
优选地,所述gsdme抑制剂设为根据gsdme被caspase3剪切的位点的n端四个氨基酸合成的多肽抑制剂。
本发明提供一种gsdmde抑制剂在制备防治肿瘤化疗诱导的消化道损伤的药物中的应用。
优选地,所述gsdmde抑制剂设为多肽抑制剂。
优选地,所述gsdmde多肽抑制剂设为四肽抑制剂。
相比现有技术,本发明具有如下有益效果:
本发明提出的gsdme抑制剂是根据gsdme被剪切位点的n端四个氨基酸合成的多肽抑制剂,该抑制剂可与caspase3结合,竞争性抑制对gsdme的剪切作用,降低gsdme介导的细胞焦亡,从而可在体抑制化疗药物诱导的细胞焦亡并用于防治肿瘤化疗诱导的消化道损伤。
本发明针对gsdme设计了一种多肽抑制剂,该抑制剂可与caspase3结合,竞争性抑制caspase3对gsdme的剪切作用,从而显著抑制肿瘤化疗诱导的组织损伤模型小鼠消化道组织中gsdme活化水平,降低消化道组织损伤程度,增加了小鼠体重,从而改善肿瘤化疗诱导的组织损伤不良反应。本发明提供的gsdme多肽抑制剂可用于防治肿瘤化疗诱导的消化道损伤。
附图说明
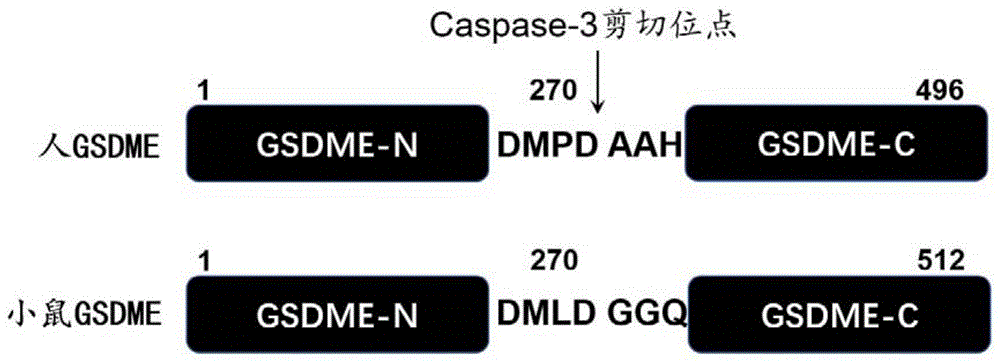
图1为gsdmde作为caspase3底物的剪切位点原理图;
图2为小鼠源性多肽抑制剂z-dmld-fmk化学结构图;
图3为gsdme抑制剂对卵巢癌小鼠顺铂化疗后消化道的外观大体影响。
图中从左至右依次为a图为对照组,b图为顺铂组,c图为gsdme抑制剂组,d图为顺铂+gsdme抑制剂组;
图4为gsdme抑制剂对卵巢癌小鼠顺铂化疗诱导消化道损伤的影响;
图中a图为对照组,顺铂组,gsdme抑制剂组,顺铂+gsdme抑制剂组试验小鼠的消化道组织染色图。
b图为试验小鼠的消化道绒毛长度统计图;纵坐标表示绒毛长度(μm);横坐标从左至右依次为对照组,顺铂组,gsdme抑制剂组,顺铂+gsdme抑制剂组。
c图为试验小鼠的绒毛长度/隐窝深度比值统计图。纵坐标表示v/c(绒毛长度/隐窝深度比值)比值;横坐标从左至右依次为对照组,顺铂组,gsdme抑制剂组,顺铂+gsdme抑制剂组。
图5为gsdme抑制剂对卵巢癌小鼠顺铂化疗消化道中gsdme活化水平的影响。图中从左至右依次为对照组,顺铂组,gsdme抑制剂组,顺铂+gsdme抑制剂组;
图6为gsdme抑制剂对卵巢癌小鼠顺铂化疗卵巢癌负荷的影响。
图中a图为荧光活体成像图,图中从左至右依次为对照组,顺铂组,gsdme抑制剂组,顺铂+gsdme抑制剂组;
b图为荧光强度对比图。纵坐标表示荧光强度,横坐标从左至右依次为对照组,顺铂组,gsdme抑制剂组,顺铂+gsdme抑制剂组。
具体实施方式
为使本发明更明显易懂,兹以优选实施例,并配合附图作详细说明如下:
本发明提供一种gsdmde抑制剂;包括鼠源性多肽抑制剂z-dmld-fmk和人源性多肽抑制剂z-dmpd-fmk,z-dmld-fmk化学结构如式(i)所示;
gsdmde抑制剂竞争性抑制caspase3对于gsdmde的剪切作用;gsdme抑制剂设为根据gsdme被caspase3剪切的位点的n端四个氨基酸合成的多肽抑制剂。
本发明提供一种gsdmde抑制剂在制备防治肿瘤化疗诱导的消化道损伤的药物中的应用。gsdmde抑制剂设为多肽抑制剂;设为四肽抑制剂。
如图1所示,gsdme多肽抑制剂是根据gsdme肽链中caspase3的剪切位点-da(人)或dg(小鼠)氨基酸位点(人d270a271,小鼠d270g271)设计;gsdme多肽抑制剂为4肽(小鼠源性dmld),并通过多肽修饰增强该抑制剂的细胞通透性。小鼠源性多肽抑制为z-dmld-fmk(化学结构见图2)。此外,与之对应的人源性多肽抑制剂为z-dmpd-fmk。
实施例
gsdme多肽抑制剂对肿瘤化疗诱导的消化道损伤的防治作用:
本发明采用6-7周龄雌性c57小鼠予以3×106id8细胞腹腔注射,构建卵巢癌肿瘤模型14天后,随机分为四组:(1)对照组,(2)顺铂组,(3)gsdme抑制剂组,(4)顺铂+gsdme抑制剂组,其中第2、4组于第15天、第29天各腹腔注射顺铂(10mg/kg)各一次,第3、4组gsdme抑制剂组于第15天开始连续腹腔注射gsdme抑制剂(200微克/只/天)共18天,对照组腹腔注射等体积生理盐水。实验过程中记录体重,并于第34天取消化道进行病理检测。结果发现,与对照组相比,顺铂组小鼠体重明显降低,gsdme抑制剂组小鼠体重无明显改变;而顺铂+gsdme抑制剂组小鼠体重相对于顺铂组明显升高(如表1)。这表明卵巢癌顺铂化疗导致了小鼠明显营养不良,而gsdme抑制剂可在体改善化疗诱导的营养不良。本发明也检测了消化道损伤水平;结果发现,与对照组相比,顺铂组小鼠消化道整体明显萎缩,且消化道绒毛明显损伤,gsdme抑制剂组小鼠消化道整体与绒毛都无明显改变;而与顺铂组相比,顺铂+gsdme抑制剂组小鼠消化道整体明显恢复,且消化道绒毛损伤也明显减轻(如图3、4)。
同时,检测了小鼠消化道gsdme活化水平;结果发现,与对照组相比,顺铂组小鼠消化道gsdme明显活化;而与顺铂组相比,gsdme抑制剂显著降低了消化道gsdme活化水平(如图5)。此外,本发明通过荧光活体成像检测了各组小鼠卵巢癌负荷水平,结果发现,与对照组相比,顺铂组小鼠腹腔卵巢癌负荷明显降低,gsdme抑制剂组无明显改变;而与顺铂组相比,顺铂+gsdme抑制剂组小鼠腹腔卵巢癌负荷亦无明显改变(如图6)。这表明gsdme多肽抑制剂可在体抑制肿瘤化疗诱导的gsdme活化水平,降低肿瘤化疗诱导的消化道损伤,从而改善化疗导致的营养不良,而对化疗的抗癌作用无影响。
表1.gsdme抑制剂对卵巢癌小鼠顺铂化疗后体重改变的影响(单位:g)
注:每组n=5,与对照组相比,***p<0.001;与顺铂组相比,###p<0.001。
细胞焦亡在肿瘤化疗诱导的消化道组织损伤中发挥了重要作用,而gsdme是介导化疗药物诱导细胞焦亡的关键分子。gsdme肽链中da(人)或dg(小鼠)氨基酸位点(人d270a271,小鼠d270g271)是caspase3的剪切位点;gsdme被剪切后,其氨基端(gsdme-n)将多聚体化并在细胞膜上形成孔洞从而介导细胞焦亡。本发明根据gsdme被剪切位点的n端四个氨基酸合成多肽抑制剂,该抑制剂将与caspase3结合,竞争性抑制caspase3对gsdme的剪切作用,从而降低gsdme介导的细胞焦亡。从而可在体抑制化疗药物诱导的细胞焦亡并用于防治肿瘤化疗诱导的消化道损伤。
本发明提供的gsdme多肽抑制剂溶解后可在体注射,竞争性抑制caspase3对gsdme的剪切作用,用于防治肿瘤化疗诱导的消化道损伤。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!