手性二胺类化合物和应用以及亚胺的不对称加成的方法
1.本发明涉及手性配体的制备领域,具体涉及一种手性二胺类化合物和应用以及亚胺的不对称加成的方法。
背景技术:
2.天然产物(-)-cytisine、(-)-sparteine和(+)-sparteine分子(bispidine的相关天然衍生物)都是含有双哌啶的母核结构。手性双哌啶天然产物(-)-cytisine自1865年被提分离出以来就受到了人们的广泛关注,随着天然产物(-)-sparteine和(+)-sparteine等的陆续发现,手性双哌啶家族在生物及化学领域掀起一股热潮。
[0003][0004]
早期美国的印第安人就把天然产物(-)-cytisine当作传统药物用于催吐和导泻。在欧洲被用作呼吸兴奋剂、利尿剂或杀虫剂。在二战期间金链花的叶子被当作烟草的替代品。cytisine是世界上最早的戒烟药,早在上世纪六十年代的东欧和中欧地区就开始用于戒烟。20世纪90年代末,(-)-cytisine被证明与烟碱型乙酰胆碱受体的α4β2亚型具有高度亲和力,是低非特异性的部分激动剂。近期研究发现,cytisine还具有止痛、抗高血压、抗痉挛、抗氧化和抗抑郁等多方面的药理作用。虽然(-)-cytisine可从供应商处可得,但(-)-cytisine仍然是一种相对昂贵的化学药物。
[0005]
sparteine具有抗心律失常和抗微生物感染的活性。此外,其它的sparteine、cytisine类似物,例如从苦参根中提取的双哌啶化合物a-c具有显著的抗金黄色葡萄球菌以及抗大肠杆菌活性;从苦豆草中提取的化合物d还具有抗乙肝型病毒的活性。
[0006][0007]
在(-)-sparteine研究历程中的一个里程碑是1990年hoppe等人在不对称碳锂化构建手性碳碳键反应中发现(-)-sparteine能作为手性配体实现高度的立体选择性,这为高效构建手性中心提供了一个有效途径,开辟了手性bispidine配体的新领域。尽管近年来人们一致致力于上述天然产物及其衍生物研究与合成,例如以全合成或半合成的方式,但是上述天然产物及其衍生物的研究仍然存在很多挑战。
技术实现要素:
[0008]
本发明研究开发了一种天然产物sparteine类型的手性二胺类化合物和应用,该化合物在水相中能够实现高反应活性及高立体选择性,在绿色合成层面也属于一项新的挑战。此外,本发还提供了一种亚胺的不对称加成的方法。
[0009]
为了实现上述目的,本发明第一方面提供一种手性二胺类化合物,该化合物具有式(i)所示的通式结构或其盐,
[0010][0011]
其中,式(i)中,
[0012]
q环为取代或未取代的六元环,x为-ch
2-,或者x为碳氧双键或碳硫双键;
[0013]r1-r7各自独立地选自h、卤素、c1-c20的烷基、c1-c20的卤代烷基、c1-c20的烷氧基、c6-c20的芳基、c2-c20的酯基、c2-c20的羰基、c2-c20的烷氧羰基、烯基、炔基、氨基、酰胺基、磺酰基、氰基、硝基、羧基、羟基或巯基。
[0014]
本发明中,r
1-r7全部为h,且q不含双键或者含有两个双键的未取代六元环除外。
[0015]
本发明第二方面提供一种前述所述化合物在水相不对称反应中的应用,特别是在水相不对称加成反应中的应用。
[0016]
本发明第三方面提供一种前述化合物在亚胺的不对称加成反应中的应用。
[0017]
本发明第四方面提供一种亚胺的不对称加成的方法,该方法包括:在过渡金属催化剂与前述化合物的存在下,使亚胺与加成试剂接触。
[0018]
与现有技术相比,本发明提供的技术方案至少具有以下优势:
[0019]
(1)本发明提供的二胺类化合物(手性双哌啶类化合物),在分子层面,同时包含刚性和共价元素,既具有刚性的母核结构,同时还提供了共价连接的有利因素;
[0020]
(2)本发明提供的二胺类化合物在作为手性配体应用时,相较于其它bispidine类化合物而言,具有能在水中实现高效手性催化的优势,可应用于环状磺酰胺(特别是六环磺酰亚胺)的不对称(芳基化)反应中,能够达到90%以上收率及对映选择性,为手性bispidine化合物的应用开拓了一个新领域。
具体实施方式
[0021]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0022]
本发明中,“c1-20的烷基”包括碳原子总数为1-20的直链、支链、环状烷基,包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、正己基、环丙基、甲基环丙基、乙基环丙基、环戊基、甲基环戊基、环己基
……
等,“c1-c20的卤代烷基、c1-c20的烷氧基、c6-c20的芳基、c2-c20的酯基、c2-c20的羰基、c2-c20的烷氧羰基”亦然,也即
具有有类似的含义。
[0023]
如前所述,本发明第一方面提供一种手性二胺类化合物,该化合物具有式(i)所示的通式结构或其盐,
[0024][0025]
其中,式(i)中,
[0026]
q环为取代或未取代的六元环,x为-ch
2-,或者x为碳氧双键或碳硫双键;
[0027]r1-r7各自独立地选自h、卤素、c1-c20的烷基、c1-c20的卤代烷基、c1-c20的烷氧基、c6-c20的芳基、c2-c20的酯基、c2-c20的羰基、c2-c20的烷氧羰基、烯基、炔基、氨基、酰胺基、磺酰基、氰基、硝基、羧基、羟基或巯基。
[0028]
本发明中,r
1-r7全部为h,且q不含双键或者含有两个双键的未取代六元环除外。
[0029]
本发明中,q环上的虚线代表可以代表碳碳单键或碳碳双键。
[0030]
根据本发明的一些实施方式,r
1-r7各自独立地选自h、卤素、c1-c10的烷基、c1-c10的卤代烷基、c1-c10的烷氧基、c6-c10的芳基、c2-c10的酯基、c2-c10的羰基、c2-c10的烷氧羰基、烯基、炔基、氨基、酰胺基、磺酰基、氰基、硝基、羧基、羟基或巯基。
[0031]
本发明中,优选地,r
1-r7各自独立地选自h、卤素、c1-c4的烷基、c1-c4的卤代烷基、c1-c4的烷氧基、c6-c8的芳基、c2-c6的酯基、c2-c6的羰基、c2-c6的烷氧羰基、烯基、炔基、氨基、酰胺基或磺酰基。
[0032]
根据本发明的一些实施方式,r3、r4、r5和r7全部为h,r1、r2和r6至少一个不为h。
[0033]
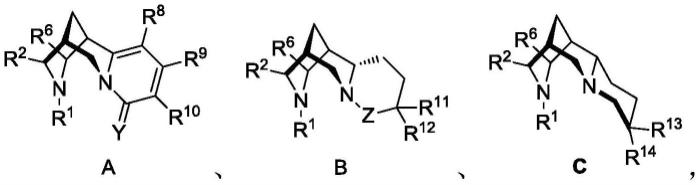
根据本发明的一些实施方式,所述化合物选自式a-c所示结构中的一种,
[0034][0035]
式a-c中,r1、r2和r6与前述定义相同;
[0036]
式a中r
8-r
10
、式b中r
11
和r
12
、式c中r
13
和r
14
各自独立地选自h、卤素、c1-c20的烷基、c1-c20的卤代烷基、c1-c20的烷氧基、c6-c20的芳基、c2-c20的酯基、c2-c20的羰基、c1-c20的烷氧羰基、烯基、炔基、氨基、酰胺基、磺酰基、氰基、硝基、羧基、羟基或巯基;
[0037]
式a中,y为o或s;
[0038]
式b中,z为-ch
2-,或者z为碳氧双键或碳硫双键。
[0039]
根据本发明的一些实施方式,式a中r
8-r
10
、式b中r
11
和r
12
、式c中r
13
和r
14
各自独立地选自h、卤素、c1-c10的烷基、c1-c10的卤代烷基、c1-c10的烷氧基、c6-c10的芳基、c2-c10的酯基、c2-c10的羰基、c1-c10的烷氧羰基、烯基、炔基、氨基、酰胺基、磺酰基、氰基、硝基、羧基、羟基或巯基。
[0040]
本发明中,优选地,式a中r
8-r
10
、式b中r
11
和r
12
、式c中r
13
和r
14
各自独立地选自h、卤
素、c1-c4的烷基、c1-c4的卤代烷基、c1-c4的烷氧基、c6-c8的芳基、c2-c6的酯基、c2-c6的羰基、c2-c6的烷氧羰基、烯基、炔基、氨基、酰胺基或磺酰基。
[0041]
根据本发明的一些实施方式,式a-c中,r1、r2和r6各自独立地选自h、卤素、c1-c4的烷基、c1-c4的卤代烷基、c6-c8的芳基、c2-c6的烷氧羰基、氨基或磺酰基。
[0042]
根据本发明的一些实施方式,式a中,r9为h,r8和r
10
各自独立地选自h、卤素、c1-c4的烷基或c6-c8的芳基。
[0043]
根据本发明的一些实施方式,式b中,r
11
和r
12
各自独立地选自h、卤素、c1-c4的烷基、c6-c8的芳基或c1-c6的烷氧羰基。
[0044]
根据本发明的一些实施方式,式c中,r
13
和r
14
各自独立地选自h、卤素、c1-c4的烷基、c6-c8的芳基、c2-c6的烷氧羰基、氨基或磺酰基。
[0045]
根据本发明的一些实施方式,所述化合物选自以下具体化合物中的一种:
[0046]
[0047]
[0048][0049]
本发明中,本发明提供的式(i)所示结构的化合物的盐的形式(例如盐酸盐形式)也在本发明的保护范围内;这是考虑到某些化合物以盐形式存在结构比较稳定,且呈固体形式,容易储存和转移。
[0050]
本发明对制备具有式(i)所示结构的手性二胺类化合物的方法没有特别的限定,可以参照本领域常规的方式进行。
[0051]
示例性地,以化合物13、14、19、78的合成为例:首先,以(-)-cytisine为起始原料与boc2o酸酐进行取代反应,得到化合物101;然后将化合物101在pto2和氢气的存在下进行还原反应,之后在hcl的作用下脱boc得到化合物78;化合物78进一步在lialh4和nabh4的作用下,得到化合物13;进一步地,化合物13中氮上的氢原子,可以被不同的取代基取代,例如甲基、苯基,分别得到化合物14和19;
[0052][0053]
示例性地,以化合物1、2、3、6、7、8的合成为例:首先,以化合物102为起始原料,在叔丁醇钾的存在下反应得到化合物103和104,然后化合物103和104与格式试剂rmgcl(例如r为甲基、异丙基、苯基)接触进行反应,得到化合物a和b,化合物a和b在pto2和氢气的存在下进行还原反应,得到化合物c和d,化合物c和d进一步在lialh4和nabh4的作用下,得到化合物e和f;
[0054][0055]
其中,化合物102可以通过本领域常规的方式获得,例如可以通过如下方法制备:使cytisine与ncs(n-氯代丁二酰亚胺)进行反应得到;
[0056][0057]
示例性地,以化合物79和80的合成为例:首先以化合物101为起始原料,使化合物101与nbs(n-溴代琥珀酰亚胺)进行反应得到化合物105和106;之后化合物105和106与芳基硼在醋酸钯的存在下,得到偶联化合物107和108;化合物107和108在经两步还原,最终得到化合物79和80;
[0058][0059]
本发明中,可以先以手性天然产物(
–
)-cytisine为起始原料进行化合物的制备,在有需要的情况下,再进一步拆分。其中,对所述拆分的方法没有特别的限定,可以参照本领域常规的方式。
[0060]
本发明对以上制备过程中涉及的反应条件没有特别的限定,本领域技术人员可以根据有机合成领域内的公知常识以及本发明实施例部分提供的具体实例获得适宜的反应条件。
[0061]
如前所述,本发明第二方面提供一种前述所述化合物在水相不对称反应中的应用,特别是在水相不对称加成反应中的应用。
[0062]
本发明中,不对称反应可以指不对称偶联、加成、氧化还原和不对称拆分等。
[0063]
如前所述,本发明第三方面提供一种前述化合物在亚胺的不对称加成反应中的应用。
[0064]
如前所述,本发明第四方面提供一种亚胺的不对称加成的方法,该方法包括:在过渡金属催化剂与前述化合物的存在下,使亚胺与加成试剂接触。
[0065]
根据本发明的一些实施方式,所述接触的条件包括:温度为50-120℃,优选为80-110℃;时间为5-30h,优选为10-24h。
[0066]
本发明中,在前述亚胺的不对称加成的反应中,优选地,相对于1mmol的亚胺,过渡金属催化剂的用量可以为0.05-0.2mol,前述化合物的用量可以为0.05-0.2mol,加成试剂的用量可以为1.5-3mol。
[0067]
根据本发明的一些实施方式,所述过渡金属催化剂包括过渡金属,选自pd、rh、ru和cu中的至少一种,优选为pd。
[0068]
根据本发明的一些实施方式,所述亚胺选自磺酰亚胺和/或酰基亚胺,优选为磺酰亚胺,更优选为环状磺酰亚胺。
[0069]
根据本发明的一些实施方式,所述加成试剂选自芳基硼化合物,优选为芳基硼酸和/或硼酸酯,更优选为芳基硼酸。
[0070]
本发明提供的手性二胺类化合物在亚胺的不对称加成中,产物的收率可达98%,ee值(对映体过量值)也可达98%。此外,本发明提供的化合物在前述其他的不对称反应中也能够获得中等的(ee值为30%-50%)对映选择性。
[0071]
以下将通过实施例对本发明进行详细描述。
[0072]
以下制备例和实施例中,所有商购获得的原料、试剂直接使用,不做进一步的处理。有机溶剂通过旋转蒸发器在减压下浓缩。除非另有说明,否则在硅胶(粒径50-75μm)上进行闪蒸柱层析。用薄层层析法(tlc)在玻璃背板上预涂二氧化硅(gf254)监测反应。用紫外光(254nm)或碘染色观察斑点。核磁共振谱在25℃的600mhz或400mhz bruker avance光
谱仪上获得,并以残留的未氘溶剂作为内参照物进行校准。在手性相上用高效液相色谱(hplc)测定对映体过量值。在q-tof micro(bruker compass data and analysis 4.0)光谱仪或q exactive hf lc-ms(thermo fisher)上进行高分辨率质谱(hrms)以进行精确的质谱分析。熔点记录在国家标准熔点测定仪上,不作校正。
[0073]
制备例
[0074]
化合物101的制备
[0075][0076]
将(-)-cytisine(5.7克,30毫摩尔)和boc2o(9.7毫升,1.4当量)溶于thf(116毫升)中,然后加入na2co3(3.20克,1.0当量)的水溶液(87ml);将上述混合物在40℃下搅拌反应24小时,用dcm(170毫升)和饱和nacl水溶液(30毫升)稀释,待分层后,用dcm萃取水相3次。收集所有有机相用无水na2so4干燥,在减压下过滤和浓缩,得到化合物101(8.61克,收率99%)白色固体。1h nmr(400mhz,cdcl3)δ7.30
–
7.21(m,1h),6.42(br,1h),6.05(br,1h),4.45
–
4.01(m,3h),3.87
–
3.72(m,1h),3.13
–
2.86(m,3h),2.40(br,1h),1.94(dd,j=13.5,10.0hz,2h),1.26(br,9h);
13
c nmr(101mhz,cdcl3)δ163.5,154.5(br),149.3-148.8(m),139.0-138.5(m),117.2,105.8-105.1(m),80.4-79.8(m),51.7,50.6,49.4,48.9,34.9,28.1,27.7,27.6,26.2。
[0077]
化合物78的制备
[0078][0079]
将化合物101(n-boc-cytisine)(5克,17.2毫摩尔)、甲醇(250毫升)和pto2(80%pt)(0.5克,2毫摩尔)的混合液在室温下搅拌反应4天。反应后的混合物用过滤,滤饼用ch2cl2/meoh(9:1)彻底清洗。浓缩后的残渣用甲醇(40ml)溶解,然后加入hcl(conc.)。甲醇在室温下搅拌24h后,蒸发成白色粘性物质,用饱和k2co3水溶液碱化,然后用ch2cl2萃取5次。所有收集的有机层在无水na2so4上干燥,过滤并在减压下浓缩,得到化合物78(4.6克,收率92%),白色固体。1h nmr(400mhz,cdcl3)δ4.68(dt,j=13.7,2.0hz,1h),3.57
–
3.51(m,1h),3.36(d,j=14.1hz,1h),3.12(d,j=13.4hz,1h),3.03
–
2.97(m,1h),2.97
–
2.91(m,1h),2.91
–
2.85(m,1h),2.53
–
2.45(m,1h),2.42
–
2.31(m,1h),2.02(ddd,j=12.6,5.5,3.2hz,1h),1.93(ddd,j=10.3,6.2,3.1hz,1h),1.89
–
1.74(m,5h),1.74
–
1.63(m,1h),1.49(s,1h);
13
c nmr(101mhz,cdcl3)δ170.2,60.1,51.9,47.0,46.9,33.5,33.3,33.2,28.5,28.3,20.4。
[0080]
化合物13的制备
[0081][0082]
在氩气气氛下用溶剂净化系统得到的lialh4(228毫克,1.0当量)和干四氢呋喃(15ml)充入圆底烧瓶。用注射器将1.16g的四氢胞苷(1.16克,6毫摩)加入干燥的四氢呋喃(15毫升)中,在氩气气氛下,温度为0℃。然后允许反应混合物在室温下搅拌30min,用饱和的罗谢尔盐(10毫升)熄灭。混合物在室温下搅拌15min,形成白色沉淀物,过滤除去。滤渣用乙醇彻底洗涤,滤液干燥浓缩成无色油,然后加入甲醇(30毫升)和硼氢化钠(227.0毫克,1.0当量)。将得到的溶液在室温下搅拌10min,然后用hcl(conc.)。通过蒸发除去溶剂,产生白色粘性物质,然后用ch2cl2稀释,并在无水na2so4上干燥。不溶性物质被过滤掉了。滤液蒸发得到化合物13(0.97克,收率90%),白色固体。1h nmr(400mhz,cdcl3)δ11.04(br,1h),3.66(d,j=13.2hz,1h),3.50(d,j=12.9hz,1h),3.29(dt,j=12.8,2.7hz,1h),3.14(d,j=13.2hz,1h),2.97(dt,j=11.6,2.2hz,1h),2.82(d,j=11.3hz,1h),2.50(dt,j=11.7,2.5hz,1h),2.28(d,j=10.5hz,1h),2.11(br,1h),2.00
–
1.73(m,5h),1.70
–
1.44(m,4h),1.36
–
1.21(m,1h);
13
c nmr(101mhz,cdcl3)δ65.5,60.9,56.5,49.8,45.9,32.5,31.8,30.0,27.3,25.4,24.0.hrms(esi)calcd for c
11h21
n2(m+h)
+
181.17047,found 181.17051.m.p.:138-140℃.
[0083]
化合物14的制备
[0084][0085]
在化合物13(0.6毫摩尔,108毫克)的甲醇(2毫升)溶液中加入37%的甲醛水溶液(2当量),然后在0℃缓慢加入nabh4(1当量)。然后将反应升温至室温,并搅拌一夜。反应混合物在减压下浓缩。用盐酸(1m)调节ph值在7-8之间,然后用ch2cl2(20毫升
×
3)提取。收集并浓缩结合的有机层,得到粗品。硅胶(甲醇/ch2cl2,2:98-1:9)经闪蒸柱进一步纯化,得到化合物14(108.4毫克,93%),为淡黄色油。1h nmr(400mhz,cdcl3)δ3.84(d,j=11.7hz,1h),3.73(d,j=10.9hz,1h),3.55(d,j=11.3hz,1h),3.25(d,j=11.9hz,1h),2.95(d,j=11.7hz,1h),2.86(d,j=11.7hz,1h),2.51(d,j=8.0hz,5h),2.47
–
2.37(m,1h),2.20
–
2.08(m,2h),1.94
–
1.73(m,6h),1.67(d,j=13.7hz,1h),1.56
–
1.43(m,1h);
13
c nmr(101mhz,cdcl3)δ66.6,59.7,59.2,56.8,56.2,46.1,33.4,32.1,29.2,28.6,24.2,23.2.hrms(esi)calcd for c
12h23
n2(m+h)
+
195.18612,found 195.18636。
[0086]
化合物19的制备
[0087]
[0088]
在密闭的试管中充入化合物13(0.3毫摩,54毫克)、溴苯(1当量)、tbuok(5.0当量)和二甲基亚砜(1毫升)。然后在120℃下搅拌加热24h,冷却至室温后,将反应混合物转移到乙酸乙酯(etoac)(10毫升)的分离漏斗中,并用nacl(aq)(3
×
10毫升)洗涤。收集有机层,在无水na2so4上干燥,然后浓缩得到粗品。硅胶(甲醇/ch2cl2,1:9)经闪蒸柱纯化,最终得到化合物19(61.5毫克,收率80%),黄油。1h nmr(400mhz,cdcl3)δ7.25(d,j=10.4hz,2h),6.88(d,j=6.1hz,2h),6.75(t,j=6.8hz,1h),3.86(d,j=11.9hz,1h),3.69(d,j=10.6hz,1h),3.06(dd,j=11.2,4.3hz,1h),2.90
–
2.84(m,1h),2.39(s,1h),2.12(s,1h),1.97
–
1.16(m,13h);
13
c nmr(101mhz,cdcl3)δ149.8,128.1,121.4,117.9,65.8,58.2,56.4,54.5,50.8,32.1,30.5,28.0,27.5,22.8,21.7.hrms(esi)calcd for c
17h25
n2(m+h)
+
257.20177,found 257.20203。
[0089]
化合物1、2、3、6、7、8的制备
[0090][0091]
其中,r分别为甲基、异丙基和苯基,相应得到化合物1、2、3、6、7、8。
[0092]
具体操作步骤如下:
[0093]
将化合物102(cl-cytisine)(1当量)溶解在四氢呋喃溶液中,加入叔丁醇钾的四氢呋喃溶液(0.2m,1.2当量)。反应在室温下搅拌3h,然后用乙醚洗涤2次,过滤后真空浓缩,得到化合物103和104。
[0094]
氮气保护下,用烘箱烘干的250ml的schlenck烧瓶,配以搅拌子,将化合物103和104的混合物(14.2g,21.8mmol,1当量)溶解在四氢呋喃(100ml)中。缓慢加入格氏试剂rmgcl(2m,38.15ml,3.5当量),在0℃搅拌过夜。
[0095]
然后用甲醇和氨水淬灭反应液,浓缩反应液。二氯甲烷:甲醇(80:1)萃取3次,有机相经无水硫酸钠干燥后真空浓缩得到粗产物。用硅胶(10%v/v异丙醇-二氯甲烷+0.1%nh3·
h2o)纯化得到35-40%收率的相应产品a和b(化合物1、2、3、6、7、8)。
[0096][0097]1h nmr(400mhz,cdcl3)δ7.28(dd,j=9.0,6.9hz,1h),6.44(dd,j=9.0,1.4hz,1h),5.96(dd,j=6.9,1.2hz,1h),3.99(dt,j=15.6,11.1hz,2h),3.15(dd,j=11.9,2.5hz,1h),2.81(s,1h),2.67(dt,j=11.9,2.4hz,1h),2.44(d,j=1.9hz,1h),2.32(d,j=10.2hz,1h),2.16(ddt,j=13.1,10.3,6.5hz,1h),2.04(dd,j=13.1,2.6hz,1h),1.73(dt,j=5.4,4.6hz,1h),0.94(dt,j=17.0,8.5hz,6h).
[0098]
13
c nmr(101mhz,cdcl3)δ163.66(s),151.65(s),138.74(s),116.65(s),104.58(s),65.83(s),51.50(s),47.97(s),35.18(s),27.79(s),25.22(s),21.38(s),20.14(d,j=6.3hz),-0.00(s).
[0099][0100]1h nmr(400mhz,cdcl3)δ7.51(d,j=8.2hz,2h),7.40(t,j=7.7hz,2h),7.33(dd,j=9.0,6.9hz,1h),7.29(d,j=7.6hz,1h),6.50(dd,j=9.0,1.3hz,1h),6.01(dd,j=6.9,1.2hz,1h),4.36(d,j=15.7hz,1h),4.19(s,1h),4.11(dd,j=15.8,6.7hz,1h),3.28(dd,j=12.2,2.2hz,1h),2.95(d,j=3.3hz,1h),2.85
–
2.77(m,2h),1.95(d,j=12.9hz,1h),1.80
–
1.76(m,1h).
[0101]
13
c nmr(101mhz,cdcl3)δ163.76(s),151.18(s),141.03(s),138.95(s),128.63(s),126.64(s),126.36(s),116.83(s),104.80(s),60.31(s),50.84(s),48.89(s),35.29(s),30.46(s),21.42(s).
[0102][0103]1h nmr(400mhz,dmso)δ8.70-8.30(br,2h),7.39(dd,j=9.2,6.8hz,1h),6.37
–
6.29(dd,j=9.2,1.2hz,1h),6.20(dd,j=6.8,1.0hz,1h),3.94(d,j=15.9hz,1h),3.79(dd,j=15.9,6.9hz,1h),3.67(q,j=7.0hz,1h),3.47(dd,j=12.9,2.8hz,1h),3.21(s,1h),3.00(d,j=12.9hz,1h),2.39(s,1h),2.18(d,j=13.7hz,1h),1.75(d,j=13.0hz,1h),1.41(d,j=7.0hz,3h).
[0104]
13
c nmr(101mhz,dmso)δ139.50(s),105.69(s),53.51(s),49.43(s),44.62(s),31.58(s),30.34(s),18.36(s),15.19(s).
[0105][0106]1h nmr(400mhz,cdcl3)δ7.28(dd,j=9.0,7.0hz,1h),6.42(t,j=9.0hz,1h),5.96(d,j=7.0hz,1h),4.09(d,j=15.5hz,1h),3.92
–
3.83(m,1h),3.11(d,j=11.6hz,1h),2.99(s,1h),2.77(d,j=12.3hz,1h),2.32
–
2.23(m,2h),2.24
–
2.14(m,1h),2.07(d,j=13.1hz,1h),1.71(dd,j=13.1,2.1hz,1h),0.96(dt,j=14.4,7.2hz,6h).
[0107]
13
c nmr(101mhz,cdcl3)δ163.69(s),153.05(s),138.75(s),116.42(s),104.87(s),66.71(s),50.10(s),47.07(s),35.78(s),27.46(s),25.07(s),20.87(s),20.17(s),20.12(s).
[0108]
[0109]1h nmr(400mhz,cdcl3)δ7.51(d,j=8.2hz,2h),7.40(t,j=8.0hz,2h),7.33(dd,j=9.0,6.9hz,1h),7.29(t,j=7.6hz,1h),6.50(dd,j=9.0,1.3hz,1h),6.01(dd,j=6.9,1.2hz,1h),4.36(d,j=15.7hz,1h),4.19(s,1h),4.11(dd,j=15.8,6.7hz,1h),3.28(dd,j=12.2,2.2hz,1h),2.95(d,j=3.3hz,1h),2.85
–
2.77(m,2h),1.95(d,j=12.9hz,1h),1.80
–
1.76(m,1h).
[0110]
13
c nmr(101mhz,cdcl3)δ151.81(s),140.30(s),138.87(s),128.75(s),126.81(s),126.46(s),117.02(s),105.29(s),61.43(s),49.97(s),47.68(s),38.21(s),27.53(s),20.94(s).
[0111]
化合物21、22、23、27、28、29的制备:
[0112][0113]
其中,r分别为甲基、异丙基和苯基,相应得到化合物c和d(化合物21、22、23、27、28、29)。
[0114]
具体操作如下:
[0115]
使用烘干的100ml的schlenck烧瓶,配以搅拌子,分别将起始原料化合物a和b(化合物1、2、3、6、7、8)(1当量)和二氧化铂(10%mmol)溶解于醋酸中,置换氢气,搅拌3天。
[0116]
反应完全后在氮气保护下,真空过滤浓缩,得到相应的产品,收率达95%。
[0117][0118]1h nmr(600mhz,cdcl3)δ7.45(d,j=11.8hz,2h),7.35(t,j=7.7hz,2h),7.24(t,j=7.3hz,1h),4.80(d,j=13.6hz,1h),3.93(s,1h),3.44(t,j=17.2hz,1h),3.05(dd,j=13.9,6.0hz,1h),2.98(d,j=13.8hz,1h),2.89
–
2.84(m,1h),2.51(dd,j=16.2,2.9hz,1h),2.43
–
2.29(m,2h),2.19(d,j=12.3hz,1h),1.96
–
1.87(m,1h),1.86
–
1.78(m,1h),1.75
–
1.64(m,3h),1.60(d,j=13.1hz,1h).
[0119]
13
c nmr(151mhz,cdcl3)δ175.86
–
172.55(m),170.92(s),142.03
–
141.79(m),128.59(s),127.08(s),126.84(s),60.45(s),60.17(s),47.38(s),42.12(s),33.18(s),32.97(s),31.65(s),27.85(s),27.44(s),19.93(s).
[0120][0121]1h nmr(400mhz,cdcl3)δ7.44(d,j=7.5hz,2h),7.35(t,j=6.9hz,2h),7.23(dd,j=7.5,6.9hz,1h),4.68(d,j=13.3hz,1h),4.17(s,1h),3.67
–
3.59(m,1h),3.21(dd,j=13.2,5.2hz,1h),2.85(t,j=12.4hz,2h),2.53(d,j=17.3hz,1h),2.44
–
2.33(m,1h),2.07
(d,j=12.4hz,2h),1.90(t,j=15.6hz,5h),1.56(d,j=12.1hz,1h).
[0122]
13
c nmr(101mhz,cdcl3)δ170.75(s),143.77(s),128.53(s),126.61(d,j=13.5hz),60.92(s),55.17(s),47.24(d,j=18.5hz),37.72(s),33.36(s),27.89(d,j=17.2hz),27.49(s),20.16(s).
[0123]
化合物36、37、38、41、42、43的制备
[0124][0125]
其中,当r分别为甲基、异丙基和苯基,相应得到化合物c和d(化合物36、37、38、41、42、43)。
[0126]
具体操作步骤如下:
[0127]
氮气保护下,分别将化合物c和d(化合物21、22、23、27、28、29)(1当量)和lialh4(1.2当量)置于装有搅拌子的干燥50ml的schlenck烧瓶中,分别溶解于干燥的thf中,将lialh4溶液分别滴加到化合物c和d(化合物21、22、23、27、28、29)的溶液中,0℃下搅拌2h。
[0128]
用酒石酸钾钠饱和溶液淬灭,直至无气泡出现。抽滤、洗涤有机相5次以上,合并有机相并旋干得到中间体。然后将中间体溶解在甲醇中,加入nabh4(1当量),室温下搅拌3h。调整ph值6-7后,真空浓缩,然后溶解在二氯甲烷中并用无水na2so4干燥,再次浓缩得到相应的产物化合物36、37、38、41、42、43,收率分别为95%、92%、88%、90%、89和85%。
[0129][0130]1h nmr(600mhz,cdcl3)δ7.32(t,j=7.9hz,2h),7.27(d,j=6.9hz,2h),6.99(t,j=7.2hz,1h),4.28(d,j=9.9hz,1h),4.01(dd,j=23.4,10.3hz,2h),3.76(d,j=12.0hz,1h),3.42(d,j=9.6hz,1h),3.26(d,j=11.5hz,1h),2.95(dd,j=25.2,11.2hz,2h),2.83(t,j=11.6hz,1h),2.32(d,j=13.4hz,1h),2.09(d,j=15.5hz,3h),1.90(ddd,j=35.4,23.9,13.0hz,6h).
[0131]
按照上述类似的方式,制备得到了以下一些具体化合物。
[0132][0133]
h nmr(400mhz,meod)δ4.14(d,j=69.3hz,3h),3.12(ddd,j=92.4,42.3,32.2hz,5h),1.86(t,j=59.2hz,11h),1.49(s,9h)).
[0134]
[0135]1h nmr(400mhz,cdcl3)δ4.71(dd,j=13.6,2.0hz,1h),4.60(d,j=13.9hz,1h),4.15(dd,j=13.3,1.5hz,1h),3.44(d,j=11.3hz,1h),3.04(dd,j=13.3,2.2hz,1h),2.80(dd,j=22.8,8.3hz,2h),2.35(dd,j=9.4,4.1hz,2h),2.16(ddd,j=24.9,13.2,3.1hz,1h),1.98
–
1.77(m,5h),1.71
–
1.58(m,2h),1.44(d,j=13.1hz,9h).
[0136][0137]1h nmr(400mhz,cdcl3)δ7.39
–
7.20(m,4h),7.02(dt,j=126.6,36.9hz,2h),6.53(d,j=9.0hz,1h),5.92(s,1h),4.80(s,1h),4.09(dd,j=33.5,26.6hz,1h),3.96
–
3.51(m,2h),3.12(d,j=54.3hz,3h),2.43(d,j=63.8hz,1h),2.07
–
1.98(m,2h).
[0138]
13
c nmr(101mhz,cdcl3)δ171.27(s),163.30(s),135.27(s),129.56(s),126.58(s),117.65(s),117.62
–
117.53(m),48.81
–
48.71(m),34.78(s),27.62(s),26.26(s).
[0139][0140]1h nmr(400mhz,cdcl3)δ5.45(d,j=143.5hz,1h),3.16(s,2h),3.06(s,1h),2.94(s,1h),2.78
–
2.31(m,7h),2.23(d,j=15.9hz,6h),1.96(s,1h),1.88
–
1.51(m,8h),1.50
–
1.26(m,3h).
[0141][0142]1h nmr(400mhz,cdcl3)δ4.45
–
4.06(m,1h),3.07(dd,j=18.2,10.8hz,2h),2.90(t,j=12.1hz,1h),2.82(d,j=9.4hz,1h),2.55
–
2.45(m,1h),2.43
–
2.26(m,4h),2.23(d,j=6.7hz,6h),2.00(t,j=30.1hz,2h),1.89
–
1.66(m,4h),1.64
–
1.47(m,5h),1.38
–
1.20(m,3h).
[0143][0144]1h nmr(400mhz,cdcl3)δ7.32(d,j=9.6hz,1h),6.45(d,j=9.6hz,1h),4.12(d,j
=15.6hz,1h),3.95
–
3.89(m,1h),3.32(s,1h),3.23(dt,j=13.0,3.5hz,2h),2.90(dt,j=12.5,2.4hz,1h),2.26
–
2.20(m,1h),2.14(s,1h),1.76
–
1.71(m,1h),1.31(d,j=6.9hz,3h).
[0145]
13
c nmr(101mhz,cdcl3)δ163.67(s),151.64(s),138.72(s),116.69(s),104.54(s),65.85(s),51.51(s),48.00(s),35.21(s),27.82(s),25.27(s),21.42(s),20.15(d,j=5.5hz).
[0146][0147]1h nmr(400mhz,cdcl3)δ7.31(d,j=9.6hz,1h),6.43(d,j=9.6hz,1h),4.05
–
3.92(m,2h),3.31(s,1h),3.07(dd,j=11.9,2.5hz,1h),2.82(ddd,j=15.4,8.9,6.5hz,1h),2.49
–
2.43(m,1h),2.32(d,j=10.2hz,1h),2.18(ddt,j=13.1,10.2,6.5hz,1h),2.09(dt,j=13.3,2.5hz,1h),1.75
–
1.66(m,1h),1.00
–
0.91(m,6h).
[0148]
13
c nmr(101mhz,cdcl3)δ162.29(s),147.51(s),139.96(s),117.32(s),109.85(s),65.56(s),52.43(s),44.35(s),31.98(s),27.42(s),25.15(s),21.38(s),20.18(s),19.95(s).
[0149][0150]1h nmr(400mhz,dmso)δ9.80(br,1h),8.42(br,1h),7.49(s,1h),7.34(s,1h),6.83(s,1h),4.34(d,j=16.4hz,1h),4.19(s,1h),3.48
–
3.42(m,1h),3.31(dd,j=30.4,11.8hz,2h),3.23
–
3.14(m,2h),2.76(s,1h),2.05(d,j=12.2hz,1h),1.92(d,j=13.2hz,1h).
[0151][0152]1h nmr(400mhz,cdcl3)δ7.59(d,j=8.3hz,1h),7.17(s,3h),6.85(s,2h),6.64(t,j=7.8hz,1h),5.28(d,j=7.1hz,1h),4.90
–
4.81(m,2h),4.14(dd,j=16.1,5.1hz,1h),4.01(dd,j=13.5,7.2hz,1h),3.56(d,j=13.8hz,1h),3.26(s,1h),2.93(s,1h),2.12(d,j=11.6hz,1h),2.01(d,j=10.5hz,1h),1.17(s,9h).
[0153][0154]1h nmr(400mhz,cdcl3)δ7.66(dd,j=8.5,1.5hz,1h),7.13(dd,j=8.5,7.2hz,
1h),6.48(dd,j=7.2,1.4hz,1h),4.53(d,j=16.0hz,1h),4.27(dd,j=16.0,6.8hz,1h),3.04(d,j=2.5hz,1h),2.93
–
2.87(m,1h),2.84
–
2.78(m,1h),2.52(dd,j=6.1,2.9hz,1h),2.28(dt,j=7.3,3.6hz,1h),2.22(d,j=11.1hz,1h),2.09(s,3h),1.90
–
1.83(m,1h),1.81
–
1.75(m,1h).
[0155][0156]1h nmr(400mhz,cdcl3)δ7.31(dd,j=9.1,6.8hz,1h),6.50(dd,j=9.1,1.2hz,1h),6.09
–
6.01(dd,j=6.8,0.8hz,1h),4.19(d,j=15.9hz,1h),4.02
–
3.83(m,3h),3.35(dd,j=11.8,6.6hz,2h),3.15(s,1h),2.61(s,1h),2.09(d,j=13.3hz,1h),1.97(d,j=13.2hz,1h).
[0157]
13
c nmr(101mhz,cdcl3)δ163.29(s),146.76(s),138.80(s),118.35(s),105.65(s),53.60(s),52.74(s),48.30(s),34.05(s),26.96(s),25.03(s)).
[0158]
19
f nmr(376mhz,cdcl3)δ-74.62(s).
[0159][0160]1h nmr(400mhz,cdcl3)δ7.32(dd,j=9.0,6.8hz,1h),6.48(d,j=9.0hz,1h),6.03(d,j=6.8hz,1h),4.21(d,j=15.6hz,1h),3.94(dd,j=15.7,6.5hz,1h),3.45
–
3.33(m,2h),2.97(s,1h),2.88(d,j=11.7hz,1h),2.72(s,1h),2.28(d,j=13.4hz,1h),1.88(d,j=13.4hz,1h).
[0161]
19
f nmr(376mhz,cdcl3)δ-71.27(s).
[0162][0163]1h nmr(400mhz,cdcl3)δ7.79(s,1h),7.19
–
7.13(m,3h),6.96(dd,j=7.3,1.9hz,2h),3.96
–
3.86(m,2h),3.35(d,j=2.8hz,1h),3.07(d,j=10.9hz,1h),2.91(d,j=10.8hz,1h),2.62
–
2.57(m,2h),2.55
–
2.47(m,2h),2.40(s,1h),2.36(d,j=11.0hz,1h),2.24(dd,j=10.9,2.1hz,1h),1.82(d,j=2.2hz,2h).
[0164][0165]1h nmr(400mhz,cdcl3)δ7.28
–
7.22(m,1h),7.20
–
7.16(m,1h),6.90
–
6.84(m,2h),4.87(d,j=13.6hz,1h),3.78(d,j=13.4hz,1h),3.24(dd,j=13.6,2.6hz,1h),3.03(dd,j=11.4,2.7hz,1h),2.94
–
2.78(m,2h),2.33(dt,j=11.4,2.0hz,1h),2.18(d,j=11.3hz,1h),1.92
–
1.71(m,6h),1.64(ddt,j=17.5,10.1,3.6hz,3h),1.49(d,j=11.1hz,1h),1.35
–
1.29(m,1h).
[0166][0167]1h nmr(600mhz,cdcl3)δ8.58
–
8.49(m,1h),7.74(dtd,j=27.4,7.7,1.7hz,1h),7.66
–
7.35(m,1h),7.30
–
7.21(m,1h),4.91(ddd,j=109.7,13.5,1.6hz,1h),3.77(ddd,j=165.7,13.7,1.5hz,1h),3.44
–
3.25(m,1h),3.08
–
2.94(m,1h),2.86
–
2.71(m,1h),2.66
–
2.50(m,1h),2.27
–
2.18(m,1h),1.98(dt,j=12.0,7.5hz,1h),1.95
–
1.81(m,2h),1.81
–
1.68(m,2h),1.68
–
1.61(m,2h),1.61
–
1.50(m,2h),1.50
–
1.35(m,2h),1.18
–
1.02(m,1h).
[0168][0169]1h nmr(600mhz,dmso)δ7.76(s,1h),7.33
–
7.20(m,6h),6.53(s,1h),4.67(s,1h),4.57(d,j=14.0hz,1h),4.12(d,j=13.2hz,1h),3.63(d,j=10.6hz,1h),3.38(t,j=10.0hz,1h),3.25(s,1h),3.00(d,j=11.1hz,1h),2.86(dd,j=13.3,7.7hz,1h),2.76(d,j=7.8hz,1h),2.47(d,j=14.3hz,1h),2.40
–
2.35(m,1h),2.05(s,1h),1.94
–
1.69(m,8h),1.56
–
1.45(m,2h),1.38(s,9h).
[0170][0171]1h nmr(600mhz,dmso)δ7.76
–
6.53(m,8h),4.74
–
4.64(m,1h),4.54(dd,j=29.9,12.9hz,1h),4.13(t,j=12.2hz,1h),3.86(dd,j=63.3,17.1hz,1h),3.69
–
3.59(m,1h),2.98(dd,j=50.5,16.9hz,2h),2.89
–
2.83(m,1h),2.79
–
2.72(m,2h),2.37(dd,j=17.0,15.2hz,1h),2.07
–
1.93(m,2h),1.91
–
1.70(m,6h),1.48(dd,j=53.4,11.3hz,2h),1.36(d,j=26.1hz,9h).
[0172][0173]1h nmr(400mhz,dmso)δ7.35
–
7.19(m,3h),7.02(s,1h),6.96(s,2h),6.90(s,1h),4.26
–
4.07(m,4h),3.79
–
3.73(m,1h),3.05(d,j=11.1hz,1h),2.90(dd,j=11.7,8.2hz,1h),2.41(s,1h),2.30(s,6h),2.26(d,j=4.6hz,7h),1.95(t,j=12.0hz,1h),1.86(d,j=12.8hz,1h),1.24(d,j=22.5hz,9h).
[0174][0175]1h nmr(600mhz,cdcl3)δ7.37(d,j=7.1hz,1h),7.22(s,2h),6.89(s,1h),6.10(s,1h),4.42
–
4.04(m,3h),3.82(dd,j=15.5,6.3hz,1h),3.04(d,j=12.8hz,1h),2.99
–
2.86(m,2h),2.38(d,j=18.3hz,1h),1.94(d,j=12.9hz,1h),1.88(d,j=13.0hz,1h),1.37
–
1.14(m,9h).
[0176][0177]1h nmr(400mhz,cdcl3)δ7.24(dd,j=9.1,7.3hz,4h),7.18
–
7.12(m,1h),4.59(d,j
=13.4hz,1h),3.27(dd,j=9.7,5.4hz,1h),2.99(t,j=10.6hz,1h),2.67(d,j=2.2hz,1h),2.52
–
2.27(m,4h),2.14
–
2.04(m,2h),1.92(d,j=8.4hz,1h),1.89(s,3h),1.82
–
1.70(m,2h),1.64
–
1.48(m,2h),1.30
–
1.25(m,1h).
[0178][0179]1h nmr(600mhz,cdcl3)δ4.60(d,j=13.7hz,1h),4.52(d,j=13.8hz,1h),4.05(d,j=13.0hz,1h),3.41(d,j=11.2hz,1h),3.00(d,j=13.1hz,1h),2.79(t,j=15.6hz,2h),2.18(dd,j=23.4,13.3hz,1h),1.92(s,1h),1.83(dd,j=25.6,11.7hz,2h),1.69
–
1.59(m,4h),1.41(d,j=19.6hz,9h),1.17(d,j=25.6hz,6h).
[0180][0181]1h nmr(400mhz,dmso)δ10.40-9.10(m,2h),7.74(br,1h),3.52(d,j=13.0hz,1h),3.37(d,j=12.2hz,1h),3.11(s,1h),2.99(s,1h),2.88(d,j=11.2hz,1h),2.36(d,j=9.8hz,1h),2.26(d,j=11.3hz,1h),2.03(d,j=12.2hz,2h),1.89(d,j=9.6hz,2h),1.71(dd,j=15.0,12.2hz,2h),1.68
–
1.61(m,1h),1.58(d,j=11.1hz,1h),1.41(d,j=12.2hz,1h),1.16(td,j=13.2,4.0hz,1h),1.01(d,j=9.0hz,3h),0.84(s,3h).
[0182][0183]1h nmr(400mhz,cdcl3)δ4.70(d,j=13.5hz,1h),4.62(dd,j=13.8,1.4hz,1h),4.14(dd,j=16.3,4.4hz,1h),3.45(d,j=11.4hz,1h),3.03(dd,j=13.3,2.3hz,1h),2.84
–
2.80(m,1h),2.79
–
2.76(m,1h),2.35(td,j=12.8,6.5hz,1h),2.23(ddd,j=25.3,13.3,3.1hz,1h),2.01
–
1.73(m,6h),1.59(d,j=20.4hz,1h),1.41(s,9h),1.13(d,j=7.0hz,3h).
[0184][0185]1h nmr(400mhz,cdcl3)δ7.26(s,5h),7.18
–
7.11(m,3h),7.06
–
7.01(m,2h),4.72(d,j=13.8hz,1h),4.57(d,j=13.7hz,1h),4.13(dd,j=9.9,6.9hz,1h),3.52(d,j=12.8hz,1h),3.16(d,j=13.7hz,1h),3.07(s,1h),3.03
–
2.96(m,2h),2.72(dd,j=27.5,
13.1hz,2h),2.33(dd,j=24.8,11.9hz,1h),2.21(d,j=12.8hz,1h),1.89(s,1h),1.83
–
1.76(m,1h),1.68(d,j=12.6hz,1h),1.56(s,2h),1.50(dd,j=13.3,2.8hz,1h),1.41(s,9h),1.36(s,1h).
[0186][0187]1h nmr(400mhz,cdcl3)δ7.23(d,j=7.5hz,2h),7.17(d,j=7.2hz,1h),7.12(t,j=7.1hz,2h),4.76(d,j=13.6hz,1h),4.57(d,j=13.8hz,1h),4.16(d,j=13.4hz,1h),3.48(dd,j=12.6,2.5hz,1h),3.41(d,j=11.6hz,1h),3.03(dd,j=13.2,2.2hz,1h),2.82(d,j=13.7hz,1h),2.76(dd,j=13.9,1.9hz,1h),2.56
–
2.40(m,2h),2.10(td,j=15.1,3.6hz,1h),1.94
–
1.80(m,3h),1.78
–
1.68(m,2h),1.59(s,1h),1.45(s,9h),1.36
–
1.24(m,1h).
[0188][0189]1h nmr(400mhz,cdcl3)δ10.94(br,1h),7.30-7.24(m,2h),7.18(t,j=7.3hz,1h),7.12(d,j=7.0hz,2h),3.62(d,j=13.2hz,1h),3.43(d,j=10.2hz,2h),3.28(d,j=12.8hz,1h),3.13(d,j=13.0hz,1h),2.91(d,j=11.6hz,1h),2.72(d,j=10.2hz,1h),2.53
–
2.40(m,3h),2.23(d,j=10.7hz,1h),2.08(s,1h),2.00
–
1.89(m,2h),1.81(d,j=12.4hz,3h),1.64
–
1.49(m,3h),1.02(qd,j=12.4,4.3hz,1h).
[0190][0191]1h nmr(600mhz,cdcl3)δ11.24(br,1h),7.85(br,1h),7.32(t,j=7.4hz,2h),7.27(d,j=6.4hz,1h),7.23(dd,j=13.2,6.3hz,2h),7.21
–
7.18(m,1h),7.15(d,j=7.1hz,2h),6.98(d,j=6.9hz,2h),3.66(d,j=13.3hz,1h),3.53(d,j=12.8hz,1h),3.33(s,1h),3.20(s,1h),2.92(dd,j=12.6,6.8hz,2h),2.80(d,j=13.7hz,1h),2.60
–
2.54(m,1h),2.51
–
2.45(m,2h),2.35(t,j=12.5hz,1h),2.07(s,1h),2.01(d,j=11.8hz,1h),1.92(ddd,j=15.1,12.8,3.0hz,2h),1.75(d,j=11.6hz,2h),1.69(d,j=12.9hz,1h),1.59(d,j=13.1hz,1h),1.42
–
1.30(m,2h).
[0192]
13
c nmr(151mhz,cdcl3)δ138.11(s),137.18(s),131.01(s),130.62(s),128.25(s),127.82(s),126.56(s),126.24(s),65.37(s),64.02(s),60.77(s),49.86(s),45.98(s),45.27(s),42.81(s),37.34(s),32.17(s),31.33(s),30.50(s),27.21(s),25.92(s).
[0193][0194]1h nmr(400mhz,cdcl3)δ7.23(dt,j=4.4,2.1hz,3h),7.03(dd,j=6.6,2.6hz,2h),6.91(dd,j=9.0,6.9hz,1h),6.39(dd,j=9.0,1.3hz,1h),4.83(dd,j=6.9,1.2hz,1h),4.18(d,j=15.4hz,1h),4.12(q,j=6.9hz,1h),4.06(d,j=2.0hz,1h),3.93(dd,j=15.1,7.1hz,1h),3.31
–
3.25(m,1h),3.16(dd,j=11.2,1.0hz,1h),2.89(s,1h),2.45(s,1h),2.17
–
2.08(m,2h).
[0195]
测试例
[0196]
环状n-磺酰亚胺不对称芳基化的一般步骤:
[0197]
用亚胺(0.2毫摩尔)、芳基硼酸(2当量)、pd(tfa)2(10mol%)和二胺配体(手性二胺类化合物)(10mol%)充入密封管,然后用水(1.6毫升)。反应用搅拌加热24小时,冷却至室温后,将反应混合物转移到乙酸乙酯(etoac)15毫升的分离漏斗中。有机层用氯化钠水溶液洗涤、干燥和浓缩。残留物用闪蒸柱(石油醚/乙酸乙酯,5:1)纯化。表1列出了醛亚胺(143a)与不同的芳基硼酸反应的结果,同时,也以相同的方式得到了化合物144aa。
[0198][0199]
表1
[0200][0201]
由表1可以看出,在大多数情况下,24h后都能获得较高的产率和较好的ee值,尤其是含给电子基的芳基硼酸。更多的缺电子芳基硼酸(如噻吩硼酸)提供了较低的ee值,也收集到了醛亚胺的水解产物(143a)。此外,间位或对位含取代基的芳基硼酸的ee值明显高于邻位含取代基的芳基硼酸。
[0202]
对不同位置具有不同取代基的醛亚胺进行了考察。如下表2所示。
[0203][0204]
表2
[0205][0206]
[a]
反应分别在100℃,90℃和80℃下进行。
[0207]
由表2可以看出,含给电子基的醛亚胺,特别是位于143b的6位的醛亚胺(单取代的亚胺)具有较高的产率和较好的对映选择性,而含吸电子基团的醛亚胺更有可能发生水解反应生成相应的水杨醛。因此,在亚胺加成之前,应增加芳基硼酸用量或醛亚胺容易发生环状裂解。而6-硝基取代醛亚胺在较低温度下水解容易,不能进行芳基化反应,也不能生成芳基化产物。
[0208]
对以下手性二胺类化合物进行了效果测试,得到了对应上述反应(以化合物143a和phb(oh)2作为原料)的反应立体选择性,如表3所示。
[0209]
表3
[0210][0211][0212]1h nmr(400mhz,cdcl3)δ7.33(t,j=7.8hz,1h),7.25(d,j=8.2hz,2h),7.09(t,j=7.9hz,2h),6.94(d,j=8.6hz,2h),6.84(d,j=7.8hz,1h),5.87(d,j=8.4hz,1h),4.56(d,j=8.5hz,1h),3.84(s,3h);
13
c nmr(101mhz,cdcl3)δ160.6,151.6,130.2,130.1,129.9,128.8,125.4,122.4,119.0,114.9,61.7,55.6.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=18.38min(主产物),t
r2
=31.82min(次产物)];ee=91%.
[0213]
[0214]1h nmr(400mhz,cdcl3)δ7.48
–
7.41(m,3h),7.37
–
7.30(m,3h),7.11-7.08(m,2h),6.83(d,j=7.6hz,1h),5.91(d,j=8.7hz,1h),4.67(d,j=8.5hz,1h);
13
c nmr(101mhz,cdcl3)δ151.6,137.9,129.8,129.6,129.5,128.8,128.6,125.3,122.0,118.9,62.0.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=15.18min(主产物),t
r2
=17.68min(次产物)];ee=76%.
[0215][0216]1h nmr(400mhz,cdcl3)δ7.46
–
7.40(m,1h),7.35(dd,j=7.5,1.6hz,1h),7.28(ddd,j=8.8,4.8,0.7hz,1h),7.04(dtd,j=16.9,7.6,1.0hz,3h),6.97(d,j=8.2hz,1h),6.68(d,j=7.8hz,1h),5.91(d,j=10.2hz,1h),5.70(d,j=10.2hz,1h),3.68(s,3h);
13
c nmr(101mhz,cdcl3)δ157.3,151.2,131.3,131.0,129.3,126.9,125.0,124.6,122.8,121.4,118.4,112.1,60.4,55.7.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=19.77min(主产物),t
r2
=28.66min(次产物)];ee=76%.
[0217][0218]1h nmr(400mhz,cdcl3)δ7.37
–
7.29(m,2h),7.12
–
7.06(m,1h),7.03(dd,j=8.3,1.0hz,1h),6.98
–
6.94(m,1h),6.91(d,j=7.6hz,1h),6.85(dd,j=7.7,5.5hz,2h),5.85(d,j=8.7hz,1h),4.91(d,j=8.7hz,1h),3.80(s,3h);
13
c nmr(101mhz,cdcl3)δ160.3,151.4,139.2,130.6,129.7,128.6,125.3,122.0,121.0,118.8,115.0,114.5,61.9,55.4.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=23.05min(主产物),t
r2
=27.09min(次产物)];ee=93%.
[0219][0220]1h nmr(400mhz,cdcl3)δ7.35(ddd,j=8.2,7.5,0.7hz,1h),7.29
–
7.22(m,4h),7.17
–
7.04(m,2h),6.86(d,j=7.8hz,1h),5.89(d,j=8.7hz,1h),4.80(d,j=8.7hz,1h),2.42(s,3h);
13
c nmr(101mhz,cdcl3)δ151.6,139.7,135.0,130.2,129.8,128.8,128.7,125.3,122.4,118.9,61.9,21.4.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=15.76min(主产物),t
r2
=17.50min(次产物)];ee=91%.
[0221][0222]1h nmr(400mhz,cdcl3)δ7.35(ddd,j=8.7,5.5,1.5hz,3h),7.18
–
7.06(m,4h),6.82(d,j=7.8hz,1h),5.91(d,j=8.5hz,1h),4.71(d,j=8.4hz,1h);
13
c nmr(101mhz,cdcl3)δ163.3(d,j=249.7hz),151.6,133.9(d,j=3.4hz),130.9(d,j=8.5hz),130.1,128.6,125.5,121.8,119.1,116.7(d,j=21.8hz),61.4.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=13.27min(主产物),t
r2
=17.71min(次产物)];ee=96%.
[0223][0224]1h nmr(400mhz,cdcl3)δ7.51
–
7.45(m,1h),7.39(ddd,j=7.9,6.5,2.7hz,1h),7.37
–
7.29(m,3h),7.12
–
7.08(m,2h),6.81
–
6.75(m,1h),6.30(d,j=9.2hz,1h),5.07(d,j=9.1hz,1h);
13
c nmr(101mhz,cdcl3)δ151.5,135.0,134.1,131.3,130.9,130.7,129.8,127.8,127.7,125.4,121.2,118.9,59.5.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=11.76min(次产物),t
r2
=12.28min(主产物)];ee=78%.
[0225][0226]1h nmr(400mhz,cdcl3)δ7.45
–
7.31(m,4h),7.25(d,j=7.7hz,1h),7.13(t,j=7.4hz,1h),7.06(d,j=8.3hz,1h),6.83(d,j=7.8hz,1h),5.86(d,j=8.5hz,1h),4.93(d,j=8.5hz,1h);
13
c nmr(101mhz,cdcl3)δ151.5,139.7,135.3,130.8,130.0,129.8,129.1,128.4,127.1,125.5,121.3,119.0,61.4.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=16.79min(次产物),t
r2
=23.09min(主产物)];ee=90%.
[0227][0228]1h nmr(400mhz,cdcl3)δ7.45
–
7.39(m,2h),7.38
–
7.32(m,1h),7.32
–
7.27(m,2h),7.15
–
7.07(m,2h),6.81(d,j=7.8hz,1h),5.90(d,j=8.5hz,1h),4.68(d,j=8.4hz,1h);
13
c nmr(101mhz,cdcl3)δ151.4,136.3,135.6,130.3,130.0,129.7,128.5,125.4,121.5,119.0,61.2.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=13.82min(主产物),t
r2
=22.08min(次产物)];ee=94%.
[0229][0230]1h nmr(400mhz,cdcl3)δ7.61
–
7.53(m,2h),7.39
–
7.30(m,1h),7.25
–
7.21(m,2h),7.11(td,j=7.7,1.1hz,1h),7.07(dd,j=8.3,0.9hz,1h),6.81(d,j=7.8hz,1h),5.87(d,j=8.6hz,1h),4.82(d,j=8.5hz,1h);
13
c nmr(101mhz,cdcl3)δ151.5,136.8,132.6,130.6,130.0,128.5,125.4,123.8,121.4,119.0,61.3.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=14.61min(主产物),t
r2
=23.80min(次产物)];ee=85%.
[0231][0232]1h nmr(400mhz,cdcl3)δ7.65(d,j=8.2hz,2h),7.60(d,j=7.3hz,2h),7.47(t,j=7.5hz,2h),7.43
–
7.39(m,3h),7.38
–
7.32(m,1h),7.11(dd,j=16.4,8.0hz,2h),6.90(d,j=7.8hz,1h),5.96(d,j=8.6hz,1h),4.81(t,j=7.8hz,1h);
13
c nmr(101mhz,cdcl3)δ151.6,142.5,140.1,136.7,129.8,129.3,129.0,128.7,128.1,127.9,127.2,125.3,122.0,118.9,61.7.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.0ml/min.t
r1
=22.87min(主产物),t
r2
=28.14min(次产物)];ee=76%.
[0233][0234]1h nmr(400mhz,cdcl3)δ7.41(dd,j=5.1,0.8hz,1h),7.35(t,j=7.7hz,1h),7.19
–
7.11(m,2h),7.09
–
7.01(m,3h),6.21(d,j=8.6hz,1h),4.88(d,j=8.5hz,1h);
13
c nmr(101mhz,cdcl3)δ151.0,140.1,130.3,129.0,128.6,127.7,127.4,125.4,121.7,119.0,57.0.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=15.91min(主产物),t
r2
=17.32min(次产物)];ee=66%.
[0235][0236]1h nmr(400mhz,cdcl3)δ7.88(ddd,j=10.0,9.3,6.5hz,4h),7.61
–
7.52(m,2h),7.35(ddd,j=8.1,3.5,1.6hz,2h),7.15
–
7.05(m,2h),6.85(d,j=7.8hz,1h),6.08(d,j=8.5hz,1h),4.79(d,j=8.5hz,1h);
13
c nmr(101mhz,cdcl3)δ151.7,135.0,133.7,133.3,
123.0,129.9,129.0,128.8,128.3,128.0,127.4,127.2,125.5,125.3,122.1,119.1,62.4.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=20.58min(主产物),t
r2
=39.2min(次产物)];白色固体,ee=86%.
[0237][0238]1h nmr(400mhz,cdcl3)δ7.49
–
7.40(m,3h),7.38
–
7.30(m,2h),7.11(ddd,j=8.4,1.4,0.6hz,1h),6.96(d,j=8.4hz,1h),6.59(s,1h),5.85(d,j=8.6hz,1h),4.62(d,j=8.5hz,1h),2.20(s,3h);
13
c nmr(101mhz,cdcl3)δ144.8,133.3,130.4,125.7,124.8,124.8,124.1,123.9,116.8,113.9,57.3,16.0.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1ml/min.t
r1
=19.10min(主产物),t
r2
=21.45min(次产物)];白色固体,ee=94%.
[0239][0240]1h nmr(400mhz,cdcl3)δ7.47
–
7.40(m,3h),7.39
–
7.32(m,2h),7.17(dd,j=6.8,0.6hz,1h),6.97(t,j=7.6hz,1h),6.63(d,j=7.8hz,1h),5.87(d,j=8.7hz,1h),5.00(d,j=8.6hz,1h),2.25(s,3h);
13
c nmr(101mhz,cdcl3)δ150.0,138.1,131.1,129.5,129.4,128.9,128.1,126.1,124.6,121.9,62.0,15.5.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1ml/min.t
r1
=13.94min(主产物),t
r2
=15.69min(次产物)];白色固体,ee=79%.
[0241][0242]1h nmr(600mhz,cdcl3)δ7.46
–
7.39(m,3h),7.33(dd,j=6.7,2.9hz,2h),6.90(d,j=8.0hz,1h),6.88(s,1h),6.69(d,j=8.0hz,1h),5.86(d,j=8.6hz,1h),4.67(d,j=8.6hz,1h);
13
c nmr(151mhz,cdcl3)δ151.4,140.3,138.1,129.5,129.4,128.8,128.3,126.2,119.1,119.0,61.9,21.0.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1ml/min.t
r1
=19.16min(主产物),t
r2
=20.16min(次产物)];白色固体,ee=80%.
[0243][0244]1h nmr(400mhz,cdcl3)δ7.51
–
7.42(m,4h),7.37
–
7.30(m,2h),6.99
–
6.93(m,2h),5.86(d,j=8.7hz,1h),4.76(d,j=8.6hz,1h);
13
c nmr(101mhz,cdcl3)δ156.7,145.5,137.9,129.8,129.7,128.9,122.9,120.0,115.4,113.4,62.3,55.8.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=27.4min(主产物),t
r2
=30.75min(次产物)];白色固体,ee=82%.
[0245][0246]1h nmr(400mhz,cdcl3)δ7.56
–
7.40(m,4h),7.37
–
7.29(m,2h),6.95(d,j=8.8hz,2h),5.85(d,j=8.7hz,1h),4.87(d,j=8.7hz,1h);
13
c nmr(101mhz,cdcl3)δ150.6,137.0,132.9,131.2,130.0,129.8,128.8,124.0,120.7,118.0,61.7.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1.5ml/min.t
r1
=19.69min(主产物),t
r2
=22.5min(次产物)];白色固体,ee=86%.
[0247][0248]1h nmr(400mhz,cdcl3)δ7.50
–
7.44(m,3h),7.37
–
7.28(m,3h),7.05(d,j=8.8hz,1h),6.81(d,j=1.7hz,1h),5.87(d,j=8.6hz,1h),4.65(d,j=8.5hz,1h);
13
c nmr(101mhz,cdcl3)δ150.0,137.0,130.6,129.9,129.9,129.7,128.8,128.3,123.7,120.3,61.8.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1ml/min.t
r1
=11.16min(主产物),t
r2
=12.65min(次产物)];白色固体,ee=85%.
[0249][0250]1h nmr(400mhz,dmso-d6)δ9.20(d,j=6.0hz,1h),8.09(d,j=9.0hz,1h),8.00(d,j=7.9hz,1h),7.50
–
7.37(m,4h),7.33
–
7.24(m,3h),7.17(dd,j=7.0,2.1hz,2h),6.49(d,
j=5.8hz,1h);
13
c nmr(101mhz,dmso-d6)δ150.2,139.4,131.5,131.0,130.4,129.2,128.6,128.3,127.9,126.0,124.7,118.8,114.5,58.4.hplc[daicel chiralpak ic,正己烷/i-proh=90/10,220nm,1ml/min.t
r1
=20.34min(次产物),t
r2
=22.7min(主产物)];ee=98%。
[0251]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1